一株拜耳接合酵母及其应用的制作方法
1.本发明属于生物工程领域,特别涉及到一株在高浓度的烟草废弃物水提液中具有高抗逆 性的拜耳接合酵母zygosaccharomyces bailii mc-9a1(菌种保藏号:cctcc m 2021464)及 其分离方法及应用。
背景技术:
2.在造纸法再造烟叶的工艺流程中,使用水来浸提烟草废弃物,经过固液分离、液处理和 薄膜浓缩获得了高浓度烟草废弃物水提液(tobacco waste extract,twe),是一种十分重要的 中间产物。twe是一种高浓度的植物水提取液,含有大量的烟草内源水溶性化合物,密度为 1.3g/cm3,ph值为4,还原糖含量为163.8g/l,尼古丁含量为19.5g/l(根据具体的工艺及 烟草原料,其具体数值会有些变化)。由于twe具有很强的环境胁迫力,使得绝大多数原料 (烟草废弃物)所携带的微生物都无法在其中有生理活性。
3.目前,对于微生物在twe中的抗逆研究较少。人们所筛选获得的菌株也多是只能适应 低浓度的twe(5-20%),因此,亟待发现能够适应twe原液并在其中有正常代谢活动的菌 株,这将提高twe在储存时的浓度以避免变质,并在再造烟叶的生产过程中避免因稀释造 成的变质问题,降低成本,并可将高抗逆菌株作为底盘菌株进行基因修饰或其他相似逆境的 研究。
技术实现要素:
4.鉴于以上研究背景,本发明的首要目的在于提供一株能够在twe原液中具有正常生理 活性的高抗逆菌株。
5.本发明提供一株拜耳接合酵母zygosaccharomyces bailii mc-9a1,一株拜耳接合酵母,该 菌株于2021年04月27日以拜耳接合酵母zygosaccharomyces bailii mc-9a1保藏于中国典型 培养物保藏中心,保藏号为cctcc no:m2021464,保藏地址为中国.武汉.武汉大学;所述菌 株在高浓度烟草废弃物水提液中具有代谢活性。
6.在一些实施例中,该拜耳接合酵母mc-9a1mc-9a1的its序列如seqid no:1所示。
7.本发明的另一个目的在于将前述拜耳接合酵母应用于高浓度烟草废弃物水提液,能够在 twe原液中进行正常的代谢活动,并消耗大量的糖分,并且该菌株表现出能够适应更高浓 度twe的潜力。
8.在一些实施例中,所述的菌株能够在twe原液中进行正常的代谢活动,并消耗大量的 糖分。
附图说明
9.图1为优势抗逆真菌mc-9a1的形态学观察结果(a为菌株在ypd平板上的菌落形态, b为相差显微镜下的观察结果,c为透射电镜下的观察结果);
10.图2为菌株mc-9a1的系统发育树;
11.图3 hplc检测结果;
12.图4为lc-ms一级质谱检测结果;
13.图5为lc-ms二级质谱正离子流检测图谱;
14.图6为lc-ms二级质谱负离子流检测图谱。
具体实施方式
15.实施例1
16.从twe中分离抗逆性菌株的方法,包括下述步骤:
17.1)微生物的富集培养:量取5ml twe,加入20ml无菌水进行搅拌稀释,于3000rpm 中离心2min,取上清液,再于5000rpm中离心2min,弃上清液,加入1ml无菌水进行重 悬,接入装有100ml ph=4的酸性luria-bertani培养基的摇瓶中,40℃、180rpm富集培养 3-5d。
18.2)twe梯度平板的筛选:配置2%水琼脂培养基(100ml蒸馏水,2g琼脂粉),与twe 80%稀释培养基(20ml蒸馏水,80ml twe),灭菌,微波炉加热融化;将培养皿一侧垫高 约5mm,倒入约10ml的2%水琼脂培养基,静置凝固后将培养皿放于水平面;倒入约10ml 的twe 80%稀释培养基,静置至凝固后,再静置过夜,twe梯度平板制备完成。待1)中 的菌液浑浊时,于5000rpm下离心2min,弃上清;加入5ml无菌水进行重悬、洗菌,再于 5000rpm下离心2min,弃上清,重复一次洗菌、离心弃上清,最后用2ml无菌水重悬备用。 取200μl重悬菌液接入制备好的twe梯度平板,涂布均匀,封口膜封口,10组平行,倒置 于40℃培养箱中,静置3-7d。选取平行组内长势最好的一块平板,取2ml灭过菌的生理盐 水进行洗板,收集菌液,取200μl菌液涂布于twe 80%稀释平板,封口膜封口,10组平行, 倒置于40℃培养箱中,静置3-7d。
19.3)菌株的分离纯化:用2ml生理盐水将twe 80%稀释平板上长出的菌落或菌苔洗下, 并稀释100倍与1000倍,分别取100μl稀释菌液涂布于80%twe稀释平板上,3组平行, 封口膜封口,倒置于40℃培养箱中,静置3-7d;等平板上长出单菌落时,同一组平行板上至 少挑取5个单菌落于1ml生理盐水中重悬,稀释100倍与1000倍,分别取100μl菌液涂布 于twe 80%稀释平板上,3组平行,封口膜封口,倒置于40℃培养箱中,静置3-7d。
20.通过以上步骤,可从twe中分离获得大量的抗逆菌株,需要进行复筛,包括下述步骤:
21.1)扩培与保藏:待菌株分离纯化完成,即twe 80%平板上长出单菌落后,挑取单菌落 于100ml的ypd培养基(yeast extract peptone dextrose medium)中,30℃,220rpm中过夜 培养。转接一次。待od
600
=0.8时,取875μl的菌液与125μl的80%甘油于1.5ml的离心 管中,混匀,制备3次,于-40℃保藏。
22.2)发酵:同时,即od600=0.8时,取20%接菌量的菌液于5000rpm下离心2min,弃 上清;加入5ml生理盐水进行重悬、洗菌,再于5000rpm下离心2min,弃上清,重复一次 洗菌、离心弃上清,最后用1ml生理盐水重悬。将重悬菌液接入装有100ml的twe原液 的锥形瓶中,摇晃均匀,于40℃的隔水式恒温培养箱中静置发酵5d。每天定时摇晃瓶身0.5 min。
23.3)葡萄糖浓度的测定:取1ml待测样品(twe发酵液),用蒸馏水将之稀释100倍, 吸取25μl于sba生物传感分析仪进行葡萄糖浓度的测定。
24.4)总糖的测定:使用苯酚-硫酸法在96孔板上对样品进行总糖浓度的测定。首先配
置0.25 mg/ml的葡萄糖标准液,配置完成后于生物传感分析仪进行检验。另将苯酚加水稀释成6% 的苯酚稀释溶液。然后制作标准曲线与样品的测定,于96孔板中依次加入0、3、6、9、12、 15、18、21μl的0.25mg/ml葡萄糖标准液,再用蒸馏水加至60μl,测定样品时则直接加 入60μl的待测样品(预先稀释5000倍),3组平行,接着再依次加入30μl 6%苯酚稀释液、 150μl浓硫酸,冷却20-30min后,使用酶标仪在490nm下进行吸光度检测。
25.5)hplc的检测:量取10ml待测样品,10ml乙酸乙酯萃取2次,合并有机层,称为 乙酸乙酯萃取样。加入无水硫酸钠进行干燥。再使用0.22μm的有机微孔滤膜过滤样品,收 集过滤好的样品于液相小瓶中,做好标记。再使用agilent 1260高效液相色谱系统(hplc)对其进行分析。使用zorbax eclipse xdb-c18色谱柱(agilent,5μm,4.6
×
250mm),柱温 25℃,流速1ml/min,进样量10μl,检测波长为275nm。流动相a为5
‰
甲酸/超纯水溶液, 流动相b为甲醇。梯度洗脱程序为:0-30min,流动相b从10%线性变化至90%;30-33min, 流动相b从90%线性变化至10%;33-40min,流动相b保持10%不变。
26.6)重复步骤1)到5),即再进行一轮的复筛。
27.通过以上步骤,可从大量的抗逆菌株中复筛获得在twe原液中代谢活性最强的一株菌 株mc-9a1,该菌株于2021年04月27日以拜耳接合酵母zygosaccharomyces bailii mc-9a1 保藏于中国典型培养物保藏中心,保藏号为cctcc no:m2021464。
28.实施例2
29.菌株mc-9a1的鉴定,以及对其在twe中代谢物的分析;包括下述步骤:
30.1)发酵:将实施例1的发酵体系100mltwe原液更改为100ml的twe 80%稀释液, 同时将未接入重悬菌液的100ml的twe 80%稀释液设置为对照组,发酵时间为6d,重复实 施例1的复筛步骤1)到5)。
31.2)lc-ms一级质谱检测:将待测样品摇匀,取1ml稀释100倍,使用0.22μm的水相 微孔滤膜过滤样品,收集过滤好的样品于液相小瓶中,做好标记。并使用thermo ultimate 3000 超高效液相色谱系统(uhplc)与thermo ltq-xl生物质谱仪(ms)联用对其进行分析。 使用zorbax eclipse xdb-c18色谱柱(agilent,5μm,4.6
×
250mm),柱温25℃,流速0.5 ml/min,进样体积1μl,检测波长为190-800nm。流动相a为1
‰
甲酸/超纯水溶液,流动 相b为乙腈。梯度洗脱程序为:0-60min,流动相b从10%线性变化至90%;60-66min,流 动相b从90%线性变化至10%;66-80min,流动相b保持10%不变。离子源为加热型电喷 雾电离(hesi),毛细管温度为250℃,离子源温度250℃,鞘流气流量40au,辅助气流量 15au。正电极电源电压为3.5kv,电流量100ua,毛细管电压48v,正质荷比全扫描范围 110.0-2000.0da;负电极电源电压为3.0kv,电流量100ua,毛细管电压-33v,负质荷比全 扫描范围100-2000da。
32.3)lc-ms二级质谱检测:量取30ml待测样品于50ml的离心管内,并置于-80℃冰箱 过夜冷冻。取出样品,于4℃的环境下解冻,取10ml样品加入20ml预冷甲醇/乙腈/超纯水 溶液(2:2:1,v/v)中,涡旋混合,低温超声30min,于-20℃静置10min;再于14000g下 低温(4℃)离心20min,取上清液进行真空干燥。质谱分析时加入100μl乙腈水溶液(乙 腈:水=1:1,v/v)复溶,涡旋,于14000g下低温(4℃)离心15min,取上清液进样分析。 使用agilent 1290infinity lc超高效液相色谱系统(uhplc)与ab triple tof 6600质谱仪 (ms)联用对其进行分析。使用acquity uplc beh amide色谱柱(waters,1.7μm,2.1
×
100 mm),柱温25℃,流速0.5ml/min,进样量2μl。流动相a为25mm乙酸铵/25mm氨水/ 超纯水溶液,流动相b为
乙腈。梯度洗脱程序如下:0-0.5min,保持95%流动相b;0.5-7min, 流动相b从95%线性变化至65%;7-8min,流动相b从65%线性变化至40%;8-9min,流 动相b维持在40%不变;9-9.1min,流动相b从40%线性变化至95%;9.1-12min,流动相b 维持在95%;整个分析过程中样品置于4℃自动进样器中。离子源为电喷雾电离(esi),离 子源温度600℃,离子间隙电压浮动(isvf)为
±
5500v(正负两种模式);tof ms质荷比 扫描范围60-1000da,产物离子扫描范围25-1000da,二级质谱采用数据相关采集(ida)获得,并采用高灵敏度模式,去簇电压(dp)为
±
60v(正负两种模式),碰撞能量为35
±
15ev, 其中ida设置为排除4da以内的同位素,每个周期监测的候选离子为10。
33.4)形态学观察:将已活化好的菌株划线接种于ypd固体平板上,于30℃倒置培养2d; 观察菌落形态;再挑取单菌落于1ml无菌水中重悬,取200μl用于相差显微镜观察。从平 板上刮取菌落,200μl无菌水重悬,200目铜网捞取样品,醋酸铀染色,无菌水洗去多余染 液,烘干固定,用于透射电镜观察。
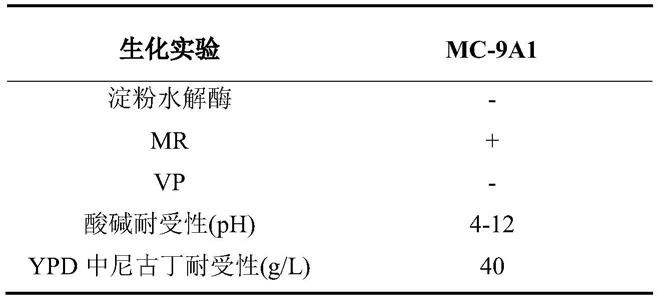
34.5)生理生化实验:进行了可溶性淀粉水解酶活性实验,mr-vp实验,ypd中酸碱耐受 性实验,ypd中尼古丁耐受实验。
35.6)唯一碳源利用特性:称取2g的待测碳源与2g琼脂粉加入100ml的msm培养基 中,灭菌,制备成平板,将已活化且洗过的菌液涂布于其上,30℃中倒置培养2-5d。其中, 待测碳源为葡萄糖,kraft木质素,羟甲基纤维素钠300-800mpa
·
s,木质素磺酸钠,木聚糖, 葡聚糖4万dextran,d-木糖,d-(+)纤维二糖,愈创木酚,d-果糖,麦芽糖,蔗糖,可溶性 淀粉,尼古丁,d-甘露糖,共15种。
36.7)its序列的测定:将待测菌株划线于ypd平板上培养2d,挑单菌落于20μl无菌水 中,吹打均匀。以菌液作为dna模板,使用真菌通用引物its1(5
’‑
tcc gta ggt gaa cctgcg g-3’)和its4(5
’‑
tcc tcc gct tat tga tat gc-3’)扩增菌株的its序列。pcr扩 增体系为:2x phantamaster mix 25μl,dna模板1μl,正向引物2μl,反向引物2μl和蒸 馏水20μl。pcr反应程序为:95℃保持3min,95℃变性15s,55℃退火30s,72℃延伸35 s,30个循环,最终72℃保持5min。pcr产物通过切胶和纯化的序列进行测序。ncbi 核苷酸碱基局部比对搜索工具(blast)用于分析数据。通过mega软件,使用clusterw 和neighbor-joinging法进行系统发育树的构建。
37.(1)形态学观测结果:对筛选获得的在twe原液中代谢活性最强的菌株mc-9a1进行详细 的形态学观察。包括菌落形态观察,相差显微镜观察与透射电镜观察,结果如图1所示。其 中,相差显微镜的观察结果是在100倍的油镜下获得,透射电镜的观察结果是在5000倍下获 得。
38.mc-9a1在ypd平板上的菌落呈白色不透明,边缘规则、光滑、呈圆形,中间凸起,菌落表 面略微哑光且有一定的光泽,相连菌落各自的边缘较难融合,可清晰地分辨相连菌落各自的 边缘。并且,在相差显微镜与透射电镜的观察下可知,单个细胞为较大的卵圆形,无鞭毛, 无菌丝,长6μm左右,宽3μm左右,且有明显的出芽生长现象。
39.(2)生理生化实验及唯一碳源利用特性:对菌株mc-9a1进行了一些生理生化实验的鉴定, 结果如表1所示;另外,还检测了其对15种唯一碳源的利用特性,结果如表2所示。并且, 在表1和表2中,“+”表示检测结果为阳性,
“‑”
表示检测结果为阴性。其中,在生理生化实 验中,ypd中尼古丁耐受性实验只测试到了40g/l的尼古丁含量,并没有检测出该菌株
atcc58445的同源性最高,e-value为0.0,query cover值为93%,per.ident值为94.57%,并从 blast比对结果中选择15株真菌的its序列,通过mega软件,使用clusterw和 neighbor-joinging法构建系统发育树,如图2所示。
46.从图2中可知,mc-9a1与zygosaccharomyces bailii atcc 58445之间的bootstrap值和 遗传变异度分别为100与0.01,因此,判断菌株mc-9a1与zygosaccharomyces bailii atcc58445为同种下的不同亚种,并将其命名为zygosaccharomyces bailii mc-9a1。
47.(4)发酵的糖代谢情况:以葡萄糖和总糖浓度来描述zygosaccharomyces bailii mc-9a1在 twe中的糖代谢情况,并且利用sba生物传感器检测发酵液中的葡萄糖含量,利用苯酚-硫 酸法联用酶标仪检测发酵液中的总糖含量,结果如表3所示。
48.表3 zygosaccharomyces bailii mc-9a1在twe中发酵的糖代谢情况
[0049][0050]
(5)hplc检测结果:将“对照组,0d”,“对照组,6d”和“mc-9a1,6d”这3个样品进行hplc 检测,结果如图3所示。在保留时间约为6.6min时,有一物质被mc-9a1大量消耗。
[0051]
(6)lc-ms一级质谱用于twe中代谢物的分析:由lc-ms一级质谱可得到物质的分子量 信息,检测结果以离子流基峰base peak ms的形式呈现,如图4。base peak ms检测结果将 同一时间检测到的所有物质的离子流基峰强度累加起来,因此每个离子流基峰都包含了大量 极性相似的物质。
[0052]
由图4可知,“对照组,0d”、“对照组,6d”、“mc-9a1,6d”的base peak ms检测结果显 示总离子基峰强度分别为1.12e7、1.18e7、4.38e6。从一定意义上,可以将离子强度等同于 物质的量,因此可知对照样品在发酵6d后,其中物质的总量增长了5.4%,这是由于物质发 生了水解、分解等反应,且生成的物质的量大于物质的水解及挥发的量,而mc-9a1培养过 后的twe中所有物质的量只为对照(6d)的37.1%,这是由于菌体的代谢活动引起的。
[0053]
根据base peak ms检测结果标记出30个基峰,由此可将twe中检测到的物质分为30 类,每一类(基峰)中都包含了大量不同的极性相似物质。“mc-9a1,6d”对比于“对照组,6 d”,这30个基峰的离子流强度变化率如表4所示。其中,几乎每一个离子流基峰都有正离子 流检测模式与负离子流检测模式,分别用“+c esi”与
“‑
c esi”表示。
[0054]
表4 30个离子流基峰的变化率
[0055][0056][0057]
可将base peak ms图谱分为3个区域,分别为rt=2-8min,rt=24-61min,rt=63-75min。 在rt=2-8min区域,mc-9a1消耗了大量强极性的物质;在rt=24-61min区域,mc-9a1 对twe的影响较小;在rt=63-75min区域,mc-9a1的变化较大,生成了大量的非极性或 小极性的物质。
[0058]
(6)lc-ms二级质谱用于twe中代谢物的分析:由lc-ms二级质谱可得到物质的分子结 构信息,检测结果以总离子流检测图谱(total ion chromatogram,tic)呈现,分为正离子流检 测图谱(pos)与负离子流检测图谱(neg),分别如图5与图6所示。
[0059]
在lc-ms二级质谱的正离子模式下检测到13858个物质,鉴定出139个物质,占1.0%, 负离子模式下检测到15197个物质,鉴定出203个物质,占1.3%,将正负离子模式合并后共 鉴定出310个物质。在这些鉴定出的物质中,zygosaccharomyces bailii mc-9a1相
比于对照(6 d)的显著性差异物质(fc》2和fc《0.5)如表5所示。
[0060]
表5 zygosaccharomyces bailii mc-9a1引起的(已鉴定)显著性差异物质
[0061][0062]
[0063][0064]
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1