一种人源脐带来源间充质干细胞的优化培养基、试剂盒及组织贴壁培养方法与流程
1.本发明涉及干细胞培养技术领域,具体涉及一种人源脐带来源间充质干细胞的优化培养基、试剂盒及组织贴壁培养方法。
背景技术:
2.干细胞存在于身体的各种器官和组织中,它们具有再生潜力,同时在整个人类生命周期中,此类细胞在修复体内受损组织方面发挥重要作用。这引起了人们对成体干细胞(asc)的极大兴趣,特别是因为与胚胎干细胞(esc) 不同,asc的使用不会造成道德和伦理困境。一些研究报告了ascs的分离,例如间充质基质细胞(mscs),造血干细胞(hsc)以及其他不同的祖细胞,包括从骨髓(bm)到脂肪组织(at)和牙髓的各种成人来源。然而,大多数(1)成人生态位中存在的asc是有限的,并且,(2)它们的提取通常涉及具有潜在供体部位发病率以及组织侵入性的痛苦过程。此外,(3) 供体年龄和环境压力也可能在确定分离细胞的质量和生物活性方面发挥重要作用。同时,(4)ascs在体外培养过程中也显示出有限的增殖能力和分化潜能。
3.为了克服当前asc的这些缺点,人们一直在寻求新的来源进行干细胞的分离。这些尝试发展为从围产期来源中分离出干细胞,包括脐带血、脐带组织、胎盘、羊膜和羊水。这些(1)来源因其具有容易获取和丰富的可用性被广泛关注。此外,(2)围产期组织可以非侵入性的方式获得,从它们中提取的干细胞比从成人来源分离的asc更原始。它们是从出生时获得的组织中分离出来,并且(3)被认为不存在由于老化和环境压力而在基因组中发生了最小的变化。
4.然而,来自围产期来源的干细胞的报告特征及其自我更新和分化的潜力差距很大。现有脐带来源间充质干细胞提取工艺条件一般是将脐带组织作为一个整体,使用组织块贴壁法获得间充质干细胞,但是(1)不同组织位置获得的细胞自我更新和分化潜力具有差异,(2)细胞倍增时间不一致,同一时间收获的细胞虽然表型一致,但不同组织块间爬出的细胞至收获时增殖代次和功能有差异,(3)随着传代次数增加,会降低整体细胞制剂的功能。目前仍缺乏可用于临床治疗用的脐带来源间充质干细胞的高效培养方法。
技术实现要素:
5.本发明的目的在于提供一种人源脐带来源间充质干细胞的优化培养基、试剂盒及组织贴壁培养方法。本发明所述优化培养基能够保证msc在多次传代扩增后仍能满足临床应用监管要求。
6.本发明提供了一种人源脐带来源间充质干细胞的优化培养基,所述培养基包括:基础培养基、血清替代物和补充剂;所述基础培养基包括dmem-lowglucose和l-glutamine;所述血清替代物包括knockout
tm
血清替代物;所述补充剂包括重组人fgf2蛋白、重组人fgf4蛋白、重组人pdgfab蛋白、重组人egf蛋白、重组人vegf蛋白、重组人hgf蛋白、重
组人tgf-beta1、重组人bmp-3蛋白和烟酰胺单核苷酸。
7.优选的是,所述优化培养基中,基础培养基、血清替代物和补充剂的体积比为90:9:1。
8.优选的是,所述优化培养基中:l-glutamine的物质的量浓度为6mm,重组人fgf2蛋白的质量浓度为40ng/ml、重组人fgf4蛋白的质量浓度为 10ng/ml、重组人pdgfab蛋白的质量浓度为4ng/ml、重组人egf蛋白的质量浓度为2ng/ml、重组人vegf蛋白的质量浓度为0.2ng/ml、重组人 hgf蛋白的质量浓度为0.2ng/ml、重组人tgf-beta 1的质量浓度为0.5 ng/ml、重组人bmp-3蛋白的质量浓度为0.2ng/ml、烟酰胺单核苷酸的物质的量浓度为5mm。
9.本发明还提供了一种培养人源脐带来源间充质干细胞的试剂盒,所述试剂盒包括上述技术方案所述的优化培养基、tryple
tm
express消化酶和 nunclon
tm
delta培养皿。
10.本发明还提供了一种基于上述技术方案所述试剂盒的人源脐带来源间充质干细胞的组织贴壁培养方法,包括以下步骤:
11.将脐带样本在tryple
tm
express消化酶溶液中进行消化,得到消化后的脐带组织;
12.将消化后的脐带样本在含上述技术方案所述优化培养基的nunclon
tm delta培养皿中进行贴壁培养,得到人源脐带来源间充质干细胞。
13.优选的是,所述脐带样本的来源包括:脐带胎盘连接处组织和/或脐带组织;所述脐带组织包括脐带衬里和/或脐带华通氏胶。
14.优选的是,所述消化的时间为5min。
15.优选的是,所述贴壁培养后还包括:待贴壁培养的细胞融合度达到 70~90%时,使用tryple
tm
express消化酶溶液进行消化培养,离心,获得原代细胞。
16.优选的是,所述消化的时间为3~4min。
17.优选的是,所述原代细胞进行传代培养时,使用优化培养基进行培养。
18.本发明提供了一种人源脐带来源间充质干细胞的优化培养基。本发明所述培养基包括:基础培养基、血清替代物和补充剂。本发明所述优化培养基能够保证msc在多次传代扩增后仍能保持其专一的细胞表型和多向分化潜能,最大限度地缩短细胞从组织内分离到适应体外培养环境过程的时间、最大限度地提高单位时间内的细胞产量,缩短代次培养间的时间,进而提高细胞性能并满足临床应用监管要求,可在体外更好的扩增人类间充质干细胞,最大限度地提高msc体外扩增效率并减少批次间细胞的差异。
附图说明
19.图1为本发明提供的脐带采集部分示意图;
20.图2为本发明提供的脐带解剖示意图;
21.图3为本发明提供的组织贴壁接种示意图;
22.图4为本发明提供的cpj/wj/cl组织在day6/12/18时间点细胞爬出状态对比;
23.图5为本发明提供的ucmsc21041101脐带来源间充质干细胞p1代细胞制备(10瓶);
24.图6为本发明提供的显示ucmsc21042101脐带来源间充质干细胞p1 代细胞制备(20瓶);
25.图7为本发明提供的显示ucmsc21062101脐带来源间充质干细胞p1 代细胞制备(30瓶);
26.图8为本发明提供的不同条件下脐带wj组织间充质细胞爬出状态;
27.图9为本发明提供的中科uc-msc优化培养基组合及达科为msc培养基组合;
28.图10为本发明提供的两种培养体系下p2/p5/p10代次脐带来源msc 镜下状态;
29.图11为本发明提供的两种培养条件下t-25培养瓶接种相同数目细胞后传至p10代所获得的细胞总数;
30.图12为本发明提供的优化培养条件下脐带间充质干细胞p10细胞表型鉴定;
31.图13为本发明提供的优化培养条件下脐带来源间充质干细胞p2/p5/p10 代次三系分化能力鉴定。
具体实施方式
32.本发明提供了一种人源脐带来源间充质干细胞的优化培养基,所述培养基包括:基础培养基、血清替代物和补充剂;所述基础培养基包括dmem-lowglucose;所述血清替代物包括knockout
tm
血清替代物;所述补充剂包括 l-glutamine、重组人fgf2蛋白、重组人fgf4蛋白、重组人pdgf ab蛋白、重组人egf蛋白、重组人vegf蛋白、重组人hgf蛋白、重组人tgf-beta1、重组人bmp-3蛋白和烟酰胺单核苷酸。
33.在本发明中,所述优化培养基中,基础培养基、血清替代物和补充剂的体积比优选为90:9:1。
34.在本发明中,所述优化培养基中:l-glutamine的物质的量浓度为6mm,重组人fgf2蛋白的质量浓度为40ng/ml、重组人fgf4蛋白的质量浓度为 10ng/ml、重组人pdgfab蛋白的质量浓度为4ng/ml、重组人egf蛋白的质量浓度为2ng/ml、重组人vegf蛋白的质量浓度为0.2ng/ml、重组人 hgf蛋白的质量浓度为0.2ng/ml、重组人tgf-beta 1的质量浓度为0.5 ng/ml、重组人bmp-3蛋白的质量浓度为0.2ng/ml、烟酰胺单核苷酸的物质的量浓度为5mm。
35.脐带组织除含有间充质干细胞外仍包含很多上皮细胞和其他类型细胞。从中分离并扩增所需的间充质干细胞需要强大的体外细胞培养扩增方法以获得足够数量的、高纯度的细胞以满足基础研究和临床应用。本发明人源脐带来源间充质干细胞的提取及扩增方法中使用的经优化的培养基是一种无血清且不含动物源性成分的完全培养基,适用于人间充质干细胞的生长和扩增,为间充质干细胞提供了细胞专一性完整的营养及扩增支持,同时可以保证msc在多次传代扩增后仍能保持其专一的细胞表型和多向分化潜能。本发明优化后的培养基能够最大限度地缩短细胞从组织内分离到适应体外培养环境过程的时间、最大限度地提高单位时间内的细胞产量,缩短代次培养间的时间,进而提高细胞性能并满足临床应用监管要求。本发明所述优化培养基除了基础培养基和血清替代物,另加入了间充质干细胞刺激补充剂,结合使用可在体外更好的扩增人类间充质干细胞。本发明补充剂中的内容物细胞因子比例进行特定设置,能够最大限度地提高msc体外扩增效率并减少批次间细胞的差异。
36.本发明还提供了一种培养人源脐带来源间充质干细胞的试剂盒,所述试剂盒包括上述技术方案所述的优化培养基、tryple
tm
express消化酶和 nunclon
tm
delta培养皿。
37.使用本发明试剂盒中的tryple
tm
express消化酶对脐带来源组织进行消化,在nunclon
tm
delta培养皿上进行贴壁培养,使用优化培养基作为培养用培养基,能够稳定的实现脐带间充质干细胞的培养,提高组织细胞爬出效率,降低细胞的突变概率,保证细胞可维
系稳定的表型和功能,最终能够实现足够数量的、高纯度的细胞的获得,符合临床应用标准,实现msc的长期传代,保持细胞一致性的同时维系间充质干细胞的三系分化潜能。
38.本发明还提供了一种基于上述技术方案所述试剂盒的人源脐带来源间充质干细胞的组织贴壁培养方法,包括以下步骤:
39.将脐带样本在tryple
tm
express消化酶溶液中进行短时温和消化,得到消化后的脐带组织;
40.将消化后的脐带样本在含上述技术方案所述优化培养基的nunclon
tm delta培养皿中进行贴壁培养,得到人源脐带来源间充质干细胞。
41.本发明将脐带样本在tryple
tm
express消化酶溶液中进行短时温和消化,得到消化后的脐带组织。在本发明中,所述脐带样本的来源优选包括:脐带胎盘连接处(cord-placenta junction,cpj)组织和/或脐带(umbilical cord, uc)组织;所述脐带组织包括脐带衬里(cl)和/或脐带华通氏胶(wj)。 cpj作为样本进行培养,产出的细胞多,快,能够缩短细胞制备时间,减少细胞突变概率;华通式胶慢一点,但是因为组织多,细胞总量大。本发明实施例证明,单位时间内,相比cl和wj部位,从cpj组织部位分离msc 细胞所需时间短,得率更高,在实验第3~4天即能观察到明显的msc细胞爬出,7~10天即能达到70%以上的细胞汇合。在所述消化前,本发明优选将脐带样本剪碎。正常的组织消化法时间通常为120~180min,以将细胞从组织中释放,进行细胞接种,在本发明中,所述短时消化的时间优选为5min,并没有将组织消化为细胞,是进行组织块接种,短时消化会促进组织块在培养皿表面的粘附效率,促进细胞从组织中爬出效率,本技术组织处理所需操作时间更短。在本发明中,所述短时消化在37℃培养箱中进行。在本发明中,所述tryple
tm
express消化酶优选购自thermo fisher公司,货号:a1217702。本发明所述tryple
tm
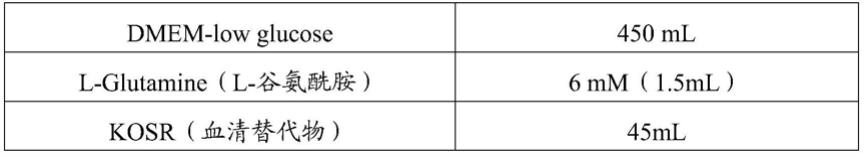
express消化酶经稀释即可灭活,无需添加蛋白酶抑制剂,不含动物源组分。本发明优选使用37℃预热的tryple
tm
express(10
×
) 进行组织剪切处理,随后在37℃预热的tryple
tm
express(1
×
)进行温和的消化。本发明对消化终止的操作没有特殊限制,用培养基进行稀释即可终止消化。
42.得到消化后的脐带组织后,本发明将消化后的脐带样本在含上述技术方案所述优化培养基的nunclon
tm
delta培养皿中进行贴壁培养,得到人源脐带来源间充质干细胞。在本发明中,所述贴壁培养的温度优选为37℃;所述贴壁培养优选在体积百分含量为5%的co2培养箱中进行。本发明将消化后的脐带组织优选铺在培养皿上,加入优化培养基后,优选孵育3d,孵育后,本发明优选进行半量换液,待细胞爬出后,优选每3d更换新的优化培养基。在本发明中,cpj组织孵育3~4d明显有细胞爬出,cl和wj组织孵育7~10d 后,细胞明显爬出。孵育的前三天,若有漂浮的碎片,本发明优选将碎片转移到新的nunclon
tm
delta培养皿中进行附着。
43.本发明组织贴壁前使用37℃预热的tryple
tm
express(1
×
)进行温和的消化,可以促进细胞从组织中爬出;同时将组织接种在nunclon
tm
delta培养皿中进行贴壁,带有nunclon delta涂层的培养皿可以促进组织在其表面的黏附。两项技术步骤共同作用下将缩短组织黏附时间,增大组织黏附面积,进而提高单位时间内的uc-msc细胞产量。试验结果表明,本发明组织消化酶解处理和特定培养皿的使用缩短原代细胞制备流程时间,增加单位时间内的细胞产量,提高单位时间内组织切片的黏附效率,缩短组织在培养皿表面的贴壁时间,为细胞爬出创造了良好的外部环境,进而加速细胞从组织中的爬出速度,最终实现
单位时间内高数量的细胞产出。
44.在本发明中,所述贴壁培养后优选还包括:待贴壁培养的细胞融合度达到70~90%时,使用tryple
tm
express消化酶溶液进行消化培养,离心,获得原代细胞。在本发明中,所述消化的时间优选为3~4min,所述消化优选使用37℃预热的tryple express(1
×
)进行。在本发明中,所述离心的条件优选为1200rpm离心5min。在本发明中,所述原代细胞进行传代培养时,使用优化培养基进行培养。本发明所述传代培养时,优选以1
×
104/cm2的播种密度进行传代。多余的细胞优选以4
×
106/ml浓度在cryostor cs10细胞冻存液中进行冷冻保存。
45.下面结合具体实施例对本发明所述的一种人源脐带来源间充质干细胞的优化培养基、试剂盒及组织贴壁培养方法做进一步详细的介绍,本发明的技术方案包括但不限于以下实施例。
46.实施例1
47.(1)无菌采集带有脐带样本的完整组织,其中uc(umbilical cord,uc)长度约为15cm,包括至脐带胎盘连接处部位(cord-placenta junction, cpj)的10~11cm和cpj至胎盘(fetal placenta,fp)的1~3cm(个体组织间存在差异)。立即将整个组织样品放入含有组织保存液(含有4500mg/ml 葡萄糖和抗生素溶液(0.1%庆大霉素、0.2%链霉素和0.12%青霉素)的 dmem)的组织保存袋,将组织保存袋储存在4℃组织运输盒内运输至实验室。在收集组织后的2~4h内处理样品,所有操作均在无菌实验室环境中进行。
48.(2)将样品置于生物安全柜内的医用不锈钢托盘中。使用针头和注射器,用4℃预冷的d-pbs冲洗组织表面多次以去除血块。确保样品在处理过程中浸于d-pbs中保持湿润,不要让组织变干。为了保持无菌,在整个样品处理过程中使用无菌的d-pbs和手术工具对样品进行无菌处理。
49.(3)仔细检查样本以识别不同的解剖区域:uc、cpj和fp。首先剖析 uc。用镊子夹住uc的胎儿端,用一把剪刀小心地在cpj的顶部进行第一次切割。在cpj下方进行第二次切割,将cpj组织(1.5-2.5cm)与fp分开。将分离的uc、cpj和fp放在单独的培养皿中进行进一步处理。(脐带采集部分示意图如图1,包括胎盘和脐带组织连接处组织(右上)和脐带组织(右下))。
50.(4)在剪刀和镊子的帮助下纵向切割uc,uc被进一步解剖为两个区域:脐带衬里(cl)和华通式胶(wj)。在不干扰上皮的情况下完全暴露血管和周围的wj。脐带解剖示意图如图2所示,包括剔除的动脉血管和保留的华通式胶和脐带衬里。
51.(5)用手术刀将wj从羊膜下的血管和内皮上刮下来,然后取出血管。确保收集血管下方和周围任何剩余的血管周围wj,并将收集的wj放在单独的培养皿中。
52.(6)在单独的培养皿中收集剩余的组织、脐带衬里(cl)。
53.(7)代表cl、wj、cpj的组织分离后,用5mltryple express(10
×
) 替换d-pbs,并使用剪刀将每个组织分别切成2mm的碎片。
54.(8)在37℃预热的tryple express(1
×
)溶液中将组织块在37℃培养箱中培养5min,以对样品进行短时边缘消化。通过使用相差显微镜可视化细胞的释放来观察部分消化过程。
55.(9)向部分消化的样品中加入5ml的msc完全培养基以稀释trypleexpress溶液。
将内容物转移到50ml离心管中,让部分消化的组织块静置 3min。
56.(10)小心吸出上清液,包括单细胞(它们不能有效扩增),将15~20 个部分消化的组织片铺在100mm nunclon
tm
delta培养皿上,并加入5ml msc优化培养基。在37℃,5%co2条件下下孵育3天,期间不要移动培养皿,以利于组织片的粘附。组织贴壁接种示意图如图3,包括cpj组织(左), wj组织(中)和cl组织(下)。
57.(11)培养3天后,吸出3ml培养上清并添加3ml新的msc优化培养基进行半量换液,观察外植体是否有细胞生长;正常情况下细胞生长分别开始于cpj细胞孵育3~4天、cl或wj细胞孵育7~10后,从贴壁外植体中可以明显观察到细胞爬出。从此时起,每3天更换新的msc优化培养基。外植体初始细胞生长后7~10天达到70%~90%汇合。非粘附组织块在粘附到塑料上之前不会产生任何细胞生长。必须小心操作以免触碰贴壁组织,避免粘附组织碎片的分离。如果在培养的前3天后有任何漂浮的碎片,可以将它们转移到新的100mm nunclon
tm
delta培养皿中进行附着。图4为cpj/wj/cl 组织在day6/12/18时间点细胞爬出状态对比。可以看出,cpj组织部分细胞从组织爬出的最早,d12的时候已经到达可进行富集的细胞密度,其次是 wj组织部位,两组在d18时间充质干细胞均呈现生长均一的生长状态。而, cl组织部位细胞相对爬出细胞速度较cpj组织和wj组织较慢,细胞数量较少。
58.(12)为了细胞收获并进行细胞传代,使用4ml tryple express(1
×
) /培养皿在37℃下孵育3~4min以消化分离细胞。消化后用4ml的msc优化培养基稀释tryple express后经1200rpm离心5min收获细胞。确保在添加tryple express的同时轻微振荡培养皿,以使其均匀分布。
59.(13)获得的细胞被认为是第0代(p0),将其重悬悬浮在msc优化培养基中,并使用细胞计数仪进行计数,并以1
×
104/cm2的播种密度进行传代,用于放大、表征和冷冻保存。多余的细胞可以以4
×
106/ml浓度在cryostorcs10细胞冻存液中进行冷冻保存。
60.实施例2
61.验证本发明脐带间充质干细胞培养方法具有可重复应用的稳定性
62.基于实施例1的方法条件,在3个不同组织供体来源的脐带组织上均实现了cpj/wj/cj各自部位的间充质干细胞稳定的分离和扩增。
63.(1)ucmsc21041101脐带来源间充质干细胞p1代细胞制备
64.通过实施例1的组织贴壁法进行人源脐带来源间充质干细胞(p0代) 的提取及扩增,其中uc长度19cm,cpj长度2.6cm,实验第18天,接种p1代cpj来源msc 4个t-175培养瓶(2
×
106/瓶),接种p1代wj来源msc 4个t-175培养瓶(2
×
106/瓶),接种p1代cj来源msc 2个t-175 培养瓶(2
×
106/瓶)。图5显示ucmsc21041101脐带来源间充质干细胞p1 代细胞制备(10瓶)。
65.(2)ucmsc21042101脐带来源间充质干细胞p1代细胞制备
66.通过实施例1的组织贴壁法进行人源脐带来源间充质干细胞(p0代) 的提取及扩增,其中uc长度27cm,cpj长度3.1cm,实验第19天,接种 p1代cpj来源msc 5个t-175培养瓶(2
×
106/瓶),接种p1代wj来源 msc 10个t-175培养瓶(2
×
106/瓶),接种p1代cj来源msc 5个t-175 培养瓶(2
×
106/瓶)。图6显示ucmsc21042101脐带来源间充质干细胞p1 代细胞制备(20瓶)。
67.(3)ucmsc21062101脐带来源间充质干细胞p1代细胞制备;
68.通过实施例1的组织贴壁法进行人源脐带来源间充质干细胞(p0代) 的提取及扩增,其中uc长度17.4cm,cpj长度3.2cm,实验第22天,接种p1代cpj来源msc 5个t-175培养瓶(2
×
106/瓶),接种p1代wj来源 msc 17个t-175培养瓶(2
×
106/瓶),接种p1代cj来源msc 8个t-175 培养瓶(2
×
106/瓶)。图7显示ucmsc21062101脐带来源间充质干细胞p1 代细胞制备(30瓶)。
69.实施例3
70.本发明通过以下实验比较组织接种前短时tryple
tm express的酶解处理和应用nunclon
tm
delta培养皿代替无涂层细胞培养皿的组织细胞爬出效率。
71.试验共设置4个实验组,分别为酶解涂层培养组、酶解非涂层培养组、非酶解涂层培养组、非酶解非涂层培养组,培养组织来自于同一供体wj部位,10ml uc-msc优化培养基条件下培养6天,期间不进行换液操作,第 6天镜下检查各培养皿组织部位细胞爬出状态,结果如图8所示。图8为不同条件下脐带wj组织间充质细胞爬出状态。
72.根据试验day 6镜下细胞状态结果所示,组织经过短时酶解处理后,在nunclon
tm
delta培养皿中会呈现均匀扩散状态(图8中的(1)),而在非涂层培养皿上能看存在细胞空白区域(图8中的(2)),说明nunclon
tm
delta 培养皿可以显著增加细胞的黏附效率,增加细胞扩增面积;此外,同样在 nunclon
tm
delta培养皿上进行培养,组织经过酶解处理细胞呈现均匀的从组织向周边爬出的生长增殖状态(图8中的(1)),而组织未经酶解处理细胞呈现个体形貌差异性相对较大的生长状态(图8中的(3)),因个体细胞较大限制个子代细胞扩增范围,细胞数目相对(图8中的(1))更少,说明短时酶解处理可以增加间充质干细胞的爬出数目。结果(图8中的(2))、 (图8中的(3))与(图8中的(4))相比可以得到相同的结论。
73.(图8中的(1))与(图8中的(4))比对结果说明,通过tryple
tm express的组织酶解处理和将细胞接种在100mm nunclon
tm
delta培养皿的步骤会缩短间充质干细胞爬出的时间,进而增加单位时间内间充质干细胞的爬出数目。同部位细胞倍增时间一致,短时数目扩增更多意味着单位时间内获得相同细胞数目需要更少的细胞扩增次数,降低了细胞的突变概率,进而保证细胞可维系稳定的表型和功能。
74.实施例4
75.本发明使用的uc-msc优化培养基可以实现msc的长期传代,保持细胞一致性的同时维系间充质干细胞的三系分化潜能。
76.本发明使用的优化培养基是一种专门为人间充质干细胞(msc)的生长和扩增而配置的无血清培养基(sfm)。与市售常规基础培养基附加血清替代物的组合培养体系相比,优化的培养基添加了间充质干细胞刺激补充剂,能够更好的促进msc生长并提高一致性。使用本发明优化培养基,人源msc 可以扩增超过10代的同时仍然保持极强的三谱系中胚层分化潜能(即,分化为成骨细胞、成软骨细胞和成脂肪细胞谱系的能力)。
77.本发明优化培养基成份如表1。
78.表1优化uc-msc培养基(500ml)组成
[0079][0080][0081]
注:dmem-low glucose和l-glutamine组成的基础培养基总体积为450ml;后续补充剂在配制时,使用的溶剂为dmem-low glucose,即各补充因子(重组人fgf2蛋白、重组人fgf4蛋白、重组人pdgfab蛋白、重组人egf蛋白、重组人vegf蛋白、重组人hgf蛋白、重组人tgf-beta 1、重组人bmp-3蛋白和烟酰胺单核苷酸)溶于 dmem-low glucose后的补充剂总体积为5ml。
[0082]
将dmem-low glucose(thermo fisher#11885)作为uc-msc培养用的基础培养基。本发明优化培养基中各组分的来源信息如下:
[0083]
l-glutamine(thermo fisher#a2916801);
[0084]
knockout
tm
血清替代物(knockout
tm
sr)(human platelet lysate(clinical grade),sartorius,pltgold100gmp);
[0085]
重组人fgf2蛋白(animal free)(ab179489);
[0086]
重组人fgf4蛋白(animal free)(ab222368);
[0087]
重组人pdgf ab蛋白(animal free)(ab179496);
[0088]
重组人egf蛋白(animal free)(ab9697);
[0089]
重组人vegf 165a蛋白(animal free)(ab179624);
[0090]
重组人hgf蛋白(ab105061);
[0091]
重组人tgf-beta 1蛋白(animal free)(ab217396);
[0092]
重组人bmp3蛋白(ab97412);
[0093]
nicotinamide mononucleotide,key nad+intermediate(ab223879);
[0094]
本发明以msc细胞最丰富的cpj组织位置作为细胞来源,将从组织p0 代间充质干
细胞提出开始持续在各自培养体系上扩增至p10代细胞,通过镜检各代次细胞状态,获得的细胞总数,比对各自的培养效率及细胞功能评价。同时通过检测p2/p5/p10代次间充质干细胞的三系分化能力以及p10代次间充质干细胞的细胞表型,来验证经过多次传代后,优化培养基体系上的间充质干细胞是否仍保持临床所需的细胞表型以及分化能力。
[0095]
试验共设置两个培养体系测试组,如图9所示(图9为北京吉中科(中科)uc-msc优化培养基组合及达科为msc培养基组合):
[0096]
培养体系1(本发明优化培养基):中科msc基础培养基(450ml)+ 中科msc血清替代物(45ml)+中科uc-msc培养基补充剂(5ml)。
[0097]
培养体系2(现有市售培养基):达科为msc基础培养基(480ml)+ 达科为血清替代物(20ml)。
[0098]
基于各自的培养体系,取同一组织供体来源cpj位置,按工艺流程处理,每培养皿接种25个大小均一的小组织块,期间同一时间点进行细胞消化,传代,换液操作以降低其他因素对实验的干扰,将细胞培养至p10代。
[0099]
期间显微镜下检测两实验组p0/p5/p10代细胞状态,如图10所示(图 10:两种培养体系下p2/p5/p10代次脐带来源msc镜下状态):
[0100]
根据p2代镜下细胞形态对比,可以发现,与对照培养体系相比,优化的msc培养基中培养的hmsc表现出更原始形态学特点。达科为培养基中培养的hmsc细胞的形态扁平,可达到1.0~3.0
×
104个细胞/cm2的汇合状态,而优化培养基中培养的hmsc细胞体积小很多,呈纺锤形,切密度可达》5.0
ꢀ×
104个细胞/cm2。
[0101]
而通过比对各组p2/p5/p10代次细胞状态,可以发现,中科优化培养基条件下,至p10代细胞仍能保持均一的间充质干细胞的形态特征,而达科为培养基条件下,p10代细胞间大小有差异,部分细胞内空泡化,形态一致性较差。
[0102]
以上结果说明,优化的培养体系可以在长期细胞培养和传代中维系细胞的正常生长状态。
[0103]
同时,为了测试不同培养体系的细胞扩增效率,以2.5
×
104/培养瓶接种细胞在含有不同培养基的t-25培养瓶中,每组3个平行样本,在 p1/p3/p5/p7/p10传代时进行了细胞计数,以根据收获的细胞体积计算获得的细胞总量。结果如图11所示(图11:两种培养条件下t-25培养瓶接种相同数目细胞后传至p10代所获得的细胞总数)。
[0104]
根据结果所示,分别在两种培养体系下接种相同数目的细胞 (0.25
×
106/t25),在p1代检测细胞计数时,中科培养体系下总细胞量达到 3.403
±
0.165
×
106,而达科为培养体系下总细胞量为0.383
±
0.025
×
106,说明在细胞培养初期中科体系细胞增殖更快,优于达科为体系,在p1即获得了较高的细胞数目,随后仍以相同细胞接种数目进行传代,至p10代,中科培养体系下共获得7.993
±
0.276
×
106细胞,达科为培养体系下共获得 4.300
±
0.096
×
106细胞,中科培养体系下获得的细胞总数约为达科为培养体系下的2倍,说明随着培养时间的增长,中科培养基条件下获得的细胞总量相对达科为培养体系极具优势。
[0105]
基于上述实验结果,在t-175平板上进行扩大实验,以2
×
106细胞/t175 接种同一组织来源的p4代脐带来源间充质干细胞,每个培养体系下接种10 瓶,以细胞汇合达到90%为细胞收集终点,计算中科培养体系和达科为培养体系下获得2亿细胞计算时间、培养基消耗以及人力成本,结果见表2:
[0106]
表2扩增至2亿细胞的时间、成本比较
[0107]
扩增至2亿细胞条件中科优化uc-msc培养基达科为基础培养基+血替单瓶接种细胞数2
×
10
62×
106细胞汇合度至90%时间4天5天目标细胞数需要t-175个数20瓶40瓶培养所需培养基体积25ml
×
20=500ml30ml
×
40=1200ml操作总时长4~5h7~8h
[0108]
扩大hmsc的产量对于任何活细胞治疗而言都至关重要。根据实验结果,使用优化的msc干细胞培养基与达科为基础培养基添加血替的培养体系相比,生产2亿细胞所需的培养基总量减少58%,表面积减少50%,时间缩短18%,时间精力减少40%。
[0109]
以上结果说明,在高细胞密度下实现中科msc基础培养基添加补充剂的优化条件下,可实现高效hmsc扩增,减少培养基的用量、降低细胞培养所需培养界面表面积,节省细胞制剂制备时间。
[0110]
临床应用的msc需要保成单一的细胞组成,即极高的细胞纯度以保证安全性。mscs具有独特的形态并表达一组特定的cd(分化簇)分子。临床用于鉴定mscs细胞的表型模式需要表达cd44、cd73、cd90和cd105,并且缺少cd34、cd45和hla-dr抗原。通过流式细胞技术检测的p10代 uc-msc流式表型,鉴定结果如图12所示(图12,优化培养条件下脐带间充质干细胞p10细胞表型鉴定),间充质细胞表面标志物cd44、cd73、cd90 和cd105表达占比分别为99.7%、99.9%、99.7%和97.9%;而阴性标志物表达为0.95%。
[0111]
以上结果说明,优化的工艺条件下获得至p10代次uc-msc细胞的纯度极高,符合临床应用标准。
[0112]
在优化培养工艺条件下培养的uc-msc保持其三系分化潜能
[0113]
本发明验证在优化培养体系条件下,多次传代后获得的高代次msc是否仍具有与低代次细胞相同的三系分化能力。
[0114]
在进行分化实验之前,人脐带来源msc在优化培养基中扩增至p10代。随后使用间充质干细胞相应的成脂(stempro
tm
脂肪生成分化试剂盒, thermo fisher a1007001)、成骨(stempro
tm
骨生成分化试剂盒,thermofisher a1007201)、成软骨(stempro
tm
软骨生成分化试剂盒,thermo fishera1007101)分化诱导试剂盒,根据操作手册进行培养,随后分别用油红o、茜素红、甲苯胺蓝对脂肪细胞、骨细胞和软骨细胞进行染色,评测uc-msc 的分化能力。结果如图13所示(图13,优化培养条件下脐带来源间充质干细胞p2/p5/p10代次三系分化能力鉴定)。
[0115]
根据图13可知,优化培养体系条件下获得的p2/p5/p10代次脐带间充质干细胞均具有分化为脂肪细胞、骨细胞、软骨细胞的能力,说明,在优化培养体系条件下扩增msc,经过多次传代后仍能保证msc细胞功能的稳定性。
[0116]
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1