一种低温下保护水稻叶绿体发育基因TSA及其编码蛋白质和应用
一种低温下保护水稻叶绿体发育基因tsa及其编码蛋白质和应用
技术领域
1.本发明属于基因工程领域,具体涉及一种水稻叶绿体发育相关基因tsa及其编码蛋白质和应用。
背景技术:
2.水稻是世界上重要的粮食作物之一,全球有超过一半的人口以水稻为主食。在我国,有超过60%的人以水稻为主食,是重要的粮食作物。因此,水稻的高产稳产对我国粮食安全具有重要意义。水稻高产的实现离不开叶绿体和叶绿素的作用。叶绿体发育相关基因的突变,造成叶绿体发育缺陷,光合作用降低,生长迟缓,甚至死亡。叶绿素代谢途径相关基因突变后,导致植物中叶绿素含量的变化,植物的颜色深浅发生变异,对植物的光合效率也有直接的影响。
3.水稻苗期是叶绿体系统建成时期,该时期极易受到低温影响。大田种植条件下,水稻苗期遭受低温胁迫时常表现发芽不整齐,叶色黄化甚至死亡的现象。因此,通过发掘低温条件下调节叶绿体发育基因并阐述其分子机制对提高水稻苗期的耐寒性具有重要作用。同时对于解析水稻高光合效率的成因具有重要的生物学意义,也为后续生产上超级稻的培育奠定良好的理论基础。
技术实现要素:
4.本发明的目的在于公开一种水稻低温条件下调控叶绿体发育基因tsa及其编码蛋白质和应用。
5.本发明提供基因tsa,为如下1)或2)所述的dna分子:
6.1)seq id no.1所示的dna分子;
7.2)seq id no.2所示的dna分子;
8.序列表中的seq id no.1或者seq id no.2,均由1404个核苷酸组成。
9.本发明还提供本发明所述基因tsa编码的蛋白质。
10.具体的,本发明提供的蛋白质,选自如(a)或(b)所示的任一种:
11.(a)由seq id no.3所示的氨基酸序列组成的蛋白质;
12.(b)将seq id no.3的氨基酸序列经过一个或几个氨基酸残基的取代和/或缺失和/或添加且与叶绿体发育相关的由seq id no.1或者seq id no.2衍生的蛋白质。
13.序列表中的seq id no.3,由467个氨基酸组成。
14.本发明还提供了含有所述基因tas的敲除表达载体,重组表达载体、融合互补载体或重组菌。含有以上任一所述基因的重组表达载体也属于本发明的保护范围。
15.扩增所述基因(tsa)全长或任一片段的引物也属于本发明的保护范围。
16.在精细定位此基因过程中涉及到的定位引物(见表1),indel引物为本实验需要而自行设计的引物,这些自行设计的引物也属于本发明的保护范围。
17.本发明还提供了seq id no.1所示的基因,所述蛋白质,所述重组表达载体、表达盒、转基因细胞系或重组菌中的至少一种在培育水稻叶色正常或者叶绿体发育正常的转基因水稻中的应用。
18.本发明还提供了一种培育叶色正常的转基因水稻的方法,是将seq id no.1所示的基因导入叶色异常水稻中,得到叶色正常的转基因水稻,所述的叶色异常水稻是指低温环境下出现白化表型的水稻,所述叶色正常水稻是指低温环境下叶色正常表型的水稻。
19.本发明还提供了一种培育叶绿体发育正常的转基因水稻的方法,是将seq id no.1所示的基因导入叶绿体发育异常水稻中,得到叶绿体发育正常的转基因水稻。
20.本发明还提供seq id no.2所示的基因、seq id no.2编码的蛋白质、或者包含seq id no.2所示的基因的重组表达载体、表达盒或重组菌在水稻叶色或者叶绿体发育研究中的应用。
21.有益效果:
22.本发明通过图位克隆技术克隆了一个低温条件下调控叶绿体发育的基因tsa,转基因敲除及功能互补实验证明tsa在低温条件下保护叶绿体正常发育至关重要。荧光定量pcr发现tsa在低温条件下(20℃)被诱导表达(图6),适当调节tsa的表达提高水稻冷胁迫的适应性,为培育耐冷水稻新品种提供新思路。同时可利用该基因调控水稻叶绿体发育,提高光合作用效率,增加水稻产量。除此之外该基因突变体遗传稳定,可以作为标记用于生产实践中。
附图说明:
23.图1为野生型n3与突变体tsa的表型。
24.图2为野生型n3与突变体tsa的叶绿素含量测定及透射电镜观察。
25.图3为野生型n3与突变体tsa投射电镜观察。
26.图4为tsa在水稻第2染色体上的精细定位。
27.图5为转基因敲除与功能互补植株的表型。
28.图6为tsa受低温诱导表达。
具体实施方式
29.以下的实施例便于更好地理解本发明,但并不限定本发明。下述实施例中的实验方法,如无特殊说明,均为常规方法。下述实施例中所用的试验材料,如无特殊说明,均为自常规生化试剂商店购买得到的。
30.实施例1、低温条件下叶绿体发育缺陷突变体tsa的发现
31.一、突变体tsa的表型及遗传分析
32.在ems诱变池中,筛选出一个温敏白化突变体,命名为tsa。
33.与野生型n3比较,在20℃条件下tsa第一叶淡绿,第二叶和第三叶表现出白化的表型并在四叶期开始转绿,第四叶表现为绿色;在30℃下tsa表现出淡绿的表型。说明该突变体是一个温敏白化转绿的材料,在低温环境下出现白化表型,而随着温度的升高和生长发育阶段的进行表型会逐渐恢复至野生型表型(图1)。突变体tsa与野生型进行正交和反交,f1苗期在20℃条件下生长,叶片为绿色,说明该tsa白化转绿的表型由隐性核基因控制。
34.通过对二叶期叶绿素含量进行测定,发现20℃条件下tsa幼苗第二叶中叶绿素a、叶绿素b、类胡萝卜素含量以及总叶绿素含量均极显著低于野生型(图2)。通过透射电镜观察发现,20℃条件下,tsa完全白化部位叶绿体发育异常,部分细胞叶绿体结构异常,类囊体片层缺失(图3)。
35.二、突变基因位点的图位克隆
36.1、突变基因的定位
37.在低温条件(20℃)培养箱中选取tsa和9311杂交得到的f2群体中的10株二叶期白化个体,利用165对多态性标记根据基因分型进行连锁分析,将控制叶色突变的基因初步定位在2号染色体长臂上,位于标记i2-10与indel96之间,两分子标记之间约为1mbp。在此基础上,增加白化单株至384株,并增加多态性分子标记进一步缩小定位区间至y1与y28之间,两分子标记相距约为24.56kb(图4)。
38.上述ssr标记分析的方法如下所述:
39.水稻组织dna提取,具体方法如下:
40.a)取挑选f2群体中隐形单株叶片0.2g左右于2.0ml离心管中,液氮冷冻后用研磨仪粉碎样品。
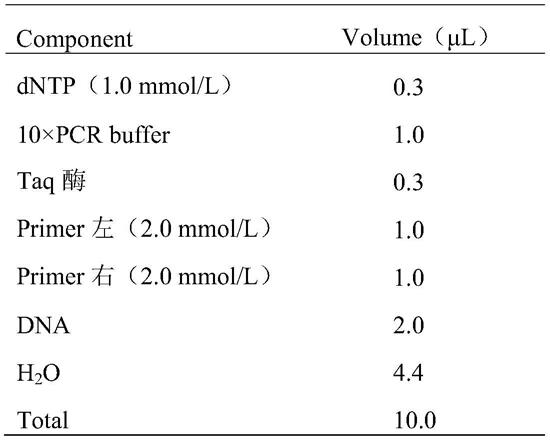
41.b)加入650μl ctab提取液,将样品65℃中孵育25min,每5min震荡一次。
42.c)加入650μl氯仿:异戊醇(24:1),颠倒混匀并静置5min。
43.d)12000rpm离心8min。
44.e)将上清液转移至一个新的1.5ml离心管中,并加入0.7倍上清体积的异丙醇,混匀后放置于-20℃。
45.f)冷冻1小时后,12000rpm离心8min(4℃),弃去上清液。
46.g)用70%乙醇洗涤沉淀两次,通风橱中将沉淀晾干。将dna沉淀溶于100μl去离子水中,-20℃保存备用。
47.(2)将上述提取的dna稀释成约20ng/μl,作为模板进行pcr扩增:
48.pcr反应体系为:
[0049][0050]
pcr反应程序为:
[0051][0052]
分子标记的开发是利用在线网站(http://ricevarmap.ncpgr.cn/),参考基因组分别是nipponbare与9311。
[0053]
表1用于精细定位的分子标记
[0054][0055]
2、目的基因的获得
[0056]
利用gramene(http://www.gramene.org/)网站预测,标记y1与y28间24.56kb区间内含了6个orfs。经过测序发现第四个orf编码区发生了一个碱基的替换,导致了一个氨基酸的改变。即由野生型的seq id no.1所示基因(编码蛋白序列如seq id no.3所示)变为突变型的seq id no.2所示的基因。
[0057]
第四个orf测序引物序列如下所述:
[0058]
primer1:tccgctctcccctatccat
[0059]
primer2:aacccctaaaactcaacgcg
[0060]
以野生型和突变体dna为模板进行pcr扩增,扩增体系为:dna模板5μl,ddh2o 10μl,2xbuffer 25μl,2μm dntps 10μl,kod 1μl,primer 5μl。
[0061]
实施例2、转基因植物的获得和鉴定
[0062]
一、重组表达载体构建
[0063]
利用crispr-p在线网站(http://cbi.hzau.edu.cn/cgi-bin/crispr)设计候选基因tsa的敲除引物,引物序列为:
[0064]
primer3:5'ggcatcggattctcctcgcccgcg 3'
[0065]
primer4:5'aaaccgcgggcgaggagaatccga 3'
[0066]
以野生型的dna为模板,进行pcr扩增获得tsa基因及启动子,构建pcambia1390互补载体,pcr引物序列如下:
[0067]
primer5:
[0068]
5'ccggcgcgccaagctt tccagtaaagtaacaagcagta 3'
[0069]
primer6:
[0070]
5'gaattcccggggatccattagttgcaaacagatgtatc 3'
[0071]
以野生型cdna为模板,扩增获得tsa基因,构建pcambia1305.1 gfp融合载体,pcr引物序列如下:
[0072]
primer7:
[0073]
5'cgg agc tag ctc tag a atggcctccctcgcctccgc 3'
[0074]
primer8:
[0075]
5'tgc tca cca tgg atc c cttcaagatcgtattgatga 3'
[0076]
上述引物扩增的pcr产物纯化回收后分别与对应的线性化载体重组。重组体系(10μl):dna 3μl,线性载体2μl,重组mix 5μl(takara)。
[0077]
载体构建步骤:
[0078]
a)将10μl混合物置于50℃水浴锅中重组20min。
[0079]
b)将重组产物转移到100μl的大肠杆菌感受态(dh5α)中混匀,冰浴25min。然后在42℃水浴锅中热激60s后,置于冰上静置5min。
[0080]
c)加入500μl大肠杆菌培养基在37℃摇床复苏1h。
[0081]
d)加相应抗生素平板涂布,在37℃培养箱中倒置培养15h。
[0082]
e)挑取单克隆菌株到含有1ml培养基的灭菌pe管中,在37℃条件培养6h,提取表达载体质粒并测序。
[0083]
f)用冻融法分别将敲除载体,功能互补载体及融合互补载体转化农杆菌eha105菌株,得到重组菌株。
[0084]
二、转基因植物的获得
[0085]
1、愈伤组织的侵染
[0086]
a)28℃条件下培养转基因敲除菌株和功能互补菌株16小时,收集菌体,并稀释到n6液体培养基(sigma公司,c1416)中至浓度为od600≈0.5,获得菌液。
[0087]
b)敲除菌株和互补菌株分别侵染野生型n3和n3/tsa杂交种制备而成的愈伤组织,培养3天。
[0088]
c)将侵染后的愈伤组织转移到含有相应抗性筛选化合物的n6固体培养基中筛选15天。
[0089]
d)挑取健康愈伤用相应筛选培养基进行第二次筛选。
[0090]
e)挑取抗性愈伤置于筛选分化培养基上分化。
[0091]
2、转基因植株的鉴定。
[0092]
转基因敲除植株的鉴定:在敲除靶点上下游200bp附近设计扩增引物,提取转基因植株dna扩增,测序分析编辑方式。敲除纯合植株均表现出白化表型。
[0093]
功能互补植株的鉴定:t1分离获得转基因植株,在突变体背景下,转基因阳性植株均表现出正常的叶色表型,而转基因隐性植株仍在低温条件下表现出白化表型(图5)。
[0094]
实施例3、低温条件下诱导tsa转录水平
[0095]
1、植物总rna的提取及反转录
[0096]
将野生型(n3)分别种植在20℃,25℃,30℃培养箱中,待幼苗生长到二叶期,选取第二片叶提取总rna。rna的提取使用北京天根生化科技公司的植物总rna提取试剂盒
(dp432)。取1μg总量rna,使用takara反转录试剂盒(rr036a)反转成20μl cdna母液,将母液稀释10倍成工作液-20℃保存备用。
[0097]
2、real-time pcr分析
[0098]
real-time pcr仪器使用的是abi 7500荧光定量检测系统(applied biosystems)。试剂是宝生物公司的tb green premix ex taqⅱ(tli rnaseh plus)预混液。
[0099]
pcr体系(20μl):
[0100][0101]
pcr程序:95℃,30s;95℃,5s;60℃,34s;至第二步39个循环;65℃至95℃的溶解曲线。每个实验组分别设有三个生物学重复和三个技术性重复。水稻ubq基因作为内参基因,定量引物如下:
[0102]
tsa forward primer:ggccaaccctgccattaagc
[0103]
tsa reverse primer:agcaagcaagaacgggaggt
[0104]
ubq forward primer:gctccgtggcggtatcat
[0105]
ubq reverse primer:cggcagttgacagccctag
[0106]
低温条件下诱导tsa转录水平结果如图6所示,可见其受低温诱导表达。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1