一种枯草芽孢杆菌菌株及其筛选方法和应用
1.本发明涉及属于微生物菌株技术领域,尤其涉及一种枯草芽孢杆菌菌株及其筛选方法和应用。
背景技术:
2.水稻稻曲病是由子囊菌门稻曲病菌(villosiclava virens)引起的水稻穗部病害。近年来稻曲病发病情况日趋严重,全世界主要稻米产区都有大面积发生,与稻瘟病、纹枯病并称水稻新三大病害。稻曲病不仅造成水稻产量损失严重,并且该病菌产生的毒素污染水稻籽粒,存在严重危害人畜健康安全的风险。因此环保有效的控制稻曲病关系到我国的粮食安全和食品安全。稻曲病的发生严重影响到了水稻的产量和品质。
3.微生物群落多样性对植物健康具有显著影响,研究表明人为利用混合菌群改变叶际微生物多样性能够显著提高植物抗病能力。已有大量报道表明部分叶际微生物对稻瘟病、纹枯病和白叶枯致病菌具有较高的抑制活性。如何从水稻穗部分离出具有抗病能力的微生物,利用该微生物制作病害抑制制剂,减少化学杀菌剂的使用,从而能够绿色有效的减少病害发生。
4.然而目前现有技术并未公开利用水稻筛选出可防治水稻稻曲病的菌株。
技术实现要素:
5.有鉴于此,本发明提出了一种枯草芽孢杆菌菌株及其制备方法,以解决现有技术中存在的技术问题。
6.第一方面,本发明提供了一种枯草芽孢杆菌菌株,所述菌株保藏号为cctcc no:m 20211416。
7.第二方面,本发明还提供了一种所述的枯草芽孢杆菌菌株的筛选方法,包括以下步骤:
8.于孕穗期采集水稻抗病品种穗苞;
9.将抗病品种穗苞消毒后,剥去穗子外皮得到颖壳,将颖壳放入无菌管中,加入磷酸钾缓冲液后超声洗涤,再涡旋震荡,收集涡旋洗脱液,再将洗脱液真空抽滤或离心分离得到沉淀,再分离得到枯草芽孢杆菌菌株。
10.优选的是,所述的枯草芽孢杆菌菌株的筛选方法,采用质量浓度为75~80%的乙醇溶液进行消毒。
11.优选的是,所述的枯草芽孢杆菌菌株的筛选方法,磷酸钾缓冲液的ph为8~9。
12.优选的是,所述的枯草芽孢杆菌菌株的筛选方法,每g颖壳加入8~12ml、0.08~0.12m的磷酸钾缓冲液。
13.第三方面,本发明还提供了一种所述的枯草芽孢杆菌菌株在防治水稻真菌病害中的应用。
14.优选的是,所述的应用,所述的水稻真菌病害包括稻曲病菌、稻瘟病菌、纹枯病菌
引起的病害。
15.本发明的一种枯草芽孢杆菌菌株及其筛选方法相对于现有技术具有以下有益效果:
16.(1)本发明的枯草芽孢杆菌菌株筛选自水稻孕穗期穗苞,该枯草芽孢杆菌菌株可用于防治水稻真菌病害,具体的可以防治稻曲病菌、稻瘟病菌、纹枯病菌引起的病害;
17.(2)本发明的枯草芽孢杆菌菌株的筛选方法,选取选取水稻孕穗期穗苞作为微生物提取材料,可以确保植物感病时期微生物定殖能力;选取水稻孕穗期穗苞作为微生物提取材料,可以确保植物感病时期微生物与致病菌存在竞争抑制;选取抗病品种水稻作为病原菌分离材料,能够提高筛选效率,得到更多对病害发生产生抑制作用的有益微生物;相比于生防菌株大多于土壤中分离,本技术的病原菌侵染位点分离的微生物具有定殖能力强,能够于植物免疫协同的的优势;本技术的筛选方法,富集过程中使用小型超声波清洗机、涡旋仪从颖壳内可最大可能洗脱微生物菌体,使用便携无油真空连接微生物限度检测仪可富集悬浮液当中几乎所有微生物,确保微生物不丢失。
附图说明
18.为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单的介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
19.图1为本发明实施例1中枯草芽孢杆菌ir28-8酚红染色结果图;
20.图2为本发明实施例1中枯草芽孢杆菌ir28-8在lb固体培养基上的生长状态图;
21.图3为mega7结合临接法(neighbor-joining method)16s序列系统发育树。
具体实施方式
22.下面将结合本发明实施方式,对本发明实施方式中的技术方案进行清楚、完整的描述,显然,所描述的实施方式仅仅是本发明一部分实施方式,而不是全部的实施方式。基于本发明中的实施方式,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施方式,都属于本发明保护的范围。
23.本技术实施例提供了一种枯草芽孢杆菌菌株,菌株保藏号为cctcc no:m 20211416。
24.基于同一发明构思,本技术实施例还提供了一种上述的枯草芽孢杆菌菌株的筛选方法,包括以下步骤:
25.s1、于孕穗期采集水稻抗病品种穗苞;
26.s2、将抗病品种穗苞消毒后,剥去穗子外皮得到颖壳,将颖壳放入无菌管中,加入磷酸钾缓冲液后超声洗涤,再涡旋震荡,收集涡旋洗脱液,再将洗脱液真空抽滤或离心分离得到沉淀,再分离得到枯草芽孢杆菌菌株。
27.需要说明的是,本技术的枯草芽孢杆菌菌株的筛选方法,孕穗期是稻曲病侵染关键时期,选取选取水稻孕穗期穗苞作为微生物提取材料,可以确保植物感病时期微生物定殖能力;选取水稻孕穗期穗苞作为微生物提取材料,可以确保植物感病时期微生物与致病
菌存在竞争抑制;选取抗病品种水稻作为病原菌分离材料,能够提高筛选效率,得到更多对病害发生产生抑制作用的有益微生物;相比于生防菌株大多于土壤中分离,本技术的病原菌侵染位点分离的微生物具有定殖能力强,能够于植物免疫协同的的优势;本技术的筛选方法,富集过程中使用小型超声波清洗机、涡旋仪从颖壳内可最大可能洗脱微生物菌体,使用便携无油真空连接微生物限度检测仪可富集悬浮液当中几乎所有微生物,确保微生物不丢失。
28.具体的,在一些实施例中,步骤s1具体为:于孕穗期且穗节高于叶枕5-10cm时期,采集水稻抗病品种穗苞。
29.在一些实施例中,采用质量浓度为75~80%的乙醇溶液进行消毒。具体的,采用质量浓度为75%的乙醇溶液进行消毒。
30.在一些实施例中,磷酸钾缓冲液的ph为8~9,优选的,磷酸钾缓冲液的ph为8。
31.在一些实施例中,每g颖壳加入8~12ml、0.08~0.12m的磷酸钾缓冲液,优选的,每g颖壳加入10ml、0.1m的磷酸钾缓冲液。
32.具体的,步骤s2中为:将抗病品种穗苞使用75%的乙醇溶液消毒后,剥去穗子外皮得到颖壳,将颖壳放入无菌管中,按重量每克样本加入10ml 0.1m磷酸钾缓冲液(ph=8.0),然后放入超声波发生器洗涤1min,取出后涡旋震荡10s,此步骤重复2次;超声波及涡旋洗脱液倒入收集杯中,重新加入新的缓冲液,再次使用超声波及涡旋洗脱穗子内部微生物;将两次洗脱液混合,将微生物限量装置链接到抽滤瓶和抽滤泵上,使用抽真空将微生物富集到过0.22μm滤膜上(或13000g离心10min,收集沉淀),重新洗脱后再使用用平板分离法,分离即可得到本技术的枯草芽孢杆菌菌株。
33.基于同一发明构思,本技术的枯草芽孢杆菌菌株在防治水稻真菌病害中的应用。具体的,水稻真菌病害包括稻曲病菌、稻瘟病菌、纹枯病菌引起的病害。
34.以下进一步以具体实施例说明本技术的枯草芽孢杆菌菌株的筛选方法。
35.实施例1
36.本技术实施例还提供了一种的枯草芽孢杆菌菌株的筛选方法,包括以下步骤:
37.s1、于孕穗期且穗节高于叶枕5-10cm时期,采集水稻抗病品种穗苞;
38.s2、将抗病品种穗苞使用75%的乙醇溶液消毒后,剥去穗子外皮得到颖壳,将颖壳放入无菌管中,按重量每克样本加入10ml 0.1m磷酸钾缓冲液(ph=8.0),然后放入超声波发生器洗涤1min,取出后涡旋震荡10s,此步骤重复2次;超声波及涡旋洗脱液倒入收集杯中,重新加入新的缓冲液,再次使用超声波及涡旋洗脱穗子内部微生物;将两次洗脱液混合,将微生物限量装置链接到抽滤瓶和抽滤泵上,使用抽真空将微生物富集到过0.22μm滤膜上,再使用用平板分离法分离;
39.分别选择抗病品种ir28和感病品种wx98的穗苞作为微生物富集来源材料,按以上方法富集穗苞内微生物,送样进行扩增子测序,使用平板分离法,分离并培养微生物群落,以菌液为模板使用16s-8f(其基因序列为5
’‑
agagtttgatcctggctcag-3’(seq id no:1))和16s-1492r(其基因序列为5
’‑
ggttaccttgttacgactt-3’(seq id no:2))扩增16s鉴定序列,通过ncbi网站中blastn比对序列,获得微生物鉴定初步结果。使用分析软件mega7结合临接法(neighbor-joining method)与芽孢杆菌属标准菌株的16s序列构建系统发育树,并通过酚红染色和菌落形态观察确定ir28-8菌株为枯草芽孢杆菌(bacillus subtilis)。将具有
候选抑菌活性的微生物继代培养并保存。
40.具体的,本技术的枯草芽孢杆菌菌株(编号ir28-8)16s测序结果为:
41.caccagcgcgtgctatacatgcaagtcgagcggacagatgggagcttgctccctgatgttagcggcggacgggtgagtaacacgtgggtaacctgcctgtaagactgggataactccgggaaaccggggctaataccggatggttgtttgaaccgcatggttcaaacataaaaggtggcttcggctaccacttacagatggacccgcggcgcattagctagttggtgaggtaacggctcaccaaggcaacgatgcgtagccgacctgagagggtgatcggccacactgggactgagacacggcccagactcctacgggaggcagcagtagggaatcttccgcaatggacgaaagtctgacggagcaacgccgcgtgagtgatgaaggttttcggatcgtaaagctctgttgttagggaagaacaagtaccgttcgaatagggcggtaccttgacggtacctaaccagaaagccacggctaactacgtgccagcagccgcggtaatacgtaggtggcaagcgttgtccggaattattgggcgtaaagggctcgcaggcggtttcttaagtctgatgtgaaagcccccggctcaaccggggagggtcattggaaactggggaacttgagtgcagaagaggagagtggaattccacgtgtagcggtgaaatgcgtagagatgtggaggaacaccagtggcgaaggcgactctctggtctgtaactgacgctgaggagcgaaagcgtggggagcgaacaggattagataccctggtagtccacgccgtaaacgatgagtgctaagtgttatggggtttccgccccttagtgctgcagctaacgcattaagcactccgcctggggagtacggtcgcagactgaaaactcaaagggaattgacgggggccgcacagcgtggagcatgtggattaatccgagcacgcgagactaacaagtctgacatcttctgacaatcctagaagaatagg(seq id no:3)
42.1、水稻穗苞微生物分离统计
43.从抗病水稻品种ir28穗部分离细菌分离物共31株,具有拮抗作用的菌株共21株,占所有细菌分离物67.7%。从感病水稻品种wx98穗部分离细菌分离物21株,具有拮抗作用的菌株2株,占所有细菌分离物9.5%。具体的,水稻品种ir28和wx98的水稻穗苞微生物分离统计表如下表1所示。
44.表1-水稻穗苞微生物分离统计表
45.[0046][0047]
表1中菌株名称为ir28-8,即为本技术的枯草芽孢杆菌菌株。
[0048]
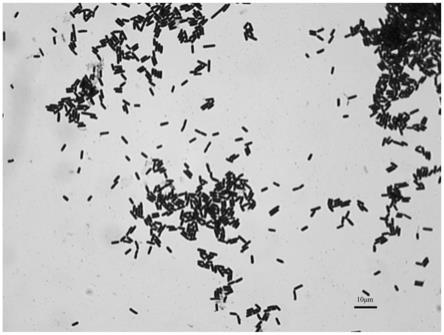
如图1所示,该菌株的菌体为短杆状,大小为0.7~0.8
×
2~6μm。
[0049]
如图2所示,该菌株在营养琼脂平板上生长是,菌落白色、表明不规则有褶皱。
[0050]
如图3所示,经临接法系统发育分析,得到结论ir28是枯草芽孢杆菌bacillus subtilis。
[0051]
2、水稻主要病害抑菌活性检测
[0052]
抑制稻瘟病和纹枯病活性测定
[0053]
于pda培养基中接种稻瘟病菌或纹枯病菌菌饼,28℃恒温培养3d后(纹枯病菌无此步骤),在菌落周围四点放置直径5mm滤纸片,将芽孢杆菌滴到滤纸片上,每个处理重复三次,以对照菌落长满培养基时测量直径并计算抑菌率。
[0054]
抑菌率(%)=处理菌株直径/对照病原菌生长直径
×
100%
[0055]
抑制稻曲病菌活性测定
[0056]
于psa培养基中混入稻曲病菌分生孢子,使培养基中孢子浓度达到1
×
106cfu/ml。在培养基四点十字型放置无菌滤纸片,滴入5ml待检测菌液,每个处理重复三次。以滴入lb培养基的滤纸片为对照,待稻曲病菌长满平板时计算抑菌率。
[0057]
经过实验,所获得的8个菌株对三种主要水稻病害具有抑制作用。接种稻曲病菌到平板中央其中菌株ir28-8和ir28-9对稻曲病菌具有较强的抑菌活性,抑制率超过50%。稻瘟病菌抑制率超过60%的菌株有ir28-4、ir28-6和ir28-8。具体,如下表2所示。
[0058]
表2-芽孢杆菌对3种水稻病原真菌的抑菌活性
[0059][0060][0061]
盆栽试验防治效果与次年田间试验防治效果
[0062]
在塑料桶中装入泥土,并栽种感病品种wx98,每桶栽种2株。活化好的拮抗细菌培养基中28,℃150r/min,摇培48h。注射接种水稻穗部,24h后注射接种稻曲病菌孢子悬浮液,每个处理重复三次,以注射lb培养液为对照。盆栽防治试验结果表明,所筛选的8个菌株对稻曲病具有一定的防治作用,其中ir28-8(即本技术的枯草芽孢杆菌菌株)防治效果最好,防效超过60%,显著高于其他菌株。总体田间试验与盆栽试验防效趋势基本一致,ir28-8和ir28-9田间防效均超过60%,显著高于其他候选菌株,具体如下表3所示。
[0063]
表3-菌株对水稻稻曲病防治效果
[0064]
菌株 盆栽防效(%)田间防效(%)ir28-4贝莱斯芽孢杆菌57.69
±
0.13c56.42
±
0.60cir28-6特基拉芽孢杆菌57.14
±
0.32c55.64
±
0.34cir28-7贝莱斯芽孢杆菌45.67
±
1.34e43.97
±
0.26fir28-8枯草芽孢杆菌64.76
±
1.02a63.41
±
0.38air28-9枯草芽孢杆菌59.65
±
0.61b61.88
±
0.95b
ir28-11海水芽孢杆菌55.32
±
0.15d51.52
±
1.17dir28-15海口芽孢杆菌58.11
±
0.81c46.43
±
0.69eir28-18海口芽孢杆菌14.87
±
0.62h12.06
±
0.67h
[0065]
表3中,相同字母表示0.05水平上差异不显著。
[0066]
以上所述仅为本发明的较佳实施方式而已,并不用以限制本发明,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1