一株高耐硒灵芝突变体菌株及其应用
1.本发明涉及一株高耐硒灵芝突变体菌株及其应用,具体涉及一种采用诱变育种方法获得的在高硒浓度条件能维持较高生长速度的灵芝突变体及应用,属于真菌育种技术领域。
背景技术:
2.灵芝(ganoderma lucidum),是一类在自然界中主要在木质材料或树木上腐生或寄生生长的大型子实体真菌,属担子菌门。灵芝以及与灵芝同一属(灵芝属,ganoderma)的紫芝、树舌等真菌在我国传统医学中大多属于有保健或治疗功能的药用或食用真菌。
3.硒是人体多种含硒活性蛋白的组成成分,硒元素在地表含量少,人体从正常食物中得到的硒有时不能完全满足人体的需求,富硒食品是帮助人们“补硒”的重要途径。灵芝有较强的富硒能力,多年来我国科技工作者对采用灵芝富硒进行了较多的研究。我国湖北省利川市、安徽省石台县等地有一些土壤中硒含量较高的小区域,这些小区域中生长的灵芝可能具有较高的耐硒和富硒能力。
技术实现要素:
4.本发明的目的是克服上述不足之处,提供一株高耐硒灵芝突变体菌株及其应用,该灵芝菌株耐硒能力较高,能够在高硒浓度环境下有较高生长速度。
5.本发明的技术方案,一株高耐硒灵芝突变体菌株ml2613,已保藏于中国典型培养物保藏中心cctcc,地址中国武汉武汉大学,分类命名为灵芝ml2613ganoderma sp.ml2613,保藏编号cctcc no:m 20211217,保藏日期为2021年9月26日。
6.所述高耐硒灵芝突变体菌株ml2613,its序列如seq id no.1所示。
7.所述高耐硒灵芝突变体菌株ml2613的制备方法,采用富硒地区的灵芝进行菌丝体分离培养,筛选出其中耐硒灵芝菌,继续进行培养后收集孢子粉,对孢子粉进行诱变,经过培养获得菌丝体菌落,选取生长速度最快的菌株,最终获得高耐硒灵芝突变体菌株ml2613。
8.进一步地,所述诱变方法具体为co
60
照射。
9.进一步地,照射剂量控制在0.4-0.6kgy。
10.进一步地,将诱变获得的孢子粉的生理盐水悬液转入高硒含量的pda液体培养基中进行培养6-8d。
11.进一步地,所述高硒含量具体为硒含量为1800mg/l。
12.所述菌株的应用,将其应用于高硒环境中进行灵芝的栽培。
13.进一步地,提高获得富硒菌丝体的效率。
14.进一步地,在硒含量1600mg/l的环境下生长速度快。
15.本发明的有益效果:本发明筛选获得的菌株与原菌株菌丝体培养物相比,突变体ganoderma sp.ml2613可以在硒含量为1600mg/l的培养液中维持正常生长,而原菌株的菌丝体在同样的发酵培养液中生长极其缓慢。突变体ganoderma sp.ml2613更适合在高硒含
量环境中培养,具有获得富硒菌丝体的潜力,也有利于在高硒环境中进行灵芝的野外栽培。
16.生物材料样品保藏:一株高耐硒灵芝突变体菌株ml2613,已保藏于中国典型培养物保藏中心cctcc,地址中国武汉武汉大学,分类命名为灵芝ml2613ganoderma sp.ml2613,保藏编号cctcc no:m 20211217,保藏日期为2021年9月26日。
附图说明
17.图1st308在发酵培养基中的菌体量增长曲线。
18.图2st308和ml2613在高硒发酵培养基中的菌体量增长曲线。
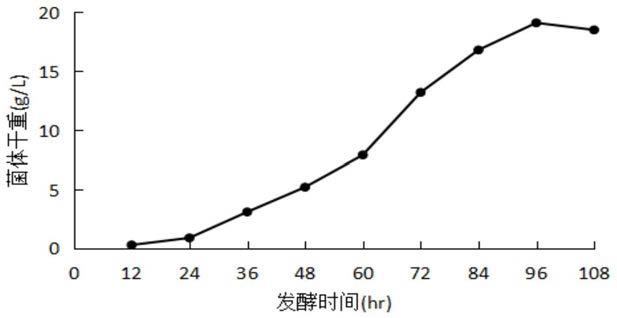
19.图3ganoderma sp.ml2613在发酵培养基中的生长曲线。
20.图4ganoderma sp.ml2613与ganoderma sp.st308在高硒发酵培养基中的生长曲线。
具体实施方式
21.通过实施例对本发明作进一步说明,实施例将不以任何方式限制本发明的范围。
22.实施例1高耐硒灵芝ml2613的制备
23.(1)灵芝菌子实体的采集与分离培养:在我国湖北省利川县、安徽省石台县等富硒地区寻找腐烂木头、树枝、树根等处生长的灵芝菌,重点采集在腐烂树根上生长的灵芝菌。将采集的灵芝在采样当天运回实验室进行菌丝体的分离培养。取上述子实体根部细长的白色菌索,先用自来水进行长时间冲洗,再用大量无菌水清洗。在质量浓度为3%的双氧水中浸泡5min左右,再用无菌水冲洗。最后将冲洗后的灵芝菌菌索接种pda培养基培养1周左右。
24.若培养物中出现黑色、绿色等有颜色的孢子的判定为霉菌,或被霉菌污染的培养物,不再使用;若菌丝体为纯白色、菌丝粗壮且向四周延展的则初步判定为灵芝菌的菌丝体。
25.按照上述培养过程共获得灵芝菌丝体培养物100多个。
26.(2)耐硒灵芝菌筛选:将上述菌丝体分别接种在含硒量为3200mg/l的pda固体培养基中。结果显示其中有11株菌在上述培养基上生长旺盛,其他菌则生长缓慢或不能生长。将上述11株菌株的菌丝体培养物接种硒含量为1400mg/l的高硒发酵培养基,观察生长情况,结果显示原始编号为st308的菌株显然具有更快的生长速度。菌株st308目前已经分别保藏在江南大学教育部工业微生物资源信息平台和无锡先秦生物科技有限公司菌种库中,保藏编号分别为cicim f7083和xq 5258。
27.(3)灵芝菌的诱变及高耐硒灵芝突变体筛选:
28.a、收集:取上述st308菌株的菌丝体接种木屑培养基。培养约5个月后培养基中的菌丝体靠近三角瓶周边的部分出现灵芝子实体的生长,将子实体取出接种缺水的木屑培养基。大约培养2周左右,部分培养的灵芝周边的铝箔上可以看到少许的孢子粉。将孢子粉取出后收集在无菌离心管中,将多次收集的孢子粉集中后用大约10ml生理盐水悬浮;
29.b、诱变:将悬浮的孢子粉进行co
60
照射,照射剂量控制在0.5kgy左右。将上述经过诱变的孢子悬液转入硒含量为1800mg/l的高硒pda液体培养基中培养7天;将培养液稀释后,涂布含4000mg/l硒的固体pda培养基,合计大约涂布了1000个平板。在培养大约1个月后,其中约60块平板的pda培养基上大约形成300多个微弱生长菌丝体菌落。将上述菌丝体
分别转移到新的硒含量为4000mg/l的高硒pda平板上。培养大约5天后大约获得120个菌丝体菌落。将上述菌丝体接种硒含量为1600mg/l的高硒pda液体培养基,在30℃,120r/min摇瓶培养,从48小时起,间隔24小时取样检测菌体干重。结果显示,其中一株编号为ml2613的菌株生长速度明显快于其它菌株,判断为耐硒突变株。
30.(4)耐硒突变株的鉴定与保藏:上述耐硒突变株ml2613菌丝体培养提取染色体后进行its基因序列分析。结果显示ml2613的its序列与出发菌st308的its基因序列完全一致,序列同seq id no.1。根据真菌的命名规则,将上述耐硒突变株ml2613的菌丝体培养物命名为:ganoderma sp.ml2613,其菌丝体培养物已保藏在中国典型培养物保藏中心(中国武汉大学),保藏编号为cctcc no:m 20211217,保藏时间为2021年9月26日。
31.材料和方法:
32.基础pda培养基:将土豆400g洗净后去皮,切成厚约3mm的小块,加水至1l,加热煮沸10min,用纱布滤去固体部分。取滤液,补加水至700ml。按每升最终培养基20g的量加入葡萄糖,即得到基础pda液体培养基;按每升最终培养基15g/l的量加入琼脂粉即得到基础固体pda培养基。上述培养基在配制时一般采用1l的三角瓶,配制前先用量筒量取1l水加入三角瓶中,准确标出1l体积水位线。上述成分配制完成后即进行灭菌,110℃,10min。
33.在实际使用时按照下面高硒培养基的配制方法在已灭菌的基础培养基中补加亚硒酸钠水溶液和水配制成不同含硒量的pda培养基。其中只补水不补亚硒酸钠溶液的培养基一般简称为pda培养基或固体pda培养基。
34.高硒培养基:取五水亚硒酸钠配制成90g/l的水溶液,用细菌过滤器过滤除菌得到亚硒酸钠溶液。配制pda培养基或发酵培养基时,在培养基灭菌后加入不同体积的上述亚硒酸钠溶液,即得到相应浓度的含硒培养基。五水亚硒酸钠的分子量为262,而硒的原子量为79,五水亚硒酸钠中硒的含量为30%。
35.实施例1中使用的3200mg/l的高硒培养基在配制时,一般是取预先灭菌的700ml培养基与118ml上述亚硒酸钠溶液混合,再补无菌水182ml得到1l硒含量为3200mg/l的高硒培养基。实际操作时由于灭菌过程会导致培养基体积变化所以最终补无菌水的量是以预先标出的1l水位线为准。其它浓度的高硒培养基按同样方式配制,例如2500mg/l的高硒培养基是取700ml已经灭菌的培养基与92ml的上述亚硒酸钠溶液混合,再补大约108ml的水得到1l硒含量为2500mg/l的高硒培养基。
36.发酵培养基:葡萄糖40g,磷酸二氢钾0.2g,尿素1g,无水氯化钙0.1g,无水氯化镁0.05g,麦芽汁粉10g,酵母粉5g。一般是取700ml的水,加入上述成分混合溶解得到初始培养基,配制完成后即按110℃灭菌15min,并同时准备无菌水。上述培养基在使用时如配制无硒普通培养基则直接补水至1l即得到总体积为1l的发酵培养基。如配制高硒发酵培养基则是在上述初始培养基中加入相应浓度的亚硒酸钠溶液,进一步补水至1l得到高硒发酵培养基。高硒发酵培养基一般是指按照上述方法配制的硒含量为1600mg/l的培养基。
37.木屑培养基:取栎木木屑晒干后粉碎成2mm大小的小木块。一般在250ml三角瓶中装入上述小木块100ml,麸皮10g,加水100ml,上方覆盖一层铝箔,铝箔上放一层10mm左右的鹅卵石小石子。三角瓶用无菌滤膜封口后灭菌即为木屑培养基。接种时一般用移液器吸取1ml的灵芝菌丝体培养液,在铝箔中央扎一小孔,将培养液注射进下层木屑中。栎木木屑为无锡军嶂山农户家收集。
38.缺水的木屑培养基:按照上述方法同样配制培养基,其中加水量由100ml减少为35ml,配制后在培养基上方覆盖一层铝箔,铝箔中央开约20mm的小孔用于接种灵芝子实体。三角瓶用无菌滤膜封口后灭菌即为缺水的木屑培养基。接种时一般是将木屑培养基中生长形成的子实体连带下层部分菌索及少量木屑取出,扎进上述铝箔中央的小孔中。
39.菌体干重的测定:同文献[沈微,王冰波,朱金寸等.一种性能改善的普鲁兰酶嵌合体及高产该嵌合体的巴斯德毕赤酵母突变株.专利号:201610306855.6]中的方法10。
[0040]
染色体dna提取及its基因序列分析方法:染色体提取方法同文献(周小玲,沈微,饶志明,王正祥,诸葛健.一种快速提取真菌染色体dna的方法[j].微生物学通报,2004,31(4):89-92);染色体提取后进一步进行its基因扩增及序列分析的方法同文献(陈源源,沈微,石贵阳,王正祥.两种分子标识在酵母分子鉴定中的比较[j].食品工业科技,2011,32(2):175-177)中有关its基因鉴定的方法。
[0041]
本发明所使用的出发菌ganoderma sp.st308已保藏在江南大学中国高校工业微生物资源平台,菌株号为:cicim f7083。
[0042]
实施例2突变株ganoderma sp.ml2613的稳定性
[0043]
将出发菌灵芝st308和灵芝突变体ml2613分别接种在实施例1材料方法种的发酵培养基中,在30℃培养5天。按1/100体积转接新的发酵培养基,培养5天后再按1/100接种量转接新的发酵培养基。如此反复10次。
[0044]
将最初保藏的出发菌st308和突变株ml2613,以及经过上述摇瓶转接的出发菌和突变株(为便于叙述分别命名为st308b和ml2613b)分别接种发酵培养基和硒含量为1600mg/l的高硒发酵培养基。
[0045]
结果显示,上述四种菌在未添加硒发酵培养基中的生长速度基本一致,未见明显差异,按1%接种量接种后摇瓶发酵达到最高菌体量的时间均为4天,达到的最高菌体量基本相同。
[0046]
图1是其中st308在发酵培养基中的菌体量增长曲线,该图实验数据是3个平行样的平均数据,三个平行实验的数据误差在10%以内。st308b、ml2613、ml2613b也进行了相同的实验,每一株菌均进行三个平行实验,平行实验间的数据误差均在10%以内。将上述四株菌的菌体量增长曲线中各时间点的菌体量的平均值进行比较,各时间点的菌体量间的差异均在5%以内。发酵至96hr的时候均达到最高菌体量。最高菌体量如下:st308:19.1g/l,st308b:19.0g/l,ml2613:19.5,ml2613b:19.2。
[0047]
在硒含量为1600mg/l的高硒发酵培养基中,ml2613和ml2613b达到最高菌体量的时间均为4天,两者达到的最高菌体量基本一致,与其在无硒发酵培养基中达到的最高菌体量未见明显差异。
[0048]
图2是ml2613和st308在硒含量为1600mg/l的高硒发酵培养基中的菌体量增长曲线,该图实验数据是3个平行样的平均数据,三个平行实验的数据误差在10%以内。由图2可见,ml2613达到最高菌体量的时间是96hr,达到的最高菌体量是19.3g/l,与ml2613在无硒发酵培养基中达到最高菌体量的时间及达到的最高菌体量一致。但ml2613在高硒发酵培养基中培养时其发酵前期的菌体量显著小于其在无硒发酵培养基中的菌体量,当发酵至72hr的时候其菌体量才与其在无硒培养基中的菌体量比较接近,并最终在96hr发酵终点时达到与其在无硒发酵培养基中相同的菌体量。针对ml2613b也进行了相同的实验,同样进行三个
平行实验,平行实验间的数据误差均在10%以内。ml2613b在硒含量为1600mg/l的高硒发酵培养基中的菌体量增长曲线与图2中ml2613的增长曲线一致,ml2613和ml2613b各时间点的菌体量间的差异均在5%以内。可见ml2613和ml2613b在硒含量为1600mg/l的高硒发酵培养基中的生长情况基本相同。
[0049]
针对st308也进行了同样的实验,在硒含量为1600mg/l的高硒发酵培养基中,st308的生长极其缓慢,培养108小时达到的菌体量不到1.2g,结果如图2所示。st308b的实验结果与st308几乎完全相同,培养108小时达到的菌体量不到1.2g。
[0050]
由上述实验可见,ml2613在无硒培养基中多次传代后性能没有明显的退化,是一株遗传性能稳定的耐硒突变株。
[0051]
实施例3突变株ganoderma sp.ml2613的发酵性能
[0052]
取灵芝出发菌st308和突变株ml2613的菌丝体培养物,接种pda液体培养基,培养5天后按1/100的体积接种发酵培养基,进行发酵性能比较。其中ml2613的实验结果如图3所示。该图实验数据为5个平行实验的平均数据,平行实验的数据误差均在10%以内。出发菌st308的实验结果与ml2613无明显差异。
[0053]
取灵芝出发菌st308和突变株ml2613的菌丝体培养物,接种发酵培养基,培养5天后按1/100左右的体积分别接种硒含量为1600mg/l的高硒发酵培养基,进行耐硒发酵性能比较。
[0054]
实验结果如图4所示,图中每个点均为5个平行实验的平均数据,平行实验的数据误差均在10%以内。由图4可见,在高硒发酵培养基中,ml2613的生长速度显著高于st308。ml2613在培养至4天时就可以达到最高菌体量,每升发酵液大概有19.1g干菌体,而出发菌st308在同样发酵条件下同样发酵时间其干菌体只有1g左右。如果继续进行培养,则st308的菌体量可以继续增加,大约在15天时达到最大菌体量,大约为5g左右。可见在高硒培养基中出发菌st308的生长受到明显的抑制,而ml2613的生长并没有受到明显的抑制,其生长速度显著高于出发菌st308,达到的最终菌体量也显著高于出发菌。
[0055]
突变株ganoderma sp.ml2613更适合在高硒培养条件下进行培养,是一种更适合于获得富硒菌体的性能稳定的突变株。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1