一种基于纤维蛋白凝胶模拟病理性血脑屏障的仿生微流控芯片及其构建方法
1.本发明属于微流控芯片领域,特别涉及一种基于纤维蛋白凝胶模拟病理性血脑屏障的仿生微流控芯片及其构建方法。
背景技术:
2.现有血脑屏障研究模型包括在体动物模型,体外细胞模型,以及计算机模型等。尽管动物模型可以高度模拟人体生理学复杂性,反映微环境的真实状态,但是尚无一种动物模型可以完全再现人类疾病所有特征,其研究结果在临床转化过程中遇到阻碍。体外模型包括细胞培养模型,大脑切片,基于纤维的动态体外血脑屏障模型,以及微流控器官芯片模型。培养皿中transwell小室培养是使用最为广泛的体外细胞模型,将一种或多种细胞培养于半通透的微孔中,尽管该方法容易操作,但该模型基于二维单层内皮细胞,并不能模拟血脑屏障的复杂结构,且这一静态培养系统不能反映血脑屏障的流体特性,内皮细胞缺乏动态流体刺激。基于微流控技术的器官芯片作为一种新兴的模型构建方法在生物医学领域具有广泛的应用前景。微流控器官芯片用于血脑屏障模型的构建有多方面的优势。首先,芯片易于设计和构建,微通道的尺寸与体内微血管结构相似。第二,芯片可以为细胞提供更好的生长环境,与传统培养皿的二维培养模式相比,微流控芯片可以建立三维培养系统,并且提供多种理化因素刺激,比如流体剪切应力。第三,芯片内可以实现多种细胞的共培养,结合活细胞成像技术可以实时观察细胞行为学的改变。
3.目前,模拟血脑屏障的微流控芯片往往只构建生理情况下的正常血脑屏障模型,但是疾病状态下血脑屏障的各组分会发生显著改变,因此有必要建立病理性的血脑屏障芯片,有助于探究病理条件下细胞的生物学行为改变,并应用于中枢神经系统药物的药效验证和筛选。纤维蛋白原是血浆中的一种糖蛋白,具有止血凝血作用,参与血栓形成过程并参与介导炎性反应。当脑卒中、多发性硬化等导致血脑屏障破坏时,血液循环中的纤维蛋白原会渗入神经组织,立即转化为纤维蛋白在神经系统沉积。而这部分渗漏的纤维蛋白可以有效激活血脑屏障处的星形胶质细胞,引发级联放大的炎症反应,降解局部细胞外基质,并破坏内皮细胞间的紧密连接蛋白,形成病理性的恶性循环。
技术实现要素:
4.本发明针对现有的微流控血脑屏障芯片无法有效构建病理性血脑屏障模型的问题,提供一种基于纤维蛋白凝胶模拟病理性血脑屏障的仿生微流控芯片及其构建方法。
5.本发明提供了一种基于纤维蛋白凝胶模拟病理性血脑屏障的仿生微流控芯片,所述芯片设有三条平行通道及对应的进样口和流出口,相邻两个通道间设有等间距排列的梯形微阀结构阵列;其中:
6.所述一侧通道包含内皮细胞进样口、内皮细胞通道及内皮细胞流出口,用于脑微血管内皮细胞的培养和内皮培养液的灌注;
7.所述中央通道包含星形胶质细胞与纤维蛋白凝胶混合溶液进样口、星形胶质细胞与纤维蛋白凝胶混合溶液通道及星形胶质细胞与纤维蛋白凝胶混合溶液流出口,用于星形胶质细胞的三维培养;
8.所述另一侧通道包含小胶质细胞进样口、小胶质细胞通道及小胶质细胞流出口,用于小胶质细胞的培养和最低必需培养基储存。
9.所述梯形微阀结构的上底边朝向中央通道,分别位于内皮细胞通道与星形胶质细胞通道、星形胶质细胞通道与小胶质细胞通道之间,该梯形微阀结构在流体灌注过程中利用气液分界处的表面张力将流体束缚在特定通道内。
10.进一步地:
11.所述内皮细胞进样口及内皮细胞流出口为圆形,直径为2-6mm,优选为5mm,内皮细胞通道宽度为0.5-1.5mm,优选为1mm;
12.所述星形胶质细胞与纤维蛋白凝胶混合溶液进样口及其流出口为圆形,直径为0.5-2mm,优选为1mm,星形胶质细胞与纤维蛋白凝胶混合溶液通道宽度为0.5-1.5mm,优选为1mm;
13.所述小胶质细胞进样口及小胶质细胞流出口为圆形,直径为2-6mm,优选为5mm,小胶质细胞通道宽度为0.5-1.5mm,优选为1mm;
14.所述相邻通道之间的微阀结构阵列,由5-50个完全相同且相互平行的梯形微柱构成,等间距、平行排列于内皮细胞通道与星形胶质细胞通道、星形胶质细胞通道与小胶质细胞通道之间;梯形结构的上底边为150μm,下底边为300μm,梯形的高为50-150μm,优选为130μm;每个梯形结构之间的间距为50-200μm,优选为200μm;
15.所述微流控芯片通道的高度为50-250μm,优选为60μm,梯形微阀的高度为50-250μm,优选为60μm。
16.本发明还提供了一种基于纤维蛋白凝胶模拟病理性血脑屏障的仿生微流控芯片的制备方法,包括:
17.(1)采用软光刻技术制作微流控芯片的阳模,包括旋涂、前烘、曝光、后烘、显影和固膜;
18.(2)将聚二甲基硅氧烷预聚物和交联剂混合均匀,将聚二甲基硅氧烷浇筑于带有通道图案的硅板表面,然后用真空泵去除气泡并固化;
19.(3)从硅板表面揭下固化后的聚二甲基硅氧烷,形成带有图案结构的芯片,并利用打孔器制作三条微通道对应的进样口和流出口;
20.(4)将芯片带有通道结构的底面和洁净载玻片的顶面朝上放置于等离子体清洗机内进行等离子体处理,使得聚二甲基硅氧烷芯片和玻璃通过化学键产生不可逆键合以封闭微流控芯片。
21.所述步骤(2)中的聚二甲基硅氧烷预聚物和交联剂的质量比为(8-12):1,优选为10:1;所述聚二甲基硅氧烷预聚物为聚乙烯硅氧烷、聚烷基链烯基硅氧烷和八甲基环四硅氧烷中的至少一种;所述交联剂为聚乙烯硅氧烷、甲基氢聚硅氧烷和甲苯中的至少一种。
22.所述步骤(2)中的固化温度为60-80℃。
23.本发明还提供了一种基于纤维蛋白凝胶模拟病理性血脑屏障模型的构建方法,包括:
24.采用仿生微流控芯片;
25.(1)将星形胶质细胞悬液、dmem培养液、纤维蛋白原母液和凝血酶母液混合,配制星形胶质细胞与纤维蛋白凝胶混合溶液;
26.(2)利用移液器将细胞凝胶混合溶液从芯片中央通道进样口注入中央通道内,将整个芯片置于湿盒内并放入恒温培养箱内固化;
27.(3)采用基质胶修饰内皮细胞通道和小胶质细胞通道;
28.(4)配制内皮细胞悬液和小胶质细胞悬液;
29.(5)采用抽吸的方式将内皮细胞悬液和小胶质细胞悬液分别由内皮细胞进样口和小胶质细胞进样口注入对应的微流控芯片通道内;
30.(6)待内皮细胞和小胶质细胞在对于的微流控芯片通道贴壁生长后,分别在进样口和流出口各加入培养液;
31.(7)将整个芯片置于恒温培养箱内培养5-6天,每天更换新鲜培养液,构建基于纤维蛋白凝胶模拟病理性血脑屏障模型。
32.本发明对所述基于纤维蛋白凝胶模拟病理性血脑屏障的仿生微流控芯片模型进行了结构和功能的表征和评价:
33.(1)构建荧光蛋白mcherry标记的永生化人脑微血管内皮细胞,绿色荧光蛋白gfp标记的永生化大鼠星形胶质细胞,蓝色荧光蛋白bfp标记的小胶质细胞,用于表征所建立的基于三种细胞共培养的血脑屏障模型。
34.(2)采用无荧光蛋白标记的内皮细胞、星形胶质细胞和小胶质细胞建立血脑屏障模型,对内皮细胞进行免疫荧光染色,表征内皮细胞间紧密连接蛋白的表达情况。
35.(3)以不同分子量的带有荧光标记的葡聚糖作为指示剂,表征基于纤维蛋白凝胶的病理性血脑屏障模型对小分子物质的通透性,观察荧光分子在通道内的扩散情况和荧光分布情况。
36.本发明基于软光刻技术制作图案化的硅片阳模,再利用模塑法制备具有良好化学稳定性、生物相容性和光学透明度的聚二甲基硅氧烷芯片,然后通过等离子体处理,将上述聚二甲基硅氧烷芯片与洁净载玻片键合,随后放置于烘箱内使得聚二甲基硅氧烷的疏水性恢复,然后采用紫外线照射进行芯片灭菌,最后在芯片中依次注入星形胶质细胞与纤维蛋白凝胶混合物,内皮细胞悬液和小胶质细胞悬液,构建三种细胞的共培养体系,获得基于纤维蛋白凝胶的病理性血脑屏障微流控芯片模型。利用上述微流控芯片,能够建立血脑屏障完整性破坏的病理模型,可以实现细胞生物学行为的实时动态成像,并进行药物效应测试和筛选。
37.有益效果
38.(1)本发明基于纤维蛋白凝胶建立病理性血脑屏障模型,模拟血脑屏障在渗漏情况下的病理改变,为建立血脑屏障的疾病模型提供了新方法;
39.(2)本发明通过微流控芯片实现三种细胞的共培养,在满足不同细胞培养需求的情况下,内皮细胞和星形胶质细胞间可以通过物理接触和旁分泌进行充分的相互作用;
40.(3)本发明基于平行通道设计的微流控芯片可以与活细胞显微镜平台整合,实现细胞生物学行为的实时动态观察。
41.(4)本发明基于纤维蛋白凝胶的病理性血脑屏障模型中,以纤维蛋白凝胶作为细
胞外基质成分,将内皮细胞与胶质细胞进行共培养,模拟血浆中纤维蛋白原渗出至中枢后的病理性血脑屏障,并且对小分子表现出渗漏的屏障功能。该方法可同时构建多个独立且重复的病理性血脑屏障模型,并且减少细胞和试剂用量,降低试验成本,在疾病机制探究和药物筛选方面具有应用前景。
附图说明
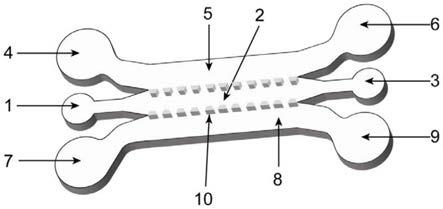
42.图1为本发明仿生微流控芯片的结构示意图;
43.图2是本发明仿生微流控芯片加入三种细胞进行共培养的血脑屏障模型结构表征;其中,a为无荧光蛋白标记细胞的相差显微镜图像,b为荧光蛋白标记细胞的荧光图像;
44.图3是本发明仿生微流控芯片中内皮细胞间紧密连接蛋白zo-1的免疫荧光染色情况,其中zo-1为蛋白表征,dapi为细胞核表征;
45.图4是本发明仿生微流控芯片对荧光标记的葡聚糖分子的通透性情况;其中a为4kda和70kda荧光标记葡聚糖的荧光分布情况,b为4kda荧光标记葡聚糖的荧光强度分布定量曲线,c为70kda荧光标记葡聚糖的荧光强度分布定量曲线。
46.其中,1星形胶质细胞与纤维蛋白凝胶混合溶液进样口;2星形胶质细胞与纤维蛋白凝胶混合溶液通道;3星形胶质细胞与纤维蛋白凝胶混合溶液流出口;4内皮细胞进样口;5内皮细胞通道;6内皮细胞流出口;7小胶质细胞进样口;8小胶质细胞通道;9小胶质细胞流出口;10梯形微阀。
具体实施方式
47.下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。此外应理解,在阅读了本发明讲授的内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本技术所附权利要求书所限定的范围。
48.实施例1
49.本实施例提供了一种基于纤维蛋白凝胶模拟病理性血脑屏障的仿生微流控芯片,其结构如图1所示。该微流控芯片主要包括三条平行通道及对应的进样口和流出口,分别是内皮细胞通道、星形胶质细胞与纤维蛋白凝胶混合溶液通道以及小胶质细胞通道;内皮细胞通道包含内皮细胞进样口、内皮细胞侧通道及内皮细胞流出口;星形胶质细胞与纤维蛋白凝胶混合溶液通道包括混合溶液进样口、主通道及其流出口;小胶质细胞通道包括小胶质细胞进样口、小胶质细胞侧通道及小胶质细胞流出口。内皮细胞进样口及内皮细胞流出口直径为5mm,内皮细胞通道宽度为1mm;星形胶质细胞与纤维蛋白凝胶混合溶液进样口及其流出口为圆形,直径为1mm,主通道宽度为1mm;小胶质细胞进样口及小胶质细胞流出口为圆形,直径为5mm,小胶质细胞通道宽度优选为1mm;相邻两个通道间设有梯形微阀结构阵列,由11个完全相同且相互平行的梯形微柱构成;芯片高度为60μm。聚二甲基硅氧烷芯片键合于洁净载玻片上,构成完整芯片。微流控芯片放置于80℃烘箱内24小时恢复疏水性后进行紫外线照射灭菌30分钟。
50.本实施例提供了一种基于纤维蛋白凝胶模拟病理性血脑屏障的仿生微流控芯片的制备方法,包括:
51.(1)采用软光刻技术制作微流控芯片的阳模,包括旋涂、前烘、曝光、后烘、显影和固膜;
52.(2)将聚二甲基硅氧烷预聚物和交联剂按质量比为10:1混合均匀,将聚二甲基硅氧烷浇筑于带有通道图案的硅板表面,然后用真空泵去除气泡并在80℃下固化;
53.(3)从硅板表面揭下固化后的聚二甲基硅氧烷,形成带有图案结构的芯片,并利用打孔器制作三条微通道对应的进样口和流出口;
54.(4)将芯片带有通道结构的底面和洁净载玻片的顶面朝上放置于等离子体清洗机内,抽真空3min后,将等离子体模式调节至“mid”,处理3min后,关闭进气旋钮及“mid”模式,缓慢放气后取出芯片和载玻片,使得聚二甲基硅氧烷芯片和玻璃通过化学键产生不可逆键合以封闭微流控芯片。
55.所述聚二甲基硅氧烷预聚物为聚乙烯硅氧烷、聚烷基链烯基硅氧烷和八甲基环四硅氧烷;所述交联剂为聚乙烯硅氧烷、甲基氢聚硅氧烷和甲苯。
56.本实施例提供了一种基于纤维蛋白凝胶模拟病理性血脑屏障模型的构建方法,包括以下步骤:
57.准备紫外线灭菌后的微流控芯片用于后续血脑屏障模型构建。制备星形胶质细胞与纤维蛋白凝胶的混合溶液,采用胰酶消化星形胶质细胞,dmem完全培养液终止消化后离心得到细胞沉淀,采用dmem完全培养液重悬细胞,使得星形胶质细胞密度为1.4
×
10^6cells/ml,然后向细胞悬液加入250u/ml凝血酶母液得到含有6u/ml凝血酶的星形胶质细胞悬液;将25mg/ml纤维蛋白原采用磷酸缓冲液稀释至10mg/ml浓度,然后将含有6u/ml凝血酶的星形胶质细胞悬液与10mg/ml纤维蛋白原以1:1体积比混合,配制成星形胶质细胞与纤维蛋白凝胶的混合溶液。上述操作均在冰上进行。
58.将混合细胞凝胶溶液注入到微流控芯片的中央通道内,准备无菌水润湿的无尘纸放入洁净的直径10cm培养皿内作为湿盒,然后将芯片放入湿盒内,使得微流控芯片在恒温培养箱内固化30分钟,湿盒的目的是防止凝胶因水分蒸发而收缩变形。待凝胶固化后,向侧通道内注入1mg/ml基质胶对侧通道进行表面修饰,有助于细胞粘附。内皮细胞消化为单细胞悬液,使得内皮细胞密度为2
×
10^6cells/ml,将内皮细胞悬液从内皮细胞进样口加入内皮细胞通道内。将小胶质细胞消化为单细胞悬液,细胞密度为4
×
10^5cells/ml,从小胶质细胞进样口向侧通道内加入小胶质细胞悬液。随后将整个芯片置于恒温培养箱内1-2h使内皮细胞和小胶质细胞充分贴附在通道内,然后分别在侧通道的进样口和流出口各加入50μl培养液,形成培养液储蓄池。芯片放入培养箱内继续培养,形成体外血脑屏障模型,并每隔24h换液一次。采用相差显微镜拍照记录三种细胞共培养体系内不同细胞生长情况。采用荧光蛋白mcherry标记的永生化人脑微血管内皮细胞,绿色荧光蛋白gfp标记的永生化大鼠星形胶质细胞以及蓝色荧光蛋白bfp标记的小胶质细胞,构建表达荧光蛋白的细胞共培养血脑屏障模型,采用荧光显微镜拍照记录细胞分布情况。如图2所示,三种细胞分别生长在各自通道内,内皮细胞与星形胶质细胞之间存在物理接触,模拟体内血脑屏障微环境内星形胶质细胞伸出突起至内皮细胞一侧的足突结构。
59.实施例2
60.基于纤维蛋白凝胶模拟病理性血脑屏障模型上内皮紧密连接蛋白的表征
61.采用上述自行设计和制作的微流控芯片,在芯片进样后建立基于纤维蛋白凝胶模
拟病理性血脑屏障模型,经过5天共培养形成内皮屏障结构,对病理性血脑屏障模型中内皮细胞的紧密连接蛋白zo-1进行免疫荧光染色,方法如下:准备待做免疫荧光的芯片,吸弃进样口培养液,在芯片一侧进样口加入pbs缓冲液洗2-3次,每次5min;用4%多聚甲醛室温固定15min,然后用pbs缓冲液洗3次,每次5min;采用含有5%bsa+0.3%triton x-100的封闭通透液室温封闭通透1h;采用含有1%bsa+0.3%triton x-100的一抗稀释液配制一抗溶液,一抗(兔抗人zo-1)稀释比例为1:100,将芯片放置于4℃孵育过夜;回收一抗后采用pbs洗3次,每次5min;二抗(tritc标记的山羊抗兔igg)以1:1000稀释,室温避光孵育1h,然后用pbs洗3次,每次5min;最后用含dapi的抗荧光淬灭封片液孵育后进行荧光显微镜成像观察。结果如图3所示。基于纤维蛋白凝胶所建立的病理性血脑屏障模型中,内皮细胞表达的紧密连接蛋白zo-1呈现出不连续的状态,且zo-1蛋白呈点状,说明内皮细胞间不能形成正常的紧密连接结构,提示该血脑屏障模型呈现出病理状态。
62.实施例3
63.基于纤维蛋白凝胶模拟病理性血脑屏障模型的通透性情况
64.采用分子量为4kda的异硫氰酸荧光素(fitc)标记的葡聚糖分子以及分子量为70kda的罗丹明标记的葡聚糖分子进行通透性试验。待基于纤维蛋白凝胶的三种细胞共培养体系形成内皮屏障后,从内皮细胞进样口向内皮细胞通道内加入不同分子量的葡聚糖分子,浓度均为400μg/ml,采用荧光显微镜连续记录30分钟芯片内荧光分子的扩散情况,每间隔5分钟拍摄荧光图像,用以表征所述病理性血脑屏障模型对不同分子量的葡聚糖的通透情况,结果如图4所示。图4所示图像表明,基于纤维蛋白凝胶的病理性血脑屏障模型对4kda以及70kda分子量的荧光分子不具有屏障作用,其内皮屏障功能受到破坏,从而模拟病理情况下血脑屏障受损的情况。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1