化合物和衍生物化试剂、以及化合物的合成方法与流程
1.本发明涉及化合物和衍生物化试剂、以及化合物的合成方法。
背景技术:
2.维生素d代谢物的定量中,已经广泛普及:使用了具备串联质谱仪(以下,也称为“ms/ms”)的液相色谱仪串联质谱仪(以下,有时称为“lc/ms/ms”)的分析。而且,已知,对于离子化效率和色谱分离,通过衍生物化试剂进行衍生物化,可以改善离子化效率和色谱分离。此处使用的衍生物化试剂具有1,2,4-三唑啉-3,5-二酮结构。
3.关于维生素d代谢物的衍生物化法,例如提出了4-[4-二甲基氨基苯基]-1,2,4-三唑啉-3,5-二酮(daptad)(参照非专利文献1)。维生素d代谢物的衍生物化法如下:使维生素d代谢物(任选包含维生素d)所具有的二烯部分进行狄尔斯-阿尔德反应,形成维生素d代谢物的衍生物,从而进行。
[0004]
现有技术文献
[0005]
非专利文献
[0006]
非专利文献1:rapid commun.mass spectrum.2013,27,2453-2460
技术实现要素:
[0007]
发明要解决的问题
[0008]
然而,非专利文献1中提出的技术中,有无法实现进一步改善维生素d代谢物的检测灵敏度的的担心。
[0009]
因此,本发明是鉴于这种情况而作出的,第1目的在于,提供:能实现进一步改善维生素d代谢物的检测灵敏度的化合物、和含有该化合物的用于使维生素d代谢物衍生物化的衍生物化试剂、以及该化合物的合成方法。
[0010]
而且,本发明中,不将分析对象的范围限定为维生素d代谢物,可以将分析对象的范围扩大至具有二烯的化合物。因此,本发明的第2目的在于,提供:能实现进一步改善具有二烯的化合物的检测灵敏度的化合物、和含有该化合物的用于使具有二烯的化合物衍生物化的衍生物化试剂、以及该化合物的合成方法。
[0011]
用于解决问题的方案
[0012]
本发明人等为了解决上述目的而进行了深入研究,结果令人惊奇的是,成功地开发出能实现进一步改善具有二烯的化合物(特别是可以举出维生素d代谢物)的检测灵敏度的化合物、和含有该化合物的用于使具有二烯的化合物(特别是可以举出维生素d代谢物)衍生物化的衍生物化试剂、以及该化合物的合成方法,至此完成了本发明。
[0013]
即,本发明中,作为第1侧面,提供一种下述的通式(100)所示的化合物。
[0014][0015]
上述通式(100)中,n为2以上的整数。
[0016]
本发明的第1侧面的化合物中,前述通式(100)所示的化合物可以为下述的式(i)所示的化合物。
[0017][0018]
另外,本发明中,作为第2侧面,提供一种衍生物化试剂,其用于使具有二烯的化合物衍生物化,其含有下述的通式(100)所示的化合物。
[0019][0020]
上述通式(100)中,n为2以上的整数。
[0021]
本发明的第2侧面的衍生物化试剂中,前述通式(100)所示的化合物可以为下述的式(i)所示的化合物。
[0022][0023]
进而,本发明中,作为第3侧面,提供一种下述的通式(100)所示的化合物的合成方法,其包含:芳基卤与饱和的杂环式胺化合物的亲核取代反应。
[0024][0025]
上述通式(100)中,n为2以上的整数。
[0026]
进而,本发明的第3侧面的合成方法中,前述通式(100)所示的化合物可以为下述的式(i)所示的化合物,
[0027]
前述饱和的杂环式胺化合物可以为哌啶。
[0028][0029]
发明的效果
[0030]
根据本发明,可以实现进一步改善具有二烯的化合物(特别是可以举出维生素d代谢物)的检测灵敏度。需要说明的是,未必限定于此处记载的效果,可以为本说明书中记载的任意效果。
附图说明
[0031]
图1为示出维生素d代谢物的piptad衍生物与维生素d代谢物的daptad衍生物的析结果的图。
[0032]
图2为示出1,2,4-三唑烷-3,5-二酮(viii)的nmr光谱数据的图。
具体实施方式
[0033]
以下,对用于实施本技术的适合的方式进行说明。以下中说明的实施方式示出本技术的代表性的实施方式的一例,不由此狭义地解释本技术的范围。
[0034]
需要说明的是,说明按照以下的顺序进行。
[0035]
1.本发明的概要
[0036]
2.第1实施方式(化合物的例1)
[0037]
3.第2实施方式(衍生物化试剂的例)
[0038]
4.第3实施方式(化合物的合成方法的例)
[0039]
5.第4实施方式(化合物的例2)
[0040]
6.实施例
[0041]
6-1.实施例1
[0042]
6-2.实施例2
[0043]
6-3.分析结果
[0044]
<1.本发明的概要>
[0045]
首先,对本发明的概要进行说明。本发明涉及:化合物和用于使具有二烯的化合物(特别是维生素d代谢物)衍生物化的衍生物化试剂、以及该化合物的合成方法。
[0046]
现有技术中,为了对于存在于生物体内微量的活性型维生素d(例如1,25-二羟基维生素d3、1,25(oh)2d3)进行检测定量,需要使用了抗体柱的浓缩(例如参照非专利文献clinica chimica acta 2017,473,173-179.)。然而,衍生物化试剂daptad中,灵敏度上不能说是充分的,为了更精确的定量,期望开发出比daptad更高灵敏度的衍生物化试剂。例如,1,25(oh)2d3是占维生素d的生理作用的中心的重要代谢物,因此,其精确的定量有大的需求。
[0047]
本发明是鉴于以上的情况而作出的。本发明用于以高灵敏度检测临床检查领域、其中使用了质谱的维生素d代谢物,无论质谱仪制造的制造商均可以使用。此后,在临床检查领域中,基于质谱的维生素d代谢物的定量广泛普及,因此,随时随地使用任何制造商的装置均必须得出相同的值,本发明通过改善检测灵敏度而弥补各制造商的设备种类差异,从而有利于普及。
[0048]
以下,对用于实施本发明的适合的方式详细地进行说明。以下中说明的实施方式示出本发明的代表性的实施方式的一例,不由此狭义地解释本发明的范围。
[0049]
<2.第1实施方式(化合物的例1)>
[0050]
本发明的第1实施方式(化合物的例1)的化合物为下述的通式(100)所示的化合物(4-环烷基氨基苯基-1,2,4-三唑啉-3,5-二酮)。
[0051][0052]
通式(100)中,n为2以上的整数。
[0053]
通式(100)所示的化合物优选为下述的式(i)所示的化合物。式(i)所示的化合物为通式(100)所示的化合物中、n=5(6元环的饱和杂环)的化合物,为4-[4-(1-哌啶基)苯基]-1,2,4-三唑啉-3,5-二酮(piptad)。
[0054]
[0055]
<3.第2实施方式(衍生物化试剂的例)>
[0056]
本发明的第2实施方式(衍生物化试剂的例)的衍生物化试剂为用于使具有二烯的化合物衍生物化的衍生物化试剂,其含有下述的通式(100)所示的化合物。而且,含有下述的通式(100)所示的化合物的衍生物化试剂为库克森型衍生物化试剂。
[0057][0058]
通式(100)中,n为2以上的整数。
[0059]
本发明的第2实施方式的衍生物化试剂是为了基于连接有液相色谱仪的串联质谱仪(lc-ms/ms)的定量分析,用于使具有二烯的化合物、特别是血液、血清、血浆、尿、唾液、脊髓液、和指(趾)甲等生物待捡体中的维生素d代谢物衍生物化,以高灵敏度进行检测的试剂。如此,根据本发明提供的衍生物化用试剂可以用于使生物待捡体中所含的具有二烯的化合物衍生物化。前述生物待捡体不限定于上述中列举者,可以为生物(特别是哺乳类、更特别是人)中所含的液态成分或固体状成分。
[0060]
而且,具有二烯的化合物与本发明的第2实施方式的衍生物化试剂中所含的通式(100)所示的化合物通过狄尔斯-阿尔德反应而定量地反应并衍生物化,例如,基于lc/esi(电喷雾离子化)-ms/ms的定量分析中,可以以高灵敏度、高选择地检测具有二烯的化合物(例如维生素d代谢物)。
[0061]
通式(100)所示的化合物优选为下述的式(i)所示的化合物。式(i)所示的化合物为在通式(100)所示的化合物中、n=5(6元环的饱和杂环结构)的化合物,为4-[4-(1-哌啶基)苯基]-1,2,4-三唑啉-3,5-二酮(piptad)。
[0062][0063]
以下中,对成为衍生物化的对象的具有二烯的化合物具体且详细地进行说明。
[0064]
作为具有二烯的化合物,例如可以举出:具有s-顺式-二烯的化合物、具有s-反式-二烯的化合物等。需要说明的是,使用含有前述通式(100)所示的化合物(例如piptad)的衍生物化试剂或含有后述的通式(100-1)所示的化合物的衍生物化试剂,使具有s-反式-二烯的化合物衍生物化的情况下,作为前热处理,需要使具有s-反式-二烯的化合物异构化为具有s-顺式-二烯的化合物。
[0065]
接着,对具有s-顺式-二烯的化合物的具体例进行说明。作为具有s-顺式-二烯的化合物,没有特别限定,例如可以举出甾类化合物、维生素d或维生素d代谢物等。
[0066]
具有s-顺式-二烯的化合物中,作为甾类化合物,没有特别限定,不限定于天然存
在的化合物,也可以为合成物、其类似体,例如可以举出7-脱氢胆固醇、麦角固醇、共轭亚油酸、维生素a等。
[0067]
具有s-顺式-二烯的化合物中,维生素d在广义的分类中属于开环甾类化合物,是源自植物性食品的维生素d2和源自动物性食品、皮肤产生的维生素d3的统称。认为两者是仅侧链结构不同的同族体,在人体内同样地被代谢,具有等同的生理活性。因此,本说明书中,有时不将两者区分而简记作维生素d。另外,本说明书中,有时将维生素d和维生素d代谢物也简记作维生素d。这些是指,与天然或由合成得到的维生素d或维生素d代谢的中间体和产物等通过维生素d的转换而生成的维生素d相关的任意分子种类。
[0068]
作为这种维生素d(维生素d代谢物)的分子种类,没有特别限定,例如可以举出:25-羟基维生素d3(25(oh)d3)、25-羟基维生素d2(25(oh)d2)、1α,25-二羟基维生素d3(1,25(oh)2d3)、1α,25-二羟基维生素d2(1,25(oh)2d2)、23,25-二羟基维生素d3(23,25(oh)2d3)、25,26-二羟基维生素d3(25,26(oh)2d3)、24,25-二羟基维生素d3(24,25(oh)2d3)、4β,25-二羟基维生素d3(4β,25(oh)2d3)、25-羟基维生素d
3-23,26-内酯(25(oh)d3lactone)、1α,25-二羟基维生素d
3-23,26-内酯(1,25(oh)2d3lactone)等。维生素d的分子种类可以为前述分子种类的异构体,例如可以举出:3-表-25-羟基维生素d3(3-表-25(oh)d3)等。另外,这些维生素d的分子种类也可以为硫酸盐,例如可以举出:25-羟基维生素d
3-3β-硫酸盐(25(oh)d3s)、25-羟基维生素d
3-3β-葡糖醛酸(25(oh)d3gluc)等。需要说明的是,维生素d的定量分析时,这些维生素d(维生素d代谢物)的分子种类可以包含多种。
[0069]
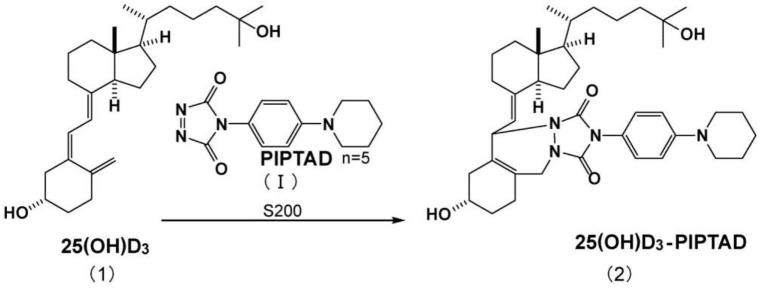
例如,25(oh)d3与piptad的衍生物化反应的反应式如以下所述。
[0070][0071]
工序s200中,在25(oh)d3(1)的s-顺式-二烯部分中加成piptad(i),形成25(oh)d
3-piptad衍生物(2)。25(oh)d
3-piptad衍生物(2)由于烷基的给电子效果而氮原子的电子密度提高,因此,质子变得更容易加成,更容易离子化。
[0072]
<4.第3实施方式(化合物的合成方法的例)>
[0073]
本发明的第3实施方式(化合物的合成方法的例)的化合物的合成方法为下述通式(100)所示的化合物的合成方法,其包括:芳基卤与饱和的杂环式胺化合物的亲核取代反应。
[0074]
[0075]
通式(100)中,n为2以上的整数。
[0076]
通式(100)所示的化合物优选为下述的式(i)所示的化合物。式(i)所示的化合物为在通式(100)所示的化合物中、n=5(6元环的饱和杂环)的化合物,为4-[4-(1-哌啶基)苯基]-1,2,4-三唑啉-3,5-二酮(piptad)。
[0077]
式(i)所示的化合物的合成方法中的亲核取代反应中,饱和的杂环式胺化合物使用哌啶。而且,式(i)所示的化合物的合成方法中的亲核取代反应中,芳基卤适合使用对氟苯甲酸甲酯。
[0078][0079]
<5.第4实施方式(化合物的例2)>
[0080]
本发明的第4实施方式(化合物的例2)的化合物为下述的通式(100-1)所示的化合物。
[0081][0082]
通式(100-1)中,x为n(氮)原子、p(磷)原子、o(氧)原子或s(硫)原子,通式(100-1)中,n为1以上的整数,n1为1以上的整数。
[0083]
含有通式(100-1)所示的化合物的试剂与本发明的第1实施方式(化合物的例1)的化合物同样地,可以使具有二烯的化合物衍生物化。具有二烯的化合物的具体例如上述。
[0084]
通式(100-1)所示的化合物的合成方法与上述的通式(100)所示的化合物的合成方法同样地可以包括:芳基卤与饱和的杂环式胺化合物的亲核取代反应。
[0085]
<6.实施例>
[0086]
以下中,可以举出实施例,对本发明的效果等具体地进行说明。需要说明的是,本发明的范围不限定于实施例。
[0087]
<6-1.实施例1>
[0088]
[4-[4-(1-哌啶基)苯基]-1,2,4-三唑啉-3,5-二酮(piptad(i))的合成]
[0089]
基于下述反应方案,合成4-[4-(1-哌啶基)苯基]-1,2,4-三唑啉-3,5-二酮(piptad(i))。
[0090][0091]
1.4-(1-哌啶基)苯甲酸甲酯(iii)的合成[工序s1]
[0092]
使对氟苯甲酸甲酯(ii)(256μl、2mmol)溶解于甲苯(5ml),加入碳酸钾(140mg、1.0mmol)和哌啶(311μl、6.0mmol),加热回流12小时。将反应液用乙酸乙酯(25ml)稀释,用食盐水(25ml
×
2)清洗。将有机层在硫酸镁(mgso4)上干燥,将溶剂减压去除后,以无色固体(403mg、1.8mmol)的形式得到4-(1-哌啶基)苯甲酸甲酯(iii)。
[0093]
2.4-(1-哌啶基)苯甲酸(iv)的合成[工序s2]
[0094]
将4-(1-哌啶基)苯甲酸甲酯(iii)(360mg、1.6mmol)与氢氧化钠(100mg、2.5mmol)用50%甲醇水溶液10ml进行混合,在100℃下搅拌一晩。将溶剂减压去除,使残渣用水2ml溶解。接着,将溶液冰冷,加入10%盐酸使其酸性化。边将析出的4-(1-哌啶基)苯甲酸(iv)的
无色粉末在冷水中充分清洗边进行抽滤而回收(290mg、1.4mmol)。
[0095]
3.4-(1-哌啶基)苯甲酸叠氮(v)的合成[工序s3]
[0096]
使4-(1-哌啶基)苯甲酸(iv)(205mg、1.0mmol)溶解于dmf(1ml),滴加dppa(265μl、1.2mmol)、和三乙胺(500μl),在冰冷下搅拌1.5小时。将反应液用乙酸乙酯(25ml)稀释,用食盐水(25ml
×
3)清洗。将有机层在硫酸镁(mgso4)上干燥,将溶剂减压蒸馏去除后、将残渣供于填充有wakogel
(r)
(注册商标)60n(粒径63~212μm)的硅胶柱色谱(150
×
12mm i.d.)。收集己烷-乙酸乙酯(9:1、v/v)洗脱馏分,将溶剂减压去除,以无色固体(170mg、0.74mmol)的形式得到4-(1-哌啶基)苯甲酸叠氮(v)。
[0097]
4.4-(1-哌啶基)苯基氨基脲(vii)的合成[工序s4和工序s5]
[0098]
使4-(1-哌啶基)苯甲酸叠氮(v)(170mg、0.74mmol)溶解于甲苯(2ml),回流20分钟,转换为化合物(vi)[工序s4]。不将化合物(vi)分离而在反应液中加入氨基甲酸乙酯(110mg、1.1mmol)的苯溶液(1ml),在室温下搅拌1小时后,进一步回流1小时。自然冷却后,边将生成的沉淀物用冷甲苯清洗边抽滤,以无色固体(210mg、0.69mmol)的形式得到4-(1-哌啶基)苯基氨基脲(vii)。
[0099]
5.4-[4-(1-哌啶基)苯基]-1,2,4-三唑烷-3,5-二酮(viii)的合成[工序s6]
[0100]
在4-(1-哌啶基)苯基氨基脲(vii)(100mg、0.32mmol)中加入碳酸钾(90mg、0.64mmol)的水溶液(5ml),在90℃下,搅拌3小时。边用universal ph试纸确认边在反应液中加入乙酸,将其ph调整至6左右。将溶剂减压去除后,将残渣供于填充有wakogel
(r)
(注册商标)100c18(粒径63~212μm)的ods柱色谱(300
×
10mm i.d.)。收集meoh-水(3:7、v/v)洗脱馏分,将溶剂减压去除后,通过水而重结晶,得到4-[4-(1-哌啶基)苯基]-1,2,4-三唑烷-3,5-二酮(viii)的无色固体(48mg、0.18mmol)。
[0101]1h-nmr(cd3od)δ7.24(d,j=9.0hz,2h),7.04(d,j=9.0 hz,2h),3.20(m,4h),1.70(m,4h),1.61(m,2h)(图2).
[0102]
6.4-[4-(1-哌啶基)苯基]-1,2,4-三唑啉-3,5-二酮(piptad)(i)的合成[工序s7]
[0103]
使4-[4-(1-哌啶基)苯基]-1,2,4-三唑烷-3,5-二酮(viii)(2mg)悬浮于乙酸乙酯(10ml),加入碘苯二乙酸酯(3mg),在室温下搅拌3小时。将反应液进行离心分离(1000g、10分钟),将上清液作为4-[4-(1-哌啶基)苯基]-1,2,4-三唑啉-3,5-二酮(piptad)(i)的乙酸乙酯溶液(2μg/10μl)保存。需要说明的是,本溶液在-18℃下保存。
[0104]
<6-2.实施例2>
[0105]
[4-[4-(1-哌啶基)苯基]-1,2,4-三唑啉-3,5-二酮(piptad(i))(基于piptad(i))的维生素d代谢物的分析]
[0106]
分别对于浓缩干固后的、5成分的维生素d代谢物(25(oh)d3、3-epi(表)-25(oh)d3、25(oh)d2、24,25(oh)2d3、1,25(oh)2d3),加入piptad(i)的乙酸乙酯溶液(2μg/10μl)100μl,在室温下静置30分钟。添加乙醇20μl,从而反应停止后,氮气吹扫干固。用50%乙腈溶液100μl再溶解后,对10μl用lc-ms/ms进行分析。
[0107]
需要说明的是,作为比较例,分别对于5成分的维生素d代谢物(25(oh)d3、3-epi(表)-25(oh)d3、25(oh)d2、24,25(oh)2d3、1,25(oh)2d3),使用daptad(3)(4-[4-二甲基氨基苯基]-1,2,4-三唑啉-3,5-二酮)的乙酸乙酯溶液(2μg/10μl)。
[0108]
例如,25(oh)d3与daptad的衍生物化反应的反应式如以下所述。
[0109][0110]
工序s500中,在25(oh)d3(1)的s-顺式-二烯部分加成daptad(3),形成25(oh)d
3-daptad衍生物(4)。
[0111]
lc/ms/ms在xevo tq-xs三重四级杆质谱仪上连接japan waters corp.制、acquity uplc i-class系统而使用。
[0112]
(lc分析条件)
[0113]
分析柱为c18系,对分析对象为25(oh)d3、3-epi(表)-25(oh)d3、25(oh)d2、24,25(oh)2d3时的lc分析条件如下述表1所示,对分析对象为1,25(oh)2d3时的lc分析条件如下述表2所示。
[0114]
(ms/ms分析条件)
[0115]
离子化条件为esi(电喷雾离子化)正极,分析对象(上述5成分的维生素d代谢物的piptad衍生物、和上述5成分的维生素d代谢物的daptad衍生物)、以及mrm参数如下述表3所示。
[0116]
需要说明的是,数据的解析使用作为waters(注册商标)masslinx 4.1软件内的自动处理系统的quanlinx。
[0117]
[表1]
[0118][0119]
[表2]
[0120][0121]
[表3]
[0122][0123]
<6-3.分析结果>
[0124]
将分析结果示于图1。图1的横轴从左起依次为25(oh)d
3-piptad衍生物、25(oh)d
3-daptad衍生物、3-epi(表)-25(oh)d
3-piptad衍生物、3-epi(表)-25(oh)d
3-daptad衍生物、25(oh)d
2-piptad衍生物、25(oh)d
2-daptad衍生物、24,25(oh)2d
3-piptad衍生物、24,25
(oh)2d
3-daptad衍生物、1,25(oh)2d
3-piptad衍生物和1,25(oh)2d
3-daptad衍生物,纵轴为离子强度。
[0125]
图1示出分别针对5成分的维生素d代谢物(25(oh)d3、3-epi(表)-25(oh)d3、25(oh)d2、24,25(oh)2d3、1,25(oh)2d3)的基于piptad的衍生物和基于daptad的衍生物的离子强度的比较(area比较(面积比较))的结果。
[0126]
如图1所示,25(oh)d
3-piptad衍生物的离子强度为83494,25(oh)d
3-daptad衍生物的离子强度为50386。即,对于25(oh)d3,piptad与daptad相比,实现了约1.7倍的灵敏度改善。
[0127]
如图1所示,3-epi(表)-25(oh)d
3-piptad衍生物的离子强度为10887,=3-epi(表)-25(oh)d
3-daptad衍生物的离子强度为6480。即,对于3-epi(表)-25(oh)d3,piptad与daptad相比,实现了约1.7倍的灵敏度改善。
[0128]
如图1所示,25(oh)d
2-piptad衍生物的离子强度为13786,25(oh)d
2-daptad衍生物的离子强度为5868。即,对于25(oh)d2,piptad与daptad相比,实现了约2.3倍的灵敏度改善。
[0129]
如图1所示,24,25(oh)2d
3-piptad衍生物的离子强度为8586,24,25(oh)2d
3-daptad衍生物的离子强度为6445。即,对于24,25(oh)2d3,piptad与daptad相比,实现了约1.3倍的灵敏度改善。
[0130]
如图1所示,1,25(oh)2d
3-piptad衍生物的离子强度为6376.3,1,25(oh)2d
3-daptad衍生物的离子强度为2871。即,对于1,25(oh)2d3,piptad与daptad相比,实现了约2.2倍的灵敏度改善。
[0131]
但是,本发明不限定于上述各实施方式和上述各实施例,可以在不脱离本发明的主旨的范围内进行各种变更。
[0132]
另外,本说明书中记载的效果只不过是示例,没有限定,而且可以为其他效果。
[0133]
另外,本发明也可以取以下的构成。
[0134]
[1]
[0135]
一种下述的通式(100)所示的化合物。
[0136][0137]
(该通式(100)中,n为2以上的整数。)
[0138]
[2]
[0139]
根据[1]所述的化合物,其中,前述通式(100)所示的化合物为下述的式(i)所示的化合物。
[0140][0141]
[3]
[0142]
一种衍生物化试剂,其用于使具有二烯的化合物衍生物化,其含有下述的通式(100)所示的化合物。
[0143][0144]
(该通式(100)中,n为2以上的整数。)
[0145]
[4]
[0146]
根据[3]所述的衍生物化试剂,其中,前述通式(100)所示的化合物为下述的式(i)所示的化合物。
[0147][0148]
[5]
[0149]
一种下述的通式(100)所示的化合物的合成方法,其包括:芳基卤与饱和的杂环式胺化合物的亲核取代反应。
[0150][0151]
(该通式(100)中,n为2以上的整数。)
[0152]
[6]
[0153]
根据[5]所述的合成方法,其中,前述通式(100)所示的化合物为下述的式(i)所示的化合物,
[0154]
前述杂环式胺化合物为哌啶。
[0155]
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1