斑马鱼vps28基因在制备神经血管单元血管障碍模型中的应用的制作方法
1.本发明属于生物技术领域,具体涉及斑马鱼vps28基因在制备神经血管单元血管新生障碍斑马鱼模型构建中的应用,以及利用该模型其筛选促血管新生药物。
背景技术:
2.脑卒中是指脑部血流循环异常引起的脑功能损害,其发病率在我国居高不下,是我国成年人最主要的致死致残性疾病。其中80%的脑卒中人群为缺血性脑卒中,中国缺血性脑卒中诊疗指南中明确指出,改善缺血区血流灌注是治疗缺血性脑卒中的关键,而有效侧支循环的建立是改善缺血性脑卒中的重要治疗手段。
3.侧支循环建立是通过血管新生形成的,血管新生是指在原来存在的血管上经出芽或其他方式形成血管,其中涉及到细胞增殖、迁移、分化、管状形成和血管生成因子的调控等生物学过程。新生血管的形成主要是通过血管出芽的生成,其中无血管组织分泌诱导生长因子,比如:血管内皮生长因子(vegf)或骨形态发生蛋白(bmp),来诱导血管出芽。目前,尚缺乏有效药物促进缺血性脑卒中后侧支循环建立。因此,有必要针对缺血性脑卒中,开发用于缺血性脑卒中的侧支循环建立治疗方法研究的生物样本,也就需要合适的动物模型。
4.斑马鱼,作为科学研究的第三大模式动物,因具有众多优势,比如体外发育,胚胎透明,饲养成本低,故斑马鱼在大规模药物筛选中具有重大优势。之前报道,可采用血管生长因子受体抑制剂(如专利cn201110327420),或采用辛伐他汀(如专利cn 201910752649)来诱导产生斑马鱼血管新生障碍模型。由于斑马鱼头部血管新生和躯干处节间血管新生的调控机制并不完全一致,针对促进脑卒中血管新生药物筛选,采用头部血管新生障碍斑马鱼更贴近临床需求,但上述血管新生障碍模型表明斑马鱼躯干节间血管新生被抑制,并未明确脑部血管新生障碍情况,因此,对促进脑血管新生药物筛选上述两种斑马鱼模型并不适用;其次,已报道的这些血管新生障碍模型均是由不同浓度药物处理胚胎产生,由于胚胎对药物的耐受程度不同,所以造模对血管新生抑制的程度也并不相同,例如辛伐他汀(专利cn201910752649) 诱导产生斑马鱼血管新生障碍模型中指出,0.15μm辛伐他汀的斑马鱼血管新生抑制率仅为 43.40
±
11.98%。基于上述问题,建立一种特异且稳定的神经血管单元血管新生障碍模型用于筛选促进大脑侧支循环建立药物至关重要。
技术实现要素:
5.针对现有技术的不足,本技术首次发现斑马鱼vps28基因与血管新生的相关性,并应用该基因制备大脑神经血管单元血管新生障碍动物模型,该建模方法操作简单,可重复性高,本技术同时提供了利用上述斑马鱼大脑血管新生障碍模型筛选促血管新生药物的方法,其可通过直接观察血管形成,在体评估药物促进血管新生的效果。
6.为达到以上发明目的,本发明通过以下技术方案实现:
7.首先,本技术提供了一种斑马鱼vps28基因在制备神经血管单元血管新生障碍模
型中的应用。斑马鱼vps28基因编码序列(ncbi登录号:nm_200590),本技术应用涉及对该基因编码序列355至376位核苷酸序列缺失的突变体斑马鱼。
8.进一步,具体应用步骤如下:
9.1)利用crispr/cas9基因组编辑技术靶向敲除vps28基因,收集常规斑马鱼受精卵,在胚胎1-细胞期共同注射vps28 sgrna(seq id no.1)和crispr cas9蛋白,将注射的胚胎饲养至性成熟(饲养条件为:室温27.5℃,光照14小时,黑暗10小时),得到g0代斑马鱼;
10.2)将g0代斑马鱼进行自由交配,获得vps28突变携带f1代个体;取f1代个体的部分尾鳍,进行基因型鉴定,筛选vps28移码突变携带者(即vps28基因编码序列355至376位核苷酸序列缺失的个体),即为vps28移码突变f1代个体。其中筛选获得vps28移码突变 f1代个体几率为40%左右。
11.3)将性成熟vps28移码突变f1代个体雌性和雄性进行交配,筛选f2代vps28纯合突变胚胎(纯合子),即为vps28突变体斑马鱼,该突变体斑马鱼的vps28基因编码序列355至 376位核苷酸序列缺失,vps28基因vps28超家族结构域中第119位氨基酸异亮氨酸被终止密码子取代。
12.待f2代胚胎发育至第54小时(54hpf,即f2代受精卵形成后的54小时),通过荧光显微镜对其进行观察分析,可发现vps28纯合突变体脑部的中央动脉(ctas)无法正常形成,即在vps28突变体斑马鱼后脑处的ctas形成障碍,即获得基于斑马鱼vps28基因缺失的神经血管单元血管新生障碍模型。
13.本技术中“神经血管单元血管新生障碍”是由vps28基因功能缺失引起,即由vps28基因移码突变导致的脑血管新生障碍,其症状为大脑实质中央动脉形成障碍。
14.优选的,上述斑马鱼受精卵为tg(kdrl:egfp)血管内皮细胞标记绿色荧光转基因斑马鱼 (绿色荧光蛋白在血管特异性表达的转基因斑马鱼品系,购自国家斑马鱼资源中心(s843tg, tg(kdrl:egfp))受精卵)。
15.优选的,上述步骤2)“基因型鉴定”方法如下:采用75%乙醇杀菌的眼科镊子,裁剪少量斑马鱼尾鳍;利用基因组提取试剂盒提取f1代斑马鱼dna,提取方法如下:将斑马鱼尾鳍置于10μl的dna提取液中,经65℃30min,95℃5min,16℃1min后,获得待f1代待鉴定斑马鱼dna,置于-20℃保存;接着以该f1代待鉴定斑马鱼dna为模板,进行pcr扩增。
16.pcr反应体系:10μl 2*mastermix,1μl vps28 f1代正向引物(5μm),1μl vps28 f1代反向引物(5μm),1μl f1代待鉴定斑马鱼dna(浓度为100ng/μl),7μl超纯水(高压灭菌);所述vps28 f1代正向引物核苷酸序列如seq id no.2所示 (5
’‑
atttagctggactgtccgct-3’),vps28 f1代反向引物核苷酸序列如seq id no.3 所示(5
’‑
attcattctaggctacacg-3’);
17.pcr扩增步骤如下:94℃5min,35个循环(94℃30sec,58℃30sec,72℃30sec), 72℃7min。pcr产物进行电泳,将pcr产物进行dna测序,筛选获得vps28移码突变f1 代个体;该vps28移码突变f1代个体对应的pcr产物电泳条带大小为557bp。
18.优选的,上述筛选f2代vps28纯合突变胚胎是指:将f2代胚胎利用基因组提取试剂盒,提取f2代斑马鱼基因组(方法如上述基因型鉴定方法),获得f2代待鉴定斑马鱼基因组;接着以该f2代待鉴定斑马鱼dna为模板,进行pcr扩增。
19.配置以下pcr扩增体系:10μl 2*mastermix,1μl vps28 f2代正向引物(5μm),1μl
vps28 f2代反向引物(5μm),1μl f2代待鉴定斑马鱼基因组(浓度为100ng/μl),7μl超纯水(高压灭菌);上述vps28 f2代正向引物核苷酸序列如seq id no.4所示 (5
’‑
atttagctggactgtccgct-3’),vps28 f2代反向引物核苷酸序列如seq id no.5 所示(5
’‑
attcattctaggctacacg-3’)。
20.pcr扩增步骤如下:94℃5min,35个循环(94℃30sec,58℃30sec,72℃10sec), 72℃7min。pcr产物进行电泳,纯合突变体pcr产物大小为137bp;杂合突变体pcr产物大小为137bp和159bp;野生型pcr产物大小为159bp。
21.其次,本技术还提供了上述神经血管单元血管新生障碍模型在筛选促进头部血管新生药物中的应用,即在f2代纯合突变体的幼鱼发育至30hpf时间(即f2代受精卵形成后的30小时),将促进血管新生的vegf蛋白通过ccv注射到血液循环系统中,vps28纯合突变体脑部中央动脉缺失部位能形成新的管状结构血管,即为用于筛选促进头部血管新生药物的斑马鱼模型。
22.本技术中,所使用的crispr/cas9基因组编辑技术为常规斑马鱼基因组编辑技术,如文献“sμn,y.,zhang,b.,lμo,l.,shi,d.l.,wang,h.,cμi,z.,hμang,h.,cao,y.,shμ,x.,zhang, w.,zhoμ,j.,li,y.,dμ,j.,zhao,q.,chen,j.,zhong,h.,zhong,t.p.,li,l.,xiong,j.w.,peng, j.,xiao,w.,zhang,j.,yao,j.,yin,z.,mo,x.,peng,g.,zhμ,j.,chen,y.,zhoμ,y.,liμ,d.,pan, w.,zhang,y.,rμan,h.,liμ,f.,zhμ,z.,meng,a.,and consortiμm,z.(2019)systematicgenome editing of the genes on zebrafish chromosome 1 by crispr/cas9.genome res”中所公开的基因编辑方法。
23.优选的,本专利所述的ccv注射vegf为斑马鱼常规ccv注射方法;
24.优选的,注射的vegfa蛋白浓度为10μg/μl,注射量为1nl/胚胎;
25.相对于现有技术,本发明具有以下有益效果:
26.本发明首次发现vps28突变体可用于头部血管形成障碍模型,该建模方法操作简单,可重复性高,胚胎发育中无需添加外源抑制药物,成功率高;且该模型已被验证可以直接用来筛选可促进脑部血管新生的药物,并且可以通过在体观察药物促进血管新生情况,具有很好的促血管新生药物筛选适用性。
附图说明
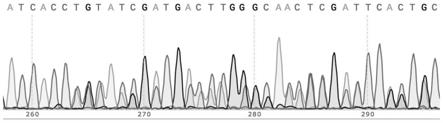
27.图1为vps28(-22bp)突变体测序峰图(部分)示意图。
28.图2为突变体vps28(-22bp)的截短蛋白结构示意图。
29.图3为实施例f2代斑马鱼普通体式荧光显微镜镜检图。
30.图4为实施例f2代vps28斑马鱼突变体鉴定pcr产物电泳图。
31.图5为实施例注射vegf蛋白后的f2代斑马鱼激光共聚焦显微镜镜检图。
具体实施方式
32.实施例中的实验方法,如无特殊说明,均为常规使用方法。
33.实施例中使用的tg(kdrl:egfp)转基因斑马鱼购自国家斑马鱼资源中心(s843tg, tg(kdrl:egfp)。
34.crispr cas9蛋白购自南京金斯瑞生物科技有限公司,为常规商业化蛋白。
35.基因组提取试剂盒购自南京尧顺禹生物科技有限公司。
36.mastermix购自南京诺唯赞生物科技有限公司。
37.vegf蛋白购自南京金斯瑞生物科技有限公司。
38.实施例中涉及的基因序列:
39.seq id no.1:ggaccgaccgatcaccattaagg;
40.seq id no.2(vps28-e7f):5
’‑
accattaactaatgctgcaagct-3’;
41.seq id no.3(vps28-e7r):5
’‑
gctccagcatgacaaagtacac-3’;
42.seq id no.4:5
’‑
atttagctggactgtccgct-3’;
43.seq id no.5:5
’‑
attcattctaggctacacg-3’。
44.实施例1.斑马鱼vsp28突变体构建
45.1.按照常规方法收取tg(kdrl:egfp)转基因斑马鱼受精卵。
46.将核苷酸序列如seq id no.1所示的sgrna(终浓度为70ng/μl)和crispr cas9蛋白 (终浓度为200ng/μl)涡旋混匀,获得混合物;经显微注射到斑马鱼受精卵中(每胚胎的混合物显微注射量为1nl),培养制备vps28基因敲除初建者(g0代),培养条件为:室温27.5℃,光照14小时,黑暗10小时。
47.2.将g0代按照常规方法饲养至性成熟,令其自由交配,获得f1代胚胎。
48.将f1代胚胎按照常规方法饲养至性成熟,通过取尾鳍提取基因组作为模板dna,pcr 扩增后进行基因型鉴定,筛选f1代移码突变体。筛选步骤如下:
49.2.1提取基因组
50.采用75%乙醇杀菌的眼科镊子,裁剪少量斑马鱼尾鳍;利用基因组提取试剂盒提取斑马鱼基因组,提取方法如下:将斑马鱼尾鳍置于10μl的基因组提取液中,经65℃30min, 95℃5min,16℃1min后,获得f1代待鉴定斑马鱼基因组,置于-20℃保存。
51.2.2突变体基因型鉴定
52.利用pcr方法,扩增包含sgrna作用位点的上游和下游共557bp的基因组序列,进行dna测序,鉴定f1代基因型。
53.pcr扩增体系:10μl 2*mastermix,1μl vps28 f1代正向引物(5μm,其核苷酸序列如seq id no.2所示),1μl vps28 f1代反向引物(5μm,其核苷酸序列如seq id no.3所示),1μl待鉴定斑马鱼基因组(浓度为100ng/μl),7μl超纯水(高压灭菌);
54.pcr扩增步骤:94℃5min,35个循环(94℃30sec,58℃30sec,72℃30sec), 72℃7min;获得pcr扩增产物。
55.将获得的pcr扩增产物送南京金斯瑞生物科技有限公司进行dna测序,筛选其中基因型为vps28 cds区域减少22bp的突变体(即vps28基因编码序列355至376位核苷酸序列缺失的个体)vps28(-22bp),即为f1代vps28(-22bp)杂合子突变体,该突变体对应的pcr扩增产物电泳条带大小约为557bp。
56.本实施例获得的vps28(-22bp)变体测序峰图(部分)如图1所示,显示进行基因型鉴定的这条vps28突变体为杂合子,且基因型为vps28(-22bp)。
57.图2为vps28突变体构建的基本信息示意图。
58.实施例2.vps28(-22bp)纯合突变体建立头部血管新生障碍模型
59.将实施例1筛选获得的f1代vps28(-22bp)杂合子突变体进行自由交配,令其生产
f2代个体。
60.将f2代个体胚胎常规培养到受精后54小时(54hpf),在普通体式荧光显微镜下观察,其中四分之一胚胎显示中央动脉形成异常如图3所示。图3中,a、b分别显示的是侧面观和背部观vps28野生型或者杂合子(即一个等位基因发生突变,另一个等位基因无突变)ctas 表型,为正常表型(ctas形成正常);c、d显示的是侧面观和背部观vps28突变体的表型(ctas 无形成),将拍照的这4条幼鱼进行基因型鉴定。
61.将f2代幼鱼放置于200μl的pcr管中,提取基因组作为模板dna进行pcr扩增,基因组提取方法同实施例1中2.1;
62.pcr扩增体系:10μl 2*mastermix,1μl vps28 f2代正向引物(5μm,其核苷酸序列如seq id no.4所示),1μl vps28 f2代反向引物(5μm,其核苷酸序列如seq id no.5 所示),1μl待鉴定斑马鱼基因组(浓度为100ng/μl),7μl超纯水(高压灭菌);
63.pcr扩增步骤:94℃5min,35个循环(94℃30sec,58℃30sec,72℃10sec),72℃ 7min。
64.扩增产物电泳图如图4所示。纯合突变体pcr产物大小为137bp;杂合突变体pcr产物大小为137bp和159bp;野生型突变体pcr产物大小为159bp;图4中,第1、3、6、9 泳道为vps28纯合子,第2、5泳道为vps28野生型,第4、7、8、10、11、12、13、14泳道为vps28杂合子。与图3镜检结果一致。其中,携带vps28纯合移码突变的f2代斑马鱼(纯合子),即为头部血管新生障碍模型。
65.实施例3.vps28纯合移码突变体可作为促血管新生药物筛选模型
66.将vegf蛋白(蛋白浓度为10μg/μl,注射量为1nl/胚胎)通过ccv注射到实施例2受精后30小时的vps28纯合移码突变的f2代幼鱼中(即头部血管新生障碍模型),发现到54hpf 时,跟未注射组相比,vegf蛋白注射组能够促进部分中央动脉形成,如图5所示。上述ccv 注射法为本领域常规方法,如文献“xu,b.,zhang,y.,du,x.f.,li,j.,zi,h.x.,bu,j.w.,yan, y.,han,h.,and du,j.l.(2017)neurons secrete mir-132-containing exosomes to regulate brainvascular integrity.cell res 27,882-897”所公开的方法。
67.图5中,a为侧面观的vps28杂合子或者野生型斑马鱼ctas(白色虚线方框中所示), b为vps28纯合突变体中ctas形成障碍图,c为vegf可促进ctas血管新生,d-f依次为a-c 图中虚线方框部分局部放大图。
68.本实施例验证了实施例2获得的头部血管新生障碍模型(vps28突变体)可以应用于筛选促进神经血管单元血管新生的药物。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1