一种用于细胞外囊泡分离的金属有机骨架材料、试剂盒及其应用
本发明涉及细胞外囊泡分离分离,更具体地,涉及一种用于细胞外囊泡分离分离的金属有机骨架材料、试剂盒及其应用。
背景技术:
1、细胞外囊泡(extracellular vesicles,evs)是由细胞释放的脂质双分子层囊泡,携带亲代细胞的信息分子,在细胞间交流发挥重要作用,与疾病的发生发展密切相关,如何有效从复杂的生物样本中分离出高纯度evs是当今的研究的热点与难题。目前已有的evs分离手段主要分为六种:超速离心法、密度梯度离心法、尺寸排阻法、超滤法、聚合物共沉淀法和免疫亲和法。
2、超速离心法是分离evs最常用的手段。该方法常常采用差速离心的策略,在较低离心力(300g,10~15min)下除去死细胞,所得上清液用较高离心力(10000g)进一步除去细胞碎片与游离细胞器,最后在超高速离心(100000~150000g)作用下收集evs沉淀。超速离心法已经广泛应用于各种生物样品evs的分离,如细胞上清,血清,血浆,尿液和脑脊液等。尽管是evs分离的金标准,本方法仍存在耗时长、回收率低、纯度难以保证等缺点,不适用于大批量、小容量样本离心,限制了其临床应用。
3、密度梯度离心法是根据evs的密度与尺寸特征进行分离的方法。该方法常用蔗糖和碘克沙醇作为介质溶液,设计一系列的密度梯度后将样品放置于顶层,通过离心作用将样品内颗粒分散在不同的密度层中。密度梯度离心法能够高效分离evs、蛋白聚集体、非膜类颗粒等,但同样存在回收率不高、分离时间长、需要精细操作等缺点。
4、尺寸排阻法是在填充柱中加入特定孔径的填料,利用球状填料内的孔径大小不同,样品中不同的物质在通过填料时的路径存在差异,从而在洗脱的过程中,收集不同时间段的过滤物,即可得到evs样品,从而进行evs和杂质的分离。但该方法仅利用尺寸的大小等特性进行evs分离,难以区分其他杂质蛋白,纯度有待提高。
5、超滤法其原理是利用具有一定孔径或不同截留分子量(molecular weight cutoff,mwco)的滤膜进行evs分离。该方法经过简单的离心法即可得到大量的evs,无需大型仪器,分离时间较超速离心法短。但超滤法所得evs缺乏特异性、分离纯度不足、存在滤膜堵塞问题,目前较多应用于样品的浓缩前处理,常常与超速离心法等方法联合使用。
6、聚合物共沉淀法分离evs主要是在样品中引入竞争性结合游离水的分子,使得evs沉淀。该方法常用的多聚物是聚乙二醇(peg),其可与疏水性蛋白和脂质分子结合共沉淀,通过低速离心即可得到产物。聚合物共沉淀法快速简便,无需大型仪器与特殊处理技巧,但存在纯度低、杂蛋白较多、颗粒大小不均一、试剂容易破坏evs结构等缺点,对于样品类型和前处理要求较高。
7、免疫亲和法是根据特异性抗体和evs表面表达的抗原相互识别结合为基础的evs分离方法。目标抗体可固定于elisa板、磁性微球、树脂和微流控装置等支持物上。该方法的优势在于能够特异性地捕获某些evs亚群,在疾病的诊断监测方面有较好前景。免疫亲和法的缺陷在于依靠evs膜表面蛋白作为捕获介质,且evs分离产量低,价格昂贵。
8、除了以上的evs常用分离方法,一些新兴的分离方法如微流控超声波分离法acoustofluidic technology)、交流电动微芯片(alternating current electrokinetic,ace)、不对称流场流分离法(asymmetric-flow field-flow fractionation,af4)、脂质分离法等也各有特色。但目前快速、简便、经济、大量分离高纯度evs还存在困难,能够同时应用于科研实验室和临床的evs分离试剂盒仍然较少。
技术实现思路
1、本发明的目的在于克服现有技术中存在的上述缺陷和不足,提供一种用于evs分离的金属有机骨架材料。
2、本发明的另一目的在于提供一种用于evs分离的试剂盒。
3、本发明的上述目的是通过以下技术方案给予实现的:
4、一种用于evs分离的金属有机骨架材料,包括金属有机骨架及结合在其表面的evs捕获元件,所述evs捕获元件由核酸及修饰在其一端的胆固醇组成。
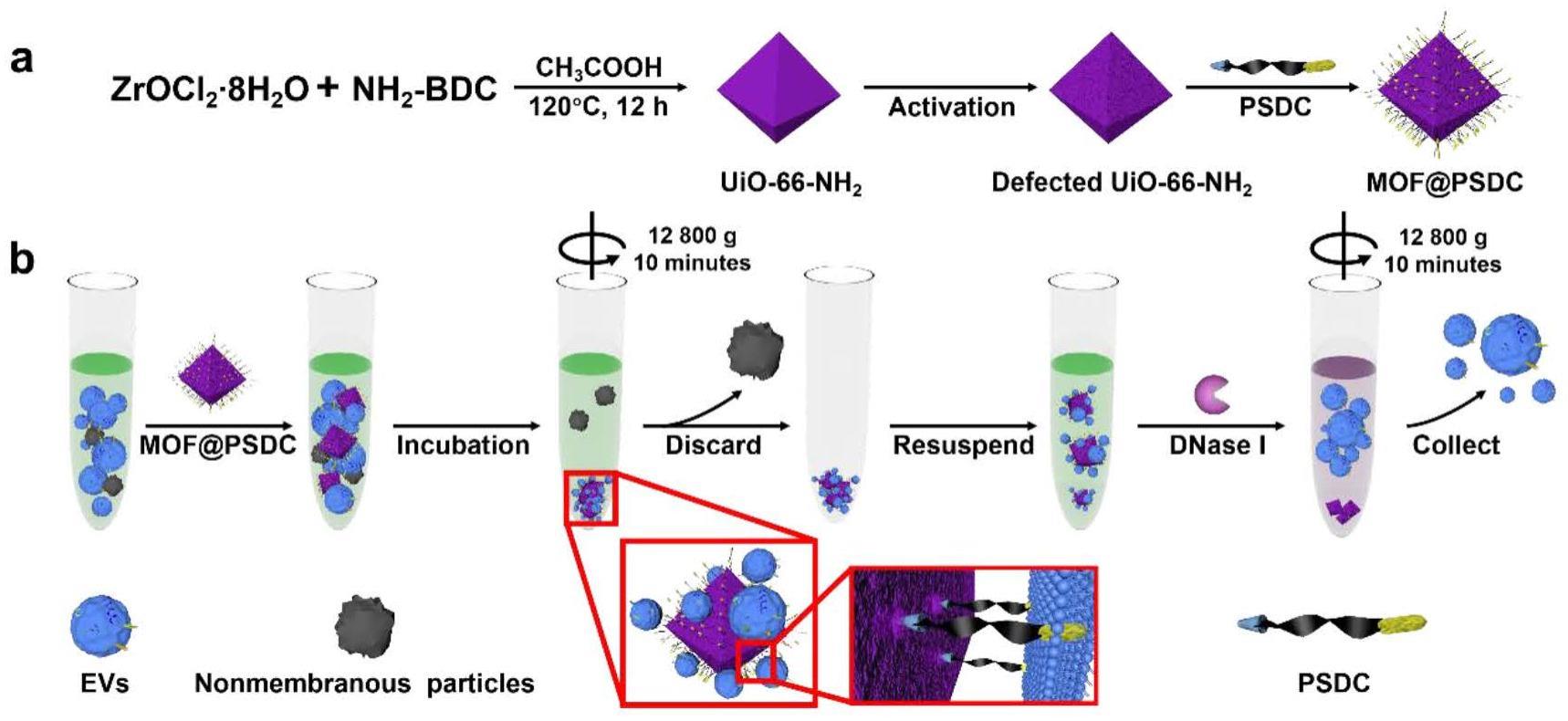
5、金属有机骨架(metal organic frameworks,mofs)是一类由金属离子和有机配体在一定的条件下自组装而成的多孔材料,该材料有着比重高、比表面积大、可修饰位点多、无明显毒性等优越特征。mof在多种缓冲液中能够保持结构的稳定,超高的稳定性为其自在不同溶液中捕获evs提供了理论基础。本发明发现,单纯的金属有机骨架并不能用于evs的捕获、分离;本发明创造性地对金属有机骨架进行修饰,在其表面结合一端修饰有胆固醇的功能化核酸作为evs捕获元件,金属有机骨架作为纳米分离载体,evs捕获元件作为捕获链对evs脂质双分子层进行识别。所述金属有机骨架材料通过捕获元件3’端修饰的胆固醇分子嵌入到evs脂质双分子层当中,胆固醇作为膜类的组成成分之一,有稳定膜结构的功能,不对evs结构造成影响,同时可有效嵌入evs脂质双分子层当中捕获evs,捕获时间仅需5-10min,比磁珠-抗体法(>12h)快数十倍。通过低速离心处理(12800g)即可实现evs的富集。进一步加入切割单元-核酸酶剪切下捕获元件,低速离心后收集上清可得到游离的evs,用于流式细胞术检测。分离过程不会对evs的膜蛋白活性产生影响。传统超速离心法分离的evs难以排除蛋白干扰,本发明引入胆固醇作为evs捕获单元可减少与evs密度、尺寸相似的杂质污染。一定长度的核酸单链在溶液中可自由摆动,修饰在金属有机骨架的表面后可增大移动的面积,增加胆固醇捕获evs的几率。
6、优选地,所述金属有机骨架为uio-66-nh2。金属有机骨架uio-66-nh2具备比重大、比表面积广、在溶液中分散性好、稳定性高的特点,能够满足基于固体颗粒的分离方法需求。且uio-66-nh2由锆离子和配体构建而成,通过调控合成过程,在其表面形成配位不饱和位点,通过共价结合方式可快速修饰功能化核酸捕获元件。同时,uio-66-nh2无细胞毒性,亦无膜类破坏性,不会破坏evs的结构完整性,是一个适用于evs分离的纳米载体。
7、优选地,所述evs捕获元件的核酸5’端修饰磷酸根基团,3’端修饰胆固醇,磷酸根离子通过与金属有机骨架的金属中心共价结合,在金属骨架的表面形成一层触手般的捕获核酸作为evs捕获元件。例如,当金属有机骨架为uio-66-nh2时,捕获原件上的磷酸根和锆离子通过形成共价键连接,修饰步骤简单快捷。较传统的在固相颗粒表面修饰抗体分子捕获evs膜上的抗原分子相比,步骤简单快捷,不需要使用价格高昂的特异性抗体,稳定,修饰后保存时间长,且不需要考虑未表达相应抗原的evs被遗漏等问题。
8、优选地,所述evs捕获元件含有长度5-50bp的核苷酸序列。
9、进一步优选地,所述evs捕获元件含有长度15bp的核苷酸序列。
10、进一步优选地,所述evs捕获元件含有seq id no.1~9任一所述的核苷酸序列。
11、更优选地,所述evs捕获元件含有seq id no.8所述的核苷酸序列。
12、优选地,所述evs捕获元件中,磷酸根基团与核苷酸序列之间连接有间隔物。所述间隔物选自18-o-二甲氧基三苯甲基六乙二醇,1-[((氰基乙基)-(n,n二异丙基)]-亚磷酰胺。
13、优选地,所述金属有机骨架的粒径为150~400nm;作为分离载体的mof,要求在溶液中具有较好的分散性和均一性,能够通过简单的离心方法将其从溶液体系中沉淀下来。
14、本发明还提供上述任一所述金属有机骨架材料的制备方法,提供金属有机骨架,配制成均匀分散的mof溶液,再加入evs捕获元件混匀孵育,期间减少mof表面和evs捕获元件的电荷排斥力,将反应好的溶液离心去除上清,洗涤若干次,重悬,即得。
15、优选地,所述金属有机骨架的金属中心具有不饱和配位点,可通过共价结合方式快速修饰evs捕获元件。
16、具体地,将金属有机骨架溶解在纯水中,浓度为0.5~2mg/ml(优选1mg/ml),加入25~75μl(优选50μl)100μm核酸捕获原件充分混匀,放置在混匀仪上共孵10~20h(优选12h)。加入50~150μl(优选110μl)2μm的氯化钠溶液,继续孵育20~40min(优选30min),增强mof和核酸捕获原件的相互结合作用,该过程重复三次。将上述混合物在8000~12000g(优选12800g)条件下离心5~20分钟(优选10min),用纯水洗涤五次除去未结合的核酸捕获原件,即得到修饰后的金属有机骨架材料,最后重悬于hepes缓冲液中,4℃储存备用。
17、本发明还提供所述金属有机骨架材料在evs分离或在制备evs分离产品中的应用。
18、优选地,所述产品为试剂盒。
19、一种利用所述金属有机骨架材料进行evs分离的方法,先将上述用于evs分离的金属有机骨架材料溶解于缓冲溶液中,得到分散性好、均一的溶液;再加入含有evs的待分离生物样本溶液混匀,离心,缓冲液洗涤,除去生物样本中的杂质;最后加入核酸酶酶切捕获元件,离心,取上清即获得分离后的evs溶液。所述生物样本包括但不限于血液、尿液、唾液、眼泪等,任何含有evs的生物样本均可适用于本发明方法。
20、一种用于evs分离的试剂盒,所述试剂盒含有上述任一所述用于evs分离的金属有机骨架材料。
21、优选地,还包含用于切断evs捕获元件与金属有机骨架连接的切割单元,从而在捕获evs后需将其从mof上释放下来,通过切下捕获元件,得到游离的evs。所述切割单元为任何可以切断核苷酸相邻碱基间磷酸二酯键的制剂,例如核酸酶等。
22、更优选地,所述切割单元为脱氧核糖核酸酶(dnase i)。脱氧核糖核酸酶i是可以剪切脱氧核糖核酸单链或双链的蛋白酶。金标准超速离心法通过超高速的离心力将evs沉淀,会导致其结构完整性受损,核酸内容物外漏,污染下游检测实验,造成假阳性、假阴性结果。dnase i的活性可通过调节辅助金属离子浓度实现“开”与“关”,在捕获过程中dnase i将游离的核酸分解,分离结束后失活dnase i,不影响evs后续核酸分析。dnase i特异性高,不对蛋白、脂质起反应,在本发明中实现了将evs从金属骨架表面释放下来的功能。evs捕获元件经过dnase i处理后被切割成不同长度的片段。
23、具体地,本发明构建了一个以uio-66-nh2作为分离载体、功能化核酸作为evs捕获元件以及核酸酶作为切割单元的evs快速简便分离试剂盒,所述试剂盒包含用于evs分离的金属有机骨架材料:以金属有机骨架uio-66-nh2为分离载体,磷酸化修饰的功能化核酸通过磷酸根离子与uio-66-nh2的锆离子共价结合,在uio-66-nh2的表面形成一层捕获核酸作为evs捕获元件;及用于将evs捕获元件从mof上释放下来的脱氧核糖核酸酶。
24、与现有技术相比,本发明具有以下有益效果:
25、(1)本发明的金属有机骨架材料对evs分离时间快,能够在短时间内分离出生物样本中的evs;胆固醇作为膜类的组成成分之一,有稳定膜结构的功能,不对evs结构造成影响,同时可有效嵌入evs脂质双分子层当中捕获evs,捕获时间仅需5~10min,比磁珠-抗体法(>12h)快数十倍。
26、(2)利用本发明金属有机骨架材料分离得到的evs数量多,且保证evs蛋白的活性,可以满足下游应用所需;能够有效捕获并通过核酸酶释放,且粒径分布有91%在300nm以下,符合evs的粒径分布定义。
27、(3)本发明金属有机骨架材料对evs的分离效率高,能够将样品中所含的大部分evs分离;
28、(4)利用本发明金属有机骨架材料所采取的evs分离方法、试剂对evs的形态结构、evs膜表面生物分子与evs内涵物无损害,不会影响后续的试验。
29、(5)利用本发明金属有机骨架材料进行evs分离操作简便,无需专门培训;
30、(6)利用本发明金属有机骨架材料分离evs成本相对低廉,无需昂贵仪器和试剂。
31、综上,本发明提供了一种快速简便的细胞上清evs分离试剂盒平台,用于解决现有技术中evs分离样品需求量大、分离时间长、蛋白污染难去除、操作繁琐、不适用于临床应用等问题。
- 还没有人留言评论。精彩留言会获得点赞!