一种蛋白酶K突变体及其表达载体的构建和应用的制作方法
一种蛋白酶k突变体及其表达载体的构建和应用
技术领域
1.本发明涉及生物工程技术领域,具体而言,涉及一种蛋白酶k突变体及其表达载体的构建和应用。
背景技术:
2.蛋白酶k属丝氨酸蛋白酶类,它是林伯氏白色念球菌(tritirachium album limber)产生的一类主要蛋白酶。因能合成该种蛋白酶的微生物能在以角蛋白(kerantin)为唯一碳氮源的环境中生长,故将其称作蛋白酶k,其三维结构见图1。蛋白酶k具有极高的酶活性和广泛的底物特异性,能优先分解与疏水性氨基酸、含硫氨基酸、芳香族氨基酸c末端邻接的酯键和肽键,常被用于降解蛋白生产短肽。它具有丝氨酸蛋白酶类所具有的典型催化三联体asp39-his69-ser224特征并且活性中心周围有两个ca 2+
结合位点以增加其稳定性,见图2,使其在更广泛的条件下保持较高的酶活力。蛋白酶k能将蛋白失活或降解,利用其这个特性,在核酸纯化、丝绸、医药、食品和酿造等领域蛋白酶k都有着重要的应用。
3.由于林伯氏白色念球菌生产比较缓慢,对于蛋白酶k的实际生产有着极大的限制。相关研究者在大肠杆菌中尝试了表达蛋白酶k,但是大多都已包涵体的形式存在,不利于工业生产。
4.鉴于此,特提出本发明。
技术实现要素:
5.本发明的目的在于提供一种蛋白酶k突变体及其表达载体的构建和应用。
6.本发明是这样实现的:
7.第一方面,本发明实施例提供了一种蛋白酶k突变体,其在seq id no.1所示的氨基酸序列的基础上,具有如下至少一种突变:f371c和t373p。
8.第二方面,本发明实施例提供了一种分离的核酸,其包括编码如前述实施例所述的蛋白酶k突变体的核酸序列。
9.第三方面,本发明实施例提供了一种重组载体,其含有如前述实施例所述的分离的核酸。
10.第四方面,本发明实施例提供了如前述实施例所述的重组载体的构建方法,其包括:将所述分离的核酸插入载体中,构建获得单拷贝重组载体。
11.第五方面,本发明实施例提供了一种基因工程菌,其含有如前述实施例所述的重组载体或如前述实施例所述的构建方法构建的重组载体。
12.第六方面,本发明实施例提供了如前述实施例所述的基因工程菌的构建方法,其包括将如前述实施例所述的重组载体或如前述实施例所述的构建方法构建的重组载体转化入菌体中获得基因工程菌。
13.第七方面,本发明实施例提供了如前述实施例所述的蛋白酶k突变体的制备方法,其包括:培养如前述实施例所述的基因工程菌或由前述实施例所述构建方法构建获得的基
因工程菌,以诱导表达所述蛋白酶k突变体;或,在seq id no.1所示的氨基酸序列的基础上,进行如下至少一种突变:f371c和t373p。
14.第八方面,本发明实施例提供了如前述实施例所述的蛋白酶k突变体或如前述实施例所述的基因工程菌或由前述实施例所述构建方法构建获得的基因工程菌在水解蛋白或制备用于水解蛋白的产品中的应用。
15.本发明具有以下有益效果:
16.本发明提供了一种蛋白酶k突变体,相对于野生型的蛋白酶k而言,具有更好的酶活,为蛋白酶k的应用和研究提供了途径。
17.此外,本发明还提供了上述蛋白酶k突变体高拷贝表达载体的构建,提高了高表达菌体的筛选称功率,减少了大量筛菌的操作,为具有应用价值的蛋白酶k的工业化生产路线指明了方向。
附图说明
18.为了更清楚地说明本发明实施例的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,应当理解,以下附图仅示出了本发明的某些实施例,因此不应被看作是对范围的限定,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他相关的附图。
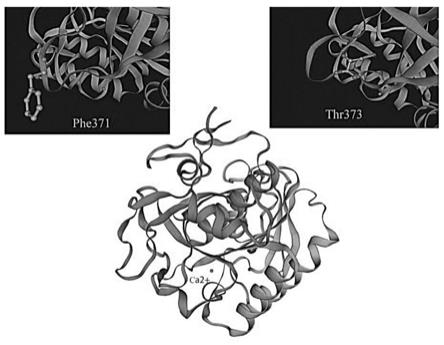
19.图1为蛋白酶k的三维结构;
20.图2为蛋白酶k的活性中心;
21.图3为蛋白酶k野生型三维结构与f371c/t373p突变体位点;
22.图4为patg9k-0的质粒图谱;
23.图5为patg9-1k的质粒图谱;
24.图6为patg9-3k的质粒图谱;
25.图7为高产菌株gs-pk在1%的干酪素bmmy平板上的抑菌结果图;
26.图8为patg9-3k/pichia pastoris gs115不同转化子发酵液上清sds-page。
具体实施方式
27.为使本发明实施例的目的、技术方案和优点更加清楚,下面将对本发明实施例中的技术方案进行清楚、完整地描述。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。
28.本发明实施例提供了一种蛋白酶k突变体,其在seq id no.1所示的氨基酸序列的基础上,具有如下至少一种突变:f371c和t373p,野生型蛋白酶k三维结构以及f371c和t373p位点见图3。
29.seq id no.1:mrlsvllsllplalgapaveqrseaaplieargemvankyivkfkegsalsaldaamekisgkpdhvyknvfsgfaatldenmvrvlrahpdveyieqdavvtinaaqtnapwglarisstspgtstyyydesagqgscvyvidtgieashpefegraqmvktyyyssrdgnghgthcagtvgsrtygvakktqlfgvkvlddngsgqystiiagmdfvasdknnrncpkgvvaslslgggysssvnsaaarlqssgvmvavaagnnnadarnyspasepsvctvgasdrydrrssfsnygsvldifgpgtsilstwiggstrsisgtsmatphvaglaaylmtlgkttaasacryiadt
ankgdlsnipfgtvnllaynnyqa。
30.优选地,当同时具有f371c和t373p时,其氨基酸序列如seq id no.2所示:mrlsvllsllplalgapaveqrseaaplieargemvankyivkfkegsalsaldaamekisgkpdhvyknvfsgfaatldenmvrvlrahpdveyieqdavvtinaaqtnapwglarisstspgtstyyydesagqgscvyvidtgieashpefegraqmvktyyyssrdgnghgthcagtvgsrtygvakktqlfgvkvlddngsgqystiiagmdfvasdknnrncpkgvvaslslgggysssvnsaaarlqssgvmvavaagnnnadarnyspasepsvctvgasdrydrrssfsnygsvldifgpgtsilstwiggstrsisgtsmatphvaglaaylmtlgkttaasacryiadtankgdlsnipcgpvnllaynnyqa。
31.本发明实施例提供了一种分离的核酸,其包括编码如前述实施例所述的蛋白酶k突变体的核酸序列。
32.优选地,所述分离的核酸的序列如seq id no.3所示,5
’‑
atgcgcctgagcgtgctgctgagcctgctgccgctggcgctgggcgcgccggcggtggaacagcgcagcgaagcggcgccgctgattgaagcgcgcggcgaaatggtggcgaacaaatatattgtgaaatttaaagaaggcagcgcgctgagcgcgctggatgcggcgatggaaaaaattagcggcaaaccggatcatgtgtataaaaacgtgtttagcggctttgcggcgaccctggatgaaaacatggtgcgcgtgctgcgcgcgcatccggatgtggaatatattgaacaggatgcggtggtgaccattaacgcggcgcagaccaacgcgccgtggggcctggcgcgcattagcagcaccagcccgggcaccagcacctattattatgatgaaagcgcgggccagggcagctgcgtgtatgtgattgataccggcattgaagcgagccatccggaatttgaaggccgcgcgcagatggtgaaaacctattattatagcagccgcgatggcaacggccatggcacccattgcgcgggcaccgtgggcagccgcacctatggcgtggcgaaaaaaacccagctgtttggcgtgaaagtgctggatgataacggcagcggccagtatagcaccattattgcgggcatggattttgtggcgagcgataaaaacaaccgcaactgcccgaaaggcgtggtggcgagcctgagcctgggcggcggctatagcagcagcgtgaacagcgcggcggcgcgcctgcagagcagcggcgtgatggtggcggtggcggcgggcaacaacaacgcggatgcgcgcaactatagcccggcgagcgaaccgagcgtgtgcaccgtgggcgcgagcgatcgctatgatcgccgcagcagctttagcaactatggcagcgtgctggatatttttggcccgggcaccagcattctgagcacctggattggcggcagcacccgcagcattagcggcaccagcatggcgaccccgcatgtggcgggcctggcggcgtatctgatgaccctgggcaaaaccaccgcggcgagcgcgtgccgctatattgcggataccgcgaacaaaggcgatctgagcaacattccgtgcggcccggtgaacctgctggcgtataacaactatcaggcg-3’。
33.本发明实施例提供了一种重组载体,其含有如前述任意实施例所述的分离的核酸。
34.本发明实施例提供了如前述实施例所述的重组载体的构建方法,其包括:将所述分离的核酸插入载体中,构建获得单拷贝重组载体。
35.优选地,所述构建方法还包括:将所述分离的核酸或其表达盒插入所述单拷贝重组载体中,获得双拷贝重组载体。
36.优选地,所述构建方法还包括将所述分离的核酸或其表达盒插入所述双拷贝重组载体中,获得三拷贝重组载体。
37.优选地,所述载体的构建方法如下:以ppic9k为基本骨架,根据golden gate组装原理设置6组引物对,克隆获得6个载体片段,将6个载体片段融合重组,获得所述载体;
38.其中,所述多组引物对包括引物对1~引物对6,所述引物对1~引物对6的序列依次如seq id no.4~15所示。
39.本发明实施例提供了一种基因工程菌,其含有如前述实施例所述的重组载体或如前述任意实施例所述的构建方法构建的重组载体。
40.本发明实施例提供了如前述实施例所述的基因工程菌的构建方法,其包括将如前述实施例所述的重组载体或如前述任意实施例所述的构建方法构建的重组载体转化入菌体中获得基因工程菌。
41.优选地,所述构建方法还包括对转化后的获得的转化子进行筛选:将所述转化子接种于含有抗生素的平板中,基于水解圈的大小,筛选获得高表达的基因工程菌。
42.优选地,所述平板为含0.5%~2%干酪素的bmmy平板。
43.本发明实施例提供了如前述任意实施例所述的蛋白酶k突变体的制备方法,其包括:培养如前述实施例所述的基因工程菌或由前述任意实施例所述构建方法构建获得的基因工程菌,以诱导表达所述蛋白酶k突变体;或,在seq id no.1所示的氨基酸序列的基础上,进行如下至少一种突变:f371c和t373p。
44.此外,本发明实施例还提供了如前述任意实施例所述的蛋白酶k突变体或如前述实施例所述的基因工程菌或由前述任意实施例所述构建方法构建获得的基因工程菌在水解蛋白或制备用于水解蛋白的产品中的应用。
45.以下结合实施例对本发明的特征和性能作进一步的详细描述。
46.实施例1
47.一种蛋白酶k突变体,其氨基酸序列如seq id no.2所示,核酸序列如seq id no.3所示。
48.上述蛋白酶k突变体的制备方法包括以下步骤。
49.1、表达载体的构建。
50.1.1单拷贝表达载体的构建。
51.以ppic9k为基本骨架,依据golden gate组装原理设计对应的引物,见表1,用南京巨匠生物科技有限公司p202-2高保真聚合酶克隆得到得到六个框架片段,分别命名为frag1、frag2、frag3、frag4、frag5和frag6。
52.表1引物序列
[0053][0054][0055]
备注:f为上游引物,r为下游引物。
[0056]
上述克隆得到的片段胶回收得到纯度较高的dna片段,并以此片段为模板通过重
叠延伸pcr将frag1与frag2融合、frag3与frag4融合、frag5与frag6融合。重叠延伸pcr体系如表2所示。
[0057]
表2 pcr体系
[0058]
体系使用量片段12μl片段22μl2
×
atg proofast mix25μl引物f1.5μl引物r1.5μlddh2o补齐至50μl
[0059]
程序参考南京巨匠生物科技有限公司p202-2高保真聚合酶说明书。
[0060]
上述所得片段胶回收获取得到融合片段,再通过南京巨匠生物科技有限公司的重组克隆试剂盒c101将融合片段进行重组连接获得重组载体连接产物-patg9k-0,质粒图谱见图4,并将其转化至xl10感受态,涂布amp抗性基因平板,筛选阳性转化子,提取质粒进行核酸电泳验证。
[0061]
通过限制性核酸内切酶not i和cop i酶切patg9k-0获得线性化载体,并同时通过如表3所示引物获得蛋白酶k基因线性化片段frag7。
[0062]
表3引物
[0063]
prk-fatgcgtttatctgttttgctttcctcprk-rctgaaacatattggccaagcagtgatg
[0064]
通过上述所获得的载体片段与基因片段通过南京巨匠生物科技有限公司的重组克隆试剂盒c111重组连接获得单拷贝载体patg9-1k,质粒图谱见图5,并将其转化至xl10感受态,涂布amp抗性基因平板,筛选阳性转化子用验证引物验证,并送测序验证。
[0065]
1.2双拷贝表达载体构建
[0066]
对上述重组载体patg9-1k验证成功之后,提取patg9-1k质粒,通过限制性核酸内切酶bamh i对其进行线性化获得线性载体片段frag8,同时通过bamh i和bgl ii对patg9-k1质粒进行酶切获得蛋白酶k的表达框架(aox1启动子+蛋白酶k+aox1终止子)片段frag9。
[0067]
对frag8和frag9两个片段进行胶回收获得高纯度dna片段,按如表4连接体系通过t4 dna连接酶在16℃过夜连接。
[0068]
表4连接体系
[0069]
10
×
t4 dna ligase buffer2μldna片段1μl载体dna0.5μlt4 dna ligase0.5μlddh2oto 20μl
[0070]
将上述连接产物转化至xl10感受态,涂布amp抗性基因平板,筛选阳性转化子用验证引物验证双拷贝载体patg9-2k构建成功,并送测序验证。
[0071]
1.3多拷贝表达载体的构建
[0072]
继续用与1.2步骤相似的方式对patg9-2k进行限制性核酸内切酶bamh i对其进行线性化获得线性载体片段frag10,通过t4dna连接酶对frag10和frag9进行连接获得重组载体patg9-3k的连接产物,质粒图谱见图6。
[0073]
1.4菌株的筛选
[0074]
将上述连接产物转接大肠杆菌xl10感受态,涂布含100μg/ml的amp抗性的lb平板中进行筛选,获得patg9-3k/xl10菌株。
[0075]
实施例2
[0076]
一种蛋白酶k突变体及其制备方法,大致与实施例1相同,区别在于,菌株的筛选步骤不同,本实施例中,菌株的筛选为:对patg9-3k质粒载体进行线性化,通过电转到毕赤酵母gs115感受态细胞中,通过含有不同浓度的g418的并含1%的干酪素bmmy平板筛选获得高拷贝高表达菌株,具体包括以下步骤:
[0077]
对patg9-3k质粒载体将其通过saci进行酶切线性化,通过0.8%的琼脂糖核酸电泳切下目的片段,胶回收纯化;
[0078]
将上述纯化完成的基因片段通过电转化至毕赤酵母gs115感受态细胞中,涂布在md平板中于28℃培养2-3天,将md平板上的毕赤酵母转化子转接至含有不同浓度(50μg/ul~500μg/ul)g418的1%干酪素bmmy平板中筛选,依据水解圈大小筛选高拷贝毕赤酵母重组转化菌株,并将水解圈最大的菌株命名为gs-pk,见图7。
[0079]
接取单菌落菌落接种至25ml bmgy培养基中,28℃培养过夜16-20h至od600为2-6。进一步将菌液转接至50ml离心管中,离心去上清,然后用100ml的bmmy培养基重悬菌体,加入1ml甲醇,28℃培养120h。每隔24小时加1ml 100%甲醇;
[0080]
4.发酵培养结束之后,离心收取发酵液上清,即可获得蛋白酶k粗酶液,利用sds-page检测目的蛋白分子量以及纯度和产量,通过bradford法测试蛋白浓度,结果见图8。
[0081]
实施例3
[0082]
验证实施例1提供的蛋白酶k突变体的活性。
[0083]
方法
[0084]
针对f371c和t373p分别设计引物,如表5所示。
[0085]
表5引物
[0086]
371/373-fcctgtccaacattccctgtggcccggtcaatttattggc371/373-rgccaataaattgaccgggccacagggaatgttggacagg
[0087]
以puc-prk质粒为模板,以f371c-f/f371c-r引物克隆得到片段frag11,通过琼脂糖核酸电泳之后胶回收目的片段,将其通过solution i连接到pmd18t载体上,转化至jm109感受态中,涂布在amp抗性lb平板中刷选转化子,挑取转化子转接至lb液体培养基中培养8-12h测序验证,将第一位点突变成功的命名为puc-mut-1。
[0088]
再用puc-mut-1为模板以t373p-f/t373p-r引物克隆得到片段frag12,同上构建得到puc-mut-12重组载体,以此获得f371c/t373p双突变点蛋白酶k基因dna片段。
[0089]
以此puc-mut-12载体为模板同上述实验方法获得patg9-3k
mut-12
重组载体,将其通过saci进行酶切线性化,胶回收纯化得到目的片段。
[0090]
将上述纯化完成的目的片段通过电转化至毕赤酵母gs115感受态细胞中,涂布在md平板中于28℃培养2-3天,将md平板上的毕赤酵母转化子转接至低浓度g418的1%干酪素
bmmy平板中筛选出突变体菌株。
[0091]
将突变体菌株进行发酵诱导,离心收集蛋白酶k粗酶液。
[0092]
取上述所得蛋白酶k粗酶测试其活力:紫外分光光度法是以酪蛋白为底物,在55℃,ph 8.0的0.02mol/l tris-hcl缓冲液中,于275nm波长处测定1min内蛋白酶k水解酪蛋白产生的1μg l-酪氨酸的量为1u。
[0093]
结果见表6。
[0094]
表6蛋白酶k酶活力测试
[0095][0096]
以上所述仅为本发明的优选实施例而已,并不用于限制本发明,对于本领域的技术人员来说,本发明可以有各种更改和变化。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1