一种植物乳杆菌在制备人参发酵液中的应用的制作方法
1.本发明涉及人参发酵技术领域,尤其是涉及一种植物乳杆菌在制备人参发酵液中的应用。
背景技术:
2.人参是我国传统的名贵中药,被称为“百草之王”,具有较高的药用价值。现代药理研究发现人参在预防肿瘤、抗衰老、缓解疲劳和提高免疫力等方面均有疗效。人参的化学成分十分复杂,含有多种有效成分,如人参皂苷、多糖、蛋白质、多肽和氨基酸等,其中人参皂苷是关键的活性成分,具有抗肿瘤、抗氧化、抗衰老和改善认知等作用。
3.直接从人参中提取出来的人参皂苷一般为ra、rb1、rb2、rb3、rc、rd、re、rf、rg1等原型人参皂苷,但是原型人参皂苷生理活性低,而且很难被人体吸收利用。rh1、rh2、rh3、rh4、rg2、rg3、rg5、rg6、rk1、rk2、rk3等稀有皂苷与原型人参皂苷相比具有相对较强的生理功能,而且更易于机体的吸收,如今在抗癌领域真正发挥作用的,都是稀有人参皂苷。
4.但稀有皂苷在人参中的含量甚微,提高稀有皂苷含量,实现人参的功效成分富集和提取,一直是研究的热点。cn109536560a公开了一种提高人参水提取物中稀有皂苷含量的方法,该方法采用微波超声协同萃取来制备人参水提取液,将人参水提取液作为发酵基质,发酵转化生成4种稀有人参皂苷(rg3、ck、f2和rh2)。cn106244487a公开了一株乳杆菌及提高稀有皂苷的人参发酵方法,利用保藏编号为cctcc m 2016372的乳杆菌对人参液进行发酵,使得人参发酵液rh1、rg2、f1、rh2、20(s)-rg3、r0的产量都有很大的提高。
5.但现有的人参发酵方法中,只考虑的是菌株的生物转化能力,而没有系统评估过所用菌株的可食用性和安全性;且现有的菌株及发酵方法,均无法同时提高人参发酵液中稀有人参皂苷rg3、rk3、rg2、rg6的含量及人参多糖和多肽含量。
技术实现要素:
6.本发明是为了克服现有技术中的发酵方法无法同时提高人参发酵液中稀有人参皂苷rg3、rk3、rg2、rg6的含量及人参多糖和多肽含量的问题,提供一种植物乳杆菌在制备人参发酵液中的应用,将特定种类的植物乳杆菌应用于人参液的发酵中,并将酶解技术与益生菌发酵技术相结合的方式,可有效提高人参发酵液中稀有皂苷rg3、rk3、rg2、rg6及人参多糖和多肽的含量,降低人参发酵液中的渣量,提高人参发酵液的生物利用率和生理活性。
7.为了实现上述目的,本发明采用以下技术方案:一种植物乳杆菌在制备人参发酵液中的应用,人参发酵液的制备方法包括如下步骤:(1)打粉:将人参打粉并过筛后得到人参粉末;(2)酶解:将人参粉末加入水中,并加入酶进行酶解,得到酶解液;(3)发酵:在酶解液中接种保藏编号为cgmcc no.13121的植物乳杆菌,发酵后得到
人参发酵液。
8.本发明将酶解工艺与益生菌发酵工艺相结合,对人参进行处理,酶解工艺的采用可以首先水解人参中的大分子物质,为接下来微生物发酵提高所需的碳源和氮源;发酵过程中微生物产生的多种酶可以进一步水解得到稀有皂苷、人参多糖和人参多肽。酶解和微生物发酵相结合的工艺可以有效的提高人参发酵液中稀有皂苷、人参多糖和人参多肽的含量,同时降低近一半的渣量,提高了人参的利用率和生理活性。
9.本发明采用保藏编号为cgmcc no.13121的植物乳杆菌(lactiplantibacillus plantarum581)对酶解液进行发酵,该菌株是可食用益生菌,食用后具有润肠通便的功能,用于人参发酵液中对人体有益。且本发明研究发现,用该菌株对人参酶解液进行发酵时,可提高发酵液中稀有皂苷rg3、rk3、rg2和rg6的含量,增加了发酵液中稀有皂苷的种类,同时还能增加其他有效成分人参多糖和人参多肽的含量,从而使得到的人参发酵液具有抗氧化、抗炎、增强免疫力和抗肿瘤活性等多种生理功能。
10.作为优选,步骤(2)中酶解时加入的酶包括β-葡聚糖酶、淀粉酶和蛋白酶;β-葡聚糖酶、淀粉酶和蛋白酶的添加量分别为人参粉末质量的0.5~1.5%。
11.作为优选,步骤(2)中的酶解方法为:将人参粉末加入水中,升温至50~60℃,加入β-葡聚糖酶和淀粉酶,酶解1~2h后,再加入蛋白酶,继续酶解2~3h,然后在95~100℃下灭酶活8~10min,冷却后得到酶解液。
12.本发明加入β-葡聚糖酶、淀粉酶和蛋白酶对人参粉进行酶解,淀粉酶可以酶解人参粉中的淀粉,β-葡聚糖酶可以酶解纤维素和果胶等成分,从而提高人参多糖含量;蛋白酶可以酶解人参中的蛋白质,从而提高人参多肽的含量。由于β-葡聚糖酶和淀粉酶本身也属于蛋白质,因此本发明先加入β-葡聚糖酶和淀粉酶酶解一定时间后,再加入蛋白酶进行酶解,避免蛋白酶的加入影响β-葡聚糖酶和淀粉酶的活性。
13.作为优选,步骤(2)中人参粉末与水的质量比为1:20~30。
14.作为优选,步骤(3)中的发酵方法为:在酶解液中接种植物乳杆菌,35~37℃静置发酵16~24h,然后95~100℃下灭菌8~10min终止发酵,得到人参发酵液。
15.作为优选,步骤(3)中植物乳杆菌的起始乳酸菌接种量为106以上。
16.作为优选,步骤(1)中将人参打粉后过40~80目筛。
17.作为优选,发酵后对所得人参发酵液再进行澄清处理,澄清处理方法为:步骤(3)将人参发酵液过筛网后收集滤液,并水洗滤渣;将水洗液再次过筛网,收集滤液,将两次的滤液合并,离心分离后收集上清液,得到澄清的人参发酵液。
18.作为优选,将人参发酵液和水洗液过筛网时,依次过60~80目、100~120目筛网。
19.作为优选,离心分离时的转速为6000~8000rpm/min。
20.因此,本发明具有如下有益效果:(1)将酶解和益生菌发酵相结合对人参进行处理,可以提高人参发酵液中多种生物活性物质的含量,同时降低近一半的渣量,提高了人参的利用率和生理活性;(2)本发明所用植物乳杆菌为可食用性的益生菌,用于人参发酵液中对人体有益;(3)不但可以提高4种稀有皂苷rg3、rk3、rg2、rg6的含量,还能增加其他有效成分如人参多糖和人参多肽的含量,从而使人参发酵液具有抗氧化、抗炎、增强免疫力和抗肿瘤活性等多种生理功能。
具体实施方式
21.下面结合具体实施方式对本发明做进一步的描述。
22.本发明发酵时使用的菌株属于植物乳杆菌(lactobacillus plantarum),命名为581,保藏在中国微生物菌种保藏管理委员会普通微生物中心,其微生物保藏号是cgmcc no.13121,保藏日期为2016年10月18日。
23.总实施例:一种人参发酵液的制备方法,包括如下步骤:(1)打粉:将人参打粉后过40~80目筛网,得到人参粉末;(2)酶解:将人参粉末加入其质量20~30倍的常温水中,升温至50~60℃,加入人参粉末质量0.5~1.5%的β-葡聚糖酶、0.5~1.5%的淀粉酶,酶解1~2h后,再加入人参粉末质量0.5~1.5%的蛋白酶,继续酶解2~3h,然后在95~100℃下灭酶活8~10min,冷却后得到酶解液;(3)发酵:在酶解液中接种保藏编号为cgmcc no.13121的植物乳杆菌,保证起始接种量为106以上,35~37℃静置发酵16~24h,然后在95~100℃下灭菌8~10min终止发酵,得到人参发酵液;(4)澄清处理:将人参发酵液分别过60~80目、100~120目的筛网,收集过滤液;并用滤渣质量10~15倍的水洗滤渣,将水洗液再过60~80目、100~120目的筛网,收集过滤液,合并两次的过滤液,以6000~8000rpm/min的转速离心分离后收集上清液,得到澄清的人参发酵液。
24.实施例1:一种人参发酵液的制备方法,包括如下步骤:(1)打粉:将人参打粉后过60目筛网,得到人参粉末;(2)酶解:将人参粉末加入其质量25倍的常温水中,升温至55℃,加入人参粉末质量1%的β-葡聚糖酶、1%的淀粉酶,酶解1.5h后,再加入人参粉末质量1%的蛋白酶,继续酶解2.5h,然后在95℃下灭酶活8min,冷却后得到酶解液;(3)发酵:在酶解液中接种保藏编号为cgmcc no.13121的植物乳杆菌,保证起始接种量为106以上,37℃静置发酵18h,然后在95℃下灭菌10min终止发酵,得到人参发酵液;(4)澄清处理:将人参发酵液分别过60目、120目的筛网,收集过滤液;并用滤渣质量10倍的水洗滤渣,将水洗液再过60目、120目的筛网,收集过滤液,合并两次的过滤液,以7000rpm/min的转速离心分离后收集上清液,得到澄清的人参发酵液。
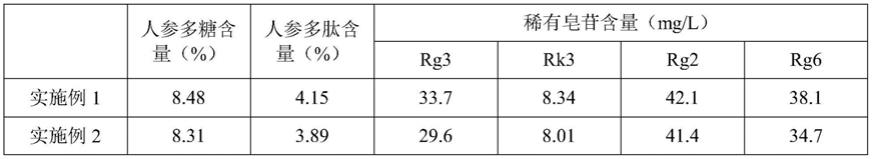
25.实施例2:一种人参发酵液的制备方法,包括如下步骤:(1)打粉:将人参打粉后过40目筛网,得到人参粉末;(2)酶解:将人参粉末加入其质量30倍的常温水中,升温至55℃,加入人参粉末质量1.5%的β-葡聚糖酶、1.5%的淀粉酶,酶解1h后,再加入人参粉末质量1.5%的蛋白酶,继续酶解2h,然后在100℃下灭酶活8min,冷却后得到酶解液;(3)发酵:在酶解液中接种保藏编号为cgmcc no.13121的植物乳杆菌,保证起始接种量为106以上,37℃静置发酵16h,然后在100℃下灭菌8min终止发酵,得到人参发酵液;(4)澄清处理:将人参发酵液分别过60目、120目的筛网,收集过滤液;并用滤渣质
量15倍的水洗滤渣,将水洗液再过60目、120目的筛网,收集过滤液,合并两次的过滤液,以6000rpm/min的转速离心分离后收集上清液,得到澄清的人参发酵液。
26.实施例3:一种人参发酵液的制备方法,包括如下步骤:(1)打粉:将人参打粉后过80目筛网,得到人参粉末;(2)酶解:将人参粉末加入其质量20倍的常温水中,升温至55℃,加入人参粉末质量0.5%的β-葡聚糖酶、0.5%的淀粉酶,酶解2h后,再加入人参粉末质量0.5%的蛋白酶,继续酶解3h,然后在95℃下灭酶活10min,冷却后得到酶解液;(3)发酵:在酶解液中接种保藏编号为cgmcc no.13121的植物乳杆菌,保证起始接种量为106以上,37℃静置发酵24h,然后在95℃下灭菌10min终止发酵,得到人参发酵液;(4)澄清处理:将人参发酵液分别过60目、120目的筛网,收集过滤液;并用滤渣质量10倍的水洗滤渣,将水洗液再过60目、120目的筛网,收集过滤液,合并两次的过滤液,以6000rpm/min的转速离心分离后收集上清液,得到澄清的人参发酵液。
27.对比例1(不进行酶解):一种人参发酵液的制备方法,包括如下步骤:(1)打粉:将人参打粉后过60目筛网,得到人参粉末;(2)水提:将人参粉末加入其质量25倍的常温水中,升温至55℃提取4h,冷却后得到水提液;(3)发酵:在水提液中接种保藏编号为cgmcc no.13121的植物乳杆菌,保证起始接种量为106以上,37℃静置发酵18h,然后在95℃下灭菌10min终止发酵,得到人参发酵液;(4)澄清处理:将人参发酵液分别过60目、120目的筛网,收集过滤液;并用滤渣质量10倍的水洗滤渣,将水洗液再过60目、120目的筛网,收集过滤液,合并两次的过滤液,以7000rpm/min的转速离心分离后收集上清液,得到澄清的人参发酵液。
28.对比例2(不进行发酵):一种人参提取液的制备方法,包括如下步骤:(1)打粉:将人参打粉后过60目筛网,得到人参粉末;(2)酶解:将人参粉末加入其质量25倍的常温水中,升温至55℃,加入人参粉末质量1%的β-葡聚糖酶、1%的淀粉酶,酶解1.5h后,再加入人参粉末质量1%的蛋白酶,继续酶解2.5h,然后在95℃下灭酶活8min,冷却后得到酶解液;(3)澄清处理:将酶解液分别过60目、120目的筛网,收集过滤液;并用滤渣质量10倍的水洗滤渣,将水洗液再过60目、120目的筛网,收集过滤液,合并两次的过滤液,以7000rpm/min的转速离心分离后收集上清液,得到澄清的人参提取液。
29.一、理化指标检测对上述实施例和对比例中的得到的澄清的人参发酵液中的生物活性物质含量进行测试,结果如表1中所示。
30.表1:生物活性物质含量测试结果。
31.从表1中可以看出,实施例1~3中采用本发明的方法,将酶解和益生菌发酵工艺相结合,可有效提升人参发酵液中的人参多糖、人参多肽及4种稀有皂苷rg3、rk3、rg2、rg6的含量。对比例1中不对人参进行酶解,发酵液中的人参多糖和人参多肽含量与实施例1中相比显著降低;且不进行酶解会导致发酵过程中的碳源和氮源不足,从而使4中稀有皂苷的含量也有所降低。对比例2中不对酶解液进行发酵,提取液中的4中稀有皂苷的含量与实施例1中相比显著降低。
32.二、生物活性检测1、抗氧化活性测试对实施例1和对比例1、2中得到的人参发酵液的abts
+
自由基清除活性进行测试,评价其抗氧化活性,测试方法为:1.1pbs缓冲液的配制:称取氯化钠8g,氯化钾0.2g,磷酸二氢钾0.24g,十二水合磷酸氢二钠3.62g,置于1000ml烧杯中,加入800ml蒸馏水,搅怑使其溶解,用盐酸或氢氧化钠调节ph至7.4,转移至1000ml容量瓶中,加蒸馏水稀释至刻度,摇匀,待用;1.2abts
+
贮存溶液的配制:精密称取abts
+
78mg左右,置于20ml棕色容量瓶中,加入15ml蒸馏水,超声5min,用蒸馏水定容至刻度,摇匀。精密称取过硫酸钾76mg左右,置于2ml棕色容量瓶中,加入1ml蒸馏水,超声使其溶解,用蒸馏水定容至刻度,摇匀。精确吸取352μl过硫酸钾溶液加入至abts
+
溶液中,摇匀,静置过夜;1.3abts
+
工作溶液的配制:精确吸取贮存溶液1ml,加入65ml左右pbs缓冲液,摇匀;1.4供试品溶液的配制:精密称取适量瓜蒌籽提取物,置于20ml棕色容量瓶中,加入15ml pbs缓冲液,超声5min,用pbs缓冲液定容至刻度,摇匀,即得;1.5操作步骤:准确吸取0.5ml供试品溶液和5ml abts
+
工作溶液混合均匀;准确吸取0.5ml供试品溶液和5ml pbs缓冲液混合均匀;准确吸取5ml abts
+
工作溶液和0.5ml pbs缓冲液混合均匀,立即在734nm处测定吸光度,并根据以下公式计算自由基清除率:ir%=[1-(ai-aj)/a0]*100%;其中,ai表示待测溶液和abts混合后溶液的吸光度;aj表示待测溶液和溶剂混合后溶液的吸光度;a0表示abts和溶剂混合后溶液的吸光度。
[0033]
测试结果如表2中所示。
[0034]
表2:abts
+
自由基清除率测试结果。 实施例1对比例1对比例2
abts
+
自由基清除率(%)47.2225.2730.35
[0035]
从表2中可以看出,由于酶解和发酵得到的人参多肽、人参多糖及稀有皂苷有更强的抗氧化活性,因此实施例1中采用本发明中的方法得到的人参发酵液的抗氧化活性与对比例1和对比例2中相比均显著提高。
[0036]
2、抗炎、增强免疫力测试采用lps诱导的人结肠癌细胞ht-29炎症细胞模型,利用elisa法分别测定实施例1和对比例1、对比例2中得到的人参发酵液作用下,ht-29细胞上清液中il-8的水平。实验组分别为空白组(细胞)、lps组(细胞+lps)和受试样品组(细胞+lps+样品),结果如表3中所示。
[0037]
表3:ht-29细胞上清液中il-8水平(pg/ml)测试结果。
[0038]
从表3中可以看出,与空白组相比,加入脂多糖lps诱导细胞炎症后,细胞显著分泌il-8,加入实施例1的人参发酵液后,il-8的分泌受到显著抑制作用(p《0.05)。表明实施例1中采用本发明中的方法得到的人参发酵液能通过抑制lps刺激ht-29细胞分泌炎症因子il-8而发挥抗炎作用。il-8是一个多种细胞来源的趋化性细胞因子,未受到刺激时无表达或少量表达,但在感染、低氧、细胞活素等刺激后多种细胞均能产生。il-8是炎性介质网络中的关键成分,对炎症和免疫过程有重要调节作用。高il-8水平与更高的肿瘤嗜中性粒细胞/单核细胞浸润、更差的t细胞功能、更弱的抗原递呈有关,人参发酵液可以抑制il-8的分泌,从而增强t细胞功能和抗原递呈,故可以增强免疫力。
[0039]
而加入对比例1和对比例2中得到的人参发酵液,对il-8的分泌也具有一定的抑制作用,但与实施例1中相比不明显,可能是由于人参中的原型皂苷也有抑制il-8分泌的作用,但不如本发明中得到的稀有皂苷抑制效果好。
[0040]
3、抗肿瘤活性测试采用结肠癌肿瘤细胞抑制实验对实施例1和对比例1、对比例2中得到的人参发酵液的抗肿瘤活性进行评价,具体方法为:用含10%胎牛血清的rpmi 1640(gibco)培养基在37℃,5%co2条件下培养,人结肠癌细胞ht-29细胞传3代后,取对数生长期细胞用于实验。调整密度为8*104个/ml,接种于96孔板中,每孔100μl,24h后加入不同浓度含药培养基100μl,对照组每孔加培养基100μl,对照组与药物组均设个3个复孔,另设空白对照组,不加细胞只加培养基的作为调零组。将96孔板置37℃,5%co2条件下培养48h。加入5mg/ml mtt20μl,继续培养4h后,弃上清,加入dmso 150μl,振荡溶解10min,酶标仪于490nm处测定od值,通过一下公式计算结肠癌肿瘤细胞抑制率:抑制率=(1-用药组平均od值/对照组平均od值)*100%。测试结果如表4中所示。
[0041]
表4:结肠癌肿瘤细胞抑制率测试结果。 实施例1对比例1对比例2抑制率(%)59.1637.5941.17
[0042]
从表4中可以看出,实施例1中采用本发明中的方法制得的人参发酵液具有良好的抗肿瘤活性,而对比例1和对比例2中得到的人参发酵液的抗肿瘤活性与实施例1中相比有所降低,说明经过本发明中的植物乳杆菌的发酵,得到了抗肿瘤活性更好的稀有皂苷。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1