食用提取物、提取方法及其组合物
1.本发明总体上涉及一种从选自旋花科(convolvulaceae family)的植物中提取树脂糖苷的方法。本发明还涉及可食用组合物及其在体重减轻和体重管理中的用途。
背景技术:
2.到2020年,体重减轻和体重管理饮食市场预计将获得4228亿美元,在2015-2020年的预测期内,cagr为9.1%。特别是,2018年美国体重减轻市场总额估计增长4.1%,从698亿美元增至727亿美元。预计到2023年,美国市场总额每年将增长2.6%。
3.巨大的市场规模部分是由于认识到肥胖会导致健康问题,从而导致更高的医疗费和保险费。特别是,统计数据表明,与肥胖相关的疾病,如糖尿病、心血管疾病等的发病率在过去几年中显著增加。此外,线性时间趋势预测表明,到2030年,大约51%的世界人口将受到肥胖的影响。由于超重和肥胖导致的健康障碍日益增加,消费者已经开始采用各种体重减轻和体重管理饮食,包括对人有好处的食品和饮料、体重减轻补充剂等。由于体重减轻和体重管理产品消费的增加,这个市场正见证收入预测的增长,预计这一趋势将在预测期内持续。
4.例如,处方肥胖药物目前可供患者使用。例如,患者可以使用奥利斯特拉(olestra)。然而,虽然奥利斯特拉作为合成脂肪替代品可以减少从脂肪中摄入的卡路里,但它也会抑制食物中一些必需维生素的吸收,并可能导致腹部绞痛和稀便。由于这些副作用,奥利斯特拉在《时代》杂志“荣膺”50项最糟糕的发明之一。
5.市场上的另一种抗肥胖药物是奥利司他(orlistat)。奥利司他是一种合成脂肪酶抑制剂,其因胃肠道副作用而臭名昭著,并且治疗期间也可能发生急性肾损伤。研究表明,这种药物对体重的影响微乎其微,奥利司他的常见副作用是内裤上出现油斑、肠胃胀气、排便紧急、脂性或油性粪便、排便次数增加、腹痛或不适,以及无法控制粪便(失禁)。严重的副作用包括结肠癌前病变(异常隐窝病灶)、肝损伤和胰腺炎。
6.预计在2022年之前没有新的抗肥胖药物进入市场并获得fda批准。
7.为了对抗肥胖,各国政府也在考虑各种政策。例如,新加坡政府最近宣布在新加坡禁止高糖饮料广告。这类饮料也会被贴上营养标签,中高糖含量饮料上具有“不健康”标签。对糖征税也在考虑之中。
8.调查还表明,节食者希望吃得“干净”,排除防腐剂、gmo、人造香料和甜味剂,这通常迫使低热量(饮食)冷冻餐(frozen entr
é
es)的生产商和饮食公司重新调整他们的食品。
9.需要克服或改善上述问题中的至少一个,或至少提供有用的替代方案。
技术实现要素:
10.本发明基于对一些天然产物例如茶黄素可以充当脂肪酶抑制剂的理解。茶黄素是由茶叶中的黄烷-3-醇在酶促氧化过程中缩合而成的多酚类。发明人已经发现其他天然化合物(来自茶叶的除外)可以充当脂质抑制剂。在这方面,发明人已经找到了一种从其他类
型的天然植物成分中提取此类化合物的方法。还发现,根据提取方法,可以提高脂质抑制功能。可以将这些提取的化合物配制成食品、补充剂和/或药物以用于控制消化和吸收的抗肥胖目的。由于提取的化合物来自天然植物来源,因此消费者认为健康且安全价值很高。
11.本发明提供了一种提取物,该提取物包含选自由以下组成的组中的至少一种树脂糖苷:batataoside i、batataoside ii、batatoside iii、pescaprein xxvii、batatoside h、batatoside f、式(i)的树脂糖苷
[0012][0013]
和式(ii)的树脂糖苷
[0014][0015]
其中树脂糖苷是从选自甘薯(ipomoea batatas)(红薯(sweet potato))的植物中提取的。
[0016]
在一些实施方式中,当存在batataoside i时,batataoside i相对于提取物的浓度为约0.5mg/g至约500mg/g;
[0017]
当存在batataoside ii时,batataoside ii相对于提取物的浓度为约0.1mg/g至约5mg/g;
[0018]
当存在batataoside iii时,batataoside iii相对于提取物的浓度为约0.1mg/g
至约10mg/g;
[0019]
当存在batataoside f时,batataoside f相对于提取物的浓度为约2mg/g至约40mg/g;
[0020]
当存在batataoside h时,batataoside h相对于提取物的浓度为约2mg/g至约8mg/g;
[0021]
当存在pescaprein xxvii时,pescaprein xxvii相对于提取物的浓度为约0.1mg/g至约5mg/g;
[0022]
当存在式(i)的树脂糖苷时,式(i)的树脂糖苷相对于提取物的浓度为约0.1mg/g至约4mg/g;以及
[0023]
当存在式(ii)的树脂糖苷时,式(ii)的树脂糖苷相对于提取物的浓度为约10mg/g至约500mg/g。
[0024]
树脂糖苷可以从植物的各个部分(包括根、块茎、叶、种子、茎和花)提取。在一些实施方式中,树脂糖苷是从甘薯(红薯)的块茎、叶、乳胶和茎中提取的。
[0025]
在一些实施方式中,提取物包含至少2种树脂糖苷的混合物。
[0026]
在一些实施方式中,至少一种树脂糖苷是batatoside i和式(i)的树脂糖苷。
[0027]
在一些实施方式中,提取物的脂肪酶抑制活性ic
50
值小于15μg/ml。
[0028]
本发明提供了一种提取物,该提取物包含选自由以下组成的组中的至少一种树脂糖苷:batatoside f、batatoside e、batatoside d、aquaterin vi、aquaterin v、aquaterin xi、aquaterin ii、stoloniferin viii、aquaterin xiv、batatoside c、batatinoside i、aquaterin vii、aquaterin iii、murucoidin xviii、aquaterin xiii、aquaterin xii、以及式(iii)、式(iv)、式(v)、式(vi)和式(vii)的a型树脂糖苷,
[0029][0030]
其中当r1为正十二烷酰基,r2为肉桂酰基,r3为2-甲基丁酰基,r4为h,r5为吡喃鼠李糖基,且r6为甲基时为式(iii);
[0031]
其中当r1为异丁酰基,r2为h,r3为h,r4为正辛酰基,r5为吡喃葡萄糖基,且r6为甲基时为式(iv);
[0032]
其中当r1为正辛酰基,r2为正辛酰基,r3为h,r4为2-甲基丁酰基,r5为正辛酰基,且r6为甲基时为式(v);
[0033]
其中当r1为正十二酰基,r2为h,r3为h,r4为h,r5为正辛酰基,且r6为甲基时为式(vi);
[0034]
其中当r1为正辛酰基,r2为h,r3为正辛酰基,r4为2-甲基丁酰基,r5为吡喃葡萄糖基,且r6为甲基时为式(vii);以及
[0035]
其中树脂糖苷是从选自蕹菜(ipomoea aquatica)(空心菜(kangkong))的植物中
提取的。
[0036]
在一些实施方式中,树脂糖苷是从蕹菜(空心菜)的种子、叶或茎中提取的。
[0037]
本发明还提供一种可食用组合物,该可食用组合物包含:
[0038]
如本文所述的从选自甘薯(红薯)和/或蕹菜(空心菜)的植物中提取的至少一种树脂糖苷。
[0039]
在一些实施方式中,可食用组合物还包含选自蛋白质、纤维、多酚化合物、脂质或其组合的成分。
[0040]
在一些实施方式中,可食用组合物作为胶囊提供。
[0041]
在一些实施方式中,可食用组合物用于体重减轻或体重管理。
[0042]
本发明还公开了一种药物组合物,该药物组合物包含可选地与药学上可接受的载体、赋形剂或稀释剂组合的如本文所述的从选自甘薯(红薯)和蕹菜(空心菜)的植物中提取的至少一种树脂糖苷或其药学上可接受的盐、溶剂化物或异构体。
[0043]
本发明公开了一种从选自甘薯(红薯)和蕹菜(空心菜)的植物中提取如本文所述的树脂糖苷的方法,该方法包括:
[0044]
a)使植物经受溶剂提取过程以获得粗提物;
[0045]
b)纯化粗提物以获得部分纯化的提取物;和
[0046]
c)进一步纯化该部分纯化的提取物得到树脂糖苷。
[0047]
在一些实施方式中,使植物经受溶剂提取过程的步骤(步骤a)包括使植物在溶剂中均质化并且液-液提取树脂糖苷作为粗提物。
[0048]
在一些实施方式中,纯化粗提物的步骤(步骤b)包括分级粗提物。
[0049]
在一些实施方式中,纯化粗提物的步骤(步骤b)包括通过具有预定流动相的液相色谱柱洗脱粗提物。
[0050]
在一些实施方式中,流动相是以下梯度:己烷:乙酸乙酯(己烷:etoac;1:1)至纯乙酸乙酯,然后是纯甲醇。
[0051]
在一些实施方式中,流动相是以下梯度:二氯甲烷:甲醇(dcm:meoh;7:1)至纯meoh。
[0052]
在一些实施方式中,流动相是以下梯度:h2o:meoh(100:0)至纯meoh。
[0053]
在一些实施方式中,进一步纯化步骤(步骤c)包括分级部分纯化的提取物。
[0054]
在一些实施方式中,进一步纯化步骤(步骤c)包括通过具有预定流动相的液相色谱柱洗脱所述部分纯化的提取物。
[0055]
在一些实施方式中,进一步纯化步骤(步骤c)包括通过液相色谱柱洗脱部分纯化的提取物,该液相色谱柱的流动相具有以下梯度:meoh-h2o(90:10)至meoh-h2o(100:0)。
[0056]
在一些实施方式中,进一步纯化步骤(步骤c)还包括从液相色谱柱洗脱级分,所述液相色谱柱的流动相具有以下梯度:meoh-h2o(90:10)至meoh-h2o(100:0)与乙腈(acn)或与acn-meoh(80:20)。
[0057]
本发明还公开了一种治疗有需要的对象的与过多体脂相关的疾病或病症的方法,包括施用如本文所公开的来自选自旋花科的植物的树脂糖苷。
[0058]
在一些实施方式中,与过多体脂相关的疾病或病症选自肥胖、超重和代谢综合征。
附图说明
[0059]
现结合附图,通过非限制性示例的方式描述本发明的实施方式,其中:
[0060]
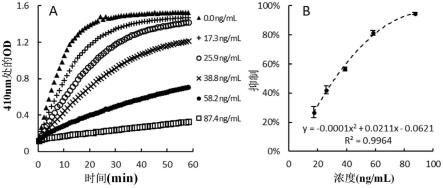
图1是使用pnpp作为底物和奥利司他作为抑制剂的pl抑制活性测定的代表性图。(a)六种奥利司他浓度下410nm的光密度的动力学读数。(b)pl抑制与奥利司他浓度的剂量-反应曲线;
[0061]
图2是第一轮分级(f5.1.23)的hplc色谱图;
[0062]
图3是第二轮分级(f5.1.23.34)的hplc色谱图;
[0063]
图4示出了在第三轮分级后级分8(f5.1.23.8)的hplc色谱图;
[0064]
图5示出了在第三轮分级后级分10(f5.1.23.10)的hplc色谱图;
[0065]
图6示出了红薯叶的胰脂肪酶(pl)抑制试验;
[0066]
图7示出了cc4的hplc色谱分析,其与粗红线的相对脂肪酶活性重叠;
[0067]
图8示出了在第三轮分级后的级分cc4.14.1的hplc色谱图;
[0068]
图9示出了空心菜幼苗(baby kangkong)和空心菜种子的脂肪酶抑制活性;
[0069]
图10是电喷雾装置的示意图;和
[0070]
图11示出了内含提取物的封装颗粒的形态。
具体实施方式
[0071]
本发明基于旋花(牵牛花(morning glory))科中的树脂糖苷可以充当脂肪酶抑制剂的发现。研究发现,该化合物可以抑制脂肪的消化和吸收,并限制能量摄入。例如,特别是在新加坡常见的两种蔬菜甘薯和空心菜中,发现了相对较高的树脂糖苷含量和相应的脂肪酶抑制能力。进一步发现提取物的脂肪酶抑制能力受到提取方法的影响,在这方面,发明人发现提取方法的特定组合有利于提供具有良好脂肪酶抑制能力的提取物。此外,还配制了包含从牵牛花科蔬菜中提取的树脂糖苷的食品配方,该食品配方能够延缓脂肪消化。通过控制消化和吸收,植物提取物和配方可用于抗肥胖应用。相信本发明可以填补以脂质消化调节和体重管理为重点的功能性食品的空白。
[0072]
如本文所示,甘薯块茎的乙醇提取物显示出胰脂肪酶(pl)抑制活性,其中ic
50
为33μg/ml。通过进一步纯化提取物,可以分离出ic
50
为4.9至6.7μm的若干种树脂糖苷,包括batatoside i、batatoside ii、batatoside iii和pescaprein xxvii。树脂糖苷因其脂肪酶抑制活性而成为红薯块茎提取物中的主要活性成分,红薯块茎提取物将成为具有体重减轻功能的功能性食品的有效成分。
[0073]
因此,本发明公开了一种从选自旋花科的植物中提取至少一种树脂糖苷的方法,该方法包括:
[0074]
a)使植物经受溶剂提取过程以获得粗提物;
[0075]
b)纯化粗糖浆以获得部分纯化的提取物;和
[0076]
c)进一步纯化该部分纯化的提取物得到树脂糖苷。
[0077]
旋花科,俗称旋花类(bindweed)或牵牛花科,是具有约60属和1650多种的科,主要是草质藤本类,也有乔木、灌木和草本植物,并且还包括红薯和一些其他的食用块茎。旋花科可以通过其漏斗形放射状对称的花冠来辨别;该科的花程式有五片萼片,五片融合花瓣,五个冠生雄蕊(与花瓣融合的雄蕊),以及两部分合生雌蕊和上位雌蕊。这些植物的茎通常
sierra gorda、ipomoea
×
sloteri-羽衣茑萝、ipomoea steudelii millsp.-steudel's morning glory、ipomoea stolonifera、来自南下加利福尼亚州的ipomoea tastensis brandegee、ipomoea temascaltepecensis wilkin、ipomoea tenuiloba torr.-spiderleaf、ipomoea tenuirostris、ipomoea tenuissima choisy-罗克兰牵牛花(rockland morning glory)、ipomoea ternifolia cav.-三叶牵牛花(triple-leaved morning glory)、ipomoea thurberi gray-thurber's morning glory、ipomoea tricolor cav.-墨西哥牵牛花(mexican morning glory)、tlitliltzin(nahuatl)、badoh negro、红薯的三浅牵牛(ipomoea trifida)野生祖先、三裂叶薯(ipomoea triloba)-littlebell、aiea morning glory、ipomoea tuberculate、ipomoea tuberosa l.-hawaiian woodrose、ipomoea tuboides o.deg.&van ooststr.-夏威夷牵牛花(hawaii morning glory)、ipomoea turbinata lag.-lilacbell、ipomoea velutina r.br.、ipomoea violacea l.-管花薯(beach moonflower)、海月光花(sea moonflower)、以及槭叶小牵牛(ipomoea wrightii)-赖特牵牛花(wright's morning glory)。
[0081]
树脂糖苷可以从植物的各个部分(包括根、块茎、叶、种子、茎和花)提取。在一些实施方式中,树脂糖苷是从红薯的块茎(茎或根茎的增厚的地下部分)、叶、胶乳和茎,或空心菜(kangkung)的种子、叶或茎中提取的。
[0082]
树脂糖苷也被称为泻药成分;即具有通便作用。树脂糖苷可以认为是碳水化合物的结构衍生物,是羟基化脂肪酸的高分子量低聚糖衍生物。根据它们在乙醚中的溶解度,它们大致分为两组——紫茉莉苷(jalapin)(可溶)和旋花苷(convolvulin)(不溶)。几乎所有的紫茉莉苷都具有共同的分子内大环酯结构。它们由1mol羟基脂肪酸(糖苷酸)的低聚糖苷组成,在糖部分被一些有机酸部分酰化,其中一些例子是酯型二聚体。另一方面,旋花苷被认为是多种酰化糖苷的低聚物。
[0083]
不希望受理论束缚,发明人首次发现树脂糖苷可以充当脂肪酶抑制剂。树脂糖苷不会被吸收到血流中。当它们充当脂肪酶抑制剂时,它们与肠道中的脂肪酶结合,从而防止膳食甘油三酯水解成甘油单酯和脂肪酸。这会减少膳食脂肪的吸收。据信,由于酯键,脂肪酶活性位点可以与酯键结合,因此以缓慢的方式进行水解,从而导致脂肪酶抑制。
[0084]
在一些实施方式中,树脂糖苷选自由以下组成的组:batatoside i、batatoside ii、batatoside iii、pescaprein xxvii、batatoside f和batatoside h及其组合。在其他实施方式中,树脂糖苷选自由以下组成的组:batatoside f、batatoside e、batatoside d、aquaterin vi、aquaterin v、aquaterin xi、aquaterin ii、stoloniferin viii、aquaterin xiv、batatoside c、batatinoside i、aquaterin vii、aquaterin iii、murucoidin xviii、aquaterin xiii、aquaterin xii及其组合。例如,这些树脂糖苷可以从红薯和/或空心菜中提取。这些化合物的化学结构如下:
[0085][0086]
[0087][0088]
mba:2-甲基丁酰基,dodeca:正十二酰基,octa:正辛酰基,deca:正癸酰基,cna:肉桂酰基,rha:吡喃鼠李糖基,glu:吡喃葡萄糖基;iba:异丁酰基
[0089]
在一些实施方式中,提取至少一种树脂糖苷的方法包括式(i)的树脂糖苷:
[0090][0091]
式(i)的树脂糖苷例如可以从红薯块茎中提取。
[0092]
在一些实施方式中,提取至少一种树脂糖苷的方法包括式(ii)的树脂糖苷:
[0093][0094]
式(ii)的树脂糖苷例如可以从红薯叶中提取。
[0095]
在一些实施方式中,提取至少一种树脂糖苷的方法包括式(iii)、式(iv)、式(v)、式(vi)和式(vii)的a型树脂糖苷:
[0096]
(a型);其中
[0097][0098][0099]
mba:2-甲基丁酰基,dodeca:正十二酰基,octa:正辛酰基,deca:正癸酰基,cna:肉桂酰基,rha:吡喃鼠李糖基,glu:吡喃葡萄糖基;iba:异丁酰基
[0100]
提取树脂糖苷的方法包括使植物经受溶剂提取过程以获得粗提物。在一些实施方式中,使植物经受溶剂提取过程的步骤(步骤a)包括使植物在溶剂中均质化并且液-液提取树脂糖苷作为粗提物。作为一般示例,可以通过混合器使植物均质化并提取化合物。提取物可以被过滤和浓缩。提取物可以被再提取一次以获得粗提物。
[0101]
在一些实施方式中,均质化在乙醇中进行。在其他实施方式中,均质化在二氯甲烷(dcm)中进行。均质化植物可以被进一步浸渍以改进提取过程。在其他实施方式中,液-液提取包括用乙酸乙酯提取。在一些实施方式中,液-液提取包括用甲醇提取。在其他实施方式中,液-液提取包括使用比例为1:1:0.05(v/v/v)的己烷:甲醇:水的混合物进行提取。
[0102]
如本文所示,该步骤后获得的粗提物的脂肪酶抑制活性ic
50
值为33μg/ml。发现该提取物包含至少3种树脂糖苷的混合物。树脂糖苷可以选自由以下组成的组:batataoside i、batataoside ii、batatoside iii、pescaprein xxvii、batatoside h、batatoside f、式(i)的树脂糖苷、式(ii)的树脂糖苷、batatoside e、batatoside d、aquaterin vi、aquaterin v、aquaterin xi、aquaterin ii、stoloniferin viii、aquaterin xiv、batatoside c、batatinoside i、aquaterin vii、aquaterin iii、murucoidin xviii、aquaterin xiii、aquaterin xii、以及式(iii)、式(iv)、式(v)、式(vi)和式(vii)的a型树脂糖苷。
[0103]
在一些实施方式中,当从1kg红薯(块茎或叶子)或空心菜中提取时,可获得约0.1%w/w至约0.3%w/w(相对于原料质量)的粗提物。例如,可获得约0.1%至约0.3%w/w(相对于原料质量)的乙醇提取物,以及可获得约0.19%w/w至约0.27%w/w(相对于原料质量)的二氯甲烷提取物。如本文所述,提取物可含有约2%至约30%的树脂糖苷。在这方面,在一些实施方式中,提取物包含至少2%的树脂糖苷,或至少3%、4%、5%、6%、7%、8%、9%、10%、15%、20%、25%或30%的树脂糖苷。在一些实施方式中,当从1kg植物中提取时,可提取至少20mg的树脂糖苷。在其他实施方式中,可提取至少30mg,可提取至少40mg,可提取至少50mg,可提取至少60mg,可提取至少70mg,可提取至少80mg,可提取至少90mg的,可提取至少100mg,可提取至少150mg,可提取至少200mg,可提取至少250mg,可提取至少300mg,可提取至少350mg,或可提取至少400mg,或可提取至少500mg,或可提取至少700mg,或可提取至少1g。
[0104]
该方法包括纯化粗提物以获得部分纯化的提取物的第一纯化步骤。在一些实施方
式中,纯化粗提物的步骤(步骤b)包括分级粗提物。例如,粗提物可以通过硅胶柱色谱纯化。可以收集级分并测试每个级分的胰腺脂质(pl)抑制活性。
[0105]
在一些实施方式中,纯化粗提物的步骤(步骤b)包括通过具有预定流动相的液相色谱柱洗脱粗提物。在一些实施方式中,流动相是以下梯度:己烷:乙酸乙酯(己烷:etoac;1:1)至纯乙酸乙酯,然后是纯甲醇。在一些实施方式中,流动相是以下梯度:二氯甲烷:甲醇(dcm:meoh;7:1)至纯meoh。在一些实施方式中,流动相是以下梯度:h2o:meoh(100:0)至纯meoh。
[0106]
根据分析,可以进行另一轮硅胶柱色谱以进一步纯化收集的级分。可以进行几轮色谱分离以提高纯度。
[0107]
在该步骤中,所得提取物的脂肪酶抑制活性ic
50
值为约15μg/ml至约30μg/ml。发现该提取物包含至少2种树脂糖苷的混合物。树脂糖苷可以选自由以下组成的组:batataoside i、batataoside ii、batatoside iii、pescaprein xxvii、batatoside h、batatoside f、式(i)的树脂糖苷、式(ii)的树脂糖苷、batatoside e、batatoside d、aquaterin vi、aquaterin v、aquaterin xi、aquaterin ii、stoloniferin viii、aquaterin xiv、batatoside c、batatinoside i、aquaterin vii、aquaterin iii、murucoidin xviii、aquaterin xiii、aquaterin xii、以及式(iii)、式(iv)、式(v)、式(vi)和式(vii)的a型树脂糖苷。
[0108]
该方法包括通过进一步纯化部分纯化的提取物得到树脂糖苷的第二纯化步骤。在一些实施方式中,进一步纯化步骤(步骤c)包括分级部分纯化的提取物。树脂糖苷可以通过使树脂糖苷通过高压液相色谱(hplc)柱并收集适当的级分来进一步纯化。在一些实施方式中,纯化步骤使用反相c18柱进行。本领域技术人员将理解其他方法,例如半制备型hplc方法也将起作用。
[0109]
在其他实施方式中,进一步纯化步骤(步骤c)包括通过液相色谱柱洗脱部分纯化的提取物。在一些实施方式中,进一步纯化步骤(步骤c)包括通过具有预定流动相的液相色谱柱洗脱部分纯化的提取物。在一些实施方式中,进一步纯化步骤(步骤c)包括通过液相色谱柱洗脱部分纯化的提取物,该液相色谱柱的流动相具有以下梯度:meoh-h2o(90:10)至meoh-h2o(100:0)。发现该步骤有利于去除部分纯化的提取物中的大部分杂质(图2)。
[0110]
可以使用不同的洗脱方法对部分纯化的提取物进行进一步纯化。例如,可以使用纯ch3cn用等度洗脱(isocratic elution)进行进一步纯化。在一些实施方式中,使用乙腈进一步洗脱部分纯化的提取物。在一些实施方式中,进一步纯化步骤(步骤c)进一步包括从液相色谱柱洗脱级分,该液相色谱柱的流动相具有以下梯度:meoh-h2o(90:10)至meoh-h2o(100:0)与乙腈。可选择地,可以使用乙腈(acn)-meoh(80:20)进一步洗脱来自液相色谱柱(流动相具有以下梯度:meoh-h2o(90:10)至meoh-h2o(100:0)与乙腈)的级分。发现这对于分离和解析不同的树脂糖苷以及从部分纯化的提取物中去除更多杂质是有利的。
[0111]
使用本文公开的方法,发现树脂糖苷的纯度可以大大提高。发现该提取物包含至少一种树脂糖苷。树脂糖苷可以选自由以下组成的组:batataoside i、batataoside ii、batatoside iii、pescaprein xxvii、batatoside f、batatoside h、式(i)的树脂糖苷、式(ii)的树脂糖苷、batatoside e、batatoside d、aquaterin vi、aquaterin v、aquaterin xi、aquaterin ii、stoloniferin viii、aquaterin xiv、batatoside c、batatinoside i、
aquaterin vii、aquaterin iii、murucoidin xviii、aquaterin xiii、aquaterin xii、以及式(iii)、式(iv)、式(v)、式(vi)和式(vii)的a型树脂糖苷。有利地,本发明人还发现可以提高ic
50
值。例如,粗提物具有ic
50
为33μg/ml的脂肪酶抑制作用。进行纯化步骤后,可以获得ic
50
约为6μg/ml的脂肪酶抑制作用。不希望受理论束缚,本发明人认为这是由于树脂糖苷的氧化/不纯(无活性)形式以及杂质阻碍与脂质结合。通过有效去除这些氧化形式,树脂糖苷可以更有效地靶向脂质并实现其预期的体重减轻功能。也正是因为这些杂质,例如单独吃红薯或空心菜的体重减轻效果是微乎其微的。在这方面,通过从这些植物中提取可食用形式的树脂糖苷,可以获得更好的效果。
[0112]
因此,在一些实施方式中,从选自旋花科的植物中提取至少一种树脂糖苷的方法包括:
[0113]
a)使植物经受溶剂提取过程以获得粗提物;
[0114]
b)纯化粗提物以获得部分纯化的提取物;和
[0115]
c)进一步纯化该部分纯化的提取物得到树脂糖苷;
[0116]
其中,植物选自甘薯(红薯)和蕹菜(空心菜);
[0117]
其中树脂糖苷选自由以下组成的组:batataoside i、batataoside ii、batatoside iii、pescaprein xxvii、batatoside f、batatoside h、式(i)的树脂糖苷
[0118][0119]
式(ii)的树脂糖苷
[0120]
[0121]
batatoside e、batatoside d、aquaterin vi、aquaterin v、aquaterin xi、aquaterin ii、stoloniferin viii、aquaterin xiv、batatoside c、batatinoside i、aquaterin vii、aquaterin iii、murucoidin xviii、aquaterin xiii、aquaterin xii、以及式(iii)、式(iv)、式(v)、式(vi)和式(vii)的a型树脂糖苷。
[0122]
在一些实施方式中,从选自旋花科的植物中提取至少一种树脂糖苷的方法包括:
[0123]
a)使植物经受溶剂提取过程以获得粗提物;
[0124]
b)纯化粗提物以获得部分纯化的提取物;和
[0125]
c)进一步纯化该部分纯化的提取物得到树脂糖苷;
[0126]
其中,植物选自甘薯(红薯);
[0127]
其中树脂糖苷选自由以下组成的组:batataoside i、batataoside ii、batatoside iii、pescaprein xxvii、batatoside f、batatoside h、式(i)的树脂糖苷
[0128][0129]
式(ii)的树脂糖苷
[0130][0131]
在一些实施方式中,从选自旋花科的植物中提取至少一种树脂糖苷的方法包括:
[0132]
a)使植物经受溶剂提取过程以获得粗提物;
[0133]
b)纯化粗提物以获得部分纯化的提取物;和
[0134]
c)进一步纯化该部分纯化的提取物得到树脂糖苷;
[0135]
其中,植物选自甘薯(红薯)和/或蕹菜(空心菜);
[0136]
其中,树脂糖苷选自由以下组成的组:batatoside i、batatoside ii、batatoside iii、pescaprein xxvii、batatoside f和batatoside h及其组合;以及
[0137]
其中,进一步纯化步骤(步骤c)包括通过液相色谱柱洗脱部分纯化的提取物,该液相色谱柱的流动相具有以下梯度:meoh-h2o(90:10)至meoh-h2o(100:0)。
[0138]
因此,在一些实施方式中,从选自旋花科的植物中提取至少一种树脂糖苷的方法包括:
[0139]
a)使植物经受溶剂提取过程以获得粗提物;
[0140]
b)纯化粗提物以获得部分纯化的提取物;和
[0141]
c)进一步纯化该部分纯化的提取物得到树脂糖苷;
[0142]
其中,植物选自甘薯(红薯)和蕹菜(空心菜);
[0143]
其中树脂糖苷选自由以下组成的组:batataoside i、batataoside ii、batatoside iii、pescaprein xxvii、batatoside f、batatoside h、式(i)的树脂糖苷、式(ii)的树脂糖苷或其组合;以及
[0144]
其中,进一步纯化步骤(步骤c)包括通过液相色谱柱洗脱部分纯化的提取物,该液相色谱柱的流动相具有以下梯度:meoh-h2o(90:10)至meoh-h2o(100:0)。
[0145]
在一些实施方式中,从选自旋花科的植物中提取至少一种树脂糖苷的方法包括:
[0146]
a)使植物经受溶剂提取过程以获得粗提物;
[0147]
b)纯化粗提物以获得部分纯化的提取物;和
[0148]
c)进一步纯化该部分纯化的提取物得到树脂糖苷;
[0149]
其中,植物选自甘薯(红薯)和蕹菜(空心菜);
[0150]
其中,树脂糖苷选自由以下组成的组:batatoside i、batatoside ii、batatoside iii、pescaprein xxvii、batatoside f和batatoside h及其组合;以及
[0151]
其中,进一步纯化步骤(步骤c)包括:通过液相色谱柱洗脱部分纯化的提取物,该液相色谱柱的流动相具有以下梯度:meoh-h2o(90:10)至meoh-h2o(100:0);和从液相色谱柱洗脱级分,该液相色谱柱的流动相具有以下梯度:meoh-h2o(90:10)至meoh-h2o(100:0)与乙腈或与acn-meoh(80:20)。
[0152]
因此,在一些实施方式中,从选自旋花科的植物中提取至少一种树脂糖苷的方法包括:
[0153]
a)使植物经受溶剂提取过程以获得粗提物;
[0154]
b)纯化粗提物以获得部分纯化的提取物;和
[0155]
c)进一步纯化该部分纯化的提取物得到树脂糖苷;
[0156]
其中,植物选自甘薯(红薯)和蕹菜(空心菜);
[0157]
其中树脂糖苷选自由以下组成的组:batataoside i、batataoside ii、batatoside iii、pescaprein xxvii、batatoside f、batatoside h、式(i)的树脂糖苷、式(ii)的树脂糖苷或其组合;以及
[0158]
其中,进一步纯化步骤(步骤c)包括通过液相色谱柱洗脱部分纯化的提取物,该液相色谱柱的流动相具有以下梯度:meoh-h2o(90:10)至meoh-h2o(100:0)(acn)或acn-meoh(80:20)。
[0159]
在一些实施方式中,从选自旋花科的植物中提取至少一种树脂糖苷的方法包括:
[0160]
a)使植物经受溶剂提取过程以获得粗提物;
[0161]
b)纯化粗提物以获得部分纯化的提取物;和
[0162]
c)进一步纯化该部分纯化的提取物得到树脂糖苷;
[0163]
其中,植物选自蕹菜(空心菜);
[0164]
其中,树脂糖苷选自由以下组成的组:batatoside f、batatoside e、batatoside d、aquaterin vi、aquaterin v、aquaterin xi、aquaterin ii、stoloniferin viii、aquaterin xiv、batatoside c、batatinoside i、aquaterin vii、aquaterin iii、murucoidin xviii、aquaterin xiii、aquaterin xii、以及式(iii)、式(iv)、式(v)、式(vi)和式(vii)的a型树脂糖苷。
[0165]
在一些实施方式中,从选自旋花科的植物中提取至少一种树脂糖苷的方法包括:
[0166]
a)使植物经受溶剂提取过程以获得粗提物;
[0167]
b)纯化粗提物以获得部分纯化的提取物;和
[0168]
c)进一步纯化该部分纯化的提取物得到树脂糖苷;
[0169]
其中,植物选自蕹菜(空心菜);
[0170]
其中,树脂糖苷选自由以下组成的组:batatoside f、batatoside e、batatoside d、aquaterin vi、aquaterin v、aquaterin xi、aquaterin ii、stoloniferin viii、aquaterin xiv、batatoside c、batatinoside i、aquaterin vii、aquaterin iii、murucoidin xviii、aquaterin xiii、aquaterin xii、以及式(iii)、式(iv)、式(v)、式(vi)和式(vii)的a型树脂糖苷;以及
[0171]
其中,进一步纯化步骤(步骤c)包括通过液相色谱柱洗脱部分纯化的提取物,该液相色谱柱的流动相具有以下梯度:meoh-h2o(90:10)至meoh-h2o(100:0)。
[0172]
因此,在一些实施方式中,从选自旋花科的植物中提取至少一种树脂糖苷的方法包括:
[0173]
a)使植物经受溶剂提取过程以获得粗提物;
[0174]
b)纯化粗提物以获得部分纯化的提取物;和
[0175]
c)进一步纯化该部分纯化的提取物得到树脂糖苷;
[0176]
其中,植物选自蕹菜(空心菜);
[0177]
其中,树脂糖苷选自由以下组成的组:batatoside f、batatoside e、batatoside d、aquaterin vi、aquaterin v、aquaterin xi、aquaterin ii、stoloniferin viii、aquaterin xiv、batatoside c、batatinoside i、aquaterin vii、aquaterin iii、murucoidin xviii、aquaterin xiii、aquaterin xii、以及式(iii)、式(iv)、式(v)、式(vi)和式(vii)的a型树脂糖苷;以及
[0178]
其中,进一步纯化步骤(步骤c)包括通过液相色谱柱洗脱部分纯化的提取物,该液相色谱柱的流动相具有以下梯度:meoh-h2o(90:10)至meoh-h2o(100:0)。
[0179]
在一些实施方式中,从选自旋花科的植物中提取至少一种树脂糖苷的方法包括:
[0180]
a)使植物经受溶剂提取过程以获得粗提物;
[0181]
b)纯化粗提物以获得部分纯化的提取物;和
[0182]
c)进一步纯化该部分纯化的提取物得到树脂糖苷;
[0183]
其中,植物选自蕹菜(空心菜);
[0184]
其中,树脂糖苷选自由以下组成的组:batatoside f、batatoside e、batatoside d、aquaterin vi、aquaterin v、aquaterin xi、aquaterin ii、stoloniferin viii、aquaterin xiv、batatoside c、batatinoside i、aquaterin vii、aquaterin iii、murucoidin xviii、aquaterin xiii、aquaterin xii、以及式(iii)、式(iv)、式(v)、式(vi)和式(vii)的a型树脂糖苷;以及
[0185]
其中,进一步纯化步骤(步骤c)包括:通过液相色谱柱洗脱部分纯化的提取物,该液相色谱柱的流动相具有以下梯度:meoh-h2o(90:10)至meoh-h2o(100:0);和从液相色谱柱洗脱级分,该液相色谱柱的流动相具有以下梯度:meoh-h2o(90:10)至meoh-h2o(100:0)与乙腈或与acn-meoh(80:20)。
[0186]
因此,在一些实施方式中,从选自旋花科的植物中提取至少一种树脂糖苷的方法包括:
[0187]
a)使植物经受溶剂提取过程以获得粗提物;
[0188]
b)纯化粗提物以获得部分纯化的提取物;和
[0189]
c)进一步纯化该部分纯化的提取物得到树脂糖苷;
[0190]
其中,植物选自蕹菜(空心菜);
[0191]
其中,树脂糖苷选自由以下组成的组:batatoside f、batatoside e、batatoside d、aquaterin vi、aquaterin v、aquaterin xi、aquaterin ii、stoloniferin viii、aquaterin xiv、batatoside c、batatinoside i、aquaterin vii、aquaterin iii、murucoidin xviii、aquaterin xiii、aquaterin xii、以及式(iii)、式(iv)、式(v)、式(vi)和式(vii)的a型树脂糖苷;以及
[0192]
其中,进一步纯化步骤(步骤c)包括通过液相色谱柱洗脱部分纯化的提取物,该液相色谱柱的流动相具有以下梯度:meoh-h2o(90:10)至meoh-h2o(100:0)(acn)或acn-meoh(80:20)。
[0193]
本发明还公开了一种提取物,该提取物包含:
[0194]
选自由以下组成的组中的至少一种树脂糖苷:batataoside i、batataoside ii、batatoside iii、pescaprein xxvii、batatoside f、batatoside h、式(i)的树脂糖苷、式(ii)的树脂糖苷、batatoside e、batatoside d、aquaterin vi、aquaterin v、aquaterin xi、aquaterin ii、stoloniferin viii、aquaterin xiv、batatoside c、batatinoside i、aquaterin vii、aquaterin iii、murucoidin xviii、aquaterin xiii、aquaterin xii、以及式(iii)、式(iv)、式(v)、式(vi)和式(vii)的a型树脂糖苷;
[0195]
其中该树脂糖苷是从选自甘薯(红薯)和/或蕹菜(空心菜)的植物中提取的。
[0196]
在一些实施方式中,该提取物包括:
[0197]
选自由以下组成的组中的至少一种树脂糖苷:batataoside i、batataoside ii、batatoside iii、pescaprein xxvii、batatoside f和batatoside h、式(i)的树脂糖苷、式(ii)的树脂糖苷或其组合。
[0198]
在一些实施方式中,该提取物包括:
[0199]
选自由以下组成的组中的至少一种树脂糖苷:batataoside i、batataoside ii、batatoside iii、pescaprein xxvii、batatoside f和batatoside h、式(i)的树脂糖苷、式(ii)的树脂糖苷或其组合;
[0200]
其中该树脂糖苷是从选自甘薯(红薯)和/或蕹菜(空心菜)的植物中提取的。
[0201]
在一些实施方式中,该提取物包括:
[0202]
选自由以下组成的组中的至少一种树脂糖苷:batataoside i、batataoside ii、batatoside iii、pescaprein xxvii、batatoside f和batatoside h、式(i)的树脂糖苷、式(ii)的树脂糖苷或其组合;
[0203]
其中树脂糖苷是从选自甘薯(红薯)的植物中提取的。
[0204]
在一些实施方式中,提取物包含选自由以下组成的组中的至少一种树脂糖苷:batatoside f、batatoside e、batatoside d、aquaterin vi、aquaterin v、aquaterin xi、aquaterin ii、stoloniferin viii、aquaterin xiv、batatoside c、batatinoside i、aquaterin vii、aquaterin iii、murucoidin xviii、aquaterin xiii、aquaterin xii、以及式(iii)、式(iv)、式(v)、式(vi)和式(vii)的a型树脂糖苷。
[0205]
其中树脂糖苷是从选自蕹菜(空心菜)的植物中提取的。
[0206]
在一些实施方式中,提取物的脂肪酶抑制活性ic
50
值可以小于15μg/ml。在其他实施方式中,提取物的ic
50
值小于14μg/ml、13μg/ml、12μg/ml、11μg/ml、10μg/ml、9μg/ml、8μg/ml、7μg/ml或6μg/ml。在其他实施方式中,提取物的脂肪酶抑制活性ic
50
值为约4μg/ml至约15μg/ml。
[0207]
在一些实施方式中,提取物包含纯度为至少80%的树脂糖苷;即提取物包含至少80wt%的树脂糖苷。在其他实施方式中,树脂糖苷的纯度为至少85%、纯度为至少90%、纯度为至少92%、纯度为至少94%、纯度为至少96%、纯度为至少98%或纯度为至少99%。
[0208]
在其他实施方式中,提取物(或部分纯化的提取物)包含:
[0209]
选自由以下组成的组中的至少两种树脂糖苷:batataoside i、batataoside ii、batatoside iii、pescaprein xxvii、batatoside f、batatoside h、式(i)的树脂糖苷、式(ii)的树脂糖苷、batatoside e、batatoside d、aquaterin vi、aquaterin v、aquaterin xi、aquaterin ii、stoloniferin viii、aquaterin xiv、batatoside c、batatinoside i、aquaterin vii、aquaterin iii、murucoidin xviii、aquaterin xiii、aquaterin xii、以及式(iii)、式(iv)、式(v)、式(vi)和式(vii)的a型树脂糖苷;
[0210]
其中该树脂糖苷是从选自甘薯(红薯)和/或蕹菜(空心菜)的植物中提取的。
[0211]
在其他实施方式中,提取物(或部分纯化的提取物)包含:
[0212]
选自由以下组成的组中的至少两种树脂糖苷:batataoside i、batataoside ii、batatoside iii、pescaprein xxvii、batatoside f、batatoside h、式(i)的树脂糖苷、式(ii)的树脂糖苷或其组合;
[0213]
其中树脂糖苷是从选自甘薯(红薯)的植物中提取的。
[0214]
在其他实施方式中,提取物(或部分纯化的提取物)包含:
[0215]
选自由以下组成的组中的至少两种树脂糖苷:batatoside f、batatoside e、batatoside d、aquaterin vi、aquaterin v、aquaterin xi、aquaterin ii、stoloniferin viii、aquaterin xiv、batatoside c、batatinoside i、aquaterin vii、aquaterin iii、murucoidin xviii、aquaterin xiii、aquaterin xii、以及式(iii)、式(iv)、式(v)、式(vi)和式(vii)的a型树脂糖苷;
[0216]
其中树脂糖苷是从选自蕹菜(空心菜)的植物中提取的。
[0217]
在一些实施方式中,提取物(或部分纯化的提取物)具有存在的杂质的特征。例如,红薯块茎中的杂质可以是低聚糖和多糖的混合物,而叶子提取物中主要是叶绿素和多酚、维生素e、类胡萝卜素、脂质和脂肪酸。杂质的量取决于纯化程度。
[0218]
在一些实施方式中,当提取物的纯度为至少80%时,低聚糖和多糖在提取物中的含量为约15%至约20%。在其他实施方式中,当提取物的纯度为至少80%时,叶绿素和多酚在提取物中的含量为约1%至约20%、约1%至约18%、约1%至约16%、约1%至约15%、约1%至约14%、约1%至约12%、约1%至约10%、约1%至约8%、约1%至约6%、约1%至约5%、约1%至约4%、约1%至约3%、或约1%至约2%。在其他实施方式中,当提取物的纯度为至少80%时,维生素e在提取物中的含量为约1%至约20%、约1%至约18%、约1%至约16%、约1%至约15%、约1%至约14%、约1%至约12%、约1%至约10%、约1%至约8%、约1%至约6%、约1%至约5%、约1%至约4%、约1%至约3%、或约1%至约2%。在其他实施方式中,当提取物的纯度为至少80%时,提取物中类胡萝卜素的含量为约1%至约20%、约1%至约18%、约1%至约16%、约1%至约15%、约1%至约14%、约1%至约12%、约1%至约10%、约1%至约8%、约1%至约6%、约1%至约5%、约1%至约4%、约1%至约3%、或约1%至约2%。在其他实施方式中,当提取物的纯度为至少80%时,提取物中脂质和脂肪酸的含量为约1%至约20%、约1%至约18%、约1%至约16%、约1%至约15%、约1%至约14%、约1%至约12%、约1%至约10%、约1%至约8%、约1%至约6%、约1%至约5%、约1%至约4%、约1%至约3%、或约1%至约2%。
[0219]
在一些实施方式中,当提取物的纯度为至少90%时,低聚糖和多糖在提取物中的含量为约5%至约10%。在其他实施方式中,当提取物的纯度为至少90%时,叶绿素和多酚在提取物中的含量为约1%至约10%、约1%至约8%、约1%至约6%、约1%至约5%、约1%至约4%、约1%至约3%、或约1%至约2%。在其他实施方式中,当提取物的纯度为至少90%时,维生素e在提取物中的含量为约1%至约10%、约1%至约8%、约1%至约6%、约1%至约5%、约1%至约4%、约1%至约3%、或约1%至约2%。在其他实施方式中,当提取物的纯度为至少90%时,提取物中类胡萝卜素的含量为约1%至约10%、约1%至约8%、约1%至约6%、约1%至约5%、约1%至约4%、约1%至约3%、或约1%至约2%。在其他实施方式中,当提取物的纯度为至少90%时,提取物中脂质和脂肪酸的含量为约1%至约10%、约1%至约8%、约1%至约6%、约1%至约5%、约1%至约4%、约1%至约3%、或约1%至约2%。
[0220]
在一些实施方式中,提取物包含相对于提取物约2mg/g至约40mg/g的batatoside f。在其他实施方式中,该量为约2mg/g至约35mg/g、约2mg/g至约30mg/g、约2mg/g至约25mg/g、约2mg/g至约20mg/g、约2mg/g至约15mg/g、约2mg/g至约12mg/g、约3mg/g至约12mg/g、约4mg/g至约12mg/g、约4mg/g至约11mg/g、约4mg/g至约10mg/g、约4mg/g至约9mg/g、约5mg/g至约9mg/g或约5mg/g至约8mg/g。
[0221]
在一些实施方式中,提取物包含相对于提取物约2mg/g至约8mg/g的batatoside h。在其他实施方式中,该量为约2mg/g至约7mg/g、约2.5mg/g至约7mg/g、约3mg/g至约7mg/g、约3mg/g至约6mg/g、约3.5mg/g至约6mg/g或约3.5mg/g至约6.5mg/g。
[0222]
在一些实施方式中,提取物包含相对于提取物约0.5mg/g至约500mg/g的batatoside i。在一些实施方式中,该量为约0.5mg/g至约450mg/g、约0.5mg/g至约400mg/g、约0.5mg/g至约350mg/g、约0.5mg/g至约300mg/g、约0.5mg/g至约250mg/g、约0.5mg/g至
约200mg/g、约0.5mg/g至约150mg/g、约0.5mg/g至约100mg/g、约0.5mg/g至约80mg/g、约0.5mg/g至约60mg/g、约0.5mg/g至约40mg/g、约0.5mg/g至约20mg/g、约0.5mg/g至约10mg/g、约0.5mg/g至约8mg/g、约0.5mg/g至约6mg/g、约0.5mg/g至约5mg/g、约0.5mg/g至约3.5mg/g、约0.5mg/g至约3mg/g、约0.5mg/g至约2.5mg/g、约0.6mg/g至约2.5mg/g、约0.7mg/g至约2.5mg/g、约0.8mg/g至约2.5mg/g、约0.9mg/g至约2.5mg/g或约0.9mg/g至约2mg/g。
[0223]
在一些实施方式中,提取物包含相对于提取物约0.1mg/g至约10mg/g的batatoside iii。在其他实施方式中,该量为约0.1mg/g至约8mg/g、约0.1mg/g至约6mg/g、约0.1mg/g至约4mg/g、约0.1mg/g至约3.5mg/g、约0.1mg/g至约3mg/g、约0.1mg/g至约2.5mg/g、约0.1mg/g至约2mg/g、约0.1mg/g至约1.5mg/g、约0.1mg/g至约1mg/g、约0.2mg/g至约1mg/g或约0.4mg/g至约1mg/g。
[0224]
在一些实施方式中,提取物包含相对于提取物约0.1mg/g至约5mg/g的batatoside ii。在其他实施方式中,该量为约0.1mg/g至约4mg/g、约0.1mg/g至约3.5mg/g、约0.1mg/g至约3mg/g、约0.1mg/g至约2.5mg/g、约0.1mg/g至约2mg/g、约0.1mg/g至约1.5mg/g、约0.1mg/g至约1mg/g、约0.2mg/g至约1mg/g、约0.4mg/g至约1mg/g或约0.4mg/g至约0.9mg/g。
[0225]
在一些实施方式中,提取物包含相对于提取物约0.1mg/g至约5mg/g的pescaprein xxvii。在其他实施方式中,该量为约0.1mg/g至约4mg/g、约0.1mg/g至约3.5mg/g、约0.1mg/g至约3mg/g、约0.1mg/g至约2.5mg/g、约0.1mg/g至约2mg/g、约0.1mg/g至约1.5mg/g、约0.1mg/g至约1mg/g、约0.2mg/g至约1mg/g或约0.4mg/g至约1mg/g。
[0226]
在一些实施方式中,提取物包含相对于提取物约0.1mg/g至约4mg/g的式(i)的树脂糖苷。在其他实施方式中,该量为约0.1mg/g至约3.5mg/g、约0.1mg/g至约3mg/g、约0.1mg/g至约2.5mg/g、约0.1mg/g至约2mg/g、约0.1mg/g至约1.5mg/g、约0.1mg/g至约1mg/g、约0.2mg/g至约1mg/g、约0.4mg/g至约1mg/g或约0.4mg/g至约0.9mg/g。
[0227]
在一些实施方式中,提取物包含相对于提取物约10mg/g至约500mg/g的式(ii)的树脂糖苷。在一些实施方式中,该量为约10mg/g至约450mg/g、约10mg/g至约400mg/g、约10mg/g至约350mg/g、约10mg/g至约300mg/g、约10mg/g至约250mg/g、约10mg/g至约200mg/g、约10mg/g至约150mg/g、约10mg/g至约100mg/g、约10mg/g至约80mg/g、约10mg/g至约60mg/g、约10mg/g至约40mg/g、约10mg/g至约20mg/g或约10mg/g至约15mg/g。
[0228]
在一些实施方式中,提取物包含至少2种树脂糖苷的混合物。在其他实施方式中,提取物包含至少3种树脂糖苷的混合物。例如,提取物可包含以下混合物中的树脂糖苷:
[0229]
[0230]
[0231]
[0232][0233]
在一些实施方式中,提取物包含相对于提取物约0.5mg/g至约500mg/g的batatoside e。在其他实施方式中,提取物包含相对于提取物约0.5mg/g至约500mg/g的batatoside d。在其他实施方式中,提取物包含相对于提取物约0.5mg/g至约500mg/g的aquaterin vi。在其他实施方式中,提取物包含相对于提取物约0.5mg/g至约500mg/g的aquaterin v。在其他实施方式中,提取物包含相对于提取物约0.5mg/g至约500mg/g的aquaterin xi。在其他实施方式中,提取物包含相对于提取物约0.5mg/g至约500mg/g的aquaterin ii。在其他实施方式中,提取物包含相对于提取物约0.5mg/g至约500mg/g的stoloniferin viii。在其他实施方式中,提取物包含相对于提取物约0.5mg/g至约500mg/g的aquaterin xiv。在其他实施方式中,提取物包含相对于提取物约0.5mg/g至约500mg/g的batatoside c。在一些实施方式中,提取物包含相对于提取物约0.5mg/g至约500mg/g的batatinoside i。在其他实施方式中,提取物包含相对于提取物约0.5mg/g至约500mg/g的aquaterin vii。在其他实施方式中,提取物包含相对于提取物约0.5mg/g至约500mg/g的aquaterin iii。在其他实施方式中,提取物包含相对于提取物约0.5mg/g至约500mg/g的murucoidin xviii。在其他实施方式中,提取物包含相对于提取物约0.5mg/g至约500mg/g的aquaterin xiii。在其他实施方式中,提取物包含相对于提取物约0.5mg/g至约500mg/g的aquaterin xii。在一些实施方式中,提取物包含相对于提取物约0.5mg/g至约500mg/g的式(iii)的树脂糖苷。在一些实施方式中,提取物包含相对于提取物约0.5mg/g至约500mg/g的式(iv)的树脂糖苷。
[0234]
在一些实施方式中,提取物包含相对于提取物约0.5mg/g至约500mg/g的式(v)的树脂糖苷。在一些实施方式中,提取物包含相对于提取物约0.5mg/g至约500mg/g的式(vi)的树脂糖苷。在一些实施方式中,提取物包含相对于提取物约0.5mg/g至约500mg/g的式(vii)的树脂糖苷。在一些实施方式中,该量为约0.5mg/g至约450mg/g、约0.5mg/g至约400mg/g、约0.5mg/g至约350mg/g、约0.5mg/g至约300mg/g、约0.5mg/g至约250mg/g、约0.5mg/g至约200mg/g、约0.5mg/g至约150mg/g、约0.5mg/g至约100mg/g、约0.5mg/g至约80mg/g、约0.5mg/g至约60mg/g、约0.5mg/g至约40mg/g、约0.5mg/g至约20mg/g、约0.5mg/g至约10mg/g、约0.5mg/g至约8mg/g、约0.5mg/g至约6mg/g、约0.5mg/g至约5mg/g、约0.5mg/g至约3.5mg/g、约0.5mg/g至约3mg/g、约0.5mg/g至约2.5mg/g、约0.6mg/g至约2.5mg/g、约0.7mg/g至约2.5mg/g、约0.8mg/g至约2.5mg/g、约0.9mg/g至约2.5mg/g或约0.9mg/g至约2mg/g。
[0235]
例如,提取物可包含以下混合物中的树脂糖苷:
[0236]
[0237]
[0238]
[0239]
[0240]
[0241]
[0242][0243]
p:存在
[0244]
在这方面,提取物(或部分纯化的提取物)的脂肪酶抑制活性ic
50
值可以为约15μg/ml至约30μg/ml提取物。在其他实施方式中,提取物的ic
50
值为约15μg/ml至约27μg/ml、约15μg/ml至约25μg/ml、约15μg/ml至约22μg/ml或约15μg/ml至约20μg/ml。
[0245]
在一些实施方式中,提取物(或部分纯化的提取物)包含纯度为约50%至约80%的树脂糖苷。在其他实施方式中,树脂糖苷的纯度为约50%至约75%、纯度为约50%至约70%、纯度为约50%至约65%或纯度为约50%至约60%。在其他实施方式中,树脂糖苷的纯度为约为50%、纯度为约55%、纯度为约60%、纯度为约65%、纯度为约70%、纯度为约75%或纯度为约80%。
[0246]
在其他实施方式中,提取物(或粗提物)包含:
[0247]
选自由以下组成的组中的至少三种树脂糖苷:batataoside i、batataoside ii、batatoside iii、pescaprein xxvii、batatoside f、batatoside h、式(i)的树脂糖苷、式(ii)的树脂糖苷、batatoside e、batatoside d、aquaterin vi、aquaterin v、aquaterin xi、aquaterin ii、stoloniferin viii、aquaterin xiv、batatoside c、batatinoside i、aquaterin vii、aquaterin iii、murucoidin xviii、aquaterin xiii、aquaterin xii、以
及式(iii)、式(iv)、式(v)、式(vi)和式(vii)的a型树脂糖苷;
[0248]
其中该树脂糖苷是从选自甘薯(红薯)和/或蕹菜(空心菜)的植物中提取的。
[0249]
在其他实施方式中,提取物(或粗提物)包含:
[0250]
选自由以下组成的组中的至少三种树脂糖苷:batataoside i、batataoside ii、batatoside iii、pescaprein xxvii、batatoside f、batatoside h、式(i)的树脂糖苷、式(ii)的树脂糖苷或其组合;
[0251]
其中树脂糖苷是从选自甘薯(红薯)的植物中提取的。
[0252]
在其他实施方式中,提取物(或粗提物)包含:
[0253]
选自由以下组成的组中的至少三种树脂糖苷:batatoside e、batatoside d、aquaterin vi、aquaterin v、aquaterin xi、aquaterin ii、stoloniferin viii、aquaterin xiv、batatoside c、batatinoside i、aquaterin vii、aquaterin iii、murucoidin xviii、aquaterin xiii、aquaterin xii、以及式(iii)、式(iv)、式(v)、式(vi)和式(vii)的a型树脂糖苷;
[0254]
其中树脂糖苷是从选自蕹菜(空心菜)的植物中提取的。
[0255]
有利地,与糖主链键合的脂肪酸侧链较少/较短的树脂糖苷具有较高的抑制效果。
[0256]
在一些实施方式中,提取物(或粗提物)的脂肪酶抑制活性ic
50
值可以大于30μg/ml。在其他实施方式中,提取物的ic
50
值大于31μg/ml、32μg/ml、33μg/ml、35μg/ml、40μg/ml或45μg/ml。
[0257]
在一些实施方式中,提取物(或粗提物)包含纯度不低于30%的树脂糖苷。在其他实施方式中,树脂糖苷的纯度不低于35%、纯度不低于40%或纯度不低于45%。在其他实施方式中,树脂糖苷的纯度约为30%、纯度约为35%、纯度约为40%、纯度约为45%或纯度约为50%。
[0258]
在一些实施方式中,该提取物包括:
[0259]
a)约2mg/g至约12mg/g的batatoside f;和
[0260]
b)约2mg/g至约8mg/g的batatoside h;
[0261]
其中该树脂糖苷是从选自甘薯(红薯)和/或蕹菜(空心菜)的植物中提取的。
[0262]
在一些实施方式中,该提取物包括:
[0263]
a)约2mg/g至约12mg/g的batatoside f;
[0264]
b)约2mg/g至约8mg/g的batatoside h;和
[0265]
a)约0.5mg/g至约5mg/g的batatoside i;
[0266]
其中该树脂糖苷是从选自甘薯(红薯)和/或蕹菜(空心菜)的植物中提取的。
[0267]
在一些实施方式中,该提取物包括:
[0268]
a)约0.5mg/g至约5mg/g的batatoside i;和
[0269]
a)约0.1mg/g至约5mg/g的batatoside ii;
[0270]
其中该树脂糖苷是从选自甘薯(红薯)和/或蕹菜(空心菜)的植物中提取的。
[0271]
在一些实施方式中,该提取物包括:
[0272]
a)约0.5mg/g至约5mg/g的batatoside i;
[0273]
a)约0.1mg/g至约5mg/g的batatoside ii;和
[0274]
a)约0.1mg/g至约5mg/g的batatoside iii;
[0275]
其中该树脂糖苷是从选自甘薯(红薯)和/或蕹菜(空心菜)的植物中提取的。
[0276]
本发明还提供了式(i)的树脂糖苷,
[0277][0278]
式(i)的树脂糖苷例如可以从红薯块茎中提取。
[0279]
本发明还提供了一种从甘薯(红薯)中提取式(i)的树脂糖苷的方法。
[0280]
本发明还提供了式(ii)的树脂糖苷,
[0281][0282]
式(ii)的树脂糖苷例如可以从红薯叶中提取。
[0283]
本发明还提供了一种从甘薯(红薯)中提取式(ii)的树脂糖苷的方法。
[0284]
本发明还提供了式(iii)、式(iv)、式(v)、式(vi)和/或式(vii)的a型树脂糖苷,
[0285]
[0286]
当r1为正十二烷酰基,r2为肉桂酰基,r3为2-甲基丁酰基,r4为h,r5为吡喃鼠李糖基,且r6为甲基时为式(iii)。
[0287]
当r1为异丁酰基,r2为h,r3为h,r4为正辛酰基,r5为吡喃葡萄糖基,且r6为甲基时为式(iv)。
[0288]
当r1为正辛酰基,r2为正辛酰基,r3为h,r4为2-甲基丁酰基,r5为正辛酰基,且r6为甲基时为式(v)。
[0289]
当r1为正十二酰基,r2为h,r3为h,r4为h,r5为正辛酰基,且r6为甲基时为式(vi)。
[0290]
当r1为正辛酰基,r2为h,r3为正辛酰基,r4为2-甲基丁酰基,r5为吡喃葡萄糖基,且r6为甲基时为式(vii)。
[0291]
式(ii)的树脂糖苷例如可以从空心菜中提取。
[0292]
预计由于提取物来自天然产物,因此副作用最小。这与奥利司他相比是有利的。积极作用与奥利司他相似,而副作用预计比奥利司他更温和,因为提取物来自具有500多年食用历史的可食用植物。此外,该提取物是淡黄色的并且有淡淡的甜味,这可有利于消费者接受。提取物可以制成具有一定粘性的粉末形式。提取物活性在100℃下相对稳定至少30分钟。该提取物非常适合掺入食品中以增加脂肪阻断功能。另一个优点是可以从红薯副产品(例如叶和茎)的生物质中提取该提取物,因此可以具有低生产成本。
[0293]
本发明还公开了一种可食用组合物,该可食用组合物包含如本文公开的从选自旋花科的植物中提取的至少一种树脂糖苷。在一些实施方式中,至少一种树脂糖苷选自由以下组成的组:batataoside i、batataoside ii、batatoside iii、pescaprein xxvii、batatoside f、batatoside h、式(i)的树脂糖苷、式(ii)的树脂糖苷、batatoside e、batatoside d、aquaterin vi、aquaterin v、aquaterin xi、aquaterin ii、stoloniferin viii、aquaterin xiv、batatoside c、batatinoside i、aquaterin vii、aquaterin iii、murucoidin xviii、aquaterin xiii、aquaterin xii、以及式(iii)、式(iv)、式(v)、式(vi)和式(vii)的a型树脂糖苷。在其他实施方式中,可食用组合物包含来自甘薯(红薯)和/或蕹菜(空心菜)的提取物。在这方面,可食用组合物可以同时包含来自甘薯(红薯)和蕹菜(空心菜)的提取物。
[0294]
在一些实施方式中,可食用组合物还包含赋形剂。该组合物可以包含任何合适的载体、稀释剂或赋形剂。这些包括所有常规溶剂、分散介质、填料、固体载体、涂料、表面活性剂、等渗剂和吸收剂等。应当理解,本发明的组合物还可以包括其他补充生理活性剂。赋形剂是一种与树脂糖苷一起配制的物质,可用于长期稳定化、膨大固体制剂或增强最终剂型中的活性成分,例如促进吸收、降低粘度或提高溶解度。赋形剂也可用于制造过程,以帮助处理活性物质问题,例如通过促进粉末流动性或不粘特性,此外还有助于体外稳定性,例如防止在预期保质期内变性或聚集。如本领域已知的,合适赋形剂的选择还取决于施用途径和剂型,以及活性成分和其他因素,并且不容易预测赋形剂中的哪一种优于另一种。
[0295]
在一些实施方式中,可食用组合物可包含选自蛋白质、纤维、淀粉、纤维素、脂质、糊精、多酚化合物或其组合的组分。
[0296]
还可以在加工过程中的任何时间,例如提取前、提取期间、提取后、干燥期间、干燥后,或包装后,通过封装(例如喷雾干燥、涂覆、挤出、凝聚和分子包合)来保护提取物的完整性。一些实施方式利用微囊化。关于封装,例如通过乳液的分子、界面、胶体和本体物理化学
性质获得封装层。包裹降低了核对外部环境(例如氧气和水)的反应性。这允许在常规包装应用中延长产品的保质期。在一些实施方式中,封装可用于内部材料或核的受控释放。包裹的粉碎产品在与水直接接触之前可以保持惰性。然后水可以溶解包裹物并且活性成分能够与水反应。
[0297]
在一些实施方式中,提取物的封装可用于优化产品功能、粒度和/或产生产品新形式。可以用一种或多种产品进行封装,包括:例如,碳水化合物、豆制品、乳制品、玉米糖浆、凝胶、聚合物、蜡、脂肪、植物油、阿拉伯树胶、卵磷脂、蔗糖酯、单双甘油酯、果胶、碳酸钾、碳酸氢钾、碳酸钠、na3po4、k3po4、麦芽糖糊精、甘油、苏糖醇、赤藓糖醇、木糖醇、阿糖醇、核糖醇、山梨糖醇、甘露糖醇、麦芽糖醇、麦芽三糖醇、麦芽四糖醇、乳糖醇、氢化异麦芽酮糖、氢化淀粉、脂质体、溶胶-凝胶中的脂质体、虫胶、水解的脂肪、乙基纤维素、羟丙基甲基纤维素、淀粉、改性淀粉、海藻酸盐和海藻酸(例如海藻酸钠)、酪蛋白钙、果胶酸钙、羧基纤维素、角叉菜胶、醋酸邻苯二甲酸纤维素、醋酸偏苯三酸纤维素、壳聚糖、玉米糖浆固体、糊精、脂肪酸、脂肪醇、明胶、结冷胶、羟基纤维素、羟乙基纤维素、羟甲基纤维素、羟基丙基纤维素、羟丙基乙基纤维素、羟丙基甲基纤维素、羟丙基甲基纤维素邻苯二甲酸酯、脂质、脂质体、低密度聚乙烯、甘油单酯、甘油二酯和甘油三酯、果胶、磷脂、聚乙二醇、聚乳酸聚合物、聚乳酸共乙醇酸聚合物、聚乙烯吡咯烷酮、硬脂酸及其衍生物、黄多糖和蛋白质、玉米胶蛋白、麸质或用于保护免受环境因素影响的其他试剂。
[0298]
例如,可以使用海藻酸钠封装提取物。在一些实施方式中,将提取物封装为球形颗粒。可以使用微囊化方法封装提取物。例如,可以使用电喷雾法(图10)。其他方法可以包括离心挤出、振动摩擦(vibrational nuzzling)、喷雾干燥、离子凝胶化、凝聚相分离、界面缩聚、界面交联、原位聚合和基质聚合。
[0299]
微囊化是微小的颗粒或液滴被涂层包围以形成小胶囊的过程。它可用于在微米尺度上掺入食品成分、酶、细胞或其他材料。微囊化还可用于将固体、液体或气体包封在由硬的或软的可溶性薄膜制成的测微壁内,以减少给药频率并防止药物降解。在相对简单的形式中,微胶囊可以是小球体,小球体周围有均匀的壁。微胶囊内部的材料称为核、内相或填充物,而壁有时称为壳、涂层或膜。一些材料,如脂质和聚合物,例如海藻酸盐,可用作混合物以将感兴趣的材料捕获在内部。大多数微胶囊具有直径在几微米到几毫米之间的孔。
[0300]
在另一个实施方式中,使用乙基纤维素、聚乙烯醇、明胶或海藻酸钠封装提取物。
[0301]
球形颗粒的直径可为约100μm至约1000μm,或直径为约100μm至约800μm,或直径为约100μm至约600μm,或直径为约100μm至约500μm,或直径为约100μm至约300μm。在一些实施方式中,颗粒的直径可为约200μm。
[0302]
在一些实施方式中,封装效率为约60%至约80%。封装效率是成功包埋在胶束或纳米颗粒中的实体的百分比。封装效率(ee%)是这样计算的:(添加的总实体-游离的非包埋实体)除以添加的总实体。在其他实施方式中,ee%为约65%、约70%、约75%或约80%。
[0303]
在一些实施方式中,可食用组合物作为胶囊提供。在其他实施方式中,可食用组合物作为片剂或小袋提供。每个胶囊、片剂或小袋可含有预定量的活性成分;作为粉末或颗粒;作为在水性或非水性液体中的溶液或悬浮液;或作为水包油液体乳液或油包水液体乳液。活性成分也可以丸剂、冲剂或糊剂的形式存在。
[0304]
有利地,本发明人已经发现,为了使可食用组合物或提取物的体重减轻或体重管
理功能最大化,树脂糖苷应仅当其在肠道中时释放,因为脂质在该位置被吸收到体内。因此,具有防止树脂糖苷释放和防止树脂糖苷在胃酸存在下降解的“屏障”可以使可食用组合物更有效。
[0305]
提取物和可食用组合物的一些优点如下:
[0306][0307][0308]
可食用组合物或提取物可用于体重减轻或体重管理。在这点上,有需要的对象不必患有与过多体脂有关的疾病或病症。例如,有需要的对象不必是肥胖的。例如,有需要的对象可以在可接受的体质指数(bmi)范围内。
[0309]
本发明还公开了一种药物组合物,该药物组合物包含可选地与药学上可接受的载体、赋形剂或稀释剂组合的如本文公开的来自选自旋花科的植物的树脂糖苷或其药学上可接受的盐、溶剂化物或异构体。
[0310]
载体、赋形剂或稀释剂必须是药学上“可接受的”,即与组合物的其他成分相容并且对患者无害。组合物可以方便地以单位剂型存在并且可以通过药学领域中公知的任何方法来制备。这种方法包括使活性成分与构成一种或多种辅助成分的载体结合的步骤。通常,通过使活性成分与液体载体或细碎的固体载体或两者均匀且紧密地结合,然后如果需要的话使产品成形来制备组合物。
[0311]
应当理解,除了上述特别提到的活性成分之外,本发明的组合物或组合可以包括本领域中关于所讨论的组合物或组合的类型的其他常规制剂,例如适合口服使用的那些制剂可以包括诸如粘合剂、甜味剂、增稠剂、调味剂、崩解剂、涂层剂、防腐剂、润滑剂和/或延时剂等其他试剂。合适的甜味剂包括蔗糖、乳糖、葡萄糖、阿斯巴甜或糖精。合适的崩解剂包括玉米淀粉、甲基纤维素、聚乙烯吡咯烷酮、黄原胶、膨润土、海藻酸或琼脂。合适的调味剂包括薄荷油、冬青油、樱桃、橙子或覆盆子调味剂。合适的涂层剂包括丙烯酸和/或甲基丙烯酸和/或它们的酯的聚合物或共聚物、蜡、脂肪醇、玉米胶蛋白、虫胶或麸质。合适的防腐剂包括苯甲酸钠、维生素e、α-生育酚、抗坏血酸、对羟基苯甲酸甲酯、对羟基苯甲酸丙酯或亚硫酸氢钠。合适的润滑剂包括硬脂酸镁、硬脂酸、油酸钠、氯化钠或滑石。合适的延时剂包括单硬脂酸甘油酯或二硬脂酸甘油酯。
[0312]
本发明还公开了一种治疗有需要的对象的与过多体脂相关的疾病或病症的方法,包括施用如本文所公开的来自选自旋花科的植物的至少一种树脂糖苷。
[0313]
在一些实施方式中,治疗有需要的对象的与过多体脂相关的疾病或病症的方法包
括施用式(i)的树脂糖苷。
[0314]
在一些实施方式中,治疗有需要的对象的与过多体脂相关的疾病或病症的方法包括施用式(ii)的树脂糖苷。
[0315]
在一些实施方式中,治疗有需要的对象的与过多体脂相关的疾病或病症的方法包括施用式(iii)的树脂糖苷。
[0316]
在一些实施方式中,治疗有需要的对象的与过多体脂相关的疾病或病症的方法包括施用式(iv)的树脂糖苷。
[0317]
在一些实施方式中,治疗有需要的对象的与过多体脂相关的疾病或病症的方法包括施用式(v)的树脂糖苷。
[0318]
在一些实施方式中,治疗有需要的对象的与过多体脂相关的疾病或病症的方法包括施用式(vi)的树脂糖苷。
[0319]
在一些实施方式中,治疗有需要的对象的与过多体脂相关的疾病或病症的方法包括施用式(vii)的树脂糖苷。
[0320]
如本文所用,治疗与过多体脂相关的疾病或病症的方法还包括预防过多体脂积累的方法。
[0321]
在一些实施方式中,所述疾病或病症是肥胖。肥胖是一种复杂的疾病,其涉及体脂肪的量过多。这是会增加你患其他疾病和健康问题例如心脏病、糖尿病、高血压和某些癌症的风险的医学问题。例如,当对象的体质指数(bmi)为30或更高时,可以诊断为肥胖。确定体质指数是将体重(公斤)除以身高(米)的平方。在这点上,在一些实施方式中,治疗肥胖的方法包括治疗bmi值大于30的对象。
[0322]
所述疾病或病症可以是超重。超重通常是由于额外的体脂。bmi为25-29.9的人被认为是超重。
[0323]
在一些实施方式中,所述疾病或病症是bmi超过25。
[0324]
在一些实施方式中,所述疾病或病症是代谢综合征。在其他实施方式中,代谢综合征与肥胖有关,并且包括但不限于胰岛素抵抗、血脂异常和人c反应蛋白(crp)水平升高。其他代谢综合征可以是高血压、中风、心脏病、糖尿病、外周血管疾病、心脏肥大和充血性心力衰竭。
[0325]
在其他实施方式中,治疗与过多体脂相关的疾病或病症的方法是用于体重减轻的方法或用于体重控制的方法。
[0326]
本发明还公开了提取物用于治疗有需要的对象的与过多体脂相关的疾病或病症的用途,该提取物包含如本文所公开的来自选自旋花科的植物的树脂糖苷。
[0327]
在一些实施方式中,所述用途是式(i)的树脂糖苷用于治疗有需要的对象的与过多体脂相关的疾病或病症的用途。
[0328]
在一些实施方式中,所述用途是式(ii)的树脂糖苷用于治疗有需要的对象的与过多体脂相关的疾病或病症的用途。
[0329]
在一些实施方式中,所述用途是式(iii)的树脂糖苷用于治疗有需要的对象的与过多体脂相关的疾病或病症的用途。
[0330]
在一些实施方式中,所述用途是式(iv)的树脂糖苷用于治疗有需要的对象的与过多体脂相关的疾病或病症的用途。
[0331]
在一些实施方式中,所述用途是式(v)的树脂糖苷用于治疗有需要的对象的与过多体脂相关的疾病或病症的用途。
[0332]
在一些实施方式中,所述用途是式(vi)的树脂糖苷用于治疗有需要的对象的与过多体脂相关的疾病或病症的用途。
[0333]
在一些实施方式中,所述用途是式(vii)的树脂糖苷用于治疗有需要的对象的与过多体脂相关的疾病或病症的用途。
[0334]
本发明还公开了提取物在制备用于治疗与过多体脂相关的疾病或病症的药物中的用途,该提取物包含如本文所公开的来自选自旋花科的植物的树脂糖苷。
[0335]
在一些实施方式中,所述用途是式(i)的树脂糖苷在制备用于治疗与过多体脂相关的疾病或病症的药物中的用途。
[0336]
在一些实施方式中,所述用途是式(ii)的树脂糖苷在制备用于治疗与过多体脂相关的疾病或病症的药物中的用途。
[0337]
在一些实施方式中,所述用途是式(iii)的树脂糖苷在制备用于治疗与过多体脂相关的疾病或病症的药物中的用途。
[0338]
在一些实施方式中,所述用途是式(iv)的树脂糖苷在制备用于治疗与过多体脂相关的疾病或病症的药物中的用途。
[0339]
在一些实施方式中,所述用途是式(v)的树脂糖苷在制备用于治疗与过多体脂相关的疾病或病症的药物中的用途。
[0340]
在一些实施方式中,所述用途是式(vi)的树脂糖苷在制备用于治疗与过多体脂相关的疾病或病症的药物中的用途。
[0341]
在一些实施方式中,所述用途是式(vii)的树脂糖苷在制备用于治疗与过多体脂相关的疾病或病症的药物中的用途。
[0342]
实施例
[0343]
一般实验程序。在酶标仪(synergy ht,biotek instruments inc.,美国佛蒙特州威努斯基)中在410nm处测量96孔微孔板(corning,透明聚苯乙烯)上的吸光度数据。使用硅胶(40-63μm,德国默克)进行柱色谱(cc)。用于hplc分析的仪器由配备有waters 2996pda(uv/vis)检测器和反相c
18
柱(phenomenex,5微米,4.6
×
250mm)的waters(millipore corp.,waters chromatography division,milford,ma)alliance 2695分离组件组成。ms谱图是使用配备有电喷雾电离(esi)源的finnigan/mat lcq离子阱质谱仪(san jose,美国加利福尼亚州)采集。使用配备有dionex ultimate 3000rs lc系统(bannockburn,美国伊利诺伊州)的bruker amazon离子阱质谱仪(billerica,美国马塞诸塞州)获得lc-esi/ms2。用bruker av500光谱仪(karlsruhe,德国)在500mhz下记录1h nmr光谱。通过配备真空泵(r-100,v-100,i-100,瑞士)的旋转蒸发仪除去溶剂。除用于hplc分析的那些溶剂为光谱级外,所有溶剂均为分析级。
[0344]
植物材料。甘薯(i.batatas)的块茎(400g)在当地市场购买,而甘薯的叶子(2.1kg)则从新加坡当地农场购买。甘薯的叶子(2.092kg)(马来西亚巴刹(pasar))是从杂货店(公允价格)购买的。块茎和叶子用去离子水洗涤并储存在冰箱(-18℃)中用于进一步测试。
[0345]
提取和分级(步骤a和b)。用混合器在加入乙醇(1.5l)的情况下使块茎(400g)均质
化,然后通过在室温(23℃)下浸渍24小时进行提取。通过布氏漏斗(150ml,欣维尔,中国北京)过滤提取物,并用旋转蒸发仪浓缩至30ml。浓缩的提取物用25ml乙酸乙酯萃取3次,收集上层,合并,用旋转蒸发仪干燥,得到深棕色糖浆(1.7g)。
[0346]
通过硅胶柱色谱进一步纯化糖浆。在具有20g硅胶的柱上,装载1.0g干燥样品,并使用己烷-乙酸乙酯(1:1)至纯乙酸乙酯的梯度进行洗脱。然后用100ml纯甲醇洗脱,以洗掉柱上的残留化合物。通过薄层色谱监测,共收集了5个级分(f1至f5),并检测每个级分的pl抑制活性。将用甲醇洗脱的级分f5在硅胶柱上用dcm-meoh(7:1)至纯meoh的梯度进一步纯化。总共收集了5个级分(f5.1至f5.5)并测试了活性。通过制备薄层色谱法(ptlc)进行进一步纯化级分f5.1,显影剂为dcm-meoh(7:1)。共收集5个级分(f5.1.1至f5.1.5)并测试活性。将级分f5.1.2和f5.1.3合并(f5.1.23,216mg)并储存在冰箱(-18℃)中直到测试其pl抑制活性。
[0347]
用搅拌机使甘薯的叶子(9.2kg)均质化,然后在室温(23℃)下用二氯甲烷(20l)浸透24小时。然后将提取物通过布氏漏斗(150ml,欣维尔,中国北京)进行过滤并使用旋转蒸发仪浓缩以获得深绿色糖浆(25.5g)。然后用甲醇(1.275l)提取深绿色糖浆,收集上清液并使用旋转蒸发仪干燥,得到干燥提取物(20.6g)。随后将该干燥提取物溶解在甲醇中并在比例为1:1:0.05(v/v/v)的己烷:甲醇:水之间分配。然后浓缩下层,得到棕色残余物(12.7g)。
[0348]
使用硅胶柱色谱进一步纯化棕色残余物(9g)。在具有60g硅胶的色谱柱上,加载了总共3g样品,并使用己烷和乙酸乙酯(5:1)、(1:1)、(0:1)的梯度进行洗脱。然后用300ml纯甲醇洗脱,以洗掉柱上的残留化合物。总共获得了4种不同的级分(cc1至cc4),并且测试了每个级分的pl抑制活性。
[0349]
在加入二氯甲烷(4l)的情况下,在室温(23℃)下用搅拌机使甘薯的叶子(2.092kg)均质化24小时。然后将提取物通过布氏漏斗(150ml,欣维尔,中国北京)进行过滤并使用旋转蒸发仪浓缩以获得深绿色糖浆(2.95g)。将该提取物(2.95g,200mg/ml)溶解在甲醇中,并用己烷和乙酸乙酯梯度(5:1,1:1,0:1)使用硅胶柱色谱纯化。然后使用纯甲醇洗脱所有残留化合物。
[0350]
基于生物测定的胰脂肪酶(pl)抑制剂分离(步骤c)。hplc分析在分析型反相c
18
柱(phenomenex,5μm,4.6
×
250mm)上进行,流速1.0ml/min,进样10μl(50mg/ml),柱温30℃。pda检测器设置为扫描190nm至400nm,分辨率为1.2nm,在210nm和280nm处监测峰。使用该方案洗脱f5.1.23和cc1至cc4。梯度洗脱是从meoh-h2o(90:10)到meoh-h2o(100:0),每分钟收集一次级分。测试每个级分的pl抑制活性。lc-esi/ms以相同的洗脱进行,并识别了uv光谱中的每个峰。然后以相同的洗脱模式进行半制备型hplc分离,流速为4.71ml/min。用纯ch3cn等度洗脱进一步纯化红薯块茎的级分3(f5.1.23.3)和级分4(f5.1.23.4),得到batatoside i(1.1mg)、batatoside ii(0.9mg)、batatoside iii(0.8mg)和pescaprein xxvii(0.7mg)。类似地,用acn:meoh(80:20)等度洗脱进一步纯化级分8(f5.1.23.8)和级分10(f5.1.23.10),分别得到batatoside f(5.15mg)和batatoside h(1.62mg)。
[0351]
类似地,该过程也可以应用于空心菜,从而表征来自硅胶柱色谱的甲醇级分中的一系列树脂糖苷。
[0352]
胰脂肪酶活性测定准备。胰脂肪酶活性测定使用4-硝基苯基棕榈酸酯(pnpp)作为比色脂肪酶底物。胰脂肪酶(来自猪胰腺,ii型,100-500单位/mg,l3126)、脱氧胆酸钠
(d6750)、4-硝基苯基棕榈酸酯(n2752)和奥利司他(phr1445)从sigma-aldrich(美国密苏里州圣路易斯)得到。tris-硼酸盐-edta缓冲液(10x,ph8.3,pb 1040)购自vivantis technologies(马来西亚雪兰莪州)。
[0353]
通过将10x tris-硼酸盐-edta缓冲液(890mm)稀释成50mm溶液,然后加入0.35%(m/v)脱氧胆酸钠,并将ph调节至8.3来制备缓冲溶液。通过将pnpp添加到异丙醇中制成1.5mg/ml溶液来制备pnpp溶液。两种溶液均储存在冰箱(4℃)中用于进一步测试。通过将pl悬浮在4℃缓冲溶液(10mg/ml)中,涡旋混合器振荡2min,并在4℃下以6000rpm离心5min来制备pl溶液。将上清液分成若干个0.5ml等分试样置于0.6ml的pp离心管中,并储存在冰箱(-18℃)中用于进一步测试。
[0354]
高通量胰腺脂肪酶活性测定。对于每个样品,将20μl提取物转移到0.6ml pp离心管中,室温干燥10分钟,然后添加300μl缓冲溶液。在水浴超声仪中对混合物进行充分超声,将150μl样品转移到96孔微孔板(corning,透明聚苯乙烯,美国)中,并在酶标仪(synergy ht,biotek instruments inc.,美国佛蒙特州威努斯基)中在37℃下孵育15分钟。同时,将冷冻的脂肪酶溶液在室温下解冻,将10μl解冻的脂肪酶溶液添加到孔中,在37℃再孵育10分钟。最后,通过在每个孔中添加10μl pnpp溶液启动反应。读数波长固定在410nm,每次读数前摇动3s,以20或60秒的读数间隔获得1小时动力学数据。在第一步中加入20μl纯溶剂代替提取物制备阴性对照组(空白)。
[0355]
前3分钟读数的趋势被视为线性增长,斜率通过excel(office 2016,microsoft,美国)中的线性回归计算。每个样品的抑制活性通过方程式1以抑制百分比计算。
[0356]
抑制(%)=1
–
(斜率
样品
/斜率
对照
)
×
100%
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
(1)
[0357]
采用上述方法筛选了12个市售红薯块茎品种。用稀释5、10和20倍的粗提取物溶液测试对pl的抑制活性(表0)。
[0358]
表0.用5x、10x和20x稀释的提取物筛选12个红薯块茎品种的pl抑制
[0359][0360]
*a)越南紫色红薯(vietnam purple);b)印度尼西亚蜂蜜红薯(indonesia honey);c)日本坎塔红薯(japan kanta);d)印度尼西亚橙色红薯(indonesia orange);e)韩国南瓜红薯(korea pumpkin);f)越南日本红薯(vietnam japanese);g)日本silk/hakura红薯(japan silk/hakura);h)印度尼西亚蜂蜜红薯(indonesia honey);i)美国卡温顿红薯(america covington);j)澳大利亚黄金红薯(australia gold);k)印度尼西亚紫色红薯(indonesia purple);l)印度尼西亚红色红薯(indonesia red);
[0361]
从植物中提取的树脂糖苷的封装
[0362]
通常,根据图10通过电喷雾法进行封装。将粗提物分散到0.5%(w/v)的海藻酸钠水溶液中,使最终浓度为1mg/ml。将提取物溶液装入与针头连接的50ml注射器中。将注射器置于注射泵上以提供2.0ml/min的稳定流。高压电源提供6.0kv电压,阳极连接到注射器针
头,阴极连接到环形电极。通过0.1mol/l氯化钙溶液将雾滴收集在烧杯中,并在溶液中保持30分钟并不断搅拌。如图11所示,封装颗粒的平均直径约为200μm。封装效率(初始溶液中的提取物的量/胶囊中的提取物的量)为74%。
[0363]
研究了从蔬菜及其封装形式中提取的脂肪酶抑制剂的ph响应释放。提取物的溶液形式和封装形式均在37℃下在ph3的模拟胃液中孵育4小时,然后在ph7的模拟肠液中孵育2小时。提取物终浓度为15μg/ml时,溶液形式的抑制率从34%下降到14%,而封装形式的抑制率从37%下降到34%。封装过程保护提取物免受胃相中酸性条件的影响。
[0364]
对照pl抑制测定(pnpp作为底物)。对硝基苯棕榈酸酯(pnpp)是一种广泛用于pl抑制测定的合成化学探针。长链脂肪酸(棕榈酸)和色度指示剂(对硝基苯酚)通过酯键连接,分子作为pl的底物。pnpp分子在缓冲溶液中被pl水解并释放指示剂,呈淡黄色。pl活性由颜色增益随时间变化的速度表示,颜色可以通过使用光谱仪测量在410nm处的光密度来测量。图1a示出了使用奥利司他(市售的脂肪酶抑制剂药物)作为抑制剂通过pnpp进行的pl抑制测定的代表性图。根据michaelis-menten方程,pl活性可以用反应的初始速率来表示。在本研究中,曲线的初始斜率可以被认为是初始反应速率,并且在大多数情况下,前5分钟的数据可以被认为是线性的(r2>0.999)。通过方程式1计算百分比抑制,并根据在不同抑制剂浓度下的pl抑制绘制剂量反应曲线(图1b)。拟合合适的模型,可以通过将50%代入拟合公式来计算ic
50
。
[0365]
基于生物测定的红薯块茎中pl抑制剂分级。红薯的乙醇提取物显示出ic
50
为33μg/ml的脂肪酶抑制。再用硅胶柱色谱和ptlc进行两轮分级(纯化),然后进行抑制活性测试,该测试表明f5、f5.1和f5.1.23具有显著的pl抑制作用。
[0366]
红薯块茎中pl抑制剂的hplc分离与鉴定。通过两轮hplc分离进一步分离活性级分f5.1.23,第一轮使用meoh-h2o洗脱来粗略分级每个峰,第二轮使用ch3cn逐个峰洗脱以分离纯化合物(步骤c)。第一轮hplc分析的色谱图如图2所示,与橙色线的相对脂肪酶活性重叠。活性化合物主要集中在保留时间10-15和20-24分钟处。第一轮hplc分离的级分3和4(保留时间13.5-15.0min,合并为f5.1.23.34)使用纯ch3cn洗脱通过hplc进一步纯化,收集到4个峰(p1至p4),对4个峰表征,并测试脂肪酶抑制活性(图3,表1)。此外,级分8(保留时间21.0-21.5min)和10(保留时间23.0-24.0)均通过hplc使用acn:meoh(80:20)等度洗脱进一步纯化。在hplc分离过程中,从级分8中分离出2种树脂糖苷(图4,表2),从级分10中分离出1种树脂糖苷(图5,表2)并分别测试脂肪酶抑制活性。
[0367]
基于1.1016g粗提物,可得到188.2mg级分8,然后是45.5mg级分5和30.1mg级分10。从级分5中提取的batatoside i、batatoside ii、batatoside iii和prescaprein xxvii的产率分别为约16.5、7.87、11.9、7.11%(w/w)。另一方面,从级分8中可以获得16.1%(w/w)的batatoside f。从级分10中获可以得22.4%(w/w)的batatoside h。因此,相同量的粗提物中可以得到最高浓度的树脂糖苷batatoside f(30mg),其次是batatoside h(6.7mg)、batatoside i(7.5mg)、batatoside iii(5.4mg)、batatoside ii(3.6mg)和prescaprein xxvii(3.2mg)。
[0368]
表1.在级分f5.1.23.34中观察到树脂糖苷的质量、可能的结构和脂肪酶抑制活性。
[0369][0370]
表2.在级分8和级分10中观察到的树脂糖苷的质量、可能的结构和脂肪酶抑制活性。
[0371][0372][0373]
红薯块茎中树脂糖苷的pl抑制活性。经过两轮hplc分离和纯化,总共收集到batatoside i(1.1mg)、batatoside ii(0.9mg)、batatoside iii(0.8mg)、pescaprein xxvii(0.7mg)、batatoside f(5.15mg)和batatoside h(1.62mg)。测试了这些树脂糖苷以
及与作为阳性对照的奥利司他的pl抑制效力(表1),树脂糖苷和奥利司他的ic
50
分别为4.9至10.6μm以及64.4nm。
[0374]
红薯叶的pl抑制试验。红薯叶的dcm提取物显示出ic
50
为90.9
±
20.2μg/ml的脂肪酶抑制作用。用甲醇进一步分级获得了为59.5
±
27.5μg/ml的较低的ic
50
。用1:1:0.05(v/v/v)的己烷:甲醇:去离子水进行液-液分级,得到47.4
±
2.0μg/ml的ic
50
。用硅胶色谱进一步分级得到四个级分cc1至cc4,并且cc4显示出最高的抑制活性,ic
50
=33.9
±
3.9μg/ml(图6)。
[0375]
红薯叶中pl抑制剂的hplc分离与鉴定。通过使用meoh-h2o洗脱用hplc分离对活性级分cc4进一步分离以对每个峰分级。hplc分析的色谱图如图7所示,与红色线的相对脂肪酶活性重叠。活性化合物主要集中在保留时间11-30和40-55分钟处。为了鉴定cc4中的化合物,使用相同的洗脱方案应用lc-esi/ms2分析,并提出了一系列树脂糖苷(表3)。将来自第一轮分离的级分14(保留时间55.0至60.0min)进一步纯化,收集级分14.1并进行表征(图8,表4)。
[0376]
表3.红薯叶的cc4中的树脂糖苷的观察到的质量和提出的结构
[0377][0378]
[0379][0380][0381]
*mba:2-甲基丁酰基,dodeca:正十二酰基,octa:正辛酰基,deca:正癸酰基,cna:肉桂酰基,rha:吡喃鼠李糖基,glu:吡喃葡萄糖基;iba:异丁酰基,ace:乙酰基
[0382]
表4.红薯叶的级分14中的树脂糖苷的观察到的质量和提出的结构
[0383][0384][0385]
红薯叶中的化合物的表征。具有高脂肪酶抑制活性的cc4的lc-esi/ms2分析揭示了红薯叶中的一系列树脂糖苷化合物。总的来说,红薯叶中的树脂糖苷的主要结构是一种五糖,其含有一个葡萄糖、一个岩藻糖和三个鼠李糖,它们分别与不同类型的脂肪酸(辛酸(羊脂酸)、癸酸(羊蜡酸)、十二酸(月桂酸)和反式-肉桂酸)相连。经过两轮hplc分离和表征过程后,从红薯叶的级分14中获得了一种新的树脂糖苷。这种新化合物的pl抑制活性为138.1
±
35.7μm。
[0386]
空心菜中脂肪酶抑制活性的筛选。植物材料包括空心菜的种子、不同栽培时间(2天、3天)的空心菜全株、不同栽培时间(5天、8天)的空心菜的叶和茎。将样品冻干并储存在冰箱中用于进一步使用。用搅拌机使样品均质化,然后在室温(23℃)下用二氯甲烷浸透24小时。然后通过布氏漏斗过滤提取物。通过旋转蒸发仪除去溶剂并获得粗提物。评估浓度为0.1mg/ml的样品的脂肪酶抑制活性。如图9所示,所有提取物均具有脂肪酶抑制作用。发芽的空心菜的提取物比种子的提取物更有效。此外,没有发现培养时间与脂肪酶抑制作用之间存在相关性。
[0387]
来自巴刹的空心菜的pl抑制试验。来自巴刹的空心菜的dcm提取物显示出ic
50
为652.80μg/ml的脂肪酶抑制作用。用甲醇进一步分级获得了为113.81μg/ml的较低的ic
50
。甲醇萃取后,进行硅胶色谱,甲醇级分获得了增加的胰脂肪酶抑制作用,ic
50
值为59.38μg/ml。
[0388]
空心菜中pl抑制剂的hplc-esi-ms/ms鉴定。通过使用meoh-h2o洗脱用hplc分离对活性甲醇级分进一步分离以分级每个峰。峰在18分钟至30分钟之间洗脱。使用相同的洗脱方案应用lc-esi/ms2分析,并提出了一系列树脂糖苷(表5)。
[0389]
表5.空心菜中的树脂糖苷的观察到的质量和提出的结构
[0390][0391]
[0392]
[0393][0394]
*mba:2-甲基丁酰基,dodeca:正十二酰基,octa:正辛酰基,deca:正癸酰基,cna:肉桂酰基,rha:吡喃鼠李糖基,glu:吡喃葡萄糖基;iba:异丁酰基
[0395]
应当理解,所描述的实施方式的各个方面的许多进一步的修改和排列是可能的。因此,所描述的方面旨在涵盖落入所附权利要求的精神和范围内的所有这样的改变、修改和变化。
[0396]
在通篇说明书以及权利要求中,除非上下文另有要求,否则词语“包含”及变形例如“包括”和“含有”将被理解为暗示包括所称的整体或步骤、或整体或步骤的组,但不排除任何其他整体或步骤、或整体或步骤的组。
[0397]
本说明书中对任何先前出版物(或从其衍生的信息)或任何已知事项的引用不是、也不应被视为承认或允许或以任何形式暗示该先前出版物(或从其衍生的信息)或已知事项构成本说明书所涉及的目标领域中的公知常识的一部分。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1