用于治疗认知障碍的KV3增强剂的制作方法
disord.18,135-138(2016)和adhd(lesch,k.-p.等人,molecular genetics of adult adhd:converging evidence from genome-wide association and extended pedigree linkage studies.j.neural transm.115,1573-1585(2008))。
7.因此,调节kv3活性为用于治疗或预防与kv3相关联的疾病的有希望的策略,该疾病为例如神经发育障碍,如自闭症和脆性x综合征、癫痫、智力残疾和认知损害、共济失调、抑郁症、精神分裂症、注意力缺陷多动障碍和感觉加工障碍(例如,听觉感觉加工障碍)。
8.因此,本发明的一个目的为提供kv3.1/kv3.2增强剂,该增强剂可用于治疗或预防或改善kv3介导的疾病和障碍,该疾病和障碍为例如神经发育障碍,如自闭症和脆性x综合征、癫痫、智力残疾和认知损害、共济失调、抑郁症、精神分裂症、注意力缺陷多动障碍和感觉加工障碍(例如,听觉感觉加工障碍)。
技术实现要素:
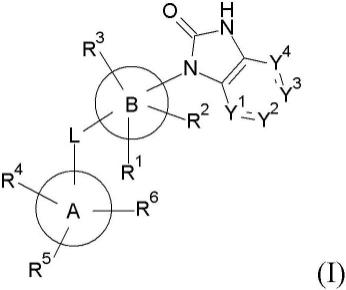
9.在第一方面,本发明提供式(i)化合物或其药用盐,
[0010][0011]
其中a、b、l、y1至y4和r1至r6如本文所述。
[0012]
在一个方面,本发明提供了一种制备本文所述的式(i)化合物的方法,其包括使式1的二胺
[0013][0014]
与偶联剂(诸如cdi或三光气)反应,以形成所述式(i)化合物。
[0015]
在另一方面,本发明提供了根据本文所述的方法制造的如本文所述的式(i)化合物。
[0016]
在另一方面,本发明提供了一种如本文所述的式(i)化合物,该化合物用作治疗活性物质。
[0017]
在另一方面,本发明提供了一种药物组合物,该药物组合物包含如本文所述的式(i)化合物和治疗惰性载体。
[0018]
在另一方面,本发明提供了如本文所述的式(i)化合物或其药用盐或包含所述式(i)化合物或其药用盐的药物组合物,其用于治疗或预防kv3介导的疾病和障碍。
具体实施方式
[0019]
定义
[0020]
结合本发明的特定方面、实施方案或实施例描述的特征、整数、特性、化合物、化学部分或基团应理解为适用于本文所述的任何其他方面、实施方案或实施例,除非与其不相容。本说明书(包括任何所附权利要求、摘要和附图)中所公开的所有特征和/或由此公开的任何方法或过程的所有步骤可以任何组合进行组合,除了这些特征和/或步骤中的至少一些互相排斥的组合之外。本发明不限于任何前述实施方案的细节。本发明扩展到本说明书(包括任何所附权利要求、摘要和附图)中所公开的特征的任何新颖特征或任何新颖组合,或者扩展到由此公开的任何方法或过程的步骤的任何新颖步骤或任何新颖组合。
[0021]
术语“烷基”是指含有1至12个碳原子的单价或多价(例如,单价或二价)直链或支链饱和烃基。在一些优选实施例中,烷基基团含有1至6个碳原子(“c
1-6-烷基”),例如1、2、3、4、5或6个碳原子。在其他实施例中,烷基基团含有1个至3个碳原子,例如1个、2个或3个碳原子。烷基的一些非限制性实例包括甲基、乙基、丙基、2-丙基(异丙基)、正丁基、异丁基、仲丁基、叔丁基和2,2-二甲基丙基。烷基的特别优选但非限制性实例是甲基。
[0022]
术语“烷氧基”是指经由氧原子附接到母体分子部分上的如前所定义的烷基基团。除非另外指明,否则烷氧基基团含有1至12个碳原子。在一些优选实施例中,烷氧基基团含有1至6个碳原子(“c
1-6-烷氧基”)。在其他实施例中,烷氧基基团含有1至4个碳原子。在其他实施例中,烷氧基基团含有1至3个碳原子。烷氧基基团的一些非限制性实例包括甲氧基、乙氧基、正丙氧基、异丙氧基、正丁氧基、异丁氧基和叔丁氧基。烷氧基的特别优选但非限制性实例是甲氧基。
[0023]
术语“卤素”或“卤代”是指氟(f)、氯(cl)、溴(br)或碘(i)。优选地,术语“卤素”或“卤代”是指氟(f)、氯(cl)或溴(br)。“卤素”或“卤代”的特别优选但非限制性实例是氟(f)和氯(cl)。
[0024]
如本文所用的术语“环烷基”是指3个至10个环碳原子(“c
3-c
10-环烷基”)的饱和或部分不饱和单环或多环烃基。在一些优选实施例中,环烷基基团为具有3个至8个环碳原子的饱和或部分不饱和单环烃基。在一些优选实施例中,环烷基基团为具有3个至8个环碳原子的饱和或部分不饱和双环烃基。“双环烃基”是指由具有两个共同碳原子的两个饱和或部分不饱和碳环组成的环烷基部分(即分离两个环的桥为单键或一个或两个环原子的链)以及螺环部分(即两个环经由一个共同环原子连接)。在一些实施例中,“多环烃”是指c
3-c
10-多环桥联单元,诸如立方烷或双环[1.1.1]戊烷。在一些实施例中,环烷基基团为具有3个至6个环碳原子(例如3个、4个、5个或6个碳原子)的饱和单环烃基。环烷基的一些非限制性实例包括环丙基、环丁基、环戊基、环己基、环庚基和双环[1.1.1]戊烷。环烷基的特别优选实例是环丙基。环烷基的另一个特别优选的实例为双环[1.1.1]戊烷。
[0025]
如本文所用,术语“杂环基”和“杂环烷基”在本文中可互换使用,并且是指具有3个至10个环原子、优选3个至8个环原子的饱和或部分不饱和的单环或双环、优选单环环体系,其中所述环原子中的1个、2个或3个环原子为选自n、o和s的杂原子,其余环原子为碳。优选地,所述环原子中的1至2个选自n和o,其余环原子是碳。“双环杂环基”是指由具有两个共同环原子的两个环组成的杂环部分(即分离两个环的桥是单键或一个或两个环原子的链)以及螺环部分(即两个环经由一个共同环原子连接)。单环杂环基基团的一些非限制性实例包
括氮杂环丁烷-3-基、氮杂环丁烷-2-基、氧杂环丁烷-3-基、氧杂环丁烷-2-基、1-哌啶基、2-哌啶基、3-哌啶基、4-哌啶基、2-氧代吡咯烷-1-基、2-氧代吡咯烷-3-基、5-氧代吡咯烷-2-基、5-氧代吡咯烷-3-基、2-氧代-1-哌啶基、2-氧代-3-哌啶基、2-氧代-4-哌啶基、6-氧代-2-哌啶基、6-氧代-3-哌啶基、吗啉基、吗啉-2-基和吗啉-3-基。双环杂环基基团的一些非限制性实例包括5-氧杂螺[2.4]庚-6-烯和5-噻螺[2.4]庚-6-烯。
[0026]
术语“芳基”是指具有总共6个至14个环成员(“c
6-c
14-芳基”)、优选6个至12个环成员并且更优选6个至10个环成员的单环、双环或三环碳环环体系,并且其中该体系中的至少一个环为芳族的。芳基的一些非限制性实例包括苯基和9h-芴基(例如,9h-芴-9-基)。芳基的特别优选但非限制性实例是苯基。
[0027]
术语“杂芳基”是指单价或多价单环或双环环体系,其总共具有5至14个环成员,优选地具有5至12个环成员,并且更优选地具有5至10个环成员,其中该体系中的至少一个环为芳香环,并且该体系中的至少一个环含有一个或多个杂原子。优选地,“杂芳基”是指包含1个、2个、3个或4个独立地选自o、s和n的杂原子的5元至10元杂芳基。最优选地,“杂芳基”是指包含1个至2个独立地选自o、s和n的杂原子的5元至10元杂芳基。杂芳基的优选但非限制性的实例包括吡啶基。
[0028]
术语“羟基”是指-oh基团。
[0029]
术语“氰基”是指-cn(丁腈)基团。
[0030]
术语“卤代烷基”是指其中烷基基团的至少一个氢原子已被卤素原子、优选氟代替的烷基基团。优选地,“卤代烷基”是指其中烷基基团的1、2或3个氢原子已被卤素原子、最优选氟代替的烷基基团。卤代烷基的特别优选但非限制性的实例为三氟甲基(cf3)和三氟乙基(例如2,2,2-三氟乙基)。
[0031]
术语“羟基烷基”是指其中烷基基团的至少一个氢原子已被羟基基团代替的烷基基团。优选地,“羟基烷基”是指其中烷基基团的1个、2个或3个氢原子已被羟基基团取代的烷基基团。羟基烷基的特别优选但非限制性的实例为羟基甲基和羟基乙基。
[0032]
术语“烷氧基烷基”是指其中烷基基团的至少一个氢原子已被烷氧基基团代替的烷基基团。优选地,“烷氧基烷基”是指其中烷基基团的1个、2个或3个氢原子已被烷氧基基团取代的烷基基团。烷氧基烷基的特别优选但非限制性的实例为甲氧基甲基、乙氧基甲基、甲氧基乙基和乙氧基乙基。
[0033]
术语“卤代烷氧基”是指其中烷氧基基团的至少一个氢原子已被卤素原子、优选氟代替的烷氧基基团。优选地,“卤代烷氧基”是指其中烷氧基基团的1、2或3个氢原子已被卤素原子、最优选氟代替的烷氧基基团。卤代烷氧基的一个特别优选但非限制性的实例为三氟甲氧基(-ocf3)。
[0034]
术语“药用盐”是指保留游离碱或游离酸的生物效果和性质的那些盐,这些盐在生物学或其他方面不是不合需要的。这些盐用无机酸诸如盐酸、氢溴酸、硫酸、硝酸、磷酸等(特别是盐酸)和有机酸诸如乙酸、丙酸、乙醇酸、丙酮酸、草酸、马来酸、丙二酸、琥珀酸、富马酸、酒石酸、柠檬酸、苯甲酸、肉桂酸、扁桃酸、甲基磺酸、乙基磺酸、对甲苯磺酸、水杨酸、n-乙酰基半胱氨酸等形成。另外,这些盐可通过向游离酸中添加无机碱或有机碱来制备。衍生自无机碱的盐包括但不限于钠、钾、锂、铵、钙、镁盐等。衍生自有机碱的盐包括但不限于以下各项的盐:伯胺、仲胺和叔胺、取代胺(包括天然存在的取代胺)、环胺和碱性离子交换
树脂(诸如异丙胺、三甲胺、二乙胺、三乙胺、三丙胺、乙醇胺、赖氨酸、精氨酸、n-乙基哌啶、哌啶、聚亚胺树脂等)。式(i)化合物的特定药用盐为盐酸盐。
[0035]
式(i)的化合物可以含有若干不对称中心,并且可以以光学纯对映体、对映体的混合物(例如外消旋体)、光学纯非对映体、非对映体的混合物、非对映外消旋体或非对映外消旋体的混合物存在。在一个优选实施例中,根据本发明的式(i)化合物分别是如本文所述的式(ia)或(ib)的顺式对映异构体。
[0036]
根据cahn-ingold-prelog惯例,非对称碳原子可以是“r”或“s”构型。
[0037]
如本文所用的术语“治疗”包括:(1)抑制疾病的至少一种临床或亚临床症状的状态、病症或病情(例如,在维持治疗的情况下,阻止、减轻或延迟疾病的发展或其复发);和/或(2)缓解病情(即,使疾病的状态、病症或病情或者至少一种临床或亚临床症状消退)。对待治疗患者的益处在统计学上是显著的或者至少是患者或医师可察觉的。然而,应当理解,当向患者施用药物以治疗疾病时,结果可能并不总是有效的治疗。
[0038]
如本文所用的术语“防治”包括:预防或延迟状态、病症或病情的临床症状的出现,该状态、病症或病情在可能患有或易患该状态、病症或病情但尚未经历或显示该状态、病症或病情的临床或亚临床症状的哺乳动物中、尤其是在人类中发展。
[0039]
如本文所用的术语“哺乳动物”包括人类和非人类,并且包括但不限于人类、非人类灵长类动物、犬、猫、鼠、牛、马和猪。在特别优选的实施例中,术语“哺乳动物”是指人类。
[0040]
术语“神经发育障碍”是指一组影响神经系统发育,导致大脑功能异常,从而可能影响情绪、学习能力、自我控制和记忆的障碍。神经发育障碍的一些非限制性实例包括但不限于自闭症、脆性x综合征、癫痫、智力残疾、认知损害、共济失调、抑郁症、精神分裂症、注意力缺陷多动障碍和感觉加工障碍(例如,听觉感觉加工障碍)。
[0041]
本发明的化合物
[0042]
在第一方面(a1),本发明提供式(i)化合物
[0043][0044]
或其药用盐,
[0045]
其中:
[0046]
a和b各自独立地选自c
6-c
14-芳基、5元至14元杂芳基、c
3-c
10-环烷基和3元至14元杂环基;
[0047]
l选自-ch
2-、-o-、-nh-、-s-、-so-和-so
2-;
[0048]
y1、y2、y3和y4各自独立地选自ch、n、c-卤素、c-氰基、c-oh、c-c
1-c
6-烷基、c-卤代-c
1-c
6-烷基、c-羟基-c
1-c
6-烷基、c-c
1-c
6-烷氧基-c
1-c
6-烷基、c-c
1-c
6-烷氧基、c-卤代-c
1-c
6-烷氧基、c-s-c
1-c
6-烷基、c-so-c
1-c
6-烷基、c-so
2-c
1-c
6-烷基、c-c
3-c
10-环烷基和c-(3元
至14元杂环基);
[0049]
(i)r1、r2、r3、r4、r5和r6各自独立地选自氢、卤素、氰基、羟基、c
1-c
6-烷基、卤代-c
1-c
6-烷基、羟基-c
1-c
6-烷基、c
1-c
6-烷氧基-c
1-c
6-烷基、c
1-c
6-烷氧基、卤代-c
1-c
6-烷氧基、-s-c
1-c
6-烷基、-so-c
1-c
6-烷基、-so
2-c
1-c
6-烷基、c
3-c
10-环烷基和3元至14元杂环基;或者
[0050]
(ii)r1、r2、r3和r6各自独立地选自氢、卤素、氰基、羟基、c
1-c
6-烷基、卤代-c
1-c
6-烷基、羟基-c
1-c
6-烷基、c
1-c
6-烷氧基-c
1-c
6-烷基、c
1-c
6-烷氧基、卤代-c
1-c
6-烷氧基、-s-c
1-c
6-烷基、-so-c
1-c
6-烷基、-so
2-c
1-c
6-烷基、c
3-c
10-环烷基和3元至14元杂环基;并且
[0051]
r4和r5与它们所连接的原子一起形成3元至14元杂环或c
3-c
10-环烷基。
[0052]
在一个实施例中,本发明提供了式(i)化合物或其药用盐,其中:
[0053]
a选自c
6-c
14-芳基和5元至14元杂芳基;
[0054]
b选自c
6-c
14-芳基、5元至14元杂芳基和c
3-c
10-环烷基;
[0055]
l为-o-;
[0056]
y1、y2和y4各自独立地选自ch和n;
[0057]
y3选自ch、n、c-卤素、c-c
1-c
6-烷基和c-卤代-c
1-c
6-烷基;
[0058]
(i)r1、r2、r3、r4、r5和r6各自独立地选自氢、卤素、氰基、羟基、c
1-c
6-烷基、卤代-c
1-c
6-烷基、羟基-c
1-c
6-烷基、c
1-c
6-烷氧基-c
1-c
6-烷基、c
1-c
6-烷氧基、卤代-c
1-c
6-烷氧基、-s-c
1-c
6-烷基、-so-c
1-c
6-烷基、-so
2-c
1-c
6-烷基、c
3-c
10-环烷基和3元至14元杂环基;或者
[0059]
(ii)r1、r2、r3和r6各自独立地选自氢、卤素、氰基、羟基、c
1-c
6-烷基、卤代-c
1-c
6-烷基、羟基-c
1-c
6-烷基、c
1-c
6-烷氧基-c
1-c
6-烷基、c
1-c
6-烷氧基、卤代-c
1-c
6-烷氧基、-s-c
1-c
6-烷基、-so-c
1-c
6-烷基、-so
2-c
1-c
6-烷基、c
3-c
10-环烷基和3元至14元杂环基;并且
[0060]
r4和r5与它们所连接的原子一起形成3元至14元杂环或c
3-c
10-环烷基;
[0061]
前提是式(i)化合物不是3-(3-苯氧基苯基)-1h-咪唑并[4,5-b]吡啶-2-酮(cas rn 61963-14-2)或3-(4-苯氧基苯基)-1h-咪唑并[4,5-b]吡啶-2-酮(cas rn 61963-12-0)。
[0062]
在一个实施例中,本发明提供式(i)化合物或其药用盐,其中所述式(i)化合物不是3-(3-苯氧基苯基)-1h-咪唑并[4,5-b]吡啶-2-酮(cas rn 61963-14-2)或3-(4-苯氧基苯基)-1h-咪唑并[4,5-b]吡啶-2-酮(cas rn 61963-12-0)。
[0063]
在一个实施例中,本发明提供了式(i)化合物或其药用盐,其中a选自c
6-c
14-芳基和5元至14元杂芳基。
[0064]
在一个优选实施例中,本发明提供了式(i)化合物或其药用盐,其中a为c
6-c
14-芳基。
[0065]
在一个特别优选的实施例中,本发明提供了式(i)化合物或其药用盐,其中a为苯基。
[0066]
在另一个特别优选的实施例中,本发明提供了式(i)化合物或其药用盐,其中a为苯基或吡啶基。
[0067]
在一个实施例中,本发明提供了式(i)化合物或其药用盐,其中b选自c
6-c
14-芳基、5元至14元杂芳基和c
3-c
10-环烷基。
[0068]
在一个优选实施例中,本发明提供了式(i)化合物或其药用盐,其中b为5元至14元杂芳基。
[0069]
在一个特别优选的实施例中,本发明提供了式(i)化合物或其药用盐,其中b为吡啶基。
[0070]
在另一个特别优选的实施例中,本发明提供了式(i)化合物或其药用盐,其中b选自苯基、吡啶基和环丁基。
[0071]
在一个实施例中,本发明提供了式(i)化合物或其药用盐,其中b为c
3-c
10-环烷基。
[0072]
在一个优选实施例中,本发明提供了式(i)化合物或其药用盐,其中b为c
3-c
10-环烷基,其中所述c
3-c
10-环烷基为多环桥联的c
3-c
10-环烷基。
[0073]
在一个特别优选的实施例中,本发明提供了式(i)化合物或其药用盐,其中b为c
3-c
10-环烷基,其中所述环烷基为多环桥联的c
3-c
10-环烷基,其中所述多环桥联的c
3-c
10-环烷基为立方烷或双环[1.1.1]戊烷,特别是其中所述多环桥联的c
3-c
10-环烷基为双环[1.1.1]戊烷。
[0074]
在一个特别优选的实施例中,本发明提供了式(i)化合物或其药用盐,其中l为-o-。
[0075]
在一个特别优选的实施例中,本发明提供了式(i)化合物或其药用盐,其中y1为ch或n。
[0076]
在一个实施例中,本发明提供了式(i)化合物或其药用盐,其中y2为ch或n。
[0077]
在一个特别优选的实施例中,本发明提供了式(i)化合物或其药用盐,其中y2为ch。
[0078]
在一个实施例中,本发明提供了式(i)化合物或其药用盐,其中y3选自ch、n、c-卤素、c-c
1-c
6-烷基和c-卤代-c
1-c
6-烷基。
[0079]
在一个优选实施例中,本发明提供了式(i)化合物或其药用盐,其中y3选自ch、n、c-卤素和c-c
1-c
6-烷基。
[0080]
在一个特别优选的实施例中,本发明提供了式(i)化合物或其药用盐,其中y3选自ch、n、c-f和c-甲基。
[0081]
在一个实施例中,本发明提供了式(i)化合物或其药用盐,其中y4为ch或n。
[0082]
在一个特别优选的实施例中,本发明提供了式(i)化合物或其药用盐,其中y4为ch。
[0083]
在一个实施例中,本发明提供了式(i)化合物或其药用盐,其中r1选自氢、卤素和c
1-c
6-烷基。
[0084]
在一个特别优选的实施例中,本发明提供了式(i)化合物或其药用盐,其中r1为氢。
[0085]
在一个特别优选的实施例中,本发明提供了式(i)化合物或其药用盐,其中r2为氢。
[0086]
在一个特别优选的实施例中,本发明提供了式(i)化合物或其药用盐,其中r3为氢。
[0087]
在一个实施例中,本发明提供了式(i)化合物或其药用盐,其中r4选自c
1-c
6-烷基、卤代-c
1-c
6-烷基和c
1-c
6-烷氧基。
[0088]
在一个优选实施例中,本发明提供了式(i)化合物或其药用盐,其中r4为c
1-c
6-烷基。
[0089]
在一个特别优选的实施例中,本发明提供了式(i)化合物或其药用盐,其中r4为甲基。
[0090]
在一个实施例中,本发明提供了式(i)化合物或其药用盐,其中r5选自卤素、氰基、c
1-c
6-烷氧基和卤代-c
1-c
6-烷氧基。
[0091]
在一个优选实施例中,本发明提供了式(i)化合物或其药用盐,其中r5为c
1-c
6-烷氧基。
[0092]
在一个特别优选的实施例中,本发明提供了式(i)化合物或其药用盐,其中r5为甲氧基。
[0093]
在一个实施例中,本发明提供了式(i)化合物或其药用盐,其中r4和r5与它们所连接的原子一起形成3元至14元杂环。
[0094]
在一个特别优选的实施例中,本发明提供了式(i)化合物或其药用盐,其中r4和r5与它们所连接的原子一起形成5-氧杂螺[2.4]庚-6-烯或5-噻螺[2.4]庚-6-烯环。
[0095]
在一个实施例中,本发明提供了式(i)化合物或其药用盐,其中r6为氢或c
1-c
6-烷基。
[0096]
在一个特别优选的实施例中,本发明提供了式(i)化合物或其药用盐,其中r6为氢。
[0097]
在一个实施方案中,本发明提供了一种式(i)的化合物或其药用盐,其中:
[0098]
a选自c
6-c
14-芳基和5元至14元杂芳基;
[0099]
b选自c
6-c
14-芳基、5元至14元杂芳基和c
3-c
10-环烷基;
[0100]
l为-o-;
[0101]
y1、y2和y4各自独立地选自ch和n;
[0102]
y3选自ch、n、c-卤素、c-c
1-c
6-烷基和c-卤代-c
1-c
6-烷基;
[0103]
r1选自氢、卤素和c
1-c
6-烷基;
[0104]
r2和r3各自为氢;
[0105]
r4选自c
1-c
6-烷基、卤代-c
1-c
6-烷基和c
1-c
6-烷氧基;并且
[0106]
r5选自卤素、氰基、c
1-c
6-烷氧基和卤代-c
1-c
6-烷氧基;或者
[0107]
r4和r5与它们所连接的原子一起形成3元至14元杂环;并且
[0108]
r6为氢或c
1-c
6-烷基。
[0109]
在一个优选实施例中,本发明提供了式(i)化合物或其药用盐,其中:
[0110]
a为c
6-c
14-芳基;
[0111]
b为5元至14元杂芳基;
[0112]
l为-o-;
[0113]
y1为ch或n;
[0114]
y2和y4两者均为ch;
[0115]
y3选自ch、n、c-卤素和c-c
1-c
6-烷基;
[0116]
r1、r2、r3和r6各自为氢;
[0117]
r4为c
1-c
6-烷基;并且
[0118]
r5为c
1-c
6-烷氧基;或者
[0119]
r4和r5与它们所连接的原子一起形成3元至14元杂环。
烯环;并且
[0158]
r6为氢。
[0159]
在一个实施方案中,本发明提供了一种式(i)的化合物或其药用盐,其中:
[0160]
y1、y2和y4各自独立地选自ch和n;并且
[0161]
y3选自ch、n、c-卤素、c-c
1-c
6-烷基和c-卤代-c
1-c
6-烷基。
[0162]
在一个优选实施例中,本发明提供了式(i)化合物或其药用盐,其中:
[0163]
y1为ch或n;
[0164]
y2和y4两者均为ch;并且
[0165]
y3选自ch、n、c-卤素和c-c
1-c
6-烷基。
[0166]
在一个特别优选的实施例中,本发明提供了式(i)化合物或其药用盐,其中:
[0167]
y1为ch或n;
[0168]
y2和y4两者均为ch;并且
[0169]
y3选自ch、n、c-f和c-甲基。
[0170]
在一个优选实施例中,本发明提供了式(i)化合物或其药用盐,其选自:
[0171]
3-(6-螺[2h-苯并呋喃-3,1
′‑
环丙烷]-4-基氧基-3-吡啶基)-1h-咪唑并[4,5-b]吡啶-2-酮;
[0172]
9-(6-螺[2h-苯并呋喃-3,1
′‑
环丙烷]-4-基氧基-3-吡啶基)-7h-嘌呤-8-酮;
[0173]
3-[6-(3-氯-4-甲基-苯氧基)-3-吡啶基]-1h-咪唑并[4,5-b]吡啶-2-酮;
[0174]
3-叔丁基-4-[[5-(2-氧代-1h-咪唑并[4,5-b]吡啶-3-基)-2-吡啶基]氧基]苯甲腈;
[0175]
1-(6-螺[2h-苯并呋喃-3,1
′‑
环丙烷]-4-基氧基-3-吡啶基)-3h-咪唑并[4,5-c]吡啶-2-酮;
[0176]
6-氟-3-[6-(3-甲氧基-4-甲基-苯氧基)-3-吡啶基]-1h-咪唑并[4,5-b]吡啶-2-酮;
[0177]
3-(3-氟-4-螺[2h-苯并呋喃-3,1
′‑
环丙烷]-4-基氧基-苯基)-1h-咪唑并[4,5-b]吡啶-2-酮;
[0178]
1-[6-[4-甲基-3-(三氟甲氧基)苯氧基]-3-吡啶基]-3h-咪唑并[4,5-c]吡啶-2-酮;
[0179]
3-[6-(3-甲氧基-4-甲基-苯氧基)-3-吡啶基]-6-甲基-]h-咪唑并[4,5-b]吡啶-2-酮;
[0180]
3-(6-螺[2h-苯并呋喃-3,1
′‑
环丙烷]-4-基氧基-3-吡啶基)-1h-苯并咪唑-2-酮;
[0181]
2-异丙基-4-[[5-(2-氧代-1h-咪唑并[4,5-b]吡啶-3-基)-2-吡啶基]氧基]苯甲腈;
[0182]
4-[[5-(6-氟-2-氧代-1h-咪唑并[4,5-b]吡啶-3-基)-2-吡啶基]氧基]-2-异丙基-苯甲腈;
[0183]
3-(5-甲基-6-螺[2h-苯并呋喃-3,1
′‑
环丙烷]-4-基氧基-3-吡啶基)-1h-苯并咪唑-2-酮;
[0184]
1-[5-氟-6-(3-甲氧基-4-甲基-苯氧基)-3-吡啶基]-3h-咪唑并[4,5-c]吡啶-2-酮;
[0185]
1-[6-(3-甲氧基-4-甲基-苯氧基)-5-甲基-3-吡啶基]-3h-咪唑并[4,5-c]吡啶-2-酮;
[0186]
3-[6-(3-甲氧基-4-甲基-苯氧基)-3-吡啶基]-1h-咪唑并[4,5-b]吡啶-2-酮;
[0187]
1-(6-螺[2h-苯并呋喃-3,1
′‑
环丙烷]-4-基氧基-3-吡啶基)-3h-咪唑并[4,5-b]吡啶-2-酮;
[0188]
2-异丙基-4-[[5-(8-氧代-7h-嘌呤-9-基)-2-吡啶基]氧基]苯甲腈;
[0189]
3-(3-氟-4-螺[2h-苯并呋喃-3,1
′‑
环丙烷]-4-基氧基-苯基)-1h-苯并咪唑-2-酮;
[0190]
1-[3-(3-甲氧基-4-甲基-苯氧基)环丁基]-3h-咪唑并[4,5-c]吡啶-2-酮;
[0191]
3-[6-(3-氟-4-甲基-苯氧基)-3-吡啶基]-1h-咪唑并[4,5-b]吡啶-2-酮;
[0192]
3-(6-螺[2h-苯并呋喃-3,1
′‑
环丙烷]-4-基氧基-3-吡啶基)-1h-咪唑并[4,5-c]吡啶-2-酮;
[0193]
3-[6-(3-甲氧基-4-甲基-苯氧基)-3-吡啶基]-1h-咪唑并[4,5-b]吡嗪-2-酮;
[0194]
3-叔丁基-4-[[5-(8-氧代-7h-嘌呤-9-基)-2-吡啶基]氧基]苯甲腈;
[0195]
3-[6-(3-甲氧基-4-甲基-苯氧基)-5-甲基-3-吡啶基]-1h-咪唑并[4,5-b]吡啶-2-酮;
[0196]
2-乙基-4-[[5-(2-氧代-1h-咪唑并[4,5-b]吡啶-3-基)-2-吡啶基]氧基]苯甲腈;
[0197]
3-[6-(2-氟-4-甲基-苯氧基)-3-吡啶基]-1h-咪唑并[4,5-b]吡啶-2-酮;
[0198]
1-[6-(3-甲氧基-4-甲基-苯氧基)-3-吡啶基]-3h-咪唑并[4,5-c]吡啶-2-酮;
[0199]
4-[2-氟-4-(2-氧代-1h-咪唑并[4,5-b]吡啶-3-基)苯氧基]-2-异丙基-苯甲腈;
[0200]
3-叔丁基-4-[[5-(2-氧代-3h-咪唑并[4,5-c]吡啶-1-基)-2-吡啶基]氧基]苯甲腈;
[0201]
3-[6-(2-甲氧基-4-甲基-苯氧基)-3-吡啶基]-1h-咪唑并[4,5-b]吡啶-2-酮;
[0202]
3,5-二甲基-4-[[5-(2-氧代-1h-咪唑并[4,5-b]吡啶-3-基)-2-吡啶基]氧基]苯甲腈;
[0203]
3-[6-(3-甲氧基-4-甲基-苯氧基)-3-吡啶基]-1h-苯并咪唑-2-酮;
[0204]
3-叔丁基-4-[[5-(6-氟-2-氧代-1h-咪唑并[4,5-b]吡啶-3-基)-2-吡啶基]氧基]苯甲腈;
[0205]
3-[6-(3-甲氧基-4-甲基-苯氧基)-3-吡啶基]-6-(三氟甲基)-1h-咪唑并[4,5-b]吡啶-2-酮;
[0206]
9-[6-[4-甲基-3-(三氟甲氧基)苯氧基]-3-吡啶基]-7h-嘌呤-8-酮;
[0207]
2-异丙基-4-[[5-(2-氧代-3h-咪唑并[4,5-c]吡啶-1-基)-2-吡啶基]氧基]苯甲腈;
[0208]
3-甲基-4-[[5-(2-氧代-1h-咪唑并[4,5-b]吡啶-3-基)-2-吡啶基]氧基]苯甲腈;
[0209]
4-[[5-(2-氧代-1h-咪唑并[4,5-b]吡啶-3-基)-2-吡啶基]氧基]-3-(三氟甲基)苯甲腈;
[0210]
9-[6-(3-甲氧基-4-甲基-苯氧基)-3-吡啶基]-7h-嘌呤-8-酮;
[0211]
6-氯-3-[6-(3-甲氧基-4-甲基-苯氧基)-3-吡啶基]-1h-咪唑并[4,5-b]吡啶-2-酮;
[0212]
1-[6-(3-氯-4-甲基-苯氧基)-3-吡啶基]-3h-咪唑并[4,5-c]吡啶-2-酮;
[0213]
3-叔丁基-4-[[5-(2-氧代-3h-苯并咪唑-1-基)-2-吡啶基]氧基]苯甲腈;
[0214]
9-[6-(3-氯-4-甲基-苯氧基)-3-吡啶基]-7h-嘌呤-8-酮;
[0215]
3-叔丁基-4-[2-氟-4-(2-氧代-1h-咪唑并[4,5-b]吡啶-3-基)苯氧基]苯甲腈;
[0216]
2-异丙基-4-[[5-(2-氧代-3h-苯并咪唑-1-基)-2-吡啶基]氧基]苯甲腈;
[0217]
3-[6-[(5-甲氧基-6-甲基-3-吡啶基)氧基]-3-吡啶基]-1h-咪唑并[4,5-b]吡啶-2-酮;
[0218]
3-异丙基-4-[3-(2-氧代-1h-咪唑并[4,5-b]吡啶-3-基)环丁氧基]苯甲腈;
[0219]
2-乙基-4-[[5-(2-氧代-3h-苯并咪唑-1-基)-2-吡啶基]氧基]苯甲腈;
[0220]
4-[2-氟-4-(8-氧代-7h-嘌呤-9-基)苯氧基]-2-异丙基-苯甲腈;
[0221]
1-[6-(3-甲氧基-4-甲基-苯氧基)-3-吡啶基]-3h-咪唑并[4,5-b]吡啶-2-酮;
[0222]
2-异丙氧基-4-[[5-(2-氧代-3h-苯并咪唑-1-基)-2-吡啶基]氧基]苯甲腈;和
[0223]
3-[6-(3-甲氧基-4-甲基-苯氧基)-3-吡啶基]-1h-咪唑并[4,5-c]吡啶-2-酮。
[0224]
在一个特别优选的实施例中,本发明提供了式(i)化合物或其药用盐,其选自:
[0225]
3-(6-螺[2h-苯并呋喃-3,1
′‑
环丙烷]-4-基氧基-3-吡啶基)-1h-咪唑并[4,5-b]吡啶-2-酮;
[0226]
9-(6-螺[2h-苯并呋喃-3,1
′‑
环丙烷]-4-基氧基-3-吡啶基)-7h-嘌呤-8-酮;
[0227]
1-(6-螺[2h-苯并呋喃-3,1
′‑
环丙烷]-4-基氧基-3-吡啶基)-3h-咪唑并[4,5-c]吡啶-2-酮;
[0228]
6-氟-3-[6-(3-甲氧基-4-甲基-苯氧基)-3-吡啶基]-1h-咪唑并[4,5-b]吡啶-2-酮;
[0229]
3-[6-(3-甲氧基-4-甲基-苯氧基)-3-吡啶基]-6-甲基-1h-咪唑并[4,5-b]吡啶-2-酮;
[0230]
3-[6-(3-甲氧基-4-甲基-苯氧基)-3-吡啶基]-1h-咪唑并[4,5-b]吡啶-2-酮;和
[0231]
1-[6-(3-甲氧基-4-甲基-苯氧基)-3-吡啶基]-3h-咪唑并[4,5-c]吡啶-2-酮。
[0232]
在一个实施例中,本发明提供了如本文所述的式(i)化合物的药用盐,尤其是盐酸盐。在另一个实施例中,本发明提供了如本文所述的式(i)化合物作为游离碱。
[0233]
在一些实施例中,式(i)的化合物通过其中一个或多个原子被具有不同原子质量或质量数的原子代替而被同位素标记。此类同位素标记(即,放射性标记)的式(i)的化合物被认为在本公开的范围内。可以掺入式(i)的化合物中的同位素的实例分别包括氢、碳、氮、氧、磷、硫、氟、氯和碘的同位素,诸如但不限于2h、3h、
11
c、
13
c、
14
c、
13
n、
15
n、
15
o、
17
o、
18
o、
31
p、
32
p、
35
s、
18
f、
36
cl、
123
i和
125
i。某些同位素标记的式(i)的化合物(例如,包含放射性同位素的那些)可用于药物和/或基体组织分布研究。放射性同位素氚(即3h)和碳-14(即
14
c)对此特别有用,因为它们容易掺入并且检测手段是现成的。例如,式(i)的化合物可以富含1、2、5、10、25、50、75、90、95或99%的给定同位素。
[0234]
用较重的同位素诸如氘(即,2h)取代可以提供由于代谢稳定性更高(例如,体内半衰期增加或所需剂量减少)而带来的某些治疗优势。
[0235]
用正电子发射同位素(诸如
11
c、
18
f、
15
o和
13
n)取代可以用于检查底物受体占用的正电子发射断层扫描(pet)研究。同位素标记的式(i)的化合物通常可以通过本领域技术人员
已知的常规技术或通过类似于如下所陈述的实施例中描述的那些过程使用适当的同位素标记的试剂代替之前使用的非标记的试剂来制备。
[0236]
生产方法
[0237]
本发明的式(i)化合物的制备可按照顺序或并发合成路线进行。本发明的合成如以下总体方案所示。执行反应和纯化所得产物所需的技能对于本领域的技术人员是已知的。除非指明是相反情况,否则以下方法说明中所用的取代基和指数具有本文所提供的含义。
[0238]
如果起始物质、中间体或式(i)化合物之一含有一种或多种在一个或多个反应步骤的反应条件下不稳定或具有反应性的官能团,则可以在关键步骤之前应用本领域中众所周知的方法引入适当的保护基(如以下文献所述:t.w.greene和p.g.m.wutts,“protective groups in organic chemistry”,第5版,2014年,john wiley&sons,n.y.)。此类保护基可在合成的后期使用文献中所述的标准方法去除。
[0239]
如果起始物质或中间体含有立体中心,则可以获得作为非对映异构体或对映异构体的混合物的式(i)化合物,其可以通过本领域中众所周知的方法(例如,手性hplc、手性sfc或手性结晶)进行分离。外消旋化合物可例如通过非对映体盐分离为相应的对应体,其通过用光学纯的酸进行结晶,或通过使用手性吸附剂或手性洗脱剂的特定色谱法分离对映体。同样可分离含有立体异构中心的起始物质和中间体,以提供非对映异构体/对映异构体富集的起始物质和中间体。在式(i)化合物的合成中使用此类非对映异构体/对映异构体富集的起始物质和中间体通常将得到相应的非对映异构体/对映异构体富集的式(i)化合物。
[0240]
本领域的技术人员将认识到,在式(i)化合物的合成中(如果不希望如此)将应用“正交保护基策略”,其允许每次裂解多个保护基而不影响分子中的其他保护基。正交保护的原理是本领域中众所周知的,并且也已经见诸文献报道(例如,barany和r.b.merrifield,j.am.chem.soc.1977,99,7363;h.waldmann等人,angew.chem.int.ed.engl.1996,35,2056)。
[0241]
本领域的技术人员将认识到,反应顺序可根据中间体的反应性和性质而变化。
[0242]
更详细地,式(i)化合物可以通过下面给出的方法、通过实例中给出的方法或通过类似方法来制备。各个反应步骤的适当反应条件是本领域技术人员已知的。同样,有关文献中报道的影响所述反应的反应条件,参见例如:comprehensive organic transformations:a guide to functional group preparations,第2版,richard c.larock.john wiley&sons,new york,ny.1999。在存在或不存在溶剂的情况下进行反应都很方便。对所用溶剂的性质没有特别的限制,只要它对反应或所涉及的试剂没有不利影响并且至少在一定程度上可以溶解试剂即可。所描述的反应可以在很宽的温度范围内发生,并且精确的反应温度对于本发明不是关键的。可以方便地在-78℃至回流的温度范围内执行上述反应。反应所需的时间还可在很大范围内变化,这取决于许多因素,特别是反应温度和试剂的性质。但是,通常需要0.5小时至几天的时间以得到所述的中间体和化合物。反应顺序不限于方案中显示的顺序,但是,根据起始物质及其相应的反应性不同,可自由改变反应步骤的顺序。
[0243]
如果起始原料或中间体无法商购获得,或者其合成未见诸文献报道,则可以采用类似于接近的类似物的现有制备方法或按照实验部分的概述进行制备。
[0244]
本发明的式(i)化合物可以通过使式1的(杂)芳族顺式二胺与偶联剂(诸如cdi、三光气)在溶剂(诸如dcm、ch3cn、thf)并且通常在弱碱(例如tea、diea、吡啶)的存在下反应来制备。(方案1)
[0245][0246]
方案1
[0247]
二胺1通常通过还原硝基(杂)芳基衍生物2来生成(例如在h2气体下使用pd/c催化,使用fe或zn在acoh或etoh/nh4cl(水溶液)中的溶液、使用sncl2.2h2o,或使用pd(oh)2和三乙基硅烷)。(方案2)
[0248][0249]
方案2
[0250]
硝基衍生物2可以通过将邻卤代硝基(杂)芳基衍生物用合适的胺3进行亲核芳族取代来生成(例如,使用k2co3在dmf中的溶液)。可替代地,对于一些吡啶基衍生物,使用柠檬酸水合物/二噁烷。可替代地,硝基衍生物2可以由邻卤代硝基(杂)芳基衍生物和胺3使用过渡金属催化的交叉偶联来生成(例如使用pd(oac)2/xantphos/k2co3或pd2(dba)3/xantphos/cs2co3在1,4-二噁烷中的溶液的buchwald反应)。(方案3)亲核芳族取代或金属催化的交叉偶联也允许使用上述可替代的二胺生成方法所需的酸/酯和cl衍生物。
[0251][0252]
方.案3
[0253]
在某些情况下,在snar和还原步骤之前,首先用合适的保护基团(例如boc)保护胺3(方案2和3)。然后可以在偶联步骤之前的单独步骤中去除保护基团(例如使用tfa)(方案
1)。
[0254]
获得二胺1的替代方法包括:(i)对例如4-氯-5-溴嘧啶(tsoh/nmp)进行胺3的snar,然后经由安装受保护的氨基基团(buchwald条件)和脱保护来将溴衍生物转化为胺(参见实例43);(ii)使用经由氯衍生物生成的fe/etoh/nh4cl(水溶液)来还原四唑并衍生物(参见实例48);(iii)来自(杂)芳基酸衍生物的curtius重排。
[0255]
胺3(其中b为任选地取代的(杂)芳族环)可以通过还原硝基衍生物7来生成(例如在h2气体下或存在甲酸铵/meoh的情况下使用pd/c催化,使用fe或zn在acoh或etoh/nh4cl(水溶液)中的溶液,或使用pd(oh)2和三乙基硅烷)。所需的硝基衍生物可以通过用合适的醇(5)进行的对卤代硝基(杂)芳烃(6)的亲核芳族取代反应来生成(例如,在溶剂(诸如dmf或ch3cn)中使用nah、cs2co3或k2co3)。(方案4)。
[0256][0257]
方案4
[0258]
可替代地,式(i)化合物可以通过使合适的苯酚(5)与合适的2-氯-杂芳基结构单元(8)反应来制备,例如在200℃下使用k2co3在nmp中的溶液(方案5)。
[0259][0260]
方案5
[0261]
可以使用一系列snar、硝基还原为胺以及二胺的环化,由2-氯-5-氨基(杂)芳基(9)生成结构单元(8)(类似于方案1、2和3)。可替代地,中间体10可以通过合适的碘化物(12)与合适的胺(13)的过渡金属催化的交叉偶联来生成(例如buchwald条件,pd2dba3/xantphos/cs2co3在二噁烷中的溶液)。(方案6)。
[0262][0263]
方案6
[0264]
可替代地,式(i)化合物可以由脲15使用分子内过渡金属催化的交叉偶联(例如使用pd2dba3、dppf和naot-bu在二噁烷中的溶液,在100℃下)来制备。脲15可以由合适的胺(3)和合适的邻卤代氨基(杂)芳烃(14),经由形成活性氨基甲酸酯(例如,使用4-硝基苯基氯甲酸酯以安装4-硝基苯基氨基甲酸酯基团)然后与14偶联(例如,使用dmap/thf)来制备。(方案7)。
[0265][0266]
方案7
[0267]
可替代地,式(i)化合物可以由合适的胺3,使用与邻卤代(杂)芳基氨基甲酸酯(16)的过渡金属催化的交叉偶联来生成(例如pd(dppf)cl2/xantphos/cs2co3/1,4-二噁烷)。(方案8)所需的氨基甲酸酯16可以通过合适的胺与氯甲酸烷基酯的酰化来合成。
[0268][0269]
方案8
[0270]
胺3(其中b为环烷基或杂环基)可以通过以下方法生成:使合适的苯酚(5)与合适的氨基醇(17)在mitsunobu条件(diad、pph3、ch2cl2)下反应以生成18,其可以在标准条件下脱保护以得到胺3(例如,其中pg=boc,用tfa脱保护)。(方案9)然后可以使用先前描述的合成方法来生成式(i)化合物。
[0271][0272]
方案9
[0273]
可替代地,式(i)化合物(其中b为环烷基或杂环基)可以通过使环烷基或杂环基醇(21)与合适的芳族氯化物(具有对ewg)(22)在snar反应中进行反应来生成(例如在dmf中与nah反应)。所需的醇可以通过合适的脲(20)的分子内过渡金属催化的交叉偶联来生成(例
如,pd2dba3/dppf/naot-bu/二噁烷)。脲可以通过合适的(杂)芳族卤化物(19)与合适的环烷基或杂环基醇(23)偶联来生成(例如,使用氯甲酸苯酯/dipea)。(方案10)。可以由对应的胺在sandmeyer条件下生成非商业化芳族氯化物(例如,亚硝酸叔丁酯与cucl2)。
[0274][0275]
方案10
[0276]
可替代地,式(i)化合物也可以通过在晚期修饰其他式(i)化合物来生成(例如,其中r
x
=i或br,经由suzuki交叉偶联用合适的硼酸盐来安装小烷基基团;参见实例47)。
[0277]
在一个方面,本发明提供了一种制备本文所述的式(i)化合物的方法,其包括使式1的二胺
[0278][0279]
与偶联剂(诸如cdi或三光气)反应,以形成所述式(i)化合物。
[0280]
在一个实施例中,反应在溶剂中执行,诸如dcm、ch3cn或thf或它们的混合物。
[0281]
在一个实施例中,反应在弱碱(例如tea、diea或吡啶或它们的混合物)的存在下执行。
[0282]
在一个方面,本发明提供了一种如本文所述的式(i)化合物,该化合物根据本文所述的方法中的任一方法进行制备。
[0283]
使用本发明的化合物
[0284]
本发明的化合物为具有治疗效用的kv3增强剂(或正调节剂)。因此,在一个方面,本发明提供了用作治疗活性物质的如本文所述的式(i)化合物。
[0285]
在另一方面,本发明提供了如本文所述的式(i)化合物用于增强哺乳动物的kv3的用途。
[0286]
在另一方面,本发明提供了如本文所述的式(i)化合物用于增强哺乳动物的kv3的方法。
[0287]
在另一方面,本发明提供了如本文所述的式(i)化合物在制备用于增强哺乳动物的kv3药物中的用途。
[0288]
在另一方面,本发明提供了增强哺乳动物的kv3的方法,该方法包括向哺乳动物施用有效量的如本文所述的式(i)化合物。
[0289]
在另一方面,本发明提供了如本文所述的式(i)化合物或其药用盐或包含所述式(i)化合物或其药用盐的药物组合物,其用于治疗或预防kv3介导的疾病和障碍。
[0290]
在另一方面,本发明提供了如本文所述的式(i)化合物或其药用盐或包含所述式(i)化合物或其药用盐的药物组合物在治疗或预防kv3介导的疾病和障碍中的用途。
[0291]
在另一方面,本发明提供了如本文所述的式(i)化合物或其药用盐在制备用于治疗或预防kv3介导的疾病和障碍的药物中的用途。
[0292]
在另一方面,本发明提供了治疗或预防kv3介导的疾病和障碍的方法,其包括向有此需要的受试者施用治疗有效量的如本文所述的式(i)化合物或其药用盐。
[0293]
在一个实施例中,所述kv3介导的疾病和障碍为神经发育障碍。
[0294]
在一个实施例中,所述kv3介导的疾病和障碍为神经发育障碍,该神经发育障碍选自由以下项组成的组:自闭症、脆性x综合征、癫痫、智力残疾、认知损害、共济失调、抑郁症、精神分裂症、注意力缺陷多动障碍和感觉加工障碍(例如,听觉感觉加工障碍)。
[0295]
在一个实施例中,所述kv3介导的疾病和障碍为自闭症。
[0296]
在一个实施例中,所述kv3介导的疾病和障碍为脆性x综合征。
[0297]
在一个实施例中,所述kv3介导的疾病和障碍为癫痫。
[0298]
在一个实施例中,所述kv3介导的疾病和障碍为智力残疾。
[0299]
在一个实施例中,所述kv3介导的疾病和障碍为认知损害。
[0300]
在一个实施例中,所述kv3介导的疾病和障碍为共济失调。
[0301]
在一个实施例中,所述kv3介导的疾病和障碍为抑郁症。
[0302]
在一个实施例中,所述kv3介导的疾病和障碍为精神分裂症。
[0303]
在一个实施例中,所述kv3介导的疾病和障碍为注意力缺陷多动障碍。
[0304]
在一个实施例中,所述kv3介导的疾病和障碍为感觉加工障碍(例如,听觉感觉加工障碍)。
[0305]
药物组合物和施用
[0306]
在一个方面,本发明提供了一种药物组合物,该药物组合物包含如本文所述的式(i)化合物和治疗惰性载体。
[0307]
在一个实施例中,本发明提供了实例55和56中所公开的药物组合物。
[0308]
式(i)的化合物及其药用盐可以用作药物(例如,以药物制剂的形式)。药物制剂可以内部施用,诸如口服(例如,以片剂、包衣片剂、糖锭剂、硬明胶胶囊和软明胶胶囊、溶液、乳液或混悬剂的形式)、鼻内(例如,以鼻用喷雾的形式)或直肠内(例如,以栓剂的形式)。但是,也可通过肠胃外诸如肌内或静脉内(例如以注射液的形式)给药。
[0309]
式(i)化合物及其药用盐可以与药学上惰性的无机或有机佐剂一起加工,以生产片剂、包衣片剂、糖锭剂和硬明胶胶囊。例如,可使用乳糖、玉米淀粉或其衍生物(滑石粉、硬脂酸或其盐等)作为片剂、糖衣丸和硬明胶胶囊的此类助剂。
[0310]
用于软明胶胶囊的合适的助剂为例如植物油、蜡、脂肪、半固体物质和液体多元醇等。
[0311]
用于制备溶液和糖浆的合适的助剂为例如水、多元醇、蔗糖、转化糖、葡萄糖等。
[0312]
用于注射液的合适的助剂为例如水、醇、多元醇、甘油、植物油等。
[0313]
用于栓剂的合适的助剂为例如天然或硬化油、蜡、脂肪、半固体或液体多元醇等。
[0314]
此外,药物制剂可以含有防腐剂、增溶剂、增粘物质、稳定剂、润湿剂、乳化剂、甜味剂、着色剂、香料、用于改变渗透压的盐、缓冲剂掩模剂或抗氧化剂。它们还可以含有其他有治疗价值的物质。
[0315]
剂量可以在宽范围内变化,当然将适合每种特定情况下的各种要求。一般来讲,在
口服施用的情况下,日剂量为每kg体重约0.1mg至20mg、优选每kg体重约0.5mg至4mg(例如,每人约300mg)(分成优选1-3个单独剂量,这些单独剂量可以例如由相同量组成)应该是合适的。但是,显而易见的是,当显示为标明时,可超过本文中给出的上限。
[0316]
实例
[0317]
通过参考以下实例将更全面地理解本发明。然而,权利要求不应被解释为限于实施例的范围。
[0318]
在作为对映体的混合物获得制备实施例的情况下,可以通过本文所述的方法或通过本领域技术人员已知的方法(诸如手性色谱(例如,手性sfc)或结晶)分离纯对映体。
[0319]
如果没有另行说明,则在氩气氛下制备所有反应实施例和中间体。
[0320]
缩写
[0321]
acoh=乙酸,acn=乙腈,bn=苄基,binap=(2,2
′‑
双(二苯基膦基)-1,1
′‑
联萘),boc=叔丁氧基羰基,cas rn=化学文摘登记号,cbz=苄氧基羰基,cs2co3=碳酸铯,co=一氧化碳,cucl=氯化铜(i),cucn=氰化铜(i),cui=碘化铜(i),dabco=1,4-二氮杂双环[2.2.2]辛烷;三乙烯二胺,dast=(二乙基氨基)三氟化硫,dbu=1,8-二氮杂双环[5,4,0]十一碳-7-烯,dead=偶氮二羧酸二乙酯,diad=偶氮二羧酸二异丙酯,dibal-h=二异丁基氢化铝,dmap=4-二甲基氨基吡啶,dme=二甲氧基乙烷,dmeda=n,n
’‑
二甲基乙烯二胺,dmf=n,n-二甲基甲酰胺,dipea=n,n-二异丙基乙胺,dppf=1,1-双(二苯基膦基)二茂铁,edc.hcl=n-(3-二甲基氨基丙基)-n
′‑
乙基碳二亚胺盐酸盐,ei=电子轰击,esi=电喷雾电离,etoac=乙酸乙酯,etoh=乙醇,h=小时,fa=甲酸,h2o=水,h2so4=硫酸,hatu=1-[双(二甲氨基)亚甲基]-1h-1,2,3-三唑并[4,5-b]吡啶鎓-3-氧化物六氟磷酸盐,hbtu=o-苯并三唑-n,n,n’,n
’‑
四甲基-脲鎓-六氟-磷酸盐,hcl=氯化氢,hobt=1-羟基-1h-苯并三唑;hplc=高效液相色谱法,iprmgcl=异丙基氯化镁,i2=碘,ipa=2-丙醇,isp=离子喷雾正(模式),isn=离子喷雾负(模式),k2co3=碳酸钾,khco3=碳酸氢钾,ki=碘化钾,koh=氢氧化钾,k3po4=磷酸三钾,lialh4或lah=氢化铝锂,lihmds=双(三甲基甲硅烷基)酰胺锂,lioh=氢氧化锂,mcpba=间氯过氧苯甲酸,mgso4=硫酸镁,min=分钟,ml=毫升,mplc=中压液相色谱法,ms=质谱,nbuli=正丁基锂,nabh3cn=氰基硼氢化钠,nah=氢化钠,nbs=n-溴代琥珀酰亚胺,nahco3=碳酸氢钠,nano2=亚硝酸钠,nabh(oac)3=三乙酰氧基硼氢化钠,naoh=氢氧化钠,na2co3=碳酸钠,na2so4=硫酸钠,na2s2o3=硫代硫酸钠,net3=三乙胺(tea),nh4cl=氯化铵,nmp=n-甲基-2-吡咯烷酮,oac=乙酰氧基,t3p=丙基膦酸酐,pe=石油醚,pg=保护基团,pd-c=活性炭载钯,pdcl2(dppf)-ch2cl2=1,1
′‑
双(二苯基膦基)二茂铁-二氯化钯(ii)二氯甲烷复合物,pd2(dba)3=三(二亚苄基丙酮)二钯(0),pd(oac)2=乙酸钯(ii),pd(oh)2=氢氧化钯,pd(pph3)4=四(三苯基膦)钯(0),ptsa=对甲苯磺酸,r=任何基团,rp=反相,rt=室温,sfc=超临界流体色谱法,s-phos=2-二环己基膦基-2
′
,6
′‑
二甲氧基联苯,tbai=碘化四丁基铵,tea=三乙胺,tfa=三氟乙酸,thf=四氢呋喃,tmeda=n,n,n
′
,n
′‑
四甲基乙二胺,zncl2=氯化锌,hal=卤素,制备型tlc=制备型薄层色谱法
[0322]
实例1
[0323]
3-(6-螺[2h-苯并呋喃-3,1
′‑
环丙烷]-4-基氧基-3-吡啶基)-1h-咪唑并[4,5-b]吡啶-2-酮
[0324][0325]
向冷却至0℃的n2-(6-螺[2h-苯并呋喃-3,1
′‑
环丙烷]-4-基氧基-3-吡啶基)吡啶-2,3-二胺(0.170g,491μmol)和tea(149mg,1.47mmol,205μl)在dcm(5ml)中的溶液分批加入三光气(65.5mg,221μmol)。将所得混合物在0℃下搅拌0.5h。将反应混合物倒入水(50ml)中,分离有机层,水相用ea(3x50ml)萃取,将合并的有机层经无水硫酸钠干燥,过滤,并且浓缩。通过制备型hplc来纯化残余物,以得到标题化合物(0.116g,312μmol,63.5%),其为白色固体。ms(esi):m/z=373.3[m+h]
+
[0326]
步骤a)3-硝基-n-(6-螺[2h-苯并呋喃-3,1-环丙烷]-4-基氧基-3-吡啶基)吡啶-2-胺
[0327][0328]
在氮气气氛下,向化合物2-氯-3-硝基吡啶(0.1g,631μmol)实例a.1(160mg,631μmol)xantphos(73.0mg,126μmol)和k2co3(131mg,946μmol)在二噁烷(3ml)中的溶液加入pd(oac)2(14.2mg,63.1μmol)。将所得混合物在100℃下搅拌6h。将反应混合物与复制品组合,通过硅藻土垫过滤,用ea(10ml x 4)冲洗,浓缩滤液。将残余物通过硅胶色谱法(pe∶ea=3∶1)纯化,以得到化合物24-2(0.25g,粗产物),其为淡黄色油状物,其不经进一步纯化即可直接用于下一步骤。
[0329]
步骤b)n2-(6-螺[2h-苯并呋喃-3,1
′‑
环丙烷]-4-基氧基-3-吡啶基)吡啶-2,3-二胺
[0330]
向化合物3-硝基-n-(6-螺[2h-苯并呋喃-3,1
′‑
环丙烷]-4-基氧基-3-吡啶基)吡啶-2-胺(0.5g,1.33mmol)在甲醇(25ml)中的溶液加入pd/c(0.2g,1.33mmol,纯度10%),将反应混合物在h2(30psi)下在50℃下搅拌1h。将反应混合物通过硅藻土垫过滤,将滤液浓缩以得到n2-(6-螺[2h-苯并呋喃-3,1
′‑
环丙烷]-4-基氧基-3-吡啶基)吡啶-2,3-二胺(0.17g,475μmol,35.7%,96.7%),其为灰白色固体,其不经进一步纯化即可用于下一步骤。ms(esi):m/z=347.2[m+h]
+
[0331]
类似于实例1,在步骤a)中使用相应的结构单元代替2-氯-3-硝基吡啶,生成下表的实例10
[0332][0333]
实例2
[0334]
9-(6-螺[2h-苯并呋喃-3,1
′‑
环丙烷]-4-基氧基-3-吡啶基)-7h-嘌呤-8-酮
[0335][0336]
在惰性气氛下,向1-(6-((2h-螺[苯并呋喃-3,1
′‑
环丙烷]-4-基)氧基)吡啶-3-基)-3-(4-溴嘧啶-5-基)脲(300mg,660μmol)在干燥二噁烷(8ml)中的溶液加入pd2(dba)3(30.2mg,33μmol)、1,1
′‑
二茂铁基-双(二苯基膦)(36.6mg,66μmol)和叔丁醇钠(95.2mg,991μmol)。将反应混合物在室温下搅拌5分钟并且在100℃下搅拌1.5h。将反应混合物冷却至室温,通过加入几滴饱和nh4cl水溶液来猝灭。将反应混合物在室温下搅拌5分钟,并且用乙酸乙酯稀释。通过经硅藻土垫过滤来去除不溶物,过滤垫用乙酸乙酯洗涤两次并将滤液蒸干。对粗材料直接进行sfc纯化,以得到220mg的标题化合物,将其通过快速色谱法进一步纯化,用庚烷和etoac∶etoh 3∶1(5%至70%)溶液的混合物洗脱,以得到117mg的标题化合物。ms(esi):m/z=374.2[m+h]
+
[0337]
步骤a)4-硝基苯基(6-((2h-螺[苯并呋喃-3,1
′‑
环丙烷]-4-基)氧基)吡啶-3-基)氨基甲酸酯盐酸盐
[0338]
向6-((2h-螺[苯并呋喃-3,1
′‑
环丙烷]-4-基)氧基)吡啶-3-胺实例a.1(785mg,2.93mmol)在甲苯(25ml)中的溶液加入4-硝基苯基氯甲酸酯(591mg,2.93mmol)并且将反应混合物在90℃下搅拌6h。真空去除挥发物,以得到1.45g的粗产物,其不经进一步纯化即可用于下一步骤。ms(esi):m/z=420.3[m+h]
+
[0339]
步骤b)1-(6-((2h-螺[苯并呋喃-3,1
′‑
环丙烷]-4-基)氧基)吡啶-3-基)-3-(4-溴嘧啶-5-基)脲
[0340]
向4-硝基苯基(6-((2h-螺[苯并呋喃-3,1
′‑
环丙烷]-4-基)氧基)吡啶-3-基)氨基甲酸盐酸盐(1.45g,3.02mmol)在无水thf(20ml)中的悬浮液加入4-溴嘧啶-5-胺(631mg,3.63mmol)和dmap(406mg,3.32mmol)。然后将反应混合物在70℃下搅拌4h。真空去除挥发物并且通过快速色谱法纯化粗材料,用庚烷和etoac∶etoh 3∶1(5%至70%)溶液的洗脱液混合物洗脱。这产生了产物,其通过sfc进一步纯化,以得到标题化合物(305mg)。ms(esi):m/z=456.2[m+h]
+
[0341]
类似于实例2,下表的实施例3、7、9、28、29、50由苯酚(步骤a)和氨基-卤代-杂芳烃
(步骤b)生成
[0342][0343]
实例4
[0344]
3-叔丁基-4-[[5-(2-氧代-1h-咪唑并[4,5-b]吡啶-3-基)-2-吡啶基]氧基]苯甲腈
[0345][0346]
向3-(1,1-二甲基乙基)-4-羟基苯甲腈(cas:4910-04-7)(280mg,1.60mmol)和3-(6-氯-3-吡啶基)-1h-咪唑并[4,5-b]吡啶-2-酮(394mg,1.60mmol)在nmp(3ml)中的溶液加入k2co3(552mg,3.99mmol),并且将混合物在200℃下搅拌5小时。将混合物用水(20ml)稀释并且用乙酸乙酯(30ml x 3)萃取,将合并的有机相经硫酸钠干燥,过滤,并且在真空下浓缩,以得到粗产物,将其通过制备型hplc纯化并且冻干,以得到标题化合物(22.8mg,58.33μmol,产率3.65%),其为灰白色固体。ms(esi):m/z=386.4[m+h]
+
[0347]
步骤a)n-(6-氯-3-吡啶基)-3-硝基-吡啶-2-胺
[0348]
将化合物2-氯-5-碘吡啶(9.64g,38.2mmol)、2-氨基-3-硝基吡啶(5.32g,38.2mmol)、cs2co3(18.7g,57.4mmol)、xantphos(4.43g,7.65mmol)和pd2(dba)3(3.50g,3.82mmol)在二噁烷(100ml)中的混合物脱气并且用n2吹扫3次,然后在n2气氛下将混合物在80℃下搅拌2h。将反应混合物过滤以得到粗产物,将其通过快速硅胶色谱法纯化,用0%至20%乙酸乙酯/石油醚梯度洗脱,以得到标题化合物(5.40g,20.0mmol,产率52.4%),其为黄色固体。ms(esi):m/z=451.0[m+h]
+
[0349]
步骤b)n2-(6-氯-3-吡啶基)吡啶-2,3-二胺
[0350]
向n-(6-氯-3-吡啶基)-3-硝基-吡啶-2-胺(4.80g,17.2mmol)在etoh(50ml)中的溶液加入nh4cl(1.38g,25.8mmol)在h2o(50ml)中的溶液。将混合物在80℃下加热,然后在搅拌下加入fe(3.85g,68.9mmol)。将混合物在80℃下搅拌3h。过滤反应混合物,并且在减压下浓缩滤液,以得到残余物,将其用h2o(100ml)溶解,并且将混合物用乙酸乙酯(100ml x 3)萃取。将合并的有机相用盐水(200ml)洗涤,用无水na2so4干燥,过滤,并且真空浓缩,以得到标题化合物(3.81g,14.9mmol,产率86.6%),其为棕色固体。ms(esi):m/z=221.1[m+h]
+
[0351]
步骤c)3-(6-氯-3-吡啶基)-1h-咪唑并[4,5-b]吡啶-2-酮
[0352]
向n2-(6-氯-3-吡啶基)吡啶-2,3-二胺(3.60g,16.3mmol)在mecn(30.0ml)中的溶液中加入cdi(5.29g,32.6mmol),并且将所形成的混合物在20℃下搅拌2h。将混合物用水(100ml)稀释,并且用乙酸乙酯(100ml
×
2)萃取。将有机相用盐水(20ml x 2)洗涤,经硫酸钠干燥,过滤,并且在真空下浓缩,以得到标题化合物(4.90g,粗产物),其为黄色固体,其不经进一步纯化即可直接使用。ms(esi):m/z=247.4[m+h]
+
[0353]
类似于实例4,在最终步骤中下表的实例5、35、36、37、49由中间体3-(6-氯-3-吡啶基)-1h-咪唑并[4,5-b]吡啶-2-酮使用不同的苯酚结构单元生成。在某些情况下,在微波条件下执行加热。
[0354][0355][0356]
实例6
[0357]
1-(6-螺[2h-苯并呋喃-3,1
′‑
环丙烷]-4-基氧基-3-吡啶基)-3h-咪唑并[4,5-c]吡啶-2-酮;盐酸盐
[0358][0359]
向n4-(6-螺[2h-苯并呋喃-3,1
′‑
环丙烷]-4-基氧基-3-吡啶基)吡啶-3,4-二胺(230mg,664μmol)在mecn(3ml)中的混合物一次加入cdi(215mg,1.33mmol)。将混合物在60℃下搅拌4h。将混合物通过制备型hplc纯化并且冻干,以得到标题化合物(105mg,255μmol,产率38.4%),其为灰白色固体。ms(esi):m/z=373.0[m+h]
+
[0360]
步骤a)n-(3-硝基-4-吡啶基)-6-螺[2h-苯并呋喃-3,1
′‑
环丙烷]-4-基氧基-吡啶-3-胺
[0361]
将实例a.1(150mg,590μmol)、4-氯-3-硝基吡啶(93.5mg,590μmol)和k2co3(122mg,885μmol)在dmf(2.00ml)中的混合物在100℃下搅拌1.5h。将混合物用水(60ml)稀释并且用乙酸乙酯(80ml x 3)萃取,将有机相用盐水(10ml x 3)洗涤并且经硫酸钠干燥,过滤,并且在真空下浓缩,以得到标题化合物(285mg,粗产物),其为黄色油状物,其不经进一步纯化即可直接使用。ms(esi):m/z=377.3[m+h]
+
[0362]
步骤b)n4-(6-螺[2h-苯并呋喃-3,1
′‑
环丙烷]-4-基氧基-3-吡啶基)吡啶-3,4-二胺
[0363]
在n2下,向n-(3-硝基-4-吡啶基)-6-螺[2h-苯并呋喃-3,1
′‑
环丙烷]-4-基氧基-吡啶-3-胺(285mg,757μmol)在thf(5ml)中的溶液加入pd/c(0.03g,纯度10%)。将悬浮液在真空下脱气并且用h2吹扫三次。在h2(20psi)下,将混合物在20℃下搅拌8h。过滤混合物以去除pd/c,过滤垫用thf(500ml)洗涤并且在真空下浓缩,以得到标题化合物(230mg,粗产物),其为黄色固体,其不经纯化即可直接使用。
[0364]
类似于实例6,实例8、11、17、23、44、45、46、51由胺结构单元a.x以及邻卤代硝基(杂)芳基或对卤代硝基(杂)芳基,使用一系列亲核芳族取代、硝基基团胺的还原以及二胺与cdi的缩合而生成。(*diea在步骤a中用作碱)对于实例44、45和46)
[0365]
[0366][0367]
实例12
[0368]
3-(6-螺[2h-苯并呋喃.3,1
′‑
环丙烷]-4-基氧基-3-吡啶基)-1h-咪唑并[4,5-c]吡啶-2-酮;甲酸盐
[0369][0370]
向n3-(6-螺[2h-苯并呋喃-3,1
′‑
环丙烷]-4-基氧基-3-吡啶基)吡啶-3,4-二胺
(140mg,0.400mmol)在thf(5ml)中的溶液加入n.n
′‑
羰基二咪唑(262mg,1.62mmol)。将混合物在60℃下搅拌5h。将混合物浓缩以得到残余物,将其通过制备型hplc(fa)纯化并且冻干,以得到标题化合物(106mg,0.250mmol,产率62.7%),其为白色固体。ms(esi):m/z=373.1[m+h]
+
[0371]
步骤a)2-硝基-n-(6-螺[2h-苯并呋喃-3,1
′‑
环丙烷]-4-基氧基-3-吡啶基)吡啶-3-胺
[0372]
在25℃下,向6-螺[2h-苯并呋喃-3,1
′‑
环丙烷]-4-基氧基吡啶-3-胺(实例a.1)(150mg,0.590mmol)和3-溴-4-硝基吡啶(144mg,0.710mmol)在1,4-二噁烷(15ml)中的混合物加入xantphos(68.3mg,0.120mmo)、二乙酸钯(13.2mg,0.06mmol)和碳酸钾(163mg,1.18mmol)。然后将混合物在80℃下搅拌16h。将混合物过滤并且真空浓缩,以得到粗产物,将其通过柱(pe∶etoac(包含30%etoh)=20∶1至3∶1)纯化,以得到n-(4-硝基-3-吡啶基)-6-螺[2h-苯并呋喃-3,1
′‑
环丙烷]-4-基氧基-吡啶-3-胺(210mg,0.560mmol,产率94.59%),其为黄色固体。ms(esi):m/z=377.4[m+h]
+
[0373]
步骤a)n3-(6-螺[2h-苯并呋喃-3,1
′‑
环丙烷]-4-基氧基-3-吡啶基)吡啶-3,4-二胺
[0374]
向2-硝基-n-(6-螺[2h-苯并呋喃-3,1
′‑
环丙烷]-4-基氧基-3-吡啶基)吡啶-3-胺(220mg,0.580mmol)在乙醇(4ml)/水(1ml)中的溶液加入zn粉(150mg,2.34mmol)和氯化铵(124mg,2.34mmol)。将混合物在25℃下搅拌2h。向混合物加入na2so4并且将混合物搅拌5分钟。将混合物过滤并且浓缩滤液,以得到粗制n3-(6-螺[2h-苯并呋喃-3,1
′‑
环丙烷]-4-基氧基-3-吡啶基)吡啶-2,3-二胺(237mg,0.680mmol,产率117%),其为黄色固体。ms(esi):m/z=347.5[m+h]
+
[0375]
类似于实例12,下表的实例13、14、27由胺结构单元a.x以及邻卤代硝基(杂)芳基或对卤代硝基(杂)芳基生成。
[0376][0377]
实例15
[0378]
2-异丙基-4-[[5-(8-氧代-7h-嘌呤-9-基)-2-吡啶基]氧基]苯甲腈
[0379][0380]
向4-[(5-氨基-2-吡啶基)氧基]-2-异丙基-苯甲腈(实例a.7)(75.4mg,0.30mmol)和n-(4-氯嘧啶-5-基)氨基甲酸乙酯(60mg,0.30mmol)在1,4-二噁烷(4ml)中的混合物在25℃下加入xantphos(17.2mg,0.030mmol)、1,1
′‑
双(二苯基膦基)二茂铁-二氯化钯(ii)二氯甲烷复合物(12.1mg,0.010mmol)和碳酸铯(194mg,0.600mmol)。然后将混合物在90℃下搅拌16h。过滤混合物并且将滤液浓缩以得到残余物,将其通过制备型hplc(fa)纯化并且冻干,以得到2-异丙基-4-[[5-(8-氧代-7h-嘌呤-9-基)-2-吡啶基]氧基]苯甲腈(43.6mg,0.120mmol,产率37.4%),其为淡黄色固体。ms(esi):m/z=373.1[m+h]
+
[0381]
步骤a)n-(4-氯嘧啶-5-基)氨基甲酸乙酯
[0382]
向4-氯嘧啶-5-胺(1000mg,7.72mmol)在吡啶(10ml)中的溶液加入氯甲酸乙酯
(1.89ml,21.2mmol)。将混合物在0℃下搅拌2h。去除溶剂以得到残余物,将其通过快速色谱法(石油醚/乙酸乙酯=20∶1至3∶1)纯化,并且浓缩,以得到n-(4-氯嘧啶-5-基)氨基甲酸乙酯(80mg,0.400mmol,产率5.1%),其为白色固体。ms(esi):m/z=202.1[m+h]
+
[0383]
类似于实例15,实例18、24、25由胺结构单元a.x和相关的氨基甲酸乙酯生成。
[0384][0385][0386]
实例16
[0387]
2-异丙基-4-[[5-(2-氧代-3h-咪唑并[4,5-c]吡啶-1-基)-2-吡啶基]氧基]苯甲腈
[0388][0389]
向4-羟基-2-异丙基-苯甲腈(cas:14114-32-0)(130mg,0.810mmol)在nmp(4ml)中的溶液加入1-(6-氯-3-吡啶基)-3h-咪唑并[4,5-c]吡啶-2-酮(200mg,0.810mmol)和碳酸钾(168mg,1.22mmol)。在微波下,将混合物在密封管中在200℃下搅拌4h。将混合物过滤,并且通过制备型hplc(fa)纯化滤液,并且冻干,以得到2-异丙基-4-[[5-(2-氧代-3h-咪唑并
[4,5-c]吡啶-1-基)-2-吡啶基]氧基]苯甲腈(8mg,0.020mmol,产率2.7%),其为灰色固体。ms(esi):m/z=372.3[m+h]
+
[0390]
步骤a)6-氯-n-(3-硝基-4-吡啶基)吡啶-3-胺
[0391]
向2-氯-5-碘吡啶(10g,41.8mmol)在1,4-二噁烷(100ml)中的溶液加入4-氨基-3-硝基吡啶(5.81g,41.8mmol)、三(二亚苄基丙酮)二钯(0)(1.91g,2.09mmol)和xantphos(2.42g,4.18mmol)和碳酸铯(20.4g,62.6mmol)。将混合物在90℃下搅拌4h。将混合物过滤并且浓缩滤液,以得到残余物,将其通过硅胶柱色谱法纯化(用石油醚/乙酸乙酯=10∶1至0∶1洗脱)并且浓缩,以得到6-氯-n-(3-硝基-4-吡啶基)吡啶-3-胺(9.2g,36.7mmol,产率87.9%),其为黄色固体。ms(esi):m/z=251.5[m+h]
+
[0392]
步骤b)n4-(6-氯-3-吡啶基)吡啶-3,4-二胺
[0393]
向6-氯-n-(3-硝基-4-吡啶基)吡啶-3-胺(300mg,1.2mmol)在乙醇(6ml)/水(2ml)中的溶液加入铁(668mg,12.0mmol)和氯化铵(323mg,5.98mmol)。将混合物在70℃下搅拌4h。将混合物过滤并且固体用etoh洗涤三次。将合并的有机层浓缩,以得到n4-(6-氯-3-吡啶基)吡啶-3,4-二胺(400mg,1.81mmol,粗产率151%),其为黄色固体。ms(esi):m/z=220.9[m+h]
+
[0394]
步骤c)1-(6-氯-3-吡啶基)-3h-咪唑并[4,5-c]吡啶-2-酮
[0395]
向n4-(6-氯-3-吡啶基)吡啶-3,4-二胺(100mg,0.450mmol)在mecn(2ml)中的溶液加入n.n
′‑
羰基二咪唑(147mg,0.910mmol)。将混合物在60℃下搅拌3h。将混合物浓缩,以得到残余物。向混合物加入meoh并且对混合物进行过滤。滤液通过制备型hplc(fa)纯化,以得到1-(6-氯-3-吡啶基)-3h-咪唑并[4,5-c]吡啶-2-酮(20mg,0.080mmol,产率17.9%),其为淡灰色固体。ms(esi):m/z=247.0[m+h]
+
[0396]
类似于实例16,在最终步骤中实例26使用相应的苯酚结构单元生成。
[0397][0398]
实例19
[0399]
2-异丙基-4-[[5-(2-氧代-3h-苯并咪唑-1-基)-2-吡啶基]氧基]苯甲腈
[0400]
[0401]
向4-羟基-2-异丙基-苯甲腈(cas:14114-32-0)(0.200g,1.36mmol)和3-(6-氯-3-吡啶基)-1h-苯并咪唑-2-酮(303mg,1.24mmol)在nmp(6.0ml)中的溶液加入k2co3(205mg,1.48mmol),并且将混合物加热至200℃下并搅拌5h。将混合物冷却至25℃并用ea(50ml)稀释并用h2o(50ml)洗涤,然后用nacl水溶液(50ml)洗涤,并且用无水mgso4干燥以得到残余物,将其通过制备型hplc纯化,以得到标题化合物(33.0mg,88.4μmol,产率7.84%),其为白色固体。ms(esi):m/z=371.2[m+h]
+
[0402]
步骤a)6-氯-n-(2-硝基苯基)吡啶-3-胺
[0403]
将2-氯-5-碘吡啶(20.0g,83.5mmol)、2-硝基苯胺(11.5g,83.5mmol)、pd(oac)2(1.88g,8.35mmol)、tea(8.45g,83.5mmol,11.6ml)、cs2co3(136g,418mmol)和binap(1.56g。2.51mmol)在甲苯(400ml)中的混合物脱气,并且用n2吹扫3次,然后在n2气氛下将混合物在110℃下搅拌48h。将粗反应混合物用乙酸乙酯(100ml x 3)和盐水(100ml x 3)洗涤。将水相用乙酸乙酯(100ml)再次萃取。将合并的有机相用无水na2so4干燥,过滤,并且真空浓缩。粗产物用混合溶剂(石油醚∶乙酸乙酯=3∶1,250ml)研磨,以得到标题化合物(13g),其为红色固体。ms(esi):m/z=250.0[m+h]
+
[0404]
步骤b)n2-(6-氯-3-吡啶基)苯-1,2-二胺
[0405]
将6-氯-n-(2-硝基苯基)吡啶-3-胺(12.0g,48.1mmol)和sncl2·
2h2o(54.2g,240mmol)在etoh(200ml)中的混合物在70℃下搅拌2h。将反应混合物蒸干。将所得的粗油状物溶解在etoac(250ml)中并且用naoh 1m(200ml)处理。将双相系统剧烈搅拌20分钟以允许锡盐完全沉淀。然后将介质通过烧结漏斗经硅藻土过滤并且用etoac(100ml x 3)充分洗涤。有机层用盐水(300ml)洗涤,并且有机层最后经na2so4干燥,过滤,并且在减压下浓缩滤液。将残余物用硅胶色谱柱通过用pe∶ea=10∶1至3∶1洗脱来纯化,以得到标题化合物(8.00g,34.2mmol,产率71.1%,纯度93.8%),其为棕色固体。ms(esi):m/z=220.2[m+h]
+
[0406]
步骤c)3-(6-氯-3-吡啶基)-1h-苯并咪唑-2-酮
[0407]
向n2-(6-氯-3-吡啶基)苯-1,2-二胺(6.40g,29.1mmol)在dcm(300.0ml)中的溶液加入吡啶(9.22g,117mmol,9.41ml)并且在0℃下搅拌。在30分钟的时间段内小心加入三光气(3.29g,11.1mmol)在dcm(100ml)中的溶液,将混合物在0℃下搅拌1h并且加热至25℃持续2h。混合物用hcl(0.5m(水溶液),150ml x 2)洗涤,将有机相在真空下浓缩,以得到粗产物。用nahco3将水相调整为ph约为8,用乙酸乙酯(300mlx 3)萃取并且在真空下浓缩,以得到粗产物。合并的粗产物(6.71g,27.3mmol,产率93.8%),其为白色固体,其不经纯化即可直接使用。ms(esi):m/z=246.1[m+h]
+
[0408]
类似于实例19,在最终步骤中实例20至22使用相应的苯酚结构单元生成。
[0409][0410]
实例30
[0411]
1-[6-(3-甲氧基-4-甲基-苯氧基)-3-吡啶基]-3h-咪唑并[4,5-b]吡啶-2-酮
[0412][0413]
在室温下,向3-n-[6-(3-甲氧基-4-甲基苯氧基)吡啶-3-基]吡啶-2,3-二胺(70mg,0.18mmol)在dcm(4ml)中的溶液加入三乙胺(0.07ml,0.53mmol)并且冷却至0℃,然后在相同温度下逐滴加入三光气(26mg,0.09mmol)在dcm(1ml)中的溶液并且将反应混合物在室温下搅拌1.5h。将反应混合物用水(20ml)稀释并且用dcm(20ml x 2)萃取。将有机层用盐水(20ml)洗涤,干燥,过滤,并且在减压下浓缩。然后粗材料通过快速色谱法纯化(用0%至10%meoh/dcm的梯度洗脱),以得到标题化合物(12.0mg,19%),其为棕色固体。ms(esi):m/z=348.9[m+h]
+
[0414]
步骤a)n-[6-(3-甲氧基-4-甲基苯氧基)吡啶-3-基]氨基甲酸叔丁酯
[0415]
在0℃下,向6-(3-甲氧基-4-甲基苯氧基)吡啶-3-胺(a.3)(100mg,0.43mmol)和二碳酸二叔丁酯(0.15ml,0.65mmol)在dcm(3ml)中的混合物加入三乙胺(0.2ml,1.30mmol)。
然后将混合物在25℃下搅拌24h。然后将反应混合物真空浓缩从而得到残余物,将其经由硅胶色谱法(0%至40%乙酸乙酯/己烷)纯化,以得到n-[6-(3-甲氧基-4-甲基苯氧基)吡啶-3-基]氨基甲酸叔丁酯(110mg,77%),其为无色粘性固体。ms(esi):m/z=330.8[m+h]
+
[0416]
步骤b)n-[6-(3-甲氧基-4-甲基苯氧基)吡啶-3-基]-n-(2-硝基吡啶-3-基)氨基甲酸叔丁酯
[0417]
向n-[6-(3-甲氧基-4-甲基苯氧基)吡啶-3-基]氨基甲酸叔丁酯(140mg,0.42mmol)在dmf(2ml)中的搅拌溶液加入3-氟-2-硝基吡啶(61mg,0.42mmol)和碳酸铯(346mg,1.06mmol)。然后将反应混合物在80℃下搅拌2h。将反应混合物用冰水(20ml)稀释并且用乙酸乙酯(20ml x 3)萃取。将合并的有机层用盐水(30ml)洗涤,干燥,过滤,并且在减压下浓缩。由此获得的粗材料通过快速色谱法(0%至50%etoac/己烷)纯化,以得到n-[6-(3-甲氧基-4-甲基苯氧基)吡啶-3-基]-n-(2-硝基吡啶-3-基)氨基甲酸叔丁酯(150mg,78%),其为微黄色粘性固体。ms(esi):m/z=452.7[m+h]
+
[0418]
步骤c)n-(2-氨基吡啶-3-基)-n-[6-(3-甲氧基-4-甲基苯氧基)吡啶-3-基]氨基甲酸叔丁酯
[0419]
在25℃下,向n-[6-(3-甲氧基-4-甲基苯氧基)吡啶-3-基]-n-(2-硝基吡啶-3-基)氨基甲酸叔丁酯(150mg,0.33mmol)在甲醇(6ml)和1滴水中的搅拌溶液加入锌粉(152mg,2.32mmol)和nh4cl(196mg,3.65mmol),并且将反应混合物在90℃下搅拌1h。通过硅藻土过滤反应混合物并且蒸发滤液。将残余物用dcm(50ml)稀释,并且用水(30ml)洗涤。将有机层干燥,过滤,并且真空浓缩,以得到n-(2-氨基吡啶-3-基)-n-[6-(3-甲氧基-4-甲基苯氧基)吡啶-3-基]氨基甲酸叔丁酯(130mg,93%),其为淡棕色固体。ms(esi):m/z=422.7[m+h]
+
[0420]
步骤d)3-n-[6-(3-甲氧基-4-甲基苯氧基)吡啶-3-基]吡啶-2,3-二胺
[0421]
向n-(2-氨基吡啶-3-基)-n-[6-(3-甲氧基-4-甲基苯氧基)吡啶-3-基]氨基甲酸叔丁酯(130mg,0.31mmol)中加入在0℃下预先冷却的4n hcl在二噁烷(3ml)中的溶液,并且将反应混合物在室温下搅拌1h。将反应混合物在减压下浓缩,并且将残余物研磨并在减压下干燥,以得到3-n-[6-(3-甲氧基-4-甲基苯氧基)吡啶-3-基]吡啶-2,3-二胺的hcl盐(90mg,98%),其为微黄色固体,其不经进一步纯化即可直接使用。(通过tlc监测。)
[0422]
类似于实例30,在步骤b)中实例31至33使用相应的氟-硝基吡啶结构单元生成。
[0423]
[0424][0425]
实例34
[0426]
3-[6-(3-甲氧基-4-甲基-苯氧基)-3-吡啶基]-1h-苯并咪唑-2-酮
[0427][0428]
将1-n-[6-(3-甲氧基-4-甲基苯氧基)吡啶-3-基]苯-1,2-二胺(40mg,0.12mmol)和三乙胺(0.052ml,0.37mmol)在dcm(3ml)中的溶液在氩气下冷却至0℃。逐滴加入三光气(18mg,0.06mmol)在dcm(1ml)中的溶液,并且搅拌30分钟,保持温度不变。将反应物料用水(10ml)猝灭并且用dcm(10ml
×
3)萃取。将合并的有机部分用盐水(10ml)洗涤,干燥,过滤并且真空浓缩,以得到粗品,将其通过快速色谱法纯化,用10%至50%etoac在己烷中的溶液洗脱,以得到标题化合物(31mg,72%),其为灰白色固体。ms(esi):m/z=348.2[m+h]
+
[0429]
步骤a)6-(3-甲氧基-4-甲基苯氧基)-n-(2-硝基苯基)吡啶-3-胺
[0430]
将6-(3-甲氧基-4-甲基苯氧基)吡啶-3-胺(a.3)(122mg,0.53mmol)和碳酸铯(432mg,1.33mmol)在1,4-二噁烷(4ml)中的混合物用氩气脱气5分钟,然后加入1-溴-2-硝基苯(107mg,0.53mmol)、pd2dba3(49mg,0.053mmol)和xantphos(46mg,0.079mmol)。然后将反应混合物密封并且在90℃下加热18h。通过硅藻土床过滤反应物料并且用etoac(50ml)洗涤。将合并的有机部分用水(20ml)、盐水(20ml)洗涤,干燥,过滤并且真空浓缩,以得到粗品,将其通过快速色谱法纯化,用2%至5%etoac在己烷中的溶液洗脱,以得到标题化合物(156mg,84%),其为棕色胶状物。ms(esi):m/z=351.9[m+h]
+
[0431]
步骤b)1-n-[6-(3-甲氧基-4-甲基苯氧基)吡啶-3-基]苯-1,2-二胺
[0432]
将6-(3-甲氧基-4-甲基苯氧基)-n-(2-硝基苯基)吡啶-3-胺(150mg,0.43mmol)、锌粉(195mg,2.99mmol)和氯化铵(251mg,4.7mmol)在甲醇(8ml)和水(0.03ml)中的混合物加热回流1h。通过烧结漏斗过滤反应混合物并且将滤液真空浓缩。将残余物用etoac(50ml)稀释并且用水(20ml x 2)、盐水(10ml)洗涤,干燥,过滤并且真空浓缩,以得到标题化合物
(130mg,95%),其为棕色固体。ms(esi):m/z=321.9[m+h]
+
[0433]
实例38
[0434]
3,5-二甲基-4-[[5-(2-氧代-1h-咪唑并[4,5-b]吡啶-3-基)-2-吡啶基]氧基j苯甲腈
[0435][0436]
图书馆化学协议:
[0437]
向4-[[5-[(3-氨基-2-吡啶基)氨基]-2-吡啶基]氧基]-3,5-二甲基-苯甲腈(1当量)在thf(0.2m)中的混合物一次加入cdi(3当量)、吡啶(2.5当量)。将混合物在65℃下搅拌3h。将反应混合物浓缩以去除thf。通过制备型hplc来纯化粗产物,以得到最终产物(24.5mg,经历5个步骤的产率为1.7%)。ms(esi):m/z=358.0[m+h]
+
[0438]
步骤a)3,5-二甲基-4-[(5-硝基-2-吡啶基)氧基]苯甲腈
[0439]
向4-羟基-3,5-二甲基-苯甲腈(4.0mmol,1.0当量)和2-氯-5-硝基吡啶(4.0mmol,1.0当量)在dmf(5.0ml)中的混合物一次加入k2co3(4mmol,1.0当量)。将混合物在100℃下搅拌1h。将混合物倒入水(10ml)中,然后用乙酸乙酯(10ml
×
3)萃取。通过speedvac浓缩合并的有机相,以得到粗产物,其直接用于下一步骤。
[0440]
步骤b)4-[(5-氨基-2-吡啶基)氧基]-3,5-二甲基-苯甲腈
[0441]
向3,5-二甲基-4-[(5-硝基-2-吡啶基)氧基]苯甲腈(4.0mmol,1.00当量)在meoh(10ml)中的溶液加入pd(oh)2(56mg,纯度10.0%,1.00当量),然后加入三乙基硅烷(4.0ml)。将混合物在20℃下搅拌1h。过滤混合物以去除pd(oh)2,用meoh(10ml x 3)洗涤并且通过speedvac浓缩,以得到粗产物,其直接用于下一步骤。
[0442]
步骤c)3,5-二甲基-4-[[5-[(3-硝基-2-吡啶基)氨基]-2-吡啶基]氧基]苯甲腈
[0443]
加入4-[(5-氨基-2-吡啶基)氧基]-3,5-二甲基-苯甲腈(1.8mmol,1.0当量)和2-氟-3-硝基吡啶(2.7mmol,1.5当量)在nmp(4ml)中的混合物一次加入cs2co3(2.7mmol,1.5当量)。将混合物在微波加热下于200℃下搅拌4小时。将混合物倒入10ml的水中,然后用乙酸乙酯(10ml
×
3)萃取。通过speedvac浓缩合并的有机相,以得到粗产物,其直接用于下一步骤。
[0444]
[在某些情况下,使用了修饰:dmso、cs2co3(1.5当量),在100℃下搅拌16h,然后过滤并且通过hplc纯化]。
[0445]
步骤d)4-[[5-[(3-氨基-2-吡啶基)氨基]-2-吡啶基]氧基]-3,5-二甲基-苯甲腈
[0446]
向3,5-二甲基-4-[[5-[(3-硝基-2-吡啶基)氨基]-2-吡啶基]氧基]苯甲腈(1.00当量)在meoh(0.1m)中的溶液加入pd(oh)2(纯度10.0%,0.1当量),然后加入三乙基硅烷(10.0当量)。将混合物在20℃下搅拌1h。将混合物过滤并且通过speedvac浓缩,以得到粗产物,其直接用于下一步骤。
[0447]
类似于实例38,在步骤a)中实例39至41使用相应的苯酚结构单元生成。
[0448][0449]
实例42
[0450]
1-[6-(3-氯-4-甲基-苯氧基)-3-吡啶基]-3h-咪唑并[4,5-c]吡啶-2-酮
[0451][0452]
向n4-[6-(3-氯-4-甲基-苯氧基)-3-吡啶基]吡啶-3,4-二胺(901mg,2.76mmol)在thf(15ml)中的溶液加入cdi(1.34g,8.27mmol)和吡啶(545mg,6.89mmol,0.556ml)。将混合物在65℃下搅拌3h。在减压下去除溶剂。将残余物通过制备型hplc(碱性条件)纯化。获得标题化合物(468mg、1.31mmol、产率47.7%、纯度99.1%),其为白色固体。ms(esi):m/z=353.0[m+h]
+
[0453]
步骤a)2-(3-氯-4-甲基-苯氧基)-5-硝基-吡啶
[0454]
向3-氯-4-甲基-苯酚(428g,3.0mol)和2-氯-5-硝基-吡啶(476g,3.00mo1)在dmf(5ml)中的混合物一次加入k2co3(415mg,3.00mmol)。将混合物在100℃下搅拌1h。将混合物冷却至20℃并且在40℃下在减压下浓缩。将残余物倒入水(8ml)中。水相用乙酸乙酯(10ml x 3)萃取。将合并的有机相用无水na2so4干燥,过滤,并且真空浓缩。获得标题化合物(820mg,粗产物),其为黄色固体,其不经进一步纯化即可用于下一步骤。ms(esi):m/z=265.1[m+h]
+
[0455]
b)6-(3-氯-4-甲基-苯氧基)吡啶-3-胺
[0456]
向2-(3-氯-4-甲基-苯氧基)-5-硝基-吡啶(820mg,3.10mmol)在meoh(15ml)中的溶液加入pd(oh)2(43.5mg,310μmol),然后加入三乙基硅烷(3.01g,25.9mmol,4.13ml)。将混合物在20℃下搅拌2h。溶液变为无色。将混合物过滤并且通过speedvac浓缩。获得标题化合物(701mg,粗产物),其为黄色固体,其不经进一步纯化即可用于下一步骤。ms(esi):m/z=234.9[m+h]
+
[0457]
步骤c)6-(3-氯-4-甲基-苯氧基)-n-(3-硝基-4-吡啶基)吡啶-3-胺
[0458]
向6-(3-氯-4-甲基-苯氧基)吡啶-3-胺(701mg,2.99mmol)和4-氯-3-硝基吡啶(947mg,5.97mmol)在二噁烷(15ml)中的混合物一次加入柠檬酸水合物(1.26g,5.97mmol,1.39ml)。将混合物在80℃下搅拌16h。将混合物冷却至20℃并且减压浓缩。残余物用饱和na2co3水溶液(30ml)稀释。水相用乙酸乙酯(30ml x 3)萃取。合并的有机相用无水na2so4干燥,过滤,并且在真空下浓缩。获得标题化合物(911mg,粗产物),其为白色固体,其不经进一步纯化即可用于下一步骤。ms(esi):m/z=357.2[m+h]
+
[0459]
步骤d)n4-[6-(3-氯-4-甲基-苯氧基)-3-吡啶基]吡啶-3,4-二胺
[0460]
向6-(3-氯-4-甲基-苯氧基)-n-(3-硝基-4-吡啶基)吡啶-3-胺(911mg,2.55mmol)在meoh(20ml)中的溶液加入三乙基硅烷(2.52g,21.7mmol,3.47ml),然后加入pd(oh)2(35.9mg,255μmol)。将混合物在20℃下搅拌1h。将反应混合物过滤并且在减压下浓缩。获得标题化合物(892mg,粗产物),其为淡黄色固体,其不经进一步纯化即可用于下一步骤。ms(esi):m/z=327.1[m+h]
+
[0461]
实例43
[0462]
9-[6-(3-甲氧基-4-甲基-苯氧基)-3-吡啶基]-7h-嘌呤-8-酮
[0463][0464]
向n4-[6-(3-甲氧基-4-甲基-苯氧基)-3-吡啶基]嘧啶-4,5-二胺(240mg,0.742mmol)在mecn(5.00ml)中的溶液加入cdi(241mg,1.48mmol),将所形成的混合物在40℃下搅拌4h。将混合物在真空下浓缩以得到粗产物,将其通过制备型hplc纯化并且冻干,以得到不纯的标题化合物(56.0mg,0.160mmol,产率21.6%),将其通过制备型hplc再纯化并且冻干,以得到标题化合物(19.5mg,55.3μmol,产率34.51%,纯度98.9%),其为白色固体。ms(esi):m/z=350.1[m+h]
+
[0465]
步骤a)5-溴-n-[6-(3-甲氧基-4-甲基-苯氧基)-3-吡啶基]嘧啶-4-胺
[0466]
向6-(3-甲氧基-4-甲基苯氧基)吡啶-3-胺(a.3)(1.00g,4.34mmol)和4-氯-5-溴嘧啶(840mg,4.34mmol)在nmp(4.00ml)中的混合物加入tsoh
·
h2o(826mg,4.34mmol)。然后将混合物在80℃下搅拌2h。将反应混合物过滤,加入水(20.0ml),并且将混合物用乙酸乙酯(20.0ml x 3)萃取。将合并的有机层用盐水(30.0ml)洗涤,经na2so4干燥,过滤,并且在减压下浓缩,以得到残余物。将残余物通过柱色谱法纯化(用石油醚/乙酸乙酯=100%至0%梯度洗脱)并且在真空下浓缩,以得到标题化合物(1.50g,3.87mmol,产率89.2%),其为黄色固体。ms(esi):m/z=387.0[m+h]
+
[0467]
步骤b)n4-[6-(3-甲氧基-4-甲基-苯氧基)-3-吡啶基]-n5-[(4-甲氧基苯基)甲
基]嘧啶-4,5-二胺
[0468]
在n2下,向5-溴-n-[6-(3-甲氧基-4-甲基-苯氧基)-3-吡啶基]嘧啶-4-胺(1.50g,3.87mmol)和(4-甲氧基苯基)甲胺(797mg,5.81mmol,752μl)在叔戊醇(15.0ml)中的混合物一次加入tbuxphos pd g3(154mg,194μmol)、tbuona(2.00m,5.81ml)。将混合物在n2下于90℃搅拌12h。向反应混合物加入水(50.0ml)并且用乙酸乙酯(50.0ml
×
3)萃取。合并的有机层用盐水(100ml)洗涤,经na2so4干燥,过滤,并且在减压下浓缩,以得到残余物。将其通过柱色谱法纯化(用石油醚/乙酸乙酯=100%至0%梯度洗脱),以得到标题化合物(250mg,564μmol,产率14.6%),其为棕色液体。ms(esi):m/z=444.2[m+h]
+
[0469]
步骤c)n4-[6-(3-甲氧基-4-甲基-苯氧基)-3-吡啶基]嘧啶-4,5-二胺
[0470]
在n2下,向n4-[6-(3-甲氧基-4-甲基-苯氧基)-3-吡啶基]-n5-[(4-甲氧基苯基)甲基]嘧啶-4,5-二胺(250mg,564μmol)在dcm(10.0ml)中的混合物一次加入tfa(4.00ml)。将混合物在20℃下搅拌2h。将混合物倒入饱和碳酸钠水溶液(30.0ml)中,并且用dcm(30.0ml x 3)萃取。然后将合并的有机相经无水na2so4干燥,过滤,并且浓缩,以得到标题化合物(240mg,粗产物),其为棕色油状物,其不经进一步纯化即可直接使用。ms(esi):m/z=324.1[m+h]
+
[0471]
实例48
[0472]
3-[6-(3-甲氧基-4-甲基-苯氧基)-3-吡啶基]-1h-咪唑并[4,5-b]吡嗪-2-酮
[0473][0474]
向n3-[6-(3-甲氧基-4-甲基-苯氧基)-3-吡啶基]吡嗪-2,3-二胺(213mg,660μmol)在thf(6ml)中的混合物一次加入cdi(641mg,3.96mmol)、吡啶(313mg,3.96mmol)。将混合物在65℃下搅拌2h。将反应混合物浓缩以去除thf。残余物通过制备型hplc纯化。获得标题化合物(82.5mg,产率35.6%,纯度90%),其为黄色固体,然后通过制备型hplc再纯化,以获得标题化合物(32.3mg,产率14.3%),其为黄色固体。ms(esi):m/z=350.2[m+h]
+
[0475]
步骤a)3-氯-n-[6-(3-甲氧基-4-甲基-苯氧基)-3-吡啶基]吡嗪-2-胺
[0476]
在n2的保护下,向6-(3-甲氧基-4-甲基苯氧基)吡啶-3-胺(a.3)(2.00mmol)在thf(18ml)中的溶液在0℃下逐滴加入nahmds溶液(4.0ml,1.0m在thf中的溶液,2.0当量)。将反应混合物升温至30℃并且搅拌8h。将2,3-二氯吡嗪(4.00mmol,2.0当量)加入上述溶液中。将反应混合物在30℃下再搅拌16h。残余物通过快速硅胶色谱法纯化。获得标题化合物,其为黄色油状物(498mg,产率72.7%)。
[0477]
步骤b)n-[6-(3-甲氧基-4-甲基-苯氧基)-3-吡啶基]四唑并[1,5-a]吡嗪-8-胺
[0478]
在n2下,向3-氯-n-[6-(3-甲氧基-4-甲基-苯氧基)-3-吡啶基]吡嗪-2-胺(200mg,583μmol)在dmf(2ml)中的混合物在25℃下一次加入nan3(130mg,2.00mmol)。将混合物加热至100℃并且搅拌20h。将混合物冷却至25℃并且倒入冰水(w/w=1/l)(6ml)中并搅拌10分钟。水相用乙酸乙酯(20ml x 2)萃取。将合并的有机相用盐水(20ml x 2)洗涤,用无水na2so4干燥,过滤,并且真空浓缩。获得标题化合物(200mg,粗产物),其为黄色固体,其不经进一步纯化即可直接使用。ms(esi):m/z=350.2[m+h]
+
[0479]
步骤c)n3-[6-(3-甲氧基-4-甲基-苯氧基)-3-吡啶基]吡嗪-2,3-二胺
[0480]
在n2下,向n-[6-(3-甲氧基-4-甲基-苯氧基)-3-吡啶基]四唑并[1,5-a]吡嗪-8-胺(190mg,489μmol)在h2o(10ml)、1-丁醇(10ml)和etoh(10ml)中的混合物在25℃下一次加入fe(1.37g,24.5mmol)和nh4cl(2.62g,49.0mmol)。将混合物加热至100℃并且搅拌13h。以进一步一次加入fe(4.10g,73.4mmol)和nh4cl(7.85g,147mmol)。将混合物在120℃下搅拌5h。将混合物冷却至25℃。过滤混合物并且将滤液在40℃下减压浓缩。将残余物倒入冰水(w/w=1/1)(20ml)中并且搅拌10分钟。水相用乙酸乙酯(30ml x 2)萃取。将合并的有机相用盐水(30ml x 2)洗涤,用无水na2so4干燥,过滤并且真空浓缩。获得标题化合物(170mg,粗产物),其为黄色油状物,其不经进一步纯化即可直接使用。ms(esi):m/z=324.2[m+h]
+
[0481]
实例52
[0482]
3-异丙基-4-[3-(2-氧代-1h-咪唑并[4,5-b]吡啶-3-基)环丁氧基]苯甲腈
[0483][0484]
向外消旋-3-((1r,3r)-3-羟基环丁基)-1,3-二氢-2h-咪唑并[4,5-b]吡啶-2-酮(50mg,244μmol)在无水dmf(1.5ml)中的溶液加入nah(20.5mg,512μmol),并且将反应混合物在室温下搅拌15分钟,然后加入4-氯-3-异丙基苯甲腈(c.2)(52.5mg,292μmol)。将反应混合物在80℃下搅拌60分钟,然后在微波辐射下在110℃下搅拌30分钟。然后将反应混合物在110℃下再搅拌16h。反应混合物通过加入几滴饱和nh4cl水溶液来猝灭,并且对粗溶液直接进行反相hplc纯化,以得到21.4mg的标题化合物。ms(esi):m/z=349.2[m+h]
+
[0485]
步骤b)外消旋-1-(2-溴吡啶-3-基)-3-((1r,3r)-3-羟基环丁基)脲
[0486]
在惰性气氛下,向2-溴吡啶-3-胺(0.5g,2.89mmol)在无水thf(10ml)中的溶液加入dipea(392mg,530μl,3.03mmol)和氯甲酸苯酯(475mg,382μl,3.03mmol),将反应混合物在室温下搅拌4h。加入外消旋-(1r,3r)-3-氨基环丁-1-醇盐酸盐(cas:1205037-95-1)(375mg,3.03mmol)和dipea(784mg,1.06ml,6.07mmol),然后将反应混合物在70℃下搅拌16h。反应混合物用乙酸乙酯稀释并且用na2co
3 2m水溶液萃取,收集有机相,并且将水相用乙酸乙酯反萃取。将合并的有机相经硫酸钠干燥,并且将其蒸干。粗材料通过快速色谱法纯化,用二氯甲烷和甲醇(0%至10%)的混合物洗脱,以得到695mg的标题化合物。ms(esi):m/z=288.1[m+h]
+
[0487]
步骤c)外消旋-3-((1r,3r)-3-羟基环丁基)-1,3-二氢-2h-咪唑并[4,5-b]吡啶-2-酮
[0488]
在惰性气氛下,向外消旋-1-(2-溴吡啶-3-基)-3-((1r,3r)-3-羟基环丁基)脲(650mg,2.27mmol)在干燥二噁烷(15ml)中的悬浮液加入dppf(126mg,227μmol)、pd2(dba)3(104mg,114μmol)和叔丁醇钠(546mg,5.68mmol)。将反应混合物在室温下搅拌10分钟,然后在90℃下搅拌1h。将反应混合物倒入乙酸乙酯和nahco
3 1m水溶液的混合物中,并且将混合物搅拌5分钟。然后将双相混合物转移至分液漏斗中以用于萃取。收集有机相,并且将水相用乙酸乙酯反萃取。将合并的有机相经硫酸钠干燥,并且将其蒸干。粗材料通过快速色谱法纯化,用二氯甲烷和甲醇(0%至10%)的混合物洗脱,以得到305mg的标题化合物。ms(esi):
m/z=206.1[m+h]
+
[0489]
实例53
[0490]
1-[3-(3-甲氧基-4-甲基-苯氧基)环丁基]-3h-咪唑并[4,5-c]吡啶-2-酮
[0491][0492]
向外消旋-n4-((1r,3r)-3-(3-甲氧基-4-甲基苯氧基)环丁基)吡啶-3,4-二胺(100mg,334μmol)在ch3cn(1ml)/dmf(0.2ml)的混合物中的悬浮液加入二(1h-咪唑-1-基)甲酮(56.9mg,351μmol),然后将反应混合物在室温下搅拌1h。然后将反应在50℃下搅拌1.5h。进一步加入cdi(114mg,701μmol),并且将反应混合物在50℃下搅拌16h。真空去除挥发物,并且粗制残余物通过反相hplc直接纯化,以得到48.3mg的标题化合物。ms(esi):m/z=206.1[m+h]
+
[0493]
步骤a)((1r,3r)-3-(3-甲氧基-4-甲基苯氧基)环丁基)氨基甲酸叔丁酯
[0494]
将((1s,3s)-3-羟基环丁基)氨基甲酸叔丁酯(cas:((1s,3s)-3-羟基环丁基)氨基甲酸叔丁酯)(0.75g,4.01mmol)在干燥ch2cl2(20ml)中的溶液加入3-甲氧基-4-甲基苯酚(609mg,4.41mmol)、三苯基膦(1.16g,4.41mmol)和diad(891mg,857μl,4.41mmol)。然后将反应混合物在室温下搅拌18h。进一步加入三苯基膦(525mg,2.0mmol)和diad(405mg,389μl,2.0mmol),然后将反应混合物在室温下再搅拌18h。反应混合物用二氯甲烷稀释并且用nahco31 n水溶液萃取。收集有机相,并且将水相用二氯甲烷反萃取。将合并的有机相经硫酸钠干燥,并且将其蒸干。粗材料通过快速色谱法纯化,用庚烷和乙酸乙酯(5%至20%)的混合物洗脱,以得到690mg的被苯酚污染的产物。将该产物通过sfc纯化,以得到标题化合物(389mg)。ms(esi):m/z=308.4[m+h]
+
[0495]
步骤b)(1r,3r)-3-(3-甲氧基-4-甲基苯氧基)环丁-1-胺;盐酸盐
[0496]
向((1r,3r)-3-(3-甲氧基-4-甲基苯氧基)环丁基)氨基甲酸叔丁酯(1.03g,3.35mmol)在二噁烷(5ml)中的溶液加入hcl(4.0m的二噁烷溶液;5.03ml,20.1mmol),并且将反应混合物在室温下搅拌18h。真空去除挥发物,以得到标题化合物(805mg,粗产物),其不经进一步纯化即可使用。ms(esi):m/z=208.2[m+h]
+
[0497]
步骤c)n-((1r,3r)-3-(3-甲氧基-4-甲基苯氧基4环丁基)-3-硝基吡啶-4-胺
[0498]
向(1r,3r)-3-(3-甲氧基-4-甲基苯氧基)环丁-1-胺盐酸盐(530mg,2.17mmol)在无水dmf(10ml)中的溶液加入dipea(703mg,949μl,5.44mmol)和4-氯-3-硝基吡啶(379mg,2.39mmol)。然后将反应混合物在80℃下搅拌18小时。真空去除挥发物,粗制残余物在乙酸乙酯与nahco31m水溶液之间分配。收集有机相,并且将水相用二氯甲烷反萃取。将合并的有机相经硫酸钠干燥,并且将其蒸干,以得到752mg的标题化合物,其不经进一步纯化即可直接使用。
[0499]
步骤d)外消旋-n4-((1r,3r)-3-(3-甲氧基-4-甲基苯氧基)环丁基)吡啶-3,4-二胺
[0500]
向n-((1r,3r)-3-(3-甲氧基-4-甲基苯氧基)环丁基)-3-硝基吡啶-4-胺(716mg,2.17mmol)在乙酸(7ml)中的溶液加入铁(425mg,7.61mmol)并且将反应混合物在50℃下搅
拌1.5h。(在50℃下30分钟后,形成中断搅拌的浓稠沉淀。需要用乙酸(2.5ml)稀释以恢复搅拌。)真空除去挥发物,将粗制残余物悬浮在二氯甲烷中并且加入6n氨水溶液。将双相混合物剧烈搅拌15分钟,水相ph值的控制指示为6至7,因此通过加入浓naoh水溶液碱化ph值,直至ph大约为10至11。通过经硅藻土垫过滤来去除所形成的沉淀,过滤垫用二氯甲烷洗涤,然后将双相滤液转移至分液漏斗中。萃取后,乳液使相分离变得困难,因此通过经硅藻土垫过滤来去除该乳液,并且收集有机相。将水相用二氯甲烷反萃取两次,并且将合并的有机相经硫酸钠干燥,并且将其蒸干。将残余物通过快速色谱法纯化,用二氯甲烷和甲醇的混合物(1%至20%,然后20%的3%et3n在甲醇中的溶液)洗脱,以得到标题化合物(698mg)。ms(esi):m/z=300.3[m+h]
+
[0501]
实例47
[0502]
1-[6-[4-甲基-3-(三氟甲氧基)苯氧基]-3-吡啶基]-3h-咪唑并[4,5-c]吡啶-2-酮
[0503][0504]
向1-[6-[4-溴-3-(三氟甲氧基)苯氧基]-3-吡啶基]-3h-咪唑并[4,5-c]吡啶-2-酮(35.0mg,0.070mmol)在1,4-二噁烷(2ml)中的溶液加入k2co3(31.1mg,0.220mmol)、三甲基环三硼氧烷(94.0mg,0.370mmol)和[1,1
′‑
双(二苯基膦基)二茂铁]二氯钯(ii)(7.0mg,0.010mmol)。在110℃和n2下,将混合物搅拌6小时。过滤反应,并且将滤液浓缩至干。将残余物通过制备型hplc(fa)纯化并且冻干(两次),以得到1-[6-[4-甲基-3-(三氟甲氧基)苯氧基]-3-吡啶基]-3h-咪唑并[4,5-c]吡啶-2-酮(4.3mg,0.010mmol,产率13.8%),其为淡灰色固体。ms(esi):m/z=403.1[m+h]
+
[0505]
步骤a)1-[6-[4-溴-3-(三氟甲氧基)苯氧基]-3-吡啶基]-3h-咪唑并[4,5-c]吡啶-2-酮
[0506]
向4-溴-3-(三氟甲氧基)苯酚(100mg,0.390mmol)在nmp(1.5ml)中的溶液加入1-(6-氯-3-吡啶基)-3h-咪唑并[4,5-c]吡啶-2-酮(实例16,步骤c)(115mg,0.470mmol)和碳酸钾(80.7mg,0.580mmol)。在微波下,将混合物在密封管中在200℃下搅拌2h。将混合物与其他三个批次合并并且过滤,并且滤液通过制备型hplc(fa)纯化并且冻干,以得到1-[6-[4-溴-3-(三氟甲氧基)苯氧基]-3-吡啶基]-3h-咪唑并[4,5-c]吡啶-2-酮(40mg,0.090mmol,产率22%),其为淡棕色固体。ms(esi):m/z=466.9[m+h]
+
[0507]
结构单元的合成
[0508]
实例a.1
[0509]
6-((2h-螺[苯并呋喃-3,1
′‑
环丙烷]-4-基)氧基)吡啶-3-胺
[0510][0511]
在惰性气氛下,向2-((2h-螺[苯并呋喃-3,1
′‑
环丙烷]-4-基)氧基)-5-硝基吡啶
(894mg,2.99mmol)在甲醇(25ml)中的溶液加入pd/c 10%(w/w 10%)(88mg,827μmol)和甲酸铵(1.88g,29.9mmol,当量:10),然后将反应混合物在50℃下搅拌3h。通过经硅藻土垫过滤来去除pd催化剂,过滤垫用甲醇洗涤两次,并且将滤液蒸干。粗制残余物在乙酸乙酯与na2co
3 1m水溶液之间分配。收集有机相,并且将水相用乙酸乙酯反萃取。将合并的有机相经硫酸钠干燥,并且将其蒸干,以得到785mg的粗制标题化合物,其不经进一步纯化即可使用。ms(esi):m/z=255.2[m+h]
+
[0512]
步骤a)2-((2h-螺[苯并呋喃-3,1
′‑
环丙烷]-4-基)氧基)-5-硝基吡啶
[0513]
向2h-螺[苯并呋喃-3,1
′‑
环丙烷]-4-醇实例b.1(500mg,3.08mmol)在dmf(15ml)中的溶液加入cs2co3(1.0g,3.08mmol)然后加入2-氟-5-硝基吡啶(438mg,3.08mmol),然后将反应混合物在80℃下搅拌3h。反应混合物用乙酸乙酯稀释并且用nahco
3 1m水溶液萃取。收集有机相,并且将水相用乙酸乙酯反萃取。将合并的有机相经硫酸钠干燥,并且将其蒸干,以得到894mg的粗制所需产物,其不经进一步纯化即可使用。ms(esi):m/z=285.2[m+h]
+
[0514]
实例a.2
[0515]
6-((2h-螺[苯并呋喃-3,1
′‑
环丙烷]-4-基)氧基)吡啶-3-胺
[0516][0517]
在惰性气氛下,向2-(3-氯-4-甲基苯氧基)-5-硝基吡啶(4.94g,17.7mmol)在甲醇(80ml)中的溶液加入pt/c 5%(500mg,2.56mmol)和甲酸铵(11.2g,177mmol),然后将反应在70℃下搅拌2h。通过经硅藻土垫过滤来去除pt催化剂,过滤垫用甲醇洗涤并且将滤液真空浓缩。粗制残余物在乙酸乙酯与nahco
3 1m水溶液之间分配,收集有机相,并且将水相用乙酸乙酯反萃取。将合并的有机相经硫酸钠干燥,并且将其蒸干,以得到4.64g的标题化合物,其为粗产物。这可以直接用于下一步骤,或者可以通过快速色谱法进一步纯化,用庚烷和乙酸乙酯(5%至70%)的混合物洗脱。ms(esi):m/z=235.2[m+h]
+
[0518]
步骤a)2-(3-氯-4-甲基苯氧基)-5-硝基吡啶
[0519]
向3-氯-4-甲基苯酚(2.5g,17.5mmol)在无水dmf(40ml)中的溶液分批加入nah(701mg,17.5mmol),然后将反应混合物在室温下搅拌10分钟,然后加入2-氯-5-硝基吡啶(2.78g,17.5mmol)。然后将反应混合物在室温下搅拌1h。反应通过添加几滴饱和nh4cl水溶液猝灭,用乙酸乙酯稀释并且用nahco
3 1m水溶液萃取。收集有机相,并且将水相用乙酸乙酯反萃取。将合并的有机相经硫酸钠干燥,并且将其蒸干,以得到4.94g的标题化合物,其不经进一步纯化即可使用。ms(esi):m/z=265.2[m+h]
+
[0520]
实例a.3
[0521]
6-(3-甲氧基-4-甲基-苯氧基)吡啶-3-胺
[0522][0523]
在惰性气氛下,向2-(3-甲氧基-4-甲基苯氧基)-5-硝基吡啶(9.87g,34.1mmol)在
甲醇(200ml)中的溶液分批加入pd/c 10%(10%w/w)(987mg,9.27mmol)然后分批加入甲酸铵(17.2g,273mmol)。然后将反应混合物在室温下搅拌2h。通过经硅藻土垫过滤来去除钯催化剂,过滤垫用甲醇洗涤两次,并且将滤液真空浓缩。将粗制残余物溶解在乙酸乙酯中并且用nahco
3 1m水溶液萃取,收集有机相,并且将水相用乙酸乙酯反萃取。将合并的有机相经硫酸钠干燥,并且将其蒸干。粗材料通过快速色谱法纯化,用庚烷和乙酸乙酯(5%至60%)的混合物洗脱,以得到标题化合物(7.25g)。ms(esi):m/z=231.2[m+h]
+
[0524]
步骤a)2-(3-甲氧基-4-甲基苯氧基)-5-硝基吡啶
[0525]
向3-甲氧基-4-甲基苯酚(4.97g,36mmol)在无水dmf(100ml)中的溶液加入2-氯-5-硝基吡啶(5.7g,36mmol)和cs2co3(12.9g,39.5mmol)。将反应混合物在80℃下搅拌2h。真空去除挥发物,并且粗制残余物在乙酸乙酯与水之间分配,收集有机相,并且将水相用乙酸乙酯反萃取。将合并的有机相用盐水洗涤,经硫酸钠干燥,并且将其蒸干,以得到标题化合物(9.87g,粗产物),其不经进一步纯化即可使用。ms(esi):m/z=261.2[m+h]
+
[0526]
实例a.4
[0527]
3-氟-4-螺[2h-苯并呋喃-3,1
′‑
环丙烷]-4-基氧基-苯胺
[0528][0529]
在n2下,向4-(2-氟-4-硝基-苯氧基)螺[2h-苯并呋喃-3,1
′‑
环丙烷](680mg,2.26mmol)在thf(10ml)中的溶液加入pd/c(100mg,纯度10%),然后在h2(15psi)下,将混合物在25℃下搅拌10h。过滤反应混合物,并且在真空下浓缩滤液,以得到标题化合物(624mg,1.82mmol,产率80.6%),其为黄色油状物。ms(esi):m/z=272.0[m+h]
+
[0530]
步骤a)4-(2-氟-4-硝基-苯氧基)螺[2h-苯并呋喃-3,1
′‑
环丙烷]
[0531]
向3,4-二氟硝基苯(350mg,2.20mmol,243μl)和实例b.1(357mg,2.20mmol)在dmf(5ml)中的溶液加入k2co3(608mg,4.40mmol),并且将混合物在60℃下搅拌3h。将混合物用水(20ml)稀释并且用乙酸乙酯(30ml x 3)萃取。将有机相经硫酸钠干燥,过滤,并且在真空下浓缩,以得到标题化合物(680mg,粗产物),其为黄色固体,其不经进一步纯化即可直接使用。ms(esi):m/z=302.0[m+h]
+
[0532]
类似于示例a.4,在步骤a)中下表的实例a.4、a.5和a.12使用相应的结构单元生成
[0533][0534]
实例a.6
[0535]
4-(4-氨基-2-氟-苯氧基)-2-异丙基-苯甲腈
[0536][0537]
向4-(2-氟-4-硝基-苯氧基)-2-异丙基-苯甲腈(710mg,2.36mmol)在乙醇(8ml)/水(2ml)中的溶液加入锌(773mg,11.8mmol)和氯化铵(632mg,11.8mmol)。将混合物在25℃下搅拌2h,过滤,并且浓缩滤液,以得到残余物。将残余物溶解在etoac/etoh(3∶1)中。将混合物过滤并且浓缩滤液,以得到4-(4-氨基-2-氟-苯氧基)-2-异丙基-苯甲腈(550mg,2.03mmol,产率86.1%),其为黄色油状物。ms(esi):m/z=271.6[m+h]
+
[0538]
步骤a)4-(2-氟-4-硝基-苯氧基)-2-异丙基-苯甲腈
[0539]
向4-氯-3-氟硝基苯(cas:350-31-2)(436mg,2.48mmol)在mecn (5.3ml)中的混合物在25℃下加入碳酸钾(1029mg,7.44mmol)和4-羟基-2-异丙基-苯甲腈(400mg,2.48mmol)。然后将混合物在90℃下搅拌10h。向混合物加入etoac。过滤混合物并且将滤液浓缩以得到残余物,将其通过快速色谱法纯化(石油醚/乙酸乙酯=20∶1至5∶1梯度)并且浓缩,以得到4-(2-氟-4-硝基-苯氧基)-2-异丙基-苯甲腈(690mg,2.3mmol,产率92.6%),其为无色油状物。ms(esi):m/z=301.1[m+h]
+
[0540]
类似于实例a.6,生成下表的实例a.7至a.9:
[0541][0542]
实例a.10
[0543]
5-氟-6-(3-甲氧基-4-甲基-苯氧基)吡啶-3-胺
[0544][0545]
在n2下,在3-氟-2-(3-甲氧基-4-甲基-苯氧基)-5-硝基-吡啶(4.0g,12.2mmol)和pd(oh)2(3.40g,24.2mmol)在meoh(100ml)中的溶液加入三乙基硅烷(14.6g,125mmol)。将混合物在25℃下搅拌17h。将该反应在50℃下减压浓缩。残余物用tmbe(50ml)洗涤。弃去残余物。在40℃下减压浓缩溶液。将残余物用pe(100ml)洗涤并且过滤,以得到标题化合物(2.6g,9.43mmol,产率77.1%),其为蓝色固体,其不经纯化即直接用于下一步骤。ms(esi):m/z=249.1[m+h]
+
[0546]
步骤a)3-氯-2-(3-甲氧基-4-甲基-苯氧基)-5-硝基-吡啶
[0547]
向3-甲氧基-4-甲基-苯酚(1.5g,10.9mmol)和2-氯-3-氟-5-硝基-吡啶(cas:1079179-12-6)(1.92g,10.9mmol)在mecn(45ml)中的溶液中加入k2co3(4.50g,32.6mmol)。将反应在85℃下搅拌16h。将溶液过滤并且真空浓缩。通过快速硅胶色谱法纯化残余物。获得标题化合物(4g,12.2mmol,产率56.3%),其为黄色固体。ms(esi):m/z=279.1[m+h]
+
[0548]
类似于实例a.10,生成下表的实例a.11:
[0549][0550]
实例b.1
[0551]
螺[2h-苯并呋喃-3,1
′‑
环丙烷]-4-醇
[0552][0553]
合成如在例如wo2012/76877 a1,2012中所报道。(cas:1311139-79-3)
[0554]
实例b.2
[0555]
4-羟基-2-异丙氧基-苯甲腈
[0556][0557]
在n2下,向4-溴-2-异丙氧基苯甲腈(fluorochem,1369898-82-7)(0.50g,2.08mmol)在二噁烷(5ml)和h2o(2ml)中的溶液一次加入koh(257mg,4.58mmol)、t-bu xphos(177mg,417μmol)和pd2(dba)3(191mg,208μmol)。将混合物在100℃下搅拌5h。过滤反应混合物,然后加入水(50ml)和1m hcl水溶液,以将ph调整至4。将水溶液用dcm(50ml x 6)进行萃取。合并的有机层用盐水(50ml)洗涤,经na2so4干燥,过滤,并且在减压下浓缩,以得到残余物,将其通过柱色谱法纯化(sio2,石油醚/乙酸乙酯=1∶0至0∶1梯度),以得到标题化合物(98.3mg,180μmol,产率78%,纯度93%),其为黄色固体。ms(esi):m/z=178.2[m+h]
+
[0558]
实例c.1
[0559]
n-(4-氯嘧啶-5-基)氨基甲酸甲酯
[0560][0561]
向4-氯嘧啶-5-胺(1500mg,11.6mmol)在吡啶(10ml)中的溶液加入氯甲酸甲酯(1.79ml,23.2mmol)。将混合物在0℃下搅拌5h。去除溶剂以得到残余物,将其通过快速色谱法纯化(石油醚/乙酸乙酯=20∶1至3∶1),并且浓缩,以得到n-(4-氯嘧啶-5-基)氨基甲酸甲酯(140mg,0.750mmol,产率6.45%),其为白色固体。ms(esi):m/z=188.4[m+h]
+
[0562]
实例c.2
[0563]
4-氯-3-异丙基苯甲腈
[0564][0565]
向4-氨基-3-异丙基苯甲腈(cas:760924-87-6)(2.05g,10.9mmol)在乙腈(45ml)中的溶液在惰性气氛下加入氯化铜(ii)(1.83g,13.6mmol)和亚硝酸叔丁酯(1.79g,2.07ml,17.4mmol),然后将反应混合物在室温下搅拌20分钟,然后在60℃下搅拌2h。然后将反应冷却至室温,用乙酸乙酯稀释并且用nh
3 4m水溶液萃取,收集有机相,并且将水相用乙酸乙酯反萃取。将合并的有机相用naoh 1m水溶液洗涤,经硫酸钠干燥,并且将其蒸干,以得到2.05g的粗制油状物,将其通过快速色谱法纯化,用庚烷和乙酸乙酯(5%至30%)的混合物洗脱,以得到1.22g的标题化合物。ms(esi):m/z=179.0[m+h]
+
[0566]
实例c.3
[0567]
n-(4-氯嘧啶-5-基)氨基甲酸叔丁酯
[0568][0569]
向4-氯嘧啶-5-胺(200mg,1.54mmol)在thf(2ml)中的溶液加入叔丁氧基羰基异丙基碳酸酯(0.07ml,1.54mmol)。将混合物在0℃下搅拌0.5h。然后加入叔丁氧基羰基异丙基碳酸酯(0.07ml,1.54mmol)并且搅拌2h。去除溶剂以得到残余物,将其通过快速色谱法纯化(石油醚/乙酸乙酯=20∶1至3∶1梯度)并且浓缩,以得到n-(4-氯嘧啶-5-基)氨基甲酸叔丁酯(98mg,0.430mmol,产率27.6%),其为白色固体。ms(esi):m/z=230.1[m+h]
+
[0570]
实例54
[0571]
kv3.1、kv3.2、kv3.3和kv3.4测定的描述
[0572]
在体外,使用高通量细胞电生理学在384孔板中检测文库和药物化学分析化合物的单一浓度筛选以及ic50测定中化合物的电压依赖性。
[0573]
在来自sophion/denmark的自动膜片钳(apc)平台qube上验证了稳定表达kv3.1、3.2、3.3和3.4的编码dna的hek-293细胞系。在37℃、5%co2下,在含有fbs和适当抗生素的dmem细胞生长培养基中维持细胞培养物最多20代。分别将含有各种单价和二价阳离子的细胞内和细胞外(含葡萄糖)hepes缓冲液调整至ph 7.2和7.4。在75%的汇合度下收获细胞并再悬浮在细胞外缓冲液中并添加至孔中。施加负压以通过apc建立全细胞记录。
[0574]
通过apc通过采用去极化电压阶跃来直接测量穿过活化通道的电流。分别使用-80mv保持电位和在+10mv下或从-80mv以10mv的步长增至+40mv下的多个测试脉冲建立了电压依赖性协议的基线电流。在基线记录后添加测试化合物,随后进行10分钟孵育和电压依赖性协议记录。将数据针对基线和漏电流(基于孔)进行校正,并针对增强%(基于板)进行归一化。两种先前报道的具有不同效力的ky3正调节剂用于逐次运行和逐板质量控制。使用非选择性和强效正调节剂作为阳性对照。在电压依赖性协议的-20mv下分析增强百分比,并
且使用从-80mv至+40mv的电压阶跃协议来分析通道活化中的电压偏移。使用类似方法评定了对kv3.2、kv3.3和kv3.4过表达细胞系的选择性。
[0575]
式(i)化合物的一些示例性结果列于表1中。
[0576]
表1
[0577]
[0578]
[0579]
[0580][0581]
实例55
[0582]
式(i)的化合物可以以本身已知的方式用作产生以下组成的片剂的活性成分:
[0583][0584]
实例56
[0585]
式(i)的化合物可以以本身已知的方式用作产生以下组成的胶囊的活性成分:
[0586][0587]
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1