具有新氧化还原酶基序的免疫原性肽的制作方法
1.本发明涉及免疫原性肽。具体地,本发明涉及包含与来源于自身抗原或变应原的t细胞表位连接的氧化还原酶基序的免疫原性肽。更具体地,本发明涉及对氧化还原酶基序的改进以产生更强效的用于治疗与针对自身抗原或变应原的不期望的免疫应答相关的疾病的肽。
背景技术:
2.已经描述了数种策略来防止产生针对抗原的不期望的免疫应答。wo2008/017517描述了使用包含氧化还原酶基序和给定抗原蛋白质的mhc ii类抗原的肽的新策略。这些肽将cd4+t细胞转化为具有溶细胞特性的细胞类型,称为溶细胞性cd4+t细胞。这些细胞能够通过触发凋亡来杀伤呈递该肽所源自的抗原的那些抗原提呈细胞(antigen presenting cell,apc)。wo2008/017517表明了用于变态反应和自身免疫病(例如i型糖尿病)的这一概念。在此,胰岛素可用作自身抗原。
3.wo2009101207和carlier et al.(2012)plos one 7,10e45366更详细地进一步描述了抗原特异性溶细胞性cd4+t细胞。
4.wo2009101206描述了具有氧化还原酶基序和可溶性同种抗原的mch ii类表位的肽在用于替代治疗中时防止针对这样的抗原的免疫应答(例如,在糖尿病患者中针对注射的胰岛素的不期望的免疫应答)的用途。
5.wo2016059236还公开了其中在氧化还原酶基序的附近存在另外的组氨酸的经修饰肽。
6.除包含变应原或抗原的mhc ii类表位的肽之外,wo2012069568a2还公开了使用nkt细胞表位、结合cd1d受体以及导致已显示以抗原特异性方式消除呈递所述特异性抗原的apc的溶细胞性抗原特异性nkt细胞活化的可能性。
7.两种策略均建立于[cst]-xx-c或c-xx-[cst]类型的氧化还原酶基序的使用。为了提高使用这样的免疫原性肽进行治疗的效力,继续寻求更多的活性肽。
技术实现要素:
[0008]
本发明提供了包含氧化还原酶基序和抗原的t细胞表位的新免疫原性肽。在进行了广泛的实验之后,本发明人已鉴定了在与常规使用的hc-xx-[cst](seq id no:118)或h[cst]-xx-c(seq id no:119)氧化还原酶基序相比时在溶细胞性cd4+t细胞诱导和体内治疗或预防作用方面具有提高的治疗性活性的新类型的氧化还原酶基序。当将这些与在所述新基序之前、内部或之后的(另外的)碱性(带电荷)氨基酸残基组合时,所述活性可进一步提高。这些作用示于附图中,并在实施例部分中进行了解释。还测试了在细胞水平下和在小鼠模型系统中的作用,并确定了本发明的免疫原性肽的活性提高。
[0009]
本发明涉及以下方面:
[0010]
方面1:免疫原性肽,所述免疫原性肽包含:
[0011]
a)氧化还原酶基序;
[0012]
b)抗原蛋白质的t细胞表位;和
[0013]
c)在a)与b)之间的0至7个氨基酸的接头,优选0至4个氨基酸的接头;
[0014]
其中所述氧化还原酶基序a)具有以下一般结构:
[0015]zm-[cst]-x
n-c-(seq no id:56至80)或z
m-c-x
n-[cst]-(seq no id:81至105),
[0016]
其中x或z为任意氨基酸,优选碱性氨基酸,更优选选自包含以下的组:k、h、r和非天然碱性氨基酸,优选k或h,更优选k;其中n为选自包含以下的组的整数:1、0、3、4、5或6,优选1、0或3,其中m为0至3的整数,优选0或1;
[0017]
其中c、s和t分别指示半胱氨酸、丝氨酸和苏氨酸氨基酸残基,并且其中[cst]指示可选择c、s或t中的任一个,优选如本文限定的未经修饰的天然氨基酸;
[0018]
其中所述抗原蛋白质是自身抗原、可溶性同种因子(soluble allofactor)、由移植物脱落的同种抗原、胞内病原体的抗原、用于基因治疗或基因疫苗接种的病毒载体的抗原、肿瘤相关抗原或变应原。
[0019]
如本文限定的免疫原性肽具有氧化还原酶活性。
[0020]
在限定氧化还原酶基序的一般结构、式或序列中的任一者中,末端的连字符(-)表示所述氧化还原酶基序与所述接头或所述表位的n端末端或与所述接头或所述t细胞表位的c端末端的连接点。
[0021]
更优选地,所述抗原蛋白质是涉及1型糖尿病(type-1diabetes,t1d)、脱髓鞘病症(例如多发性硬化(multiple sclerosis,ms)或视神经脊髓炎(neuromyelitis optica,nmo))或类风湿性关节炎(rheumatoid arthritis,ra)的自身抗原。
[0022]
涉及t1d的自身抗原的一些非限制性实例。
[0023]
来源:mallone r et al.,clin dev immunol.2011:513210。
[0024][0025]
涉及ms的自身抗原的一些非限制性实例。
[0026][0027]
涉及ra的自身抗原的一些实例。
[0028][0029][0030]
涉及nmo的自身抗原的一些实例
[0031][0032]
方面2:根据方面1所述的免疫原性肽,其中所述氧化还原酶基序不是以下的一部分:标准c-xx-[cst]或[cst]-xx-c氧化还原酶基序的重复,例如可彼此被一个或更多个氨基酸隔开的所述基序的重复(例如cxxc x cxxc x cxxc(seq id no:6)),如彼此相邻的重复(cxxccxxccxxc(seq id no:7))或如彼此重叠的重复cxccxccxcc(seq id no:8)或cxccxccxcc(seq id no:9)),尤其是当n为0或1且m为0时。
[0033]
方面3:根据方面1或2所述的免疫原性肽,其中所述基序中的至少一个x为碱性氨基酸,优选选自包含以下的组:k、h、r或非天然碱性氨基酸,优选k或r,更优选r。
[0034]
更具体地:
[0035]
当n为1时,则x优选为碱性氨基酸,优选选自包含以下的组:k、h、r或非天然碱性氨基酸,优选k或r,更优选r;
[0036]
当n为3或更大时,则至少一个x优选为碱性氨基酸,优选选自包含以下的组:k、h、r或非天然碱性氨基酸,优选k或r,更优选r。
[0037]
方面4:根据方面1至3中任一项所述的免疫原性肽,其中所述基序中的至少一个z为碱性氨基酸,优选选自包含以下的组:k、h、r或非天然碱性氨基酸,优选k或h。
[0038]
更具体地:
[0039]
当m为1时,则z优选为碱性氨基酸,优选选自包含以下的组:k、h、r或非天然碱性氨基酸,优选k或h;
[0040]
当m为2或3时,则至少一个z优选为碱性氨基酸,优选选自包含以下的组:k、h、r或非天然碱性氨基酸,优选k或h。在其中m为2或3的一些实施方案中,至少两个z优选为碱性氨基酸,优选选自包含以下的组:k、h、r或非天然碱性氨基酸,优选k或h。
[0041]
方面5:根据方面1至4中任一项所述的免疫原性肽,其中:
[0042]
n为0并且其中m为0、1、2或3;或者
[0043]
其中n为1并且m为0或1;
[0044]
其中x为碱性氨基酸,更优选选自包含以下的组:k、h、r和非天然碱性氨基酸,优选k或r,更优选r;
[0045]
其中z在存在时为碱性氨基酸,更优选选自包含以下的组:k、h、r和非天然碱性氨基酸,优选k或h,更优选k;或者
[0046]
其中n为3并且m为0或1;
[0047]
其中至少一个x为碱性氨基酸,更优选选自包含以下的组:k、h、r和非天然碱性氨基酸,优选k或r,更优选r;其中z在存在时为碱性氨基酸,更优选选自包含以下的组:k、h、r和非天然碱性氨基酸,优选k或h,更优选k。
[0048]
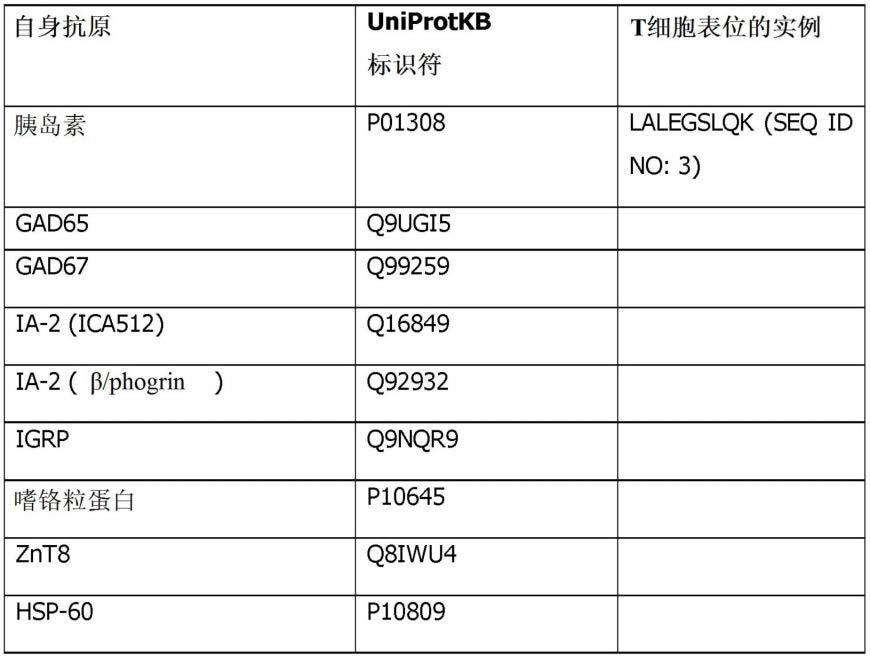
方面6:根据方面1所述的免疫原性肽,其中所述抗原蛋白质是用于治疗和/或预防1型糖尿病(t1d)的胰岛素(原)、gad65、gad67、ia-2(ica512)、ia-2(β/phogrin)、igrp、嗜铬粒蛋白、znt8或hsp-60;或者
[0049]
其中所述抗原蛋白质是用于治疗和/或预防脱髓鞘病症(例如多发性硬化(ms))的髓鞘少突胶质细胞糖蛋白(myelin oligodendrocyte glycoprotein,mog)、髓鞘碱性蛋白(myelin basic protein,mbp)、蛋白脂质蛋白(proteolipid protein,plp)、髓鞘少突胶质细胞碱性蛋白(myelin-oligodendrocytic basic protein,mobp)或少突胶质细胞特异性蛋白(oligodendrocyte-specific protein,osp);或者
[0050]
其中所述抗原蛋白质是用于治疗和/或预防脱髓鞘病症(例如视神经脊髓炎(nmo))的髓鞘少突胶质细胞糖蛋白(mog);或者
[0051]
其中所述抗原蛋白质是用于治疗和/或预防类风湿性关节炎(ra)的grp78、hsp60、60kda伴侣蛋白2、凝溶胶蛋白、壳多糖酶-3样蛋白1或组织蛋白酶s。
[0052]
方面7.根据方面1至6中任一项所述的免疫原性肽,其中所述抗原蛋白质的t细胞表位是nkt细胞表位或mhc ii类t细胞表位。
[0053]
方面8.根据方面1至7中任一项所述的免疫原性肽,其中所述抗原蛋白质的t细胞表位是长度为7至25个氨基酸的nkt细胞表位;或者其中所述抗原蛋白质的t细胞表位是长度为7至25个氨基酸的mhc ii类t细胞表位,优选9至25个氨基酸的mhc ii类t细胞表位。
[0054]
方面9:根据方面1至8中任一项所述的免疫原性肽,其中包含nkt细胞表位的所述抗原蛋白质的长度为7至50个氨基酸,和/或其中包含mhc ii类t细胞表位的所述免疫原性肽的长度为7至50个氨基酸,优选9至50个氨基酸。
[0055]
方面10:根据方面1至9中任一项所述的免疫原性肽,其中所述接头具有0至4个氨基酸。
[0056]
方面11:根据方面1至10中任一项所述的免疫原性肽,其中所述氧化还原酶基序位
于所述表位的n端或所述表位的c端,和/或其中所述氧化还原酶基序位于所述免疫原性肽的n端或c端末端。
[0057]
方面12:根据方面1至11中任一项所述的免疫原性肽,其中所述氧化还原酶基序不天然存在于所述抗原蛋白质中所述t细胞表位的n端或c端的11个氨基酸的区域内。
[0058]
方面13:根据方面1至12中任一项所述的免疫原性肽,其中所述t细胞表位不天然包含所述氧化还原酶基序。
[0059]
方面14:根据方面1至13中任一项所述的免疫原性肽,其中在所述氧化还原酶基序中,n为0并且其中m为0、1、2或3;优选0或1;
[0060]
其中z在存在时为碱性氨基酸,更优选选自包含以下的组:k、h、r和非天然碱性氨基酸,例如但不限于l-鸟氨酸,优选k或h,更优选k。
[0061]
方面15:根据方面1至13中任一项所述的免疫原性肽,其中在所述氧化还原酶基序中,n为1并且其中m为0、1、2或3;优选0或1;
[0062]
其中x为碱性氨基酸,更优选选自包含以下的组:k、h、r和非天然碱性氨基酸,例如但不限于l-鸟氨酸,优选k或r,更优选r;
[0063]
其中z在存在时为碱性氨基酸,更优选选自包含以下的组:k、h、r和非天然碱性氨基酸,例如但不限于l-鸟氨酸,优选k或h,更优选k。一些优选实施方案是其中所述氧化还原酶基序包含kcrc、hcrc或rcrc或由kcrc、hcrc或rcrc组成的那些。
[0064]
方面16:根据方面1至13中任一项所述的免疫原性肽,其中在所述氧化还原酶基序中,n为3并且其中m为0、1、2或3;优选0或1;
[0065]
其中至少一个x为碱性氨基酸,更优选选自包含以下的组:k、h、r和非天然碱性氨基酸,例如但不限于l-鸟氨酸,优选k或r,更优选r;
[0066]
其中z在存在时为碱性氨基酸,更优选选自包含以下的组:k、h、r和非天然碱性氨基酸,例如但不限于l-鸟氨酸,优选k或h,更优选k。
[0067]
方面17:根据方面16所述的免疫原性肽,其中所述基序中的至少一个x为p或y,优选地其中所述基序包含rpy、kpy或hpy。
[0068]
方面18:根据方面1至13中任一项所述的免疫原性肽,其中在所述氧化还原酶基序中,n为0或1;m为1;
[0069]
其中z为选自以下的碱性氨基酸:k、h和r,优选k或h,更优选k;并且
[0070]
其中x在存在时为选自以下的碱性氨基酸:k、h和r,优选k或r,更优选r。
[0071]
方面19:根据方面1至13中任一项所述的免疫原性肽,其中在所述氧化还原酶基序中,n为3;m为1;
[0072]
其中z为选自以下的碱性氨基酸:k、h和r,优选k或h,更优选k;并且
[0073]
其中至少一个x为选自以下的碱性氨基酸:k、h和r,优选k或r,更优选r。
[0074]
方面20.根据方面1至13中任一项所述的免疫原性肽,其中所述免疫原性肽包含来源于选自yrspfsrvv(seq id no:36)和yrppfsrvv(人seq id no:123)的髓鞘少突胶质细胞糖蛋白(mog)抗原氨基酸序列的t细胞表位,并且包含氨基酸序列gw作为接头,并且包含氨基酸序列hlyr(seq id no:122)作为侧翼,
[0075]
方面21.根据方面1至13中任一项所述的免疫原性肽,其中所述免疫原性肽包含来源于选自flrvpcvvki(seq id no:124)和flrvpswki(seq id no:125)的髓鞘少突胶质细胞
糖蛋白(mog)抗原氨基酸序列的t细胞表位,并且包含氨基酸序列vry作为接头,并且包含选自以下的氨基酸序列作为侧翼:tlf、tlfk(seq id no:126)或tlfkk(seq id no:127)。
[0076]
方面22.根据方面1至13中任一项所述的免疫原性肽,其中所述免疫原性肽选自:
[0077][0078]
方面23,多核苷酸(核酸分子),其编码根据方面1至22中任一项所述的免疫原性肽,所述多核苷酸(核酸分子)优选地选自分离的脱氧核糖核酸(desoxyribonucleic acid,dna)、质粒dna(plasmid dna,pdna)、编码dna(coding dna,cdna)、核糖核酸(ribonucleic acid,rna)、信使rna(messenger rna,mrna)或其经修饰形式。在一些实施方案中,所述核酸可以是表达盒的一部分,任选地被并入可用于基因治疗的(病毒)载体或质粒中或者可以以包封或裸露的dna或rna的形式存在,以根据药物领域和基因治疗领域中已知的技术来施用。
[0079]
方面24.根据方面1至22中任一项所述的免疫原性肽或根据方面23所述的多核苷酸,其用于治疗和/或预防自身免疫病、胞内病原体的感染、肿瘤、同种移植排斥,或者针对可溶性同种因子、针对变应原暴露或针对用于基因治疗或基因疫苗接种的病毒载体的免疫应答。
[0080]
优选地,根据方面1至22中任一项所述的免疫原性肽或根据方面23所述的多核苷酸用于治疗自身免疫病、改善自身免疫病的症状和/或预防自身免疫病,所述自身免疫病优选1型糖尿病(t1d)、脱髓鞘病症(例如多发性硬化(ms)或视神经脊髓炎(nmo))或类风湿性关节炎(ra)。
[0081]
方面25:用于制备根据方面1至22中任一项所述的免疫原性肽的方法,其包括以下步骤:
[0082]
(a)提供由所述抗原蛋白质的t细胞表位组成的肽序列,以及
[0083]
(b)将所述肽序列与所述氧化还原酶基序连接,使得所述基序和所述表位彼此相邻或被0至7个氨基酸的接头隔开,并且使得z对应于所述免疫原性肽的n端或c端末端。
[0084]
方面26:用于获得抗原特异性溶细胞性cd4+t细胞群的方法,所述抗原特异性溶细胞性cd4+t细胞针对呈递所述抗原的apc,所述方法包括以下步骤:
[0085]-提供外周血细胞,
[0086]-使所述细胞与根据方面1至22中任一项所述的免疫原性肽或与方面23所述的多核苷酸接触;以及
[0087]-在存在il-2的情况下扩增所述细胞。
[0088]
方面27:用于获得抗原特异性nkt细胞群的方法,所述方法包括以下步骤:
[0089]-提供外周血细胞,
[0090]-使所述细胞与根据方面1至22中任一项所述的免疫原性肽或与方面23所述的多核苷酸接触;以及
[0091]-在存在il-2的情况下扩增所述细胞。
[0092]
方面28:用于获得抗原特异性溶细胞性cd4+t细胞群的方法,所述抗原特异性溶细胞性cd4+t细胞针对呈递所述抗原的apc,所述方法包括以下步骤:
[0093]-提供根据方面1至22中任一项所述的免疫原性肽或方面23所述的多核苷酸,
[0094]-向对象施用所述肽,以及
[0095]-从所述对象获得所述抗原特异性溶细胞性cd4+t细胞群。
[0096]
方面29:用于获得抗原特异性nkt细胞群的方法,所述方法包括以下步骤:
[0097]-提供根据方面1至22中任一项所述的免疫原性肽或方面23所述的多核苷酸,
[0098]-向对象施用所述肽,以及
[0099]-从所述对象获得所述抗原特异性nkt细胞群。
[0100]
方面30:可通过方面25至29中任一项所述的方法获得的所述抗原特异性溶细胞性cd4+t细胞或nkt细胞的群体,其用于药物,更特别地用于治疗和/或预防1型糖尿病(t1d)、脱髓鞘病症(例如多发性硬化(ms)或视神经脊髓炎(nmo))或类风湿性关节炎(ra)。
[0101]
方面31:在对象中治疗自身免疫病、改善自身免疫病的症状和/或预防自身免疫病的方法,其包括向所述对象施用根据方面1至22中任一项所述的免疫原性肽、方面23所述的多核苷酸、或根据方面30所述的细胞群的步骤,所述自身免疫病优选1型糖尿病(t1d)、脱髓鞘病症(例如多发性硬化(ms)或视神经脊髓炎(nmo))或类风湿性关节炎(ra)。
[0102]
方面32:在对象中治疗自身免疫病、改善自身免疫病的症状和/或预防自身免疫病的方法,其包括以下步骤:
[0103]-提供所述对象的外周血细胞,
[0104]-使所述细胞与根据方面1至22中任一项所述的抗原肽或与方面23所述的多核苷酸接触;
[0105]-在体外扩增所述细胞,以及
[0106]-向所述个体施用所述扩增的细胞,
[0107]
所述自身免疫病优选1型糖尿病(t1d);脱髓鞘病症(例如多发性硬化(ms)或视神经脊髓炎(nmo));或类风湿性关节炎(ra)。
[0108]
方面33:方面1至22中任一项或本文中公开的实施方案中任一个所涵盖的氧化还原酶基序的特别优选的一些实例是:
[0109]
cc-;
[0110]
[hkr]cc-,例如hcc-,rcc-,kcc-;
[0111]
c[krh]c-,例如crc-,ckc-,chc-;
[0112]
[khr]c[krh]c-,例如kcrc-,kckc-,kchc-,rcrc-,rckc-,rchc-,hcrc-,hckc-,hchc-,对应于seq id no:10至19;
[0113]
c[khr]xxc-,例如crxxc-,chxxc-,ckxxc-,对应于seq id no:20至23,优选地其中所述基序中的一个x为p或y;
[0114]-[khr]c[khr]xxc-,kcrxxc-,kchxxc-,kckxxc-,hcrxxc-,hchxxc-,hckxxc-,rcrxxc-,rchxxc-,rckxxc-,对应于seq id no:24至33,优选地其中所述基序中的一个x为p或y;
[0115]
等等。
[0116]
特别优选的氧化还原酶基序是kcrc-(seq id no:11)和kcrpyc-(seq id no:54)、kcc-、crc-和crpyc-(seq id no:55)。在方面1至30中任一项所述的一个优选实施方案中,接头包含至少1个氨基酸、至少2个氨基酸、至少3个氨基酸或至少4个氨基酸。优选地,所述接头包含1至7个氨基酸,例如2至7个氨基酸、3至7个氨基酸、或4至7个氨基酸。
[0117]
在方面1至30中任一项所述的另一个优选实施方案中,t细胞表位在其n端末端,即紧邻接头或氧化还原酶基序,更特别地在接头不存在或仅包含1或2个氨基酸的情况下,不包含碱性氨基酸。更优选地,在所有方面中,t细胞表位在其n端末端,即紧邻接头或氧化还原酶基序,更特别地在接头不存在或仅包含1或2个氨基酸的情况下,不包含碱性氨基酸。
[0118]
在方面1至30中任一项所述的另一个实施方案中,t细胞表位在自其n端末端起计数的位置1、2和/或3中,即紧邻接头或氧化还原酶基序,更特别地在接头不存在或仅包含1或2个氨基酸的情况下,不包含碱性氨基酸。
[0119]
在方面1至30的任一项中,氧化还原酶基序在免疫原性肽的n端末端形成。在一组替代实施方案中,氧化还原酶基序在免疫原性肽的c端末端形成。
[0120]
本发明的肽与现有技术肽相比,具有更大的产生溶细胞性cd4+t细胞的能力,并且比现有技术肽具有更大的治疗或预防疾病的能力。
[0121]
针对ms治疗的患者通常具有选自以下的hla hla-drb1*类型:hla-drb1*15:01、hla-drb1*03:01、hla-drb1*04:01和hla-drb1*07:01,优选hla-drb1*15:01。
[0122]
针对nmo治疗的患者通常具有选自以下的hla类型:hla-drb1*03:01和hla-dpb1*05:01(对于亚洲)。
[0123]
针对t1d治疗的患者通常具有选自以下的hla类型:hla-drb1*03:01和04:01。
[0124]
针对ra治疗的患者通常具有选自以下的hla类型:hla-drb1*01:01、04:01和04:04。
[0125]
附图简述
[0126]
图1:示出了免疫原性肽的氧化还原活性的动力学。dtt用作阳性对照,而空白表示测定缓冲液。结果以相对荧光单位(relative fluorescent unit,rfu)表示。示出了来自一次重复的结果。详见文本。
[0127]
图2:a)示出了在用明矾或imcy-0189或imcy-0453预防性处理的小鼠中从第7天至第28天的eae平均临床评分(+sem)。b)示出了从第7天至第28天的eae临床评分的auc。c)示出了从第7天至第28天的eae临床评分的mms(+sd)。详见文本。
[0128]
图3:示出了在用不同肽或用单独明矾处理的小鼠中从第7天至第28天的eae临床评分的auc。
[0129]
图4:示出了在用不同肽或用单独明矾处理的小鼠中从第7天至第28天的eae临床评分的mms(+sd)。
[0130]
图5:示出了从第7天至第28天每天进行的临床eae评分(0至5)的盲法评价。在第0天向小鼠注射mog
35-55
以诱导eae,并且不用imcy-0189、imcy-0453或imcy-0455进行处理或
用imcy-0189、imcy-0453或imcy-0455进行治疗性处理(详见表6)。每天确定各组小鼠的平均临床评分。
[0131]
图6:示出了由图5中针对各组小鼠所显示的eae评分计算的auc。如下参考显著性差异:*p《0.05,**p《0.01,***p《0.001,****p《0.0001。
[0132]
图7:示出了由图5中针对各组小鼠所显示的eae评分计算的mms。如下参考显著性差异:*p《0.05,**p《0.01,***p《0.001,****p《0.0001。
[0133]
图8:示出了表6中呈现的各组小鼠的炎症水平。在各经h&e染色的切片中对约20个细胞的炎性焦点进行计数。当炎性浸润由多于20个细胞组成时,则对存在多少个具有20个细胞的焦点进行估计。如下参考显著性差异:*p《0.05,**p《0.01,***p《0.001,****p《0.0001。
[0134]
图9:示出了表6中呈现的各组小鼠的脱髓鞘水平。在各经抗mbp(使用免疫组织化学)染色切片中对脱髓鞘进行评分。脱髓鞘评分表示对各切片的脱髓鞘面积的估计。如下参考显著性差异:*p《0.05,**p《0.01,***p《0.001,****p《0.0001。
[0135]
图10:示出了表6中呈现的各组小鼠的血清神经丝水平。通过nf-light assay advantage试剂盒在quanterix
tm
下对神经丝轻链(nf-l)蛋白水平进行定量。如下参考显著性差异:*p《0.05,**p《0.01,***p《0.001,****p《0.0001。
[0136]
图11:示出了在不存在和存在实验肽和对照肽的情况下与apc共培养16小时之后ag特异性cd4 t细胞的百分比。在存在imcy-0189的各变体(imcy-0451至imcy-0456)的情况下,将2d2-总cd4+细胞与c57bl6 apc(比率1:1,生物学重复)共培养16小时。对照条件是添加imcy-0017(wt mog35-55)、imcy-0069(经修饰的鼠前胰岛素原)、imcy-0257(经修饰的dby抗原)和不添加肽。在孵育时间之后,通过流式细胞术来确定cd4+cd154+细胞的百分比。虚线示出了参考常规imotope(imcy-0189,黑色柱)与所有实验性和对照条件(白色柱)相比,ag特异性cd4+t细胞的百分比之间的差异。示出了每种条件的生物学重复的facs测量的sd。
[0137]
图12:示出了在不存在和存在实验肽和对照肽的情况下,与apc共培养24小时之后2d2-总cd4 t细胞的sil2。在单独存在imcy-0189的各变体(imcy-0451至imcy-0456)和对照肽的情况下,将2d2-总cd4+细胞与c57bl6 apc(比率1:1,生物学重复)共培养24小时。在孵育时间之后,收集sn,并通过流式细胞术使用legend plex试剂盒来测量il2的量。对照条件是添加imcy-0017(wt mog35-55)、imcy-0069(经修饰的鼠前胰岛素原)、imcy-0257(经修饰的dby抗原)和不添加肽。虚线示出了参考常规imotope(imcy-0189,黑色柱)相比于所有实验性和对照条件(白色柱),sil2的量(pg/ml)之间的差异。示出了每种条件的生物学重复的facs测量的sd。
[0138]
图13:示出了在不存在和存在实验肽的情况下用apc刺激之后16小时,单独或组合表达颗粒酶a、颗粒酶b、cd107a/b的ag特异性cd4t细胞的百分比。
[0139]
在s2时,在不存在和存在imcy-0189的各变体(imcy-0451至imcy-0456)的情况下,将2d2-总cd4+细胞与c57bl6 apc(比率1:1,生物学重复)共培养16小时。在孵育时间之后,通过流式细胞术确定各细胞系的表达裂解标志物的cd4+细胞的百分比。将imcy-0017(wt)的测量从经修饰肽的每个其他测量中去除,以表明氧化还原酶基序对诱导裂解标志物的作用。虚线示出了参考常规imotope(imcy-0189)与所有实验性经修饰肽相比,cd4+t细胞上的
裂解标志物的百分比之间的差异。
[0140]
发明详述
[0141]
本发明针对特定实施方案进行描述,但是本发明不限于此,而仅由权利要求书来限定。权利要求书中的任何引用标记不应被理解为限制范围。仅提供以下术语或定义以帮助理解本发明。除非本文中具体定义,否则本文中使用的所有术语具有如其对于本发明领域的技术人员将理解的相同的含义。本文中提供的定义的范围不应理解为小于本领域普通技术人员所理解的范围。
[0142]
除非另外指出,否则如对于技术人员将明显的是,可以以自身已知的方式进行并且已经以自身已知的方式进行了未详细具体描述的所有方法、步骤、技术和操作。例如再次参考标准手册,参考以上提及的一般背景技术以及参考其中引用的另外的参考文献。
[0143]
除非上下文另外明确指出,否则本文中使用的没有数量词修饰的名词包括一个/种和/或更多个/种。当与本文中使用的方面、权利要求或实施方案相关地使用时,术语“任何”是指提及的所述方面、权利要求或实施方案中任何一个(即任一)以及所有组合。
[0144]
本文中使用的术语“包含”及其变化形式与“包括”及其变化形式或“含有”及其变化形式同义,并且是包含性的或开放式的且不排除另外的、非记载的成员、要素或方法步骤。所述术语还涵盖“基本上由
……
组成”和“由
……
组成”的实施方案。
[0145]
通过端点对数值范围的记载包括各个范围内包括的所有数字和分数,以及所记载的端点。
[0146]
本文中当涉及可测量值例如参数、量、时间持续时间等时使用的术语“约/大约”意在涵盖指定的值或自指定的值起的+/-10%或更小,优选+/-5%或更小,更优选+/-1%或更小,并且仍更优选+/-0.1%或更小的变化,只要这样的变化适合于在所公开的发明中进行即可。应理解,修饰语“约/大约”所指的值本身也被具体地并且优选地公开。
[0147]
如在本文中使用的,如在“用于治疗疾病的组合物”中使用的术语“用于”还应公开了相应的治疗方法和相应的制剂用于制造用于治疗疾病的药物的用途。
[0148]
本文中使用的术语“肽”是指包含通过肽键连接的9至200个氨基酸的氨基酸序列的分子,但是其可包含非氨基酸结构。
[0149]
本文中使用的术语“免疫原性肽”是指具有免疫原性的肽,即包含能够引发免疫应答的t细胞表位的肽。
[0150]
根据本发明的肽可包含任何常规的20种氨基酸或其经修饰形式,或者可包含通过化学肽合成或通过化学或酶修饰并入的非天然存在的氨基酸。
[0151]
本文中使用的术语“抗原”是指大分子,通常是蛋白质(具有或不具有多糖)的结构或者由包含一种或更多种半抗原以及包含t或nkt细胞表位的蛋白质组合物构成的结构。
[0152]
本文中使用的术语“抗原蛋白质”是指包含一个或更多个t或nkt细胞表位的蛋白质。本文中使用的自身抗原或自身抗原蛋白质是指存在于体内的人或动物蛋白或其片段,其在同一人或动物体内引发免疫应答。
[0153]
术语“食品或药物抗原蛋白质”是指存在于食品或药物产品中,例如疫苗中的抗原蛋白质。
[0154]
术语“表位”是指抗原蛋白质的一个或数个部分(其可限定构象表位),其被抗体或其部分(fab’、fab2’等)或者呈现于b细胞或t细胞或nkt细胞的细胞表面处的受体特异性识
别并结合,并且其能够通过所述结合而诱导免疫应答。
[0155]
在本发明的上下文中,术语“t细胞表位”是指优势、亚优势或次要的t细胞表位,即抗原蛋白质的一部分,其被在t淋巴细胞的细胞表面处的受体特异性地识别并结合。表位是优势、亚优势还是次要的取决于针对该表位引发的免疫反应。优势性取决于这样的表位在蛋白质的所有可能的t细胞表位中被t细胞识别并能够将其激活的频率。t细胞表位可以是由mhc ii类分子识别的表位或由cd1d分子识别的nkt细胞表位。
[0156]
t细胞表位可以是由mhc ii类分子识别的表位,其通常由适配于mhc ii分子的沟中的9个氨基酸的序列组成。在表示mhc ii类t细胞表位的肽序列中,表位之中的氨基酸可以以p1至p9进行编号,表位的n端氨基酸以p-1、p-2等进行编号,表位的c端氨基酸以p+1、p+2等进行编号。被mhc ii类分子而非被mhc i类分子识别的肽称为mhc ii类限制性t细胞表位。
[0157]
从抗原蛋白质中鉴定和选择t细胞表位是本领域技术人员已知的。
[0158]
为了鉴定适合于本发明背景下的表位,通过例如t细胞生物技术测试抗原蛋白质的分离的肽序列,以确定该肽序列是否引发t细胞应答。将发现引发t细胞应答的那些肽序列定义为具有t细胞刺激活性。
[0159]
人t细胞刺激活性可还通过将从例如患有t1d的个体获得的t细胞与来源于参与t1d的自身抗原的肽/表位一起培养并确定是否应答于该肽/表位而发生t细胞的增殖(如例如通过氚化胸苷的细胞摄取所测量的)来进行测试。可将t细胞对肽/表位的应答的刺激指数作为应答于肽/表位的最大cpm除以对照cpm来计算。等于或大于背景水平两倍的t细胞刺激指数(stimulation index,s.i.)被认为是“阳性”。将阳性结果用于计算受试肽/表位组的每种肽/表位的平均刺激指数。
[0160]
非天然(或经修饰的)t细胞表位可还任选地针对其与mhc ii类分子的结合亲和力进行测试。这可以以不同的方式进行。例如,通过裂解对于给定ii类分子呈纯合的细胞获得可溶性hla ii类分子。然后通过亲和色谱进行纯化。将可溶性ii类分子与经生物素标记的参考肽进行孵育,该肽根据其对该ii类分子的强结合亲和力而产生。然后将待评估ii类结合的肽以不同浓度孵育,并通过添加中性抗生物素蛋白来计算所述肽将参考肽从其ii类结合中置换出的能力。
[0161]
为了通过例如精细映射技术确定最佳的t细胞表位,通过在肽的氨基或羧基端处添加或缺失氨基酸残基来修饰具有t细胞刺激活性并因此包含至少一个t细胞表位(如通过t细胞生物技术所确定)的肽,并对其进行测试,以确定针对经修饰肽的t细胞反应性的变化。如果如通过t细胞生物技术确定的发现在天然蛋白质序列中共享重叠区域的两种或更多种肽具有人t细胞刺激活性,则可产生包含这样的肽的全部或部分的另外的肽,并且这些另外的肽可通过类似的程序进行测试。按照该技术,选择肽并重组或合成产生。t细胞表位或肽基于多种因素来选择,所述因素包括在个体群体中对肽/表位的t细胞应答的强度(例如,刺激指数)和对肽的t细胞应答的频率。
[0162]
另外地和/或作为替代地,可使用一种或更多种体外算法来鉴定抗原蛋白质中的t细胞表位序列。合适的算法包括但不限于描述于以下中的那些:zhang et al.(2005)nucleic acids res 33,w180-w183(predbalb);salomon&flower(2006)bmc bioinformatics 7,501(mhcbn);schuler etal.(2007)methods mol.biol.409,75-93
(syfpeithi);donnes&kohlbacher(2006)nucleic acids res.34,w194-w197(svmhc);kolaskar&tongaonkar(1990)febs lett.276,172-174;guan et al.(2003)appl.bioinformatics 2,63-66(mhcpred)和singh and raghava(2001)bioinformatics 17,1236-1237(propred)。更特别地,这样的算法允许预测抗原蛋白质中将适配于mhc ii分子的沟中的一个或更多个八肽或九肽序列,并且这对于不同的hla类型也是如此。
[0163]
术语“mhc”是指“主要组织相容性抗原”。在人中,mhc基因被称为hla(“人白细胞抗原(human leukocyte antigen)”)基因。尽管没有始终遵循的约定,但是一些文献使用hla指hla蛋白分子,而mhc指编码hla蛋白的基因。照此,当在本文中使用时,术语“mhc”和“hla”是等同的。人中的hla系统在小鼠中具有其等同系统,即h2系统。最深入研究的hla基因是九种所谓的经典mhc基因:hla-a、hla-b、hla-c、hla-dpa1、hla-dpb1、hla-dqa1、hla dqb1、hla-dra和hla-drb1。在人中,mhc分为三个区域:i、ii和iii类。a、b和c基因属于mhc i类,而六个d基因属于ii类。mhc i类分子由包含3个结构域(α1、2和3)的单多态链构成,所述单多态链与细胞表面处的β2微球蛋白缔合。ii类分子由2条多态链构成,每条多态链包含2条链(α1和2,以及β1和2)。
[0164]
针对ms治疗的患者通常具有选自以下的hla hla-drb1*类型:hla-drb1*15:01、hla-drb1*03:01、hla-drb1*04:01、和hla-drb1*07:01、优选hla-drb1*15:01。
[0165]
针对nmo治疗的患者通常具有选自以下的hla类型:hla-drb1*03:01和hla-dpb1*05:01(对于亚洲)。
[0166]
针对t1d治疗的患者通常具有选自以下的hla类型:hla-drb1*03:01和04:01。
[0167]
针对ra治疗的患者通常具有选自以下的hla类型:hla-drb1*01:01、04:01、和04:04。
[0168]
i类mhc分子几乎在所有有核细胞上表达。
[0169]
在i类mhc分子情况下呈递的肽片段被cd8+t淋巴细胞(溶细胞性t淋巴细胞或ctl(cytolytic t lymphocyte))识别。cd8+t淋巴细胞频繁成熟为溶细胞性效应物,其可裂解荷带刺激性抗原的细胞。ii类mhc分子主要在活化的淋巴细胞和抗原提呈细胞上表达。cd4+t淋巴细胞(辅助性t淋巴细胞或th)通过识别由通常存在于抗原提呈细胞(如巨噬细胞或树突细胞)上的ii类mhc分子呈递的独特肽片段而活化。cd4+t淋巴细胞增殖并分泌支持抗体介导和细胞介导的应答的细胞因子,例如il-2、ifn-γ和il-4。
[0170]
功能性hla的特征在于深结合沟,内源性以及外来的、潜在抗原肽与之结合。进一步地,该沟的特征在于明确的形状和物理化学特性。hla i类结合位点是封闭的,因为肽端被钉到沟的末端中。它们还参与了与保守hla残基的氢键的网络。鉴于这些限制,结合的肽的长度限制于8、9或10个残基。然而,已显示具有多至12个氨基酸残基的肽也能够结合hla i类。不同hla复合物的结构的比较确定了其中肽采用相对线性、延伸的构象或者可涉及中央残基从沟中凸出的一般的结合方式。
[0171]
与hla i类结合位点相反,ii类位点在两端均开放。这允许肽从实际结合区域延伸,从而在两端“悬垂”。因此,ii类hla可结合可变长度(9个至超过25个氨基酸残基)的肽配体。类似于hla i类,ii类配体的亲和力由“恒定”和“可变”分量决定。恒定部分再次由hla ii类沟中保守性残基与结合的肽的主链之间形成的氢键网络形成。然而,该氢键模式不限于肽的n端和c端残基,而是分布在整个链上。后者很重要,因为其将复合肽的构象限制为严
格线性结合方式。这对于所有ii类同种异型都是共同的。决定肽结合亲和力的第二分量是可变的,这是由于ii类结合位点中的某些多态性位置。不同的同种异型在沟内形成不同的互补袋,从而解释了肽的亚型依赖性选择或特异性。重要地,对ii类袋中持有的氨基酸残基的限制通常比对i类的“柔和”。在不同的hla ii类同种异型之间,肽存在更多的交叉反应性。适配于mhc 11分子的沟中的mhc ii类t细胞表位的+/-9个氨基酸(即8、9或10)的序列通常以p1至p9进行编号。表位的n端另外的氨基酸以p-1、p-2等进行编号,表位的c端氨基酸以p+1、p+2等进行编号。
[0172]
术语“nkt细胞表位”是指抗原蛋白质的一部分,其被nkt细胞的细胞表面处的受体特异性地识别并结合并且通常具有7个氨基酸的长度。特别地,nkt细胞表位是被cd1d分子结合的表位。nkt细胞表位具有通用基序[fwyht]-x(2)-[vilm]-x(2)-[fwyht]。该通用基序的一些替代形式在位置1和/或位置7处具有可选项[fwyh],因此为[fwyh]-x(2)-[vilm]-x(2)-[fwyh]。
[0173]
该通用基序的一些替代形式在位置1和/或位置7处具有可选项[fwyt],[fwyt]-x(2)-[vilm]-x(2)-[fwyt]。该通用基序的一些替代形式在位置1和/或位置7具有可选项[fwy],[fwy]-x(2)-[vilm]-x(2)-[fwy]。
[0174]
不论在位置1和/或7处的氨基酸如何,通用基序的一些替代形式在位置4具有可选项[ilm],例如
[0175]
[fwyh]-x(2)-[ilm]-x(2)-[fwyh]或[fwyht]-x(2)-[ilm]-x(2)-[fwyht]或[fvvy]-x(2)-[ilm]-x(2)-[fwy].
[0176]
可任意通过使用算法例如scanprosite de castro e.et al.(2006)nucleic acids res.34(web server issue):w362-w365,任意通过人工来扫描以上序列基序的序列来鉴定蛋白质中的cd1d结合基序。
[0177]“自然杀伤t”或“nkt(natural killer t)”细胞构成识别由非经典mhc复合体分子cd1d呈递的抗原的非常规t淋巴细胞的独特子集。当前描述了nkt细胞的两个子集。i型nkt细胞,也称为不变型nkt细胞(invariant nkt cell,inkt),是最丰富的。其特征在于存在由不变型α链构成的αβt细胞受体(t cell receptor,tcr),小鼠中为valphal4,而人中为valpha24。尽管存在有限数目的β链,但该α链与变化相关。2型nkt细胞具有αβtcr,但具有多态性α链。然而,明显的是,nkt细胞的其他子集存在,其表型仍未完全限定,但其共享被在cd1d分子情况下呈递的糖脂活化的特征。
[0178]
nkt细胞通常表达自然杀伤(natural killer,nk)细胞受体(包括nkg2d和nk1.1)的组合。nkt细胞是固有免疫系统的一部分,所述固有免疫系统可通过其在获得完全效应能力之前不需要扩增的事实而区别于适应性免疫系统。它们的介质中的大多数是预形成的,并且不需要转录。已表明nkt细胞是针对胞内病原体的免疫应答和肿瘤排斥中的主要参与者。还提倡它们在控制自身免疫病和移植排斥中的作用。
[0179]
识别单元cd1d分子的结构与mhc i类分子的结构极为相似,包括β-2微球蛋白的存在。其特征在于以两条α链为界并包含高度疏水性残基的深裂口,其接受脂质链。所述裂口在两个末端均打开,使其容纳更长的链。cd1d的标准配体是合成的α半乳糖基神经酰胺(alpha galactosylceramide,αgalcer)。然而,已经描述了许多天然的替代配体,包括糖脂和磷脂、存在于髓磷脂中的天然脂质硫苷脂、微生物磷酸肌醇甘露糖苷和α-葡萄糖醛酸神
经酰胺。本领域中目前的共识(matsuda et al(2008),curr.opinion immunol.,20 358-368;godfrey et al(2010),nature rev.immunol 11,197-206)仍然是cd1d仅结合包含脂质链的配体,或一般地,由埋入到cd1d中的脂质尾和从cd1d突出的糖残基头基构成的共同结构。
[0180]
本文中对于本发明上下文中使用的表位所使用的术语“同源物”是指这样的分子:其与天然存在的表位具有至少50%、至少70%、至少80%、至少90%、至少95%或至少98%氨基酸序列同一性,从而维持表位结合抗体或者b和/或t细胞的细胞表面受体的能力。表位的特定同源物对应于在最多3个,更特别地在最多2个,最特别地在1个氨基酸中修饰的天然表位。
[0181]
本文中对于本发明的肽所使用的术语“衍生物”是指这样的分子:其包含至少肽活性部分(即,氧化还原酶基序和能够引发溶细胞性cd4+t细胞活性的mhc ii类表位),以及作为其补充,还包含可具有不同的目的,例如使肽稳定或改变肽的药动学或药效学特性的补充部分。
[0182]
本文中使用的对于两个序列的术语“序列同一性”是指当两个序列进行比对时具有相同核苷酸或氨基酸的位置的数目除以序列中较短者中核苷酸或氨基酸的数目。特别地,序列同一性为70%至80%、81%至85%、86%至90%、91%至95%、96%至100%、或100%。
[0183]
本文中使用的术语“肽编码多核苷酸(或核酸)”和“编码肽的多核苷酸(或核酸)”是指这样的核苷酸序列,其当在合适的环境中表达时导致产生相关的肽序列或其衍生物或同源物。这样的多核苷酸或核酸包括编码该肽的正常序列,以及能够表达具有所需活性的肽的这些核酸的衍生物和片段。编码根据本发明的肽或其片段的核酸是编码源自哺乳动物或对应于哺乳动物的肽或其片段、最特别是人肽片段的序列。
[0184]
术语“氧化还原酶基序”、“硫醇-氧化还原酶基序”、“硫还原酶基序”、“硫氧化还原基序”或“氧化还原基序”在本文中用作同义术语,并且是指参与将电子从一个分子(还原剂,也称为氢或电子供体)转移至另一分子(氧化剂,也称为氢或电子接纳体)的基序。特别地,术语“氧化还原酶基序”可指已知的[cst]xxc或cxx[cst]基序,但是特别是指序列基序[cst]xnc或cxn[cst],其中n为选自包含以下的组的整数:0、1、3、4、5或6,并且其中c代表半胱氨酸、s代表丝氨酸、t代表苏氨酸以及x代表任何氨基酸。为了具有还原活性,存在于经修饰的氧化还原酶基序中的半胱氨酸不应该作为胱氨酸二硫桥的一部分出现。
[0185]
术语“碱性氨基酸”是指像布朗斯特-劳里碱(bronsted-lowry base)和路易斯碱(lewis base)一样发挥作用的任何氨基酸,并且包括天然的碱性氨基酸,例如精氨酸(r)、赖氨酸(k)或组氨酸(h),或者非天然的碱性氨基酸,例如但不限于:
[0186]
·
赖氨酸变体,如fmoc-β-lys(boc)-oh(cas号219967-68-7);fmoc-orn(boc)-oh,也称为l-鸟氨酸或鸟氨酸(cas号109425-55-0);fmoc-β-homolys(boc)-oh(cas号203854-47-1);fmoc-dap(boc)-oh(cas号162558-25-0)或fmoc-lys(boc)oh(dime)-oh(cas号441020-33-3);
[0187]
·
酪氨酸/苯丙氨酸变体,如fmoc-l-3pal-oh(cas号175453-07-3);fmoc-β-homophe(cn)-oh(cas号270065-87-7);fmoc-l-β-homoala(4-吡啶基)-oh(cas号270065-69-5)或fmoc-l-phe(4-nhboc)-oh(cas号174132-31-1);
[0188]
·
脯氨酸变体,如fmoc-pro(4-nhboc)-oh(cas号221352-74-5)或fmoc-hyp(tbu)-oh(cas号122996-47-8);
[0189]
·
精氨酸变体,如fmoc-β-homoarg(pmc)-oh(cas号700377-76-0)。
[0190]
本文中公开的免疫原性肽通常可用于治疗由对变应原或(自身)抗原的升高或不受控的免疫应答引起的疾病。通常来说,所述抗原蛋白质是自身抗原、可溶性同种因子、由移植物脱落的同种抗原、胞内病原体的抗原、用于基因治疗或基因疫苗接种的病毒载体的抗原、肿瘤相关抗原或变应原。更优选地,所述抗原蛋白质是涉及1型糖尿病(t1d)、脱髓鞘病症(例如多发性硬化(ms)或视神经脊髓炎(nmo))或类风湿性关节炎(ra)的自身抗原。
[0191]
术语“免疫病症”或“免疫疾病”是指其中免疫系统的反应导致或维持生物体中的功能障碍或非生理状况的疾病。免疫病症中包括的尤其是变应性病症和自身免疫病。
[0192]
本文中使用的术语“变应性疾病”或“变应性病症”是指以免疫系统针对称为变应原的特定物质(例如花粉、蜇伤、药物或食物)的超敏反应为特征的疾病。变态反应是无论何时特应性个体患者遇到其已经对其过敏的变应原时所观察到的体征和症状的集合,这可能导致多种疾病,特别是呼吸系统疾病和症状(例如支气管哮喘)的发生。存在多种类型的分类,并且大多数变应性病症具有不同的名称,这取决于其在哺乳动物体内发生的位置。“超敏反应”是在个体中在暴露于个体已经变得对其过敏的抗原时而产生的不期望的(有损害的,产生不适的,并且有时是致命的)反应;“速发型超敏反应”取决于ige抗体的产生,并因此等同于变态反应。
[0193]
术语“自身免疫病”或“自身免疫病症”是指由于生物体无法将其自身组成部分(下至亚分子水平)识别为“自身”而引起生物体针对其自身细胞和组织的异常免疫应答而导致的疾病。该疾病组可分为两个类别:器官特异性疾病和全身性疾病。
[0194]“变应原”被定义为在具有预先倾向性的个体,特别是在具有遗传倾向性的个体(特应性)患者中引发ige抗体产生的物质,通常是大分子或蛋白质组合物。类似的定义示于liebers et al.(1996)clin.exp.allergy 26,494-516中。
[0195]
本文中使用的术语“脱髓鞘”是指围绕神经元轴突的髓鞘的损伤和/或降解,其结果是病变或斑块的形成。据了解,髓磷脂在脑、视神经和脊髓中发挥保护性覆盖周围神经纤维的作用。由于脱髓鞘,沿着受影响的神经的信号传导受损(即减慢或停止),并可导致神经症状,例如在感觉、运动、认知和/或其他神经功能上的不足。患有脱髓鞘疾病的患者的具体症状将根据疾病和疾病进展状态而变化。这些症状可包括视力模糊和/或视歧、共济失调、阵挛、构音障碍、疲劳、笨拙、手麻痹、轻偏瘫、生殖器感觉缺失(genital anaesthesia)、协调运动障碍、感觉异常(paresthesiasparaesthesia)、眼麻痹、肌肉协调受损、肌无力、感觉丧失、视力受损、神经症状、行走方式(步态)不稳、痉挛性瘫痪、失禁、听力问题、言语问题等。
[0196]
因此,本文中使用的且在本领域通常使用的“脱髓鞘疾病”或“脱髓鞘病症”表示涉及损害(例如损伤)的神经系统或神经元的髓鞘的任何病理状况。脱髓鞘疾病可分为中枢神经系统脱髓鞘疾病和周围神经系统。作为替代地,脱髓鞘疾病可根据脱髓鞘的原因进行分类:髓鞘的损坏(脱髓鞘性髓鞘脱失(demyelinating myelinoclastic)),或异常和退化性髓鞘(脱髓鞘性脑白质营养不良(dysmyelinating leukodystrophic))。脱髓鞘疾病的一些非限制性实例是:多发性硬化(ms)-(例如,复发/缓解型多发性硬化、继发进展型多发性硬
化、进展复发型多发性硬化、原发进展型多发性硬化和急性暴发性多发性硬化)、视神经脊髓炎(nmo)、视神经炎、急性播散性脑脊髓炎、巴洛病、htlv-i相关脊髓病、希尔德病、横贯性脊髓炎、特发性炎性脱髓鞘病、维生素b12诱导的中枢神经系统神经病、脑桥中央髓鞘溶解、包括脊髓痨的脊髓病、脑白质营养不良例如肾上腺脑白质营养不良、白质脑病例如进行性多灶性白质脑病(pml)和风疹诱导的智力低下。技术人员理解的是,上述注释中的数种是表示疾病组的通用分类名称,所述疾病的特征在于在分子水平上的相同或类似的异常过程组和/或者相同或类似的(临床)症状组。患有脱髓鞘病症的人患者可具有脱髓鞘病症的一种或更多种症状,例如但不限于视力受损、麻木、四肢无力、震颤或痉挛、热不耐受、言语障碍、失禁、头晕或本体感觉(例如,平衡、协调、肢体位置感觉)受损。出于该方法的目的,具有脱髓鞘病症家族史(例如,脱髓鞘病症的遗传倾向)或者表现出上述脱髓鞘病症的轻度或罕见症状的人(例如,人患者),可被认为处于发生脱髓鞘病症(例如,多发性硬化)的风险中。在本公开内容的上下文中,优选的脱髓鞘疾病是由mog自身抗原引起的或涉及抗mog抗体的那些,其包括但不限于多发性硬化(ms)或视神经脊髓炎(nmo)。
[0197]
术语“多发性硬化”,在本文中和本领域中缩写为“ms”,表示影响中枢神经系统的自身免疫病症。ms被认为是年轻成人中最常见的非创伤性致残疾病(dobson and giovannoni,(2019)eur.j.neurol.26(1),27-40),以及影响中枢神经系统的最常见的自身免疫病症(berer and krishnamoorthy(2014)febs lett.588(22),4207-4213)。ms可通过从身体到心理至精神问题范围的大量不同症状而在对象中表现其自身。典型的症状包括视力模糊或视歧、肌无力、一只眼失明、以及协调和感觉困难。在大多数情况下,ms可被视为两个阶段的疾病,其中早期炎症是复发缓解型疾病的原因并且延迟的神经退行性变导致非复发性进展,即继发和原发进展型ms。尽管在该领域中取得了进展,但疾病的决定性基本原因迄今仍难以理解,并且超过150个单核苷酸多态性已与ms易感性相关(international multiple sclerosis genetics consortium nat genet.(2013).45(11):1353-60)。已报道了维生素d缺乏、吸烟、紫外线b(uvb)暴露、儿童肥胖和通过eb病毒的感染都有助于疾病的发生(ascherio(2013)expert rev neurother.13(12增刊),3-9)。
[0198]
因此,ms可被认为是存在于从复发型(其中炎症是优势特征)延伸至进展型(神经退行性变优势)的范围内的单一疾病。因此,明显的是本文中使用的术语多发性硬化涵盖属于任何类型的疾病病程分类的任何类型的多发性硬化。特别地,本发明被设想为针对被诊断患有或怀疑患有临床孤立综合征(cis)、复发缓解型ms(rrms)、继发进展型ms(spms)、原发进展型ms(ppms)、以及甚至疑似ms的放射学孤立综合征(ris)的患者的有效治疗策略。虽然不严格考虑ms的疾病病程,但ris用于对在对应于ms病变并且不能通过其他诊断初步解释的脑和/或脊髓的磁共振成像(magnetic resonance imaging,mri)上显示异常的对象进行分类。cis是由中枢神经系统中的炎症和脱髓鞘引起的神经症状的首次发作(根据定义,持续超过24小时)。根据ris、cis分类的对象可能继续发生ms或可能不继续发生ms,其中在脑mri上显示ms样病变的对象更可能发生ms。rrms是ms的最常见的疾病病程,其中患有ms的对象中85%被诊断患有rrms。鉴于本发明,经rrms诊断的患者是优选的患者组。rrms的特征在于新的或提高的神经症状的攻击,或者是复发或恶化。在rrms中,所述复发之后是症状的周期或者部分或完全缓解,并且在这些缓解期内没有经历和/或观察到疾病进展。rrms可进一步分类为活性rrms(复发和/或新mri活动的证据)、非活性rrms、恶化的rrms(在复发之后
在特定时间段内残疾提高)或未恶化的rrms。一部分经rrms诊断的对象将进展为spms疾病病程,其特征在于神经功能随时间的进展型恶化,即残疾的累积。可对spms进行亚分类,例如活性(复发和/或新的mri活性)、非活性、进展型(疾病随时间恶化)或非进展型spms。最后,ppms是ms疾病病程,其特征在于神经功能恶化以及因此从症状发作开始的残疾累积,无早期复发或缓解。可形成另一些ppms亚组,例如活性ppms(偶尔复发和/或新的mri活性)、非活性ppms、进展型ppms(疾病随时间恶化的证据,无论新的mri活性如何)和非进展型ppms。一般而言,ms疾病病程的特征在于就复发和缓解期而言,在严重程度(在复发的情况下)和持续时间二者上有基本的对象间可变性。
[0199]
数种疾病改善治疗可用于ms,并因此本发明可作为替代治疗策略使用,或与这些现有治疗组合使用。活性药物成分的一些非限制性实例包括:干扰素β-1a、干扰素β-1b、乙酸格拉替雷(glatiramer acetate)、乙酸格拉替雷、聚乙二醇干扰素β-1a、特立氟胺(teriflunomide)、芬戈莫德(fingolimod)、克拉屈滨(cladribine)、西尼莫德(siponimod)、富马酸二甲酯、富马酸地洛西美酯、奥扎莫德(ozanimod)、阿仑单抗(alemtuzumab)、米托蒽醌(mitoxantrone)、奥美珠单抗(ocrelizumab)和那他珠单抗(natalizumab)。作为替代地,本发明可与旨在复发管理的治疗或药物,例如但不限于甲基泼尼松龙、强的松和促肾上腺皮质激素(adrenocorticotropic hormone,acth)组合使用。此外,本发明可与旨在减轻特定症状的治疗组合使用。一些非限制性实例包括旨在改善或避免选自以下的症状的药物:膀胱问题、肠功能障碍、抑郁、头晕、眩晕、情绪变化、疲劳、瘙痒、疼痛、性问题、痉挛、震颤和行走困难。
[0200]
ms的特征在于三个交织的标志性特征:1)中枢神经系统中的病变形成,2)炎症,以及3)神经元髓鞘的退化。尽管传统上被认为是中枢神经系统和白质的脱髓鞘疾病,但最近报道表明皮质和深层灰质的脱髓鞘可超过白质脱髓鞘(kutzelnigg et al.(2005).brain.128(11),2705-2712)。已假定关于如何在分子水平上引起ms的两个主要假设。通常可接受的“由外向内假说(outside-in hypothesis)”是基于外周自体反应性效应物cd4+t细胞的活化,该cd4+t细胞迁移到中枢神经系统并启动疾病病程。一旦在中枢神经系统中,所述t细胞通过apc局部再活化并募集另外的t细胞和巨噬细胞以建立炎性病变。值得注意的是,已显示ms病变包含主要存在于病变边缘处的cd8+t细胞以及存在于病变更中心的cd4+t细胞。认为这些细胞引起了脱髓鞘、少突胶质细胞破坏和轴突损伤,导致神经功能障碍。另外,触发免疫调节网络以限制炎症并启动修复,这导致通过临床缓解反映的至少部分髓鞘再生。然而,在没有足够的治疗的情况下,进一步的攻击通常导致疾病的进展。
[0201]
认为ms的发作远在检测到第一临床症状之前就开始了,如由患者的mri上明显的较老和不活跃病变的典型出现所证明的。由于在诊断方法的发展中的进步,现可检测到ms,甚至在疾病的临床表现之前(即症状前ms)也是如此。在本发明的上下文中,“ms的治疗”和类似的表达设想了针对有症状ms和症状前ms二者的治疗和治疗策略。特别地,当免疫原性肽和/或所产生的溶细胞性cd4+t细胞可用于治疗症状前ms患者时,疾病在可部分或甚至完全避免临床表现的这样的早期阶段停止。其中对象对干扰素β治疗没有完全响应的ms也涵盖在术语“ms”内。受免疫系统攻击并导致疾病的主要抗原是:髓鞘少突胶质细胞糖蛋白(mog)、髓鞘碱性蛋白(mbp)、蛋白脂质蛋白(plp)、髓鞘少突胶质细胞碱性蛋白(mobp)和少突胶质细胞特异性蛋白(osp)。
[0202]
术语“视神经脊髓炎”或“nmo”和“nmo谱系障碍(nmo spectrum disorder,nmosd)”也称为“德维克氏病(devic’s disease)”,是指其中白细胞和抗体主要攻击视神经和脊髓但也可攻击脑的自身免疫病症(在wingerchuk 2006,int ms j.2006may;13(2):42-50中进行了综述)。视神经的损伤产生引起疼痛和视力丧失的肿胀和炎症;脊髓的损伤引起腿或臂的无力或瘫痪、感觉丧失、以及膀胱和肠功能的问题。nmo是复发缓解型疾病。在复发期间,视神经和/或脊髓的新的损伤可导致累积性残疾。与ms不同,没有该疾病的进展期。因此,预防攻击对于良好的长期结局至关重要。在与抗mog抗体相关的情况下,认为抗mog抗体可触发对髓鞘的攻击,引起脱髓鞘。在大多数情况下,nmo的原因是由于对自身抗原的特异性攻击。至多三分之一的对象可对针对称为髓鞘少突胶质细胞糖蛋白(mog)的髓鞘组分的自身抗体呈阳性。患有抗mog相关nmo的患者类似地具有横贯性脊髓炎和视神经炎的发作。
[0203]
术语“类风湿性关节炎”或“ra”是在多种关节(最常见于手、腕和膝)中引起疼痛、肿胀、僵硬和功能丧失的自身免疫性炎性疾病。相应关节的衬里(lining)发炎,导致组织损伤以及慢性疼痛、不稳定和畸形。通常存在疾病进展的双侧/对称模式(例如,双手或双膝受到影响)。ra还可影响关节外部位,包括眼、口、肺和心脏。患者可经历其症状的急性恶化(称为突然恶化(flare)),但在早期干预和适当治疗的情况下,症状可在特定持续时间内得到改善(由sana iqbal et al.,2019,us pharm.2019;44(1)(specialty&oncology suppl):8-11综述)。受免疫系统攻击并导致疾病的抗原是多种多样的,但一些实例是:grp78、hsp60、60kda伴侣蛋白2、凝溶胶蛋白、壳多糖酶-3样蛋白1、组织蛋白酶s、血清白蛋白和组织蛋白酶d。
[0204]
术语“1型糖尿病”(t1d)或“糖尿病1型”(也称为“1型糖尿病(type1diabetes mellitus)”或“免疫介导的糖尿病”或以前称为“幼年型发作糖尿病”或“胰岛素依赖型糖尿病”)是通常在儿童时期在易感个体中发生的自身免疫病。t1d发病机制的基础是通过自身免疫机制破坏大多数胰岛素产生胰腺β细胞。简言之,生物体失去了针对负责胰岛素产生的胰腺β细胞的免疫耐受,并且诱导主要是细胞介导的、与自身抗体的产生相关的免疫应答,从而导致β细胞的自我破坏。受免疫系统攻击并导致疾病的主要抗原是胰岛素(原),但另一些实例是:gad65、gad67、ia-2(ica512)、ia-2(β/phogrin)、igrp、嗜铬粒蛋白、znt8和hsp-60。
[0205]
术语“治疗有效量”是指在患者中产生期望的治疗或预防作用的本发明的肽或其衍生物的量。例如,对于疾病或病症,其是在某种程度上降低该疾病或病症的一种或更多种症状,并且更特别地使与该疾病或病症相关或为其成因的生理或生物化学参数部分或完全地恢复至正常的量。通常来说,治疗有效量是将导致正常生理状况的改善或恢复的本发明的肽或其衍生物的量。例如,当用于治疗性治疗受免疫病症影响的哺乳动物时,其为每日量肽/所述哺乳动物的kg体重。或者,在通过基因治疗施用的情况下,调节裸dna或病毒载体的量以确保本发明肽、其衍生物或同源物的相关剂量的局部产生。
[0206]
当涉及肽时,术语“天然”是指序列与天然存在的蛋白质(野生型或突变体)的片段相同的事实。与此相比之下,术语“人工”是指本身在自然界中不存在的序列。通过有限的修饰,例如在天然存在的序列中改变/缺失/插入一个或更多个氨基酸或通过添加/去除天然存在的序列的n端或c端氨基酸来由天然序列获得人工序列。
[0207]
在这种情况下,已经认识到通常在表位扫描的情况下从抗原产生肽片段。巧合的
是,这样的肽可在其序列中包含t细胞表位(mhc ii类表位或cd1d结合表位),以及在其附近的具有如本文所限定的经修饰的氧化还原酶基序的序列。或者,可在所述表位与所述氧化还原酶基序之间存在具有至多11个氨基酸、至多7个氨基酸、至多4个氨基酸、至多2个氨基酸、或者甚至0个氨基酸(换言之,表位与氧化还原酶基序序列彼此紧邻)的氨基酸序列。在一些优选实施方案中,不要求保护这样的天然存在的肽:包含在其野生型中或天然序列中在所述t细胞表位的至多11个氨基酸、至多7个氨基酸、至多4个氨基酸、至多2个氨基酸或甚至0个氨基酸内的位置处的氧化还原酶基序。
[0208]
在本文中,氨基酸以其全名、其三字母缩写或其单字母缩写来指代。
[0209]
氨基酸序列的基序根据prosite的格式写于本文中。基序用于描述在序列特定部分处的某种序列多样性。符号x用于其中接受任何氨基酸的位置。可选项通过在方括号(“[]”)之间列出给定位置的可接受氨基酸来指明。例如:[cst]代表选自cys、ser或thr的氨基酸。被排除为可选项的氨基酸通过在波形括号(“{}”)之间将其列出来指明。例如:{am}代表除ala和met之外的任何氨基酸。基序中的不同元件任选地由连字符(-)使彼此隔开。在本说明书所公开的基序的上下文中,所公开的通用氧化还原酶基序通常伴有连字符而不与基序外的不同元件形成连接。这些“开放的”连字符指示基序与免疫原性肽的另一部分例如接头序列或表位序列的物理连接的位置。例如,形式“z
m-c-x
n-[cst]
‑”
的基序指示[cst]是与免疫原性肽的其它部分连接的氨基酸,并且z是免疫原性肽的末端氨基酸。优选的物理连接是肽键。基序内相同元件的重复可通过在该元件后放置圆括号之间的数值或数值范围来指明。在该方面中,“x
n”指的是n个“x”。例如,x(2)对应于x-x或xx;x(2,5)对应于2、3、4或5个x氨基酸,a(3)对应于a-a-a或aaa。为了区分氨基酸,氧化还原酶基序之外的那些可被称为外部氨基酸,氧化还原基序内的那些被称为内部氨基酸。除非另有说明,x表示任意氨基酸,特别是l-氨基酸,更特别是20种天然存在的l-氨基酸中的一种。
[0210]
包含t细胞表位,例如mhc ii类t细胞表位或nkt细胞表位(或cd1d结合肽表位)和具有还原活性的经修饰的肽基序序列的肽能够分别产生针对抗原提呈细胞的抗原特异性溶细胞性cd4+t细胞、溶细胞性nkt细胞的群。
[0211]
因此,以其最广泛的意义上讲,本发明涉及包含具有触发免疫反应潜能的抗原(自身或非自身)的至少一种t细胞表位(mhc ii类t细胞表位或nkt细胞表位)以及对肽二硫键具有还原活性的经修饰的氧化还原酶序列基序的肽。t细胞表位和经修饰的氧化还原酶基序序列可以在肽中彼此紧邻或任选地被一个或更多个氨基酸(所谓的接头序列)隔开。任选地,该肽另外地包含内体靶向序列和/或另外的“侧翼”序列。
[0212]
本发明的肽包含具有触发免疫反应潜能的抗原(自身或非自身)的t细胞表位和经修饰的氧化还原酶基序。该肽中基序序列的还原活性可针对其还原巯基的能力来测定,例如在其中胰岛素的溶解度在还原之后改变的胰岛素溶解度测定中,或者用经荧光标记的底物例如胰岛素来测定。这样的测定的一个实例使用荧光肽,并且描述于tomazzolli et al.(2006)anal.biochem.350,105
–
112中。当具有fitc标记的两个肽通过二硫桥彼此共价连接时,其会自猝灭。在被根据本发明的肽还原之后,还原的单独肽再次变为具有荧光。
[0213]
经修饰的氧化还原酶基序可位于t细胞表位的氨基端侧或t细胞表位的羧基端处。
[0214]
具有还原活性的肽片段见于硫还原酶中,所述硫还原酶是小的二硫化物还原酶,包括谷氧还蛋白、核氧化还原蛋白、硫氧还蛋白和其他硫醇/二硫化物氧化还原酶
(holmgren(2000)antioxid.redox signal.2,811-820;jacquot et al.(2002)biochem.pharm.64,1065-1069)。它们是多功能的、遍在的并且存在于许多原核生物和真核生物中。已知它们通过保守性活性结构域共有序列中的氧化还原活性半胱氨酸对蛋白质(例如酶)上的二硫键发挥还原活性,这从例如fomenko et al.((2003)biochemistry 42,11214-11225;fomenko et al.(2002)prot.science 11,2285-2296)中公知,其中x代表任何氨基酸。以及wo2008/017517包含在位置1和/或4处的半胱氨酸。因此,这里的基序为cxx[cst]或[cst]xxc。这样的结构域还存在于较大的蛋白质,例如蛋白质二硫化物异构酶(protein disulfide isomerase,pdi)和磷酸肌醇特异性磷脂酶c中。本发明已经对所述基序进行了重新设计,以寻求更大的效力和活性。
[0215]
当用于根据本文中公开的氧化还原酶基序中存在的氨基酸残基时,术语“半胱氨酸”、“c”,“丝氨酸”、“s”,和“苏氨酸”、“t”分别是指天然存在的半胱氨酸、丝氨酸或苏氨酸氨基酸。除非明确指出不同,否则所述术语因此排除经化学修饰的半胱氨酸、丝氨酸和苏氨酸,例如经修饰以在基序的氨基酸残基的n端酰胺上或在c端羧基上携带乙酰基、甲基、乙基或丙酰基的那些。
[0216]
如更进一步详细说明的,本发明的肽可通过允许并入非天然氨基酸的化学合成来制备。
[0217]
在包含经修饰的氧化还原酶基序的本发明肽中,基序的位置使得当表位适配于mhc沟中时,基序保持在mhc结合沟的外部。经修饰的氧化还原酶基序紧邻肽内的表位序列定位[换言之,基序与表位之间存在具有零个氨基酸的接头序列],或者通过包含具有5个氨基酸或更少的氨基酸序列的接头与t细胞表位隔开。更特别地,接头包含1、2、3、4或5个氨基酸。一些具体的实施方案是在表位序列与经修饰的氧化还原酶基序序列之间存在0、1、2或3个氨基酸的接头的肽。除肽接头之外,其他有机化合物也可以用作接头,以将肽的各部分彼此连接(例如,将经修饰的氧化还原酶基序序列与t细胞表位序列连接)。
[0218]
本发明的肽可还在包含t细胞表位和经修饰的氧化还原酶基序的序列的n端或c端包含另外的短氨基酸序列。这样的氨基酸序列在本文中通常被称为“侧翼序列”。侧翼序列可位于表位与内体靶向序列之间和/或位于经修饰的氧化还原酶基序与内体靶向序列之间。在不包含内体靶向序列的某些肽中,短氨基酸序列可以存在于肽中经修饰的氧化还原酶基序和/或表位序列的n端和/或c端。更特别地,侧翼序列是1至7个氨基酸的序列,最特别地是2个氨基酸的序列。
[0219]
在本发明的某些实施方案中,提供了包含一个表位序列和经修饰的氧化还原酶基序序列的肽。或者,在t细胞表位序列的n端和c端两处均可提供氧化还原酶基序。
[0220]
针对本发明肽设想的另一些变体包括包含t细胞表位序列的重复的肽,其中每个表位序列在经修饰的氧化还原酶基序之前和/或之后(例如“氧化还原酶基序-表位”的重复或“氧化还原酶基序-表位-氧化还原酶基序”的重复)。本文中,氧化还原酶基序全部均可具有相同的序列,但这不是必须的。
[0221]
通常来说,本发明的肽仅包含一个t细胞表位。如下所述,蛋白质序列中的t细胞表位可通过功能测定和/或二氧化硅预测测定中的一种或更多种来鉴定。t细胞表位序列中的氨基酸根据其在mhc蛋白结合沟中的位置进行编号或结合cd1d分子。肽内存在的mhc ii类t细胞表位通常由7至30个氨基酸,优选9至30个氨基酸,例如由9至25个氨基酸,还更特别地
由9至16个氨基酸组成,还最特别地由9、10、11、12、13、14、15或16个氨基酸组成。肽内存在的nkt细胞表位通常由7至30个氨基酸,例如由7至25个氨基酸,还更特别地由7至16个氨基酸组成,还最特别地由7、8、9、10、11、12、13、14、15或16个氨基酸组成。
[0222]
在一个更具体的实施方案中,t细胞表位由9、10或11个氨基酸的序列组成。在另一个具体实施方案中,t细胞表位是由mhc ii类分子呈递至t细胞的表位[mhc ii类限制性t细胞表位]。通常来说,t细胞表位序列是指适配于mhc ii蛋白的裂口中的八肽序列,或更具体地九肽序列。
[0223]
在一个更具体的实施方案中,t细胞表位由7、8或9个氨基酸的序列组成。在另一个具体实施方案中,t细胞表位是由cd1d分子呈递的表位[nkt细胞表位]。通常来说,nkt细胞表位序列是指与cd1d蛋白结合并由其呈递的7个氨基酸的肽序列。
[0224]
本发明肽的t细胞表位可对应于蛋白质的天然表位序列,或者可以是其经修饰形式,只要经修饰的t细胞表位保持其结合在mhc裂口内或结合cd1d受体的能力即可,类似于天然t细胞表位序列。经修饰的t细胞表位可与天然表位具有相同的针对mhc蛋白或cd1d受体的结合亲和力,但也可具有降低的亲和力。特别地,经修饰肽的结合亲和力小于原始肽的不小于10倍,更特别地不小于5倍。本发明的肽对蛋白质复合物具有稳定作用。因此,肽-mhc或cd1d复合物的稳定作用补偿了经修饰的表位对mhc或cd1d分子的降低的亲和力。
[0225]
肽中包含t细胞表位和还原性化合物的序列可还与促进肽被摄取到晚期内体中以进行加工并在mhc ii类决定簇中呈递的氨基酸序列(或另一有机化合物)连接。晚期内体靶向通过蛋白质的胞质尾中存在的信号介导,并且对应于良好鉴定的肽基序。晚期内体靶向序列允许对抗原来源t细胞表位进行加工并通过mhc ii类分子有效呈递。这样的内体靶向序列包含在例如gp75蛋白(vijayasaradhi et al.(1995)j.cell.biol.130,807-820)、人cd3γ蛋白、hla-bm 11(copier et al.(1996)j.lmmunol.157,1017-1027)、dec205受体的胞质尾(mahnke et al.(2000)j.cell biol.151,673-683)中。用作对内体的分拣信号的肽的另一些实例公开于bonifacio and traub(2003)annu.rev.biochem.72,395-447的综述中。或者,该序列可以是来自蛋白质的亚优势或次要t细胞表位的序列,其促进晚期内体中的摄取而不克服针对抗原的t细胞应答。晚期内体靶向序列可位于抗原来源肽的氨基端处或羧基端处,以有效摄取和加工,并且也可通过侧翼序列(例如多至10个氨基酸的肽序列)偶联。当出于靶向目的使用次要t细胞表位时,后者通常位于抗原来源肽的氨基端末端处。
[0226]
或者,本发明涉及包含赋予与cd1d分子结合之能力的疏水性残基的肽的产生。在施用之后,这样的肽被apc摄取,引导至晚期内体,在此它们被装载到cd1d上并呈递在apc表面处。所述疏水性肽的特征在于对应于通用序列[fwhy]-xx-[ilmv]-xx-[fwthy](seq id no:112)或[fw]-xx-[ilmv]-xx-[fw](seq id no:113)的基序,其中位置p1和p7被疏水性残基例如苯丙氨酸(f)或色氨酸(w)占据。然而,p7在其接受苯丙氨酸或色氨酸的替代疏水性残基例如苏氨酸(t)或组氨酸(h)的意义上是允许的。p4位被脂肪族残基例如异亮氨酸(i)、亮氨酸(l)或甲硫氨酸(m)占据。本发明涉及由天然地构成cd1d结合基序的疏水性残基构成的肽。在一些实施方案中,所述基序的氨基酸残基是经修饰的,通常通过用提高与15cd1d结合之能力的残基进行替换来修饰。在一个具体实施方案中,对基序进行修饰以使其与所述通用基序更紧密地配合。更特别地,产生肽以在第7位包含f或w。
[0227]
因此,本发明设想了抗原蛋白质的肽及其在引发特异性免疫反应中的用途。这些
肽可对应于在其序列中包含即被至多10个,优选7个氨基酸或更少的氨基酸隔开的还原性化合物和t细胞表位的蛋白质片段。或者,并且对于大多数抗原蛋白质,本发明的肽通过将还原性化合物,更特别地如本文中所述的还原性经修饰氧化还原酶基序与抗原蛋白质的t细胞表位的n端或c端偶联(与其直接相邻或具有至多10个,更特别至多7个氨基酸的接头)来产生。此外,与天然存在的序列相比,可对蛋白质的t细胞表位序列和/或经修饰的氧化还原酶基序进行修饰和/或可引入一个或更多个侧翼序列和/或靶向序列(或对其进行修饰)。因此,根据在目的抗原蛋白质的序列中是否可发现本发明的特征,本发明的肽可包含“人工的”或“天然存在的”序列。
[0228]
本发明的肽在长度上可显著变化。肽的长度可以为9、10或11个氨基酸(即由分别7、8或9个氨基酸的nkt细胞或mhc ii类t细胞表位、与其相邻的2个氨基酸(cc)的最小氧化还原酶基序组成)至多至12、13、14、15、16、17、18、19、20、25、30、35、40、45或多至50个氨基酸不等。
[0229]
在一些具体实施方案中,全肽由9个氨基酸多至20、25、30、40、50、75或100个氨基酸组成。例如,肽可包含40个氨基酸的内体靶向序列、约2个氨基酸的侧翼序列、2至约11个氨基酸的如本文中所述的氧化还原酶基序、4至7个氨基酸的接头和最小7、8或9个氨基酸的t细胞表位肽。更特别地,在还原性化合物是如本文中所述的经修饰的氧化还原酶基序的情况下,无内体靶向序列的包含任选地通过接头连接的表位和经修饰的氧化还原酶基序的(人工或天然)序列(本文中称为“表位-经修饰的氧化还原酶基序”序列)的长度是至关重要的。“表位-经修饰的氧化还原酶基序”的长度更特别地为9、10、11、12、13、14、15、16、17、18或19个氨基酸。这样的9、10、11、12、13或14至19个氨基酸的肽可任选地与尺寸较不关键的内体靶向信号偶联。晚期内体靶向由存在于蛋白质的胞质尾部的信号介导,并且对应于充分确定的肽基序,例如基于双亮氨酸的[de]xxx[li](seq id no:114)或dxxll(seq id no:115)基序(例如dxxxl(seq id no:117))、基于酪氨酸的yxx0(seq id no:117)基序或所谓的酸性簇基序。符号0表示具有庞大疏水性侧链的氨基酸残基,例如phe、tyr和trp。晚期内体靶向序列允许通过mhc ii类分子或cd1d分子加工和有效呈递抗原来源的t细胞表位。
[0230]
如上所述,在一些具体实施方案中,本发明的肽包含与t细胞表位序列连接的如本文中所述的还原性经修饰的氧化还原酶基序。
[0231]
在另一些具体实施方案中,本发明的肽是包含t细胞表位的肽,该t细胞表位不包含其天然序列中具有氧化还原特性的氨基酸序列。
[0232]
然而,在一些替代实施方案中,t细胞表位可包含确保表位与mhc裂口或与cd1d分子结合的任何氨基酸序列。在抗原蛋白质的目的表位在其表位序列中包含例如本文中所述的经修饰的氧化还原酶基序的情况下,根据本发明的免疫原性肽包含如本文中所述的经修饰的氧化还原酶基序和/或与表位序列n端或c端偶联的另一还原性序列的序列,使得(与埋入在裂口中的表位中存在的经修饰的氧化还原酶基序相反),连接的经修饰的氧化还原酶基序可确保还原活性。
[0233]
因此,t细胞表位和基序彼此紧邻或彼此隔开,并且不重叠。为了评估“紧邻”或“隔开”的概念,确定适配于mhc裂口或cd1d分子中的7、8或9个氨基酸的序列,并确定该八肽或九肽与经修饰的氧化还原酶基序之间的距离。
[0234]
通常,本发明的肽不是天然的(因此无这样的蛋白质片段),而是人工肽,其除t细
胞表位之外还包含如本文中所述的经修饰的氧化还原酶基序,其中经修饰的氧化还原酶基序通过由多至7个,最特别地多至4个或多至2个氨基酸组成的接头与t细胞表位直接隔开。
[0235]
已经显示,在向哺乳动物施用(即注射)包含氧化还原酶基序和mhc ii类t细胞表位的肽(或包含这样的肽的组合物)之后,该肽引发识别抗原来源t细胞表位的t细胞的活化,并通过还原表面受体向t细胞提供另外的信号。这种超最佳活化产生获得针对呈递t细胞表位的细胞的溶细胞特性以及针对旁观者t细胞的抑制特性的t细胞。
[0236]
另外,已经显示,在向哺乳动物施用(即注射)包含氧化还原酶基序和nkt细胞表位的肽(或包含这样的肽的组合物)之后,该肽引发识别抗原来源t细胞表位的t细胞的活化,并通过与cd1d表面受体结合而向t细胞提供另外的信号。这种活化产生获得针对呈递t细胞表位的细胞的溶细胞特性的nkt细胞。
[0237]
以该方式,本发明中所述的包含抗原来源t细胞表位和在表位之外的经修饰氧化还原酶基序的肽或包含所述肽的组合物可用于哺乳动物(包括人)的直接免疫接种。因此,本发明提供了用作药物的本发明肽或其衍生物。因此,本发明提供了包括向有此需要的患者施用一种或更多种根据本发明的肽的治疗方法。
[0238]
本发明提供了这样的方法,通过该方法,可通过用小肽进行免疫接种来引发赋有溶细胞特性的抗原特异性t细胞。已经发现包含以下的肽分别引发溶细胞性cd4+t细胞或nkt细胞:(i)编码来自抗原的t细胞表位的序列和(ii)具有氧化还原特性的共有序列,以及所述肽进一步任选地还包含促进该肽被摄取到晚期内体中以进行有效mhc ii类呈递或cd1d受体结合的序列。
[0239]
在治疗和预防免疫反应中,本发明肽的免疫原性特性是特别令人感兴趣的。
[0240]
本文中所述的肽用作药物,更特别地用于制造用于在哺乳动物中,更特别地在人中预防或治疗免疫病症的药物。
[0241]
本发明描述了通过使用本发明肽、其同源物或衍生物来治疗或预防需要这样的治疗或预防的哺乳动物的免疫病症的方法,所述方法包括向患有免疫病症或处于免疫病症风险之中的所述哺乳动物施用治疗有效量的本发明肽、其同源物或衍生物例如以减轻免疫病症的症状的步骤。设想了对人和动物(例如宠物和农场动物)二者的治疗。在一个实施方案中,待治疗的哺乳动物是人。以上提及的免疫病症在一个具体实施方案中选自变应性疾病和自身免疫病。
[0242]
本发明肽或包含如本文中所限定的这样的肽的药物组合物优选地通过皮下或肌内施用来施用。优选地,可将肽或包含这样的肽的药物组合物皮下(sub-cutaneously,sc)注射在上臂(肘与肩之间中部)的侧部的区域中。当需要两次或更多次分开的注射时,其可伴随地在两臂中进行施用。
[0243]
根据本发明的肽或包含这样的肽的药物组合物以治疗有效剂量施用。一些示例性但非限制性的剂量方案为50至1500μg,优选100至1200μg。更具体的剂量方案可以为50至250μg、250至450μg、或850至1300μg,这取决于患者的状况和疾病的严重程度。剂量方案可包含以单剂量或以2、3、4、5或更多剂量同时地或连续地施用。
[0244]
在某些实施方案中,治疗可以在贯穿对象的疾病中重复数次。这样的连续治疗可以每天进行,或者以1至10天,例如如每5至10天,例如约每7天的间歇进行。
[0245]
或者,所述治疗可以每周、每两周、每月、每两月或每三至四个月重复一次。
[0246]
一些示例性的非限制性施用方案如下:
[0247]-低剂量方案,其包含以两次各自分开注射25μg(各自100μl)sc施用50μg的肽,随后以两次各自分开注射12.5μg(各自50μl)三次连续注射25μg的肽。
[0248]-中剂量方案,其包含以两次各自分开注射75μg(各自300μl)sc施用150μg的肽,随后以两次各自分开注射37.5μg(各自150μl)三次连续施用75μg的肽。
[0249]-高剂量方案,其包含以两次各自分开注射225μg(各自900μl)sc施用450μg的肽,随后以两次各自分开注射112.5μg(各自450μl)三次连续施用225μg的肽。
[0250]
另一些示例性的非限制性施用方案如下:
[0251]-剂量方案,其包含以两次各自分开注射225μg间隔2周sc施用450μg的肽(6次)。
[0252]-剂量方案,其包含以两次各自分开注射675μg间隔2周sc sc施用1350μg的肽(6次)。
[0253]
本文中定义的免疫原性肽的一个特别但非限制性的剂量方案为50至1500μg,优选450至1500μg。剂量方案可包括同时或连续地以单剂或以2、3、4、5、6或更多剂施用。所述用免疫原性肽的治疗可进行1至6次,例如1至4次,优选每5至9天,例如约每7天。
[0254]
包含已知氧化还原酶基序和胰岛素t细胞表位的免疫原性肽的一个示例性剂量方案可见于clinicaltrials.gov上的标识符nct03272269下。
[0255]
本发明提供了包含任选地被0至7个氨基酸的接头隔开的新氧化还原酶基序和抗原蛋白质的t细胞表位的免疫原性肽。
[0256]
所述新氧化还原酶基序选自包含以下的组:
[0257]zm-[cst]-x
n-c-或z
m-c-x
n-[cst]-,
[0258]
其中x或z为任意氨基酸,优选碱性氨基酸,更优选选自包含以下的组:k、h、r和非天然碱性氨基酸,优选k或h,更优选k;
[0259]
其中n为整数,其选自包含以下的组:0、1、3、4、5或6,优选0、1或3,其中m为0至3的整数,优选0或1;
[0260]
其中c、s和t分别指示半胱氨酸、丝氨酸和苏氨酸氨基酸残基,并且其中[cst]指示可选择c、s或t中任一者,优选如本文中限定的未经修饰的天然氨基酸;
[0261]
在一个优选实施方案中,所述氧化还原酶基序是cc或cxc,其中x可以为选自以下的任何氨基酸:g、a、v、l、i、m、f、w、p、s、t、c、y、n、q、d、e、k、r和h、或非天然碱性氨基酸。优选地,cxc基序中的x为除c、s或t之外的任何氨基酸。在一个具体实施方案中,cxc基序中的x为碱性氨基酸,例如h、k或r,或非天然的碱性氨基酸,例如但不限于:
[0262]
·
赖氨酸变体,如fmoc-β-lys(boc)-oh(cas号219967-68-7);fmoc-orn(boc)-oh,也称为l-鸟氨酸或鸟氨酸(cas号109425-55-0);fmoc-β-homolys(boc)-oh(cas号203854-47-1);fmoc-dap(boc)-oh(cas号162558-25-0)或fmoc-lys(boc)oh(dime)-oh(cas号441020-33-3);
[0263]
·
酪氨酸/苯丙氨酸变体,如fmoc-l-3pal-oh(cas号175453-07-3);fmoc-β-homophe(cn)-oh(cas号270065-87-7);fmoc-l-β-homoala(4-吡啶基)-oh(cas号270065-69-5)或fmoc-l-phe(4-nhboc)-oh(cas号174132-31-1);
[0264]
·
脯氨酸变体,如fmoc-pro(4-nhboc)-oh(cas号221352-74-5)或fmoc-hyp(tbu)-oh(cas号122996-47-8);
[0265]
·
精氨酸变体,如fmoc-β-homoarg(pmc)-oh(cas号700377-76-0)。
[0266]
cxc基序的一些具体实例是:chc,ckc,crc,cgc,cac,cvc,clc,cic,cmc,cfc,cwc,cpc,csc,ctc,cyc,cnc,cqc,cdc,和cec。这些示例性cxc基序中的任一个其前面可以有一个或更多个氨基酸(zm),其中m为0至3的整数,优选0或1,并且其中z为任意氨基酸,优选碱性氨基酸,例如h、k或r或如本文中所限定的非天然碱性氨基酸。这样的基序的一些优选实例是:
[0267]
kchc(seq id no:13),kckc(seq id no:12),kcrc(seq i d no:11),或kcgc,kcac,kcvc,kclc,kcic,kcmc,kcfc,kcwc,kcpc,kcsc,kctc,kcyc,kcnc,kcqc,kcdc,kcec(分别为seq id no:141至156),或hchc(seq id no:19),hckc(seq id no:18),hcrc(seq id no:19),或hcgc,hcac,hcvc,hclc,hcic,hcmc,hcfc,hcwc,hcpc,hcsc hctc,hcyc,hcnc,hcqc,hcdc,hcec(分别为seq id no:157至172),或rchc(seq id no:16),rckc(seq id no:15),rcrc(seq id no:14),或rcgc,rcac,rcvc,rclc,rcic,rcmc,rcfc,rcwc,rcpc,rcsc,rctc,rcyc,rcnc,rcqc,rcdc,和rcec(分别为seq id no:173至188);
[0268]
在一个优选实施方案中,所述氧化还原酶基序为cx3c,即cxxxc,通常为cx1x2x3c,其中x1、x2和x3各自独立地可以为选自以下的任何氨基酸:g、a、v、l、i、m、f、w、p、s、t、c、y、n、q、d、e、k、r和h、或如本文中限定的非天然碱性氨基酸。优选地,所述基序中的x1、x2和x3为除c、s或t之外的任何氨基酸。在一个具体实施方案中,所述基序中的x1、x2或x3中的至少一个为碱性氨基酸,例如h、k或r,或如本文中限定的非天然碱性氨基酸。
[0269]
cxxxc基序的一些具体实例是:cxpyc(seq id no:186)、cpxyc(seq id no:190)和cpyxc(seq id no:191),其中x可以为任何氨基酸,更优选地是
[0270]c×
pyc(seq id no:186),例如:ckpyc(seq id no:192),crpyc(seq id no:55),chpyc(seq id no:193),或cgpyc,capyc,cvpyc,clpyc,cipyc,cmpyc,cfpyc,cwpyc,cppyc,cspyc,ctpyc,ccpyc,cypyc,cnpyc,cqpyc,cdpyc,和cepyc(分别为seq id no:194至210);或者
[0271]
cpxyc(seq id no:190),例如:cpkyc,cpryc,cphyc,cpgyc,cpayc,cpvyc,cplyc,cpiyc,cpmyc,cpfyc,cpwyc,cppyc,cpsyc,cptyc,cpcyc,cpyyc,cpnyc,cpqyc,cpdyc,和cpeyc(分别为seq id no:211至230);或者
[0272]
cpy
×
c(seq id no:191),例如:cpykc,cpyrc,cpyhc,cpygc,cpyac,cpyvc,cpylc,cpyic,cpymc,cpyfc,cpywc,cpypc,cpysc,cpytc,cpycc,cpyyc,cpync,cpyqc,cpydc,cpyec,和cpylc(分别为seq id no:231至251)。
[0273]
cxxxc基序的另一些具体实例是:cxhgc(seq id no:252)、chxgc(seq id no:253)和chgxc(seq id no:254),其中x可以为任何氨基酸,更优选地是
[0274]
cxhgc(seq id no:252),例如:ckhgc,crhgc,chhgc,cghgc,cahgc,cvhgc,clhgc,cihgc,cmhgc,cfhgc,cwhgc,cphgc,cshgc,cthgc,cchgc,cyhgc,cnhgc,cqhgc,cdhgc,和cehgc(分别为seq id no:255至274);或者
[0275]
cgxhc(seq id no:253),例如:cgkhc,cgrhc,cghhc,cgghc,cgahc,cgvhc,cglhc,cgihc,cgmhc,cgfhc,cgwhc,cgphc,cgshc,cgthc,cgchc,cgyhc,cgnhc,cgqhc,cgdhc,和cgehc(分别为seq id no:275至294);或者
[0276]
chgxc(seq id no:254),例如:chgkc,chgrc,chghc,chggc,chgac,chgvc,chglc,
chgic,chgmc,chgfc,chgwc,chgpc,chgsc,chgtc,chgcc,chgyc,chgnc,chgqc,chgdc,和chgec(分别为seq id no:295至314)。
[0277]
cxxxc基序的另一些具体实例是:cxgpc(seq id no:315)、cgxpc(seq id no:316)和cgpxc(seq id no:317),其中x可以为任何氨基酸,更优选地是
[0278]
cxgpc(seq id no:315),例如:ckgpc,crgpc,chgpc,cggpc,cagpc,cvgpc,clgpc,cigpc,cmgpc,cfgpc,cwgpc,cpgpc,csgpc,ctgpc,ccgpc,cygpc,cngpc,cqgpc,cdgpc,和cegpc(分别为seq id no:318至337);或者
[0279]
cgxpc(seq id no:316),例如:cgkpc,cgrpc,cghpc,cggpc,cgapc,cgvpc,cglpc,cgipc,cgmpc,cgfpc,cgwpc,cgppc,cgspc,cgtpc,cgcpc,cgypc,cgnpc,cgqpc,cgdpc,和cgepc(分别为seq id no:338至357);或者
[0280]
cgpxc(seq id no:317),例如:cgpkc,cgprc,cgphc,cgpgc,cgpac,cgpvc,cgplc,cgpic,cgpmc,cgpfc,cgpwc,cgppc,cgpsc,cgptc,cgpcc,cgpyc,cgpnc,cgpqc,cgpdc,和cgpec(分别为seq id no:358至377)。
[0281]
cxxxc基序的另一些具体实例是:cxghc(seq id no:378)、cgxhc(seq id no:379)、和cghxc(seq id no:380),其中x可以为任何氨基酸,更优选地是
[0282]
cxghc(seq id no:378),例如:ckghc,crghc,chghc,cgghc,caghc,cvghc,clghc,cighc,cmghc,cfghc,cwghc,cpghc,csghc,ctghc,ccghc,cyghc,cnghc,cqghc,cdghc,和ceghc(分别为seq id no:381至400);或者
[0283]
cgxhc(seq id no:379),例如:cgkhc,cgrhc,cghhc,cgghc,cgahc,cgvhc,cglhc,cgihc,cgmhc,cgfhc,cgwhc,cgphc,cgshc,cgthc,cgchc,cgyhc,cgnhc,cgqhc,cgdhc,和cgehc(分别为seq id no:659至678);或者
[0284]
cghxc(seq id no:380),例如:cghkc,cghrc,cghhc,cghgc,cghac,cghvc,cghlc,cghic,cghmc,cghfc,cghwc,cghpc,cghsc,cghtc,cghcc,cghyc,cghnc,cghqc,cghdc,和cghec(分别为seq id no:421至439)。
[0285]
cxxxc基序的另一些具体实例是:cxgfc(seq id no:440)、cgxfc(seq id no:401)和cgfxc(seq id no:441),其中x可以为任何氨基酸,更优选地是
[0286]c×
gfc(seq id no:440),例如:ckgfc,crgfc,chgfc,cggfc,cagfc,cvgfc,clgfc,cigfc,cmgfc,cfgfc,cwgfc,cpgfc,csgfc,ctgfc,ccgfc,cygfc,cngfc,cqgfc,cdgfc,和cegfc(分别为seq id no:442至460);或者
[0287]
cgxfc(seq id no:401),例如:cgkfc,cgrfc,cghfc,cggfc,cgafc,cgvfc,cglfc,cgifc,cgmfc,cgffc,cgwfc,cgpfc,cgsfc,cgtfc,cgcfc,cgyfc,cgnfc,cgqfc,cgdfc,和cgefc(分别为seq id no:402至420);或者
[0288]
cgfxc(seq id no:441),例如:cgfkc,cgfrc,cgfhc,cgfgc,cgfac,cgfvc,cgflc,cgfic,cgfmc,cgffc,cgfwc,cgfpc,cgfsc,cgftc,cgfcc,cgfyc,cgfnc,cgfqc,cgfdc,和cgfec(分别为seq id no:461至479)。
[0289]
cxxxc基序的另一些具体实例是:cxrlc(seq id no:480)、crxlc(seq id no:481)和crlxc(seq id no:482),其中x可以为任何氨基酸,更优选地是
[0290]
cxrlc(seq id no:480),例如:ckrlc,crrlc,chrlc,cgrlc,carlc,cvrlc,clrlc,cirlc,cmrlc,cfrlc,cwrlc,cprlc,csrlc,ctrlc,ccrlc,cyrlc,cnrlc,cqrlc,cdrlc,和
cerlc(分别为seq id no:483至502);或者
[0291]
crxlc(seq id no:481),例如:crklc,crrlc,crhlc,crglc,cralc,crvlc,crllc,crilc,crmlc,crflc,crwlc,crplc,crslc,crtlc,crclc,crylc,crnlc,crqlc,crdlc,和crelc(分别为seq id no:503至522);或者
[0292]
crlxc(seq id no:482),例如:crlkc,crlrc,crlhc,crl.gc,crlac,crlvc,crllc,crlic,crlmc,crlfc,crlwc,crlpc,crlsc,crltc,crlcc,crlyc,crlnc,crlqc,crldc,和crlec(分别为seq id no:523至541)。
[0293]
cxxxc基序的另一些具体实例是:cxhpc(seq id no:542)、chxpc(seq id no:543)和chpxc(seq id no:544),其中x可以为任何氨基酸,更优选地是
[0294]
cxhpc(seq id no:542),例如:ckhpc,crhpc,chhpc,cghpc,cahpc,cvhpc,clhpc,cihpc,cmhpc,cfhpc,cwhpc,cphpc,cshpc,cthpc,cchpc,cyhpc,cnhpc,cqhpc,cdhpc,和cehpc(分别为seq id no:545至564);或者
[0295]
chxpc(seq id no:543),例如:chkpc,chrpc,chhpc,chgpc,chapc,chvpc,chlpc,chipc,chmpc,chfpc,chwpc,chppc,chspc,chtpc,chcpc,chypc,chnpc,chqpc,chdpc,chepc,和chlpc(分别为seq id no:566至585);或者
[0296]
chpxc(seq id no:544),例如:chpkc,chprc,chphc,chpgc,chpac,chpvc,chplc,chpic,chpmc,chpfc,chpwc,chppc,chpsc,chptc,chpcc,chpyc,chpnc,chpqc,chpdc,和chpec(分别为seq id no:586至605)。
[0297]
这些示例性cxxxc基序中的任一个其前面可以有一个或更多个氨基酸(zm),其中m为0至3的整数,优选0或1,并且其中z为任意氨基酸,优选碱性氨基酸,例如h、k或r或如本文中所限定的非天然碱性氨基酸。
[0298]
在一个优选实施方案中,所述氧化还原酶基序是cx4c,即cxxxxc(seq id no:606),通常为cx1x2x3x4c,其中x1、x2、x3和x4各自独立地可以为选自以下的任何氨基酸:g、a、v、l、i、m、f、w、p、s、t、c、y、n、q、d、e、k、r和h,或如本文中所限定的非天然碱性氨基酸。优选地,所述基序中的x1、x2、x3和x4为除c、s或t之外的任何氨基酸。在一个具体实施方案中,所述基序中的x1、x2、x3或x4中的至少一个为碱性氨基酸,例如h、k或r,或如本文中所限定的非天然碱性氨基酸。
[0299]
cxxxxc基序的一些具体实例是:clavlc,ctvqac或cgavhc(分别为seq id no:607至609)及其变体,例如:cx1avlc,clx2vlc,clax3lc(分别为seq id no:610至612)或clavx4c;cx1vqac,ctx2qac,ctvx3ac(分别为seq id no:613至616)或ctvqx4c;cx1avhc,cgx2vhc,cgax3hc(分别为seq id no:617至620)或cgavx4c(seq id no:621);其中x1、x2、x3和x4各自独立地可以为选自以下的任何氨基酸:g、a、v、l、i、m、f、w、p、s、t、c、y、n、q、d、e、k、r和h,或如本文中所限定的非天然碱性氨基酸。
[0300]
这些示例性cxxxxc(seq id no:622)基序中的任一个其前面可以有一个或更多个氨基酸(zm),其中m为0至3的整数,优选0或1,并且其中z为任意氨基酸,优选碱性氨基酸,例如h、k或r或如本文中限定的非天然碱性氨基酸。
[0301]
在一个优选实施方案中,所述氧化还原酶基序为cx5c,即cxxxxxc,通常为cx1x2x3x4x5c,其中x1、x2、x3、x4和x5各自独立地可以为选自以下的任何氨基酸:g、a、v、l、i、m、f、w、p、s、t、c、y、n、q、d、e、k、r和h,或如本文中所限定的非天然碱性氨基酸。优选地,所述
基序中的x1、x2、x3、x4和x5为除c、s或t之外的任何氨基酸。在一个具体实施方案中,所述基序中的x1、x2、x3、x4或x5中的至少一个为碱性氨基酸,例如h、k或r,或如本文中所限定的非天然碱性氨基酸。
[0302]
cxxxxxc基序的一些具体实例是:cpafplc(seq id no:623)或cdqggec(seq id no:624)及其变体,例如:
[0303]
cx1afplc,cpx2fplc,cpax3plc,cpafx4lc,或cpafpx5c;cx1qggec,cdx2ggec,cdqx3gec,cdqgx4ec,或cdqggx5c
[0304]
(分别为seq id no:625至634),其中x1、x2、x3、x4和x5各自独立地可以为选自以下的任何氨基酸:g、a、v、l、i、m、f、w、p、s、t、c、y、n、q、d、e、k、r和h,或如本文中所限定的非天然碱性氨基酸。这些示例性cxxxxxc基序中的任一个其前面可以有一个或更多个氨基酸(zm),其中m为0至3的整数,优选0或1,并且其中z为任意氨基酸,优选碱性氨基酸,例如h、k或r,或如本文中所限定的非天然碱性氨基酸。
[0305]
在一个优选实施方案中,所述氧化还原酶基序为cx6c,即cxxxxxxc(seq id no:635),通常为cx1x2x3x4x5x6c,其中x1、x2、x3、x4、x5和x6各自独立地可以为选自以下的任何氨基酸:g、a、v、l、i、m、f、w、p、s、t、c、y、n、q、d、e、k、r和h,或如本文中所限定的非天然碱性氨基酸。优选地,所述基序中的x1、x2、x3、x4、x5和x6为除c、s或t之外的任何氨基酸。在一个具体实施方案中,所述基序中的x1、x2、x3、x4、x5或x6中的至少一个为碱性氨基酸,例如h、k或r,或如本文中所限定的非天然碱性氨基酸。
[0306]
cxxxxxxc基序的一个具体实例是:cdiadkyc(seq id no:636)或其变体,例如:cx1iadkyc,cdx2adkyc,cdix3dkyc,cdiax4kyc,cdiadx5yc,或cdiadkx6c(分别为seq id no:637至642),其中x1、x2、x3、x4和x5各自独立地可以为选自以下的任何氨基酸:g、a、v、l、i、m、f、w、p、s、t、c、y、n、q、d、e、k、r和h,或如本文中所限定的非天然碱性氨基酸。
[0307]
这些示例性cxxxxxxc基序中的任一个其前面可以有一个或更多个氨基酸(zm),其中m为0至3的整数,优选0或1,并且其中z为任意氨基酸,优选碱性氨基酸,例如h、k或r,或如本文中所限定的非天然碱性氨基酸。
[0308]
这样的氧化还原酶基序的一些特别优选的实例是:
[0309]
c[khr]c,cx[khr]xc,cxx[khr]c,c[khr]xxc,[khr]cc,[khr]cxc,[khr]xxxc cc[khr],cxc[khr],cxxxc[khr],[khr]cc[khr],[khr]cxc[khr],[khr]cxxxc[khr],[khr]c[khr]c,c[khr]c[khr],[khr]cxx[khr]c,[khr]cx[khr]
×
c,[khr]c[khr]xxc,cxx[khr]c[khr],cx[khr]xc[khr],c[khr]xxc[khr]
[0310]
(分别为seq id no:643至658)等。
[0311]
本发明的肽还可用于用于在样品中检测ii类限制性cd4+t细胞的体外诊断方法中。在该方法中,使样品与mhc ii类分子与根据本发明的肽的复合物接触。通过测量复合物与样品中细胞的结合来检测cd4+t细胞,其中复合物与细胞结合表明样品中存在cd4+t细胞。该复合物可以是肽与mhc ii类分子的融合蛋白。或者,复合物中的mhc分子是四聚体。该复合物可作为可溶性分子提供或可与载体连接。
[0312]
本发明的肽还可用于用于在样品中检测nkt细胞的体外诊断方法中。在该方法中,使样品与cdld分子与根据本发明的肽的复合物接触。通过测量复合物与样品中细胞的结合来检测nkt细胞,其中复合物与细胞结合指示样品中存在nkt细胞。该复合物可以是肽与
cdld分子的融合蛋白。
[0313]
因此,在一些具体实施方案中,本发明的治疗和预防方法包括施用如本文中所述的免疫原性肽,其中所述肽包含在待治疗的疾病中发挥作用的抗原蛋白质的t细胞表位(例如如上所述的那些)。在另一些具体实施方案中,使用的表位是优势表位。
[0314]
根据本发明的肽可通过合成其中t细胞表位和经修饰的氧化还原酶基序被0至7个氨基酸隔开的肽来制备。在某些实施方案中,经修饰的氧化还原酶基序可通过在表位序列之外引入1、2或3个突变来获得,以保持如在蛋白质中出现的序列背景。通常来说,参考作为天然序列的一部分的九肽在p-2和p-1中以及在p+10和p+11中的氨基酸被保持在肽序列中。这些侧翼残基通常使与mhc ii类或cd1d分子的结合稳定。在另一些实施方案中,表位的n端或c端序列与包含t细胞表位序列的抗原蛋白质的序列不相关。
[0315]
因此,基于用于设计肽的以上方法,通过化学肽合成、重组表达方法或在更特殊的情况下,蛋白质的蛋白水解或化学片段化来产生肽。
[0316]
如以以上方法产生的肽可在体外和体内方法中测试t细胞表位之存在,并且可在体外测定中测试其还原活性。作为最终的品质控制,可以在体外测定中测试所述肽,以验证该肽是否可产生通过针对呈递包含表位序列的抗原的抗原提呈细胞的凋亡途径而具有溶细胞性的cd4+t或nkt细胞,所述表位序列也存在于具有经修饰的氧化还原酶基序的肽中。
[0317]
本发明的肽可使用重组dna技术在细菌、酵母、昆虫细胞、植物细胞或哺乳动物细胞中产生。鉴于肽的长度有限,其可通过化学肽合成来制备,其中肽通过将不同的氨基酸彼此偶联来制备。化学合成特别适合于包含例如d-氨基酸、具有非天然存在的侧链的氨基酸或具有经修饰的侧链的天然氨基端等。
[0318]
化学肽合成方法已充分描述,并且可从公司例如applied biosystems和其他公司订购肽。
[0319]
肽合成可以以固相肽合成(solid phase peptide synthesis,spps)或与液相肽合成相反的方式来进行。最著名的spps方法是t-boc和fmoc固相化学:
[0320]
在肽合成期间,使用了数个保护基。例如,羟基和羧基官能团通过叔丁基保护,赖氨酸和色氨酸通过t-boc基团保护,以及天冬酰胺、谷氨酰胺、半胱氨酸和组氨酸通过三苯甲基保护,以及精氨酸通过pbf基团保护。如果合适,在合成之后,这样的保护基可以留在肽上。可使用如kent(schnelzer&kent(1992)lnt.j.pept.protein res.40,180-193)最初所描述的以及例如tam et al.(2001)biopolymers 60,194-205中综述的连接策略(两个未经保护的肽片段的化学选择性偶联)将肽彼此连接以形成更长的肽,这为实现蛋白质合成提供了巨大的潜能,这超出了spps的范围。通过该方法已经成功地合成了尺寸为100至300个残基的许多蛋白质。由于spps的巨大进步,合成肽在生物化学、药理学、神经生物学、酶学和分子生物学的研究领域中继续发挥着越来越至关重要的作用。
[0321]
或者,所述肽可通过在包含编码核苷酸序列的合适的表达载体中使用编码本发明肽的核酸分子来合成。这样的dna分子可使用自动化dna合成仪和遗传密码的公知的密码子-氨基酸关系来容易地制备。使用寡核苷酸探针和常规杂交方法,这样的dna分子也可作为基因组dna或作为cdna获得。可将这样的dna分子并入到表达载体(包括质粒)中,其适合于在合适的宿主例如细菌(例如大肠杆菌(escherichia coli))、酵母细胞、动物细胞或植物细胞中表达dna和产生多肽。
[0322]
对目的肽的物理和化学特性(例如溶解度、稳定性)进行检查,以确定该肽是否/是否将适合于用于治疗组合物中。通常来说,这通过调节肽的序列来优化。任选地,可在合成之后使用本领域已知的技术对肽进行修饰(化学修饰,例如添加/缺失官能团)。
[0323]
包含标准氧化还原酶基序和mhc ii类t细胞表位的免疫原性肽的作用机制被以上引用的pct申请wo2008/017517和本发明人的公开中公开的实验数据证实。包含标准氧化还原酶基序和cd1d结合nkt-细胞表位的免疫原性肽的作用机制被以上引用的pct申请wo2012/069568和本发明人的公开中公开的实验数据证实。
[0324]
本发明提供了用于在体内或体外产生抗原特异性溶细胞性cd4+t细胞(当使用如本文中公开的包含mhc ii类表位的免疫原性肽时)或抗原特异性溶细胞性nkt细胞(当使用如本文中公开的包含结合cd1d分子的nkt细胞表位的免疫原性肽时)的方法。
[0325]
本发明描述了用于产生抗原特异性cd4+t细胞或nkt细胞的体内方法。一个具体实施方案涉及用于通过用如本文中所述的本发明肽免疫接种动物(包括人)并随后从经免疫接种的动物分离cd4+t细胞或nkt细胞来产生或分离cd4+t细胞或nkt细胞的方法。本发明描述了用于产生针对apc的抗原特异性溶细胞性cd4+t细胞或nkt细胞的体外方法。本发明提供了用于产生针对apc的抗原特异性溶细胞性cd4+t细胞和nkt细胞的方法。
[0326]
在一个实施方案中,提供了这样的方法,其包括分离外周血细胞,通过根据本发明的免疫原性肽体外刺激细胞群,以及扩增经刺激的细胞群,更特别地在存在il-2的情况下进行。根据本发明的方法的优点是产生高数目的cd4+t细胞,并且可产生对抗原蛋白质具有特异性的cd4+t细胞(通过使用包含抗原特异性表位的肽)。
[0327]
在一个替代实施方案中,cd4+t细胞可以在体内产生,即通过向对象注射本文中所述的免疫原性肽,以及收集体内产生的溶细胞性cd4+t细胞。
[0328]
可通过本发明的方法获得的针对apc的抗原特异性溶细胞性cd4+t细胞在预防变应性反应和治疗自身免疫病中向哺乳动物施用免疫治疗是特别令人感兴趣的。设想了使用同种细胞和自体细胞二者。
[0329]
溶细胞性cd4+t细胞群如下文中所述获得。
[0330]
在一个实施方案中,本发明提供了扩增特异性nkt细胞的方法,其结果是活性提高,包括但不限于:
[0331]
(i)细胞因子产生提高
[0332]
(ii)抗原提呈细胞的接触依赖性消除和可溶性因子依赖性消除提高。因此,结果是对胞内病原体、自身抗原,优选涉及1型糖尿病(t1d)、脱髓鞘病症(例如多发性硬化(ms)或视神经脊髓炎(nmo))或类风湿性关节炎(ra)的自身抗原的更加有效的应答。
[0333]
本发明还涉及在体液或器官中鉴定具有所需特性的nkt细胞。该方法包括通过其表面表型(包括nk1.1、cd4、nkg2d和cd244的表达)鉴定nkt细胞。然后使细胞与限定为能够由cd1d分子呈递的肽的nkt细胞表位接触。然后将细胞在存在il-2或il-15或il-7的情况下进行体外扩增。
[0334]
如本文中所述的抗原特异性溶细胞性cd4+t细胞或nkt细胞可用作药物,更特别地用于过继细胞治疗,更特别地用于治疗急性变应性反应和自身免疫病(例如多发性硬化)的复发。如所述产生的分离的溶细胞性cd4+t细胞或nkt细胞或细胞群,更特别地抗原特异性溶细胞性cd4+t细胞或nkt细胞群用于制造用于预防或治疗免疫病症的药物。公开了通过使
用分离的或产生的溶细胞性cd4+t细胞或nkt细胞的治疗方法。
[0335]
如wo2008/017517中说明的,针对apc的溶细胞性cd4+t细胞可基于细胞的表达特征区别于天然treg细胞。更特别地,与天然treg细胞群相比,溶细胞性cd4+t细胞群显示出以下特征中的一种或更多种:
[0336]
在活化之后表面标志物(包括cd103、ctla-4、fasl和icos)的表达提高,cd25中等表达,cd4、icos、ctla-4、gitr表达以及cd127(il7-r)低表达或不表达,cd27不表达,转录因子t-bet和egr-2(krox-20)表达但转录阻遏物foxp3不表达,高ifn-γ产生,以及无或仅痕量的il-10、il-4、il-5、il-13或tgf-β。
[0337]
此外,溶细胞性t细胞表达cd45ro和/或cd45ra,不表达ccr7、cd27,并且呈现高水平的颗粒酶b和其他颗粒酶以及fas配体。
[0338]
如wo2008/017517中所说明的,针对apc的溶细胞性nkt细胞可基于细胞的表达特征区别于非溶细胞性nkt细胞。更特别地,与非溶细胞性nkt细胞群相比,溶细胞性cd4+nkt细胞群显示出以下特征中的一种或更多种:nk1.i、cd4、nkg2d和cd244表达。
[0339]
本发明肽在施用于活动物、通常是人之后引发对旁观者t细胞发挥抑制活性的特异性t细胞。
[0340]
在一些具体实施方案中,本发明的溶细胞性细胞群的特征在于fasl和/或干扰素γ表达。在一些具体实施方案中,本发明的溶细胞性细胞群的特征还在于颗粒酶b表达。
[0341]
该机制还蕴含并且实验结果表明,本发明的肽尽管包含某抗原的特定t细胞表位但可用于预防或治疗由针对相同抗原的其他t细胞表位的免疫反应引发的病症,或者在某些情况下,甚至用于治疗由针对其他不同抗原的其他t细胞表位的免疫反应引发的病症,如果它们将通过相同的机制由mhc ii类分子或cd1d分子在被本发明肽活化的t细胞附近呈递的话。
[0342]
公开了具有上述特征的另外是抗原特异性的,即能够抑制抗原特异性免疫应答的细胞类型的分离的细胞群。
[0343]
本发明提供了包含一种或更多种根据本发明的肽的药物组合物,其还包含可药用载体。如上所述,本发明还涉及用作药物的组合物或涉及通过使用所述组合物治疗哺乳动物的免疫病症的方法,以及涉及所述组合物用于制造用于预防或治疗免疫病症的药物的用途。所述药物组合物可例如是适合于治疗或预防免疫病症,尤其是空气传播性和食源性变态反应以及变应源疾病的疫苗。作为药物组合物的本文中进一步描述的一个实例,将根据本发明的肽吸附在适合于施用于哺乳动物的佐剂,例如氢氧化铝(明矾)上。通常来说,50μg的吸附在明矾上的肽通过皮下途径以2周的间隔注射3次。对于本领域技术人员应明显的是,其他施用途径也是可以的,包括经口、鼻内或肌内。同样,注射次数和注射量可根据待治疗的病症而变化。此外,可使用除明矾之外的其他佐剂,只要它们促进mhc ii类呈递中的肽呈递和t细胞活化即可。因此,尽管活性成分可单独地施用,但它们通常作为药物制剂存在。本发明的针对兽用和针对人用二者的制剂均包含至少一种如上所述的活性成分以及一种或更多种可药用载体。本发明涉及包含与可药用载体混合的作为活性成分的一种或更多种根据本发明的肽的药物组合物。本发明的药物组合物应包含治疗有效量的活性成分,例如下文中对于治疗或预防方法所指明的。任选地,所述组合物还包含其他治疗成分。合适的其他治疗成分以及其取决于其所属类别的常用剂量对于本领域技术人员是公知的,并且可选
自用于治疗免疫病症的其他已知药物。
[0344]
本文中使用的术语“可药用载体”意指与活性成分一起配制的任何材料或物质,以便例如通过溶解、分散或扩散所述组合物而利于其应用于或散布于待治疗的部位,和/或在不损害其效力的情况下利于其储存、运输或处理。它们包括任何和所有的溶剂、分散介质、包衣、抗菌和抗真菌剂(例如酚、山梨酸、氯丁醇)、等张剂(例如糖或氯化钠)等。另外的成分可包含在内以便控制组合物中免疫原性肽的作用持续时间。可药用载体可以是固体或液体或已被压缩至形成液体的气体,即本发明的组合物可适当地用作浓缩剂、乳剂、溶液剂、颗粒剂、粉剂(dust)、喷雾剂、气雾剂、混悬剂、软膏剂、乳膏、片剂、丸剂或粉末。用于药物组合物及其制剂的合适的药用载体对于本领域技术人员是公知的,并且在本发明中对其选择没有特别限制。它们还可包括添加剂,例如润湿剂、分散剂、黏着剂(sticker)、黏合剂、乳化剂、溶剂、包衣、抗细菌和抗真菌剂(例如酚、山梨酸、氯丁醇)、等张剂(例如糖或氯化钠)等,只要它们与药学实践一致即可,即对哺乳动物不会造成永久损害的载体和添加剂。本发明的药物组合物可以以任何已知的方式来制备,例如通过以一步或多步程序将活性成分与所选择的载体材料和(合适的话)另一些添加剂例如表面活性剂均匀地混合,对其进行包衣和/或研磨来制备。它们也可通过微粉化来制备,例如鉴于以通常直径为约1至10μm的微球体形式获得它们,即制造用于控释或缓释活性成分的微胶囊剂。
[0345]
待用于本发明药物组合物中的合适的表面活性剂,也称为乳化剂(emulgent)或乳化剂(emulsifier),是具有良好的乳化、分散和/或润湿特性的非离子、阳离子和/或阴离子材料。合适的阴离子表面活性剂包括水溶性皂剂和水溶性合成表面活性剂二者。合适的皂剂是高级脂肪酸(c
10
至c
22
)的碱金属或碱土金属盐、未经取代或经取代的铵盐,例如油酸或硬脂酸的钠盐或钾盐,或者可从椰子油或牛油中获得的天然脂肪酸混合物的钠盐或钾盐。合成表面活性剂包括聚丙烯酸的钠盐或钙盐;脂肪磺酸盐和硫酸盐;磺化苯并咪唑衍生物和烷基芳基磺酸盐。脂肪磺酸盐或硫酸盐通常为以下形式:碱金属或碱土金属盐、未经取代的铵盐或被具有8至22个碳原子的烷基或酰基基团取代的铵盐,例如木质素磺酸或十二烷基磺酸的钠盐或钙盐,或从天然脂肪酸中获得的脂肪醇硫酸盐的混合物、硫酸或磺酸酯的碱金属或碱土金属盐(例如月桂基硫酸钠)和脂肪醇/环氧乙烷加成物的磺酸。合适的磺化苯并咪唑衍生物通常包含8至22个碳原子。烷基芳基磺酸盐的一些实例是十二烷基苯磺酸或二丁基-萘磺酸或萘-磺酸/甲醛缩合产物的钠盐、钙盐或链烷醇胺(alcanolamine)盐。同样合适的是相应的磷酸盐,例如磷酸酯和对壬基苯酚与环氧乙烷和/或环氧丙烷的加成物或磷脂的盐。用于该目的的合适的磷脂是脑磷脂或卵磷脂类型的天然(起源于动物或植物细胞)或合成的磷脂,例如如磷脂酰-乙醇胺、磷脂酰丝氨酸、磷脂酰甘油、溶血卵磷脂、心磷脂、二辛基磷脂酰胆碱、二棕榈酰基磷脂酰胆碱,及其混合物。
[0346]
合适的非离子表面活性剂包括烷基酚、脂肪醇、脂肪酸、分子中包含至少12个碳原子的脂肪族胺或酰胺、烷基芳烃磺酸盐和二烷基磺基琥珀酸盐的聚乙氧基化和聚丙氧基化衍生物,例如脂肪族和脂环族醇、饱和和不饱和脂肪酸和烷基酚的聚乙二醇醚衍生物,所述衍生物通常在(脂肪族)烃部分中包含3至10个乙二醇醚基和8至20个碳原子,以及在烷基酚的烷基部分中包含6至18个碳原子。另一些合适的非离子表面活性剂是聚环氧乙烷与聚丙二醇、在烷基链中包含1至10个碳原子的乙二胺基-聚丙二醇的水溶性加成物,该加成物包含20至250个乙二醇醚基和/或10至100个丙二醇醚基。这样的化合物通常包含1至5个乙二
醇单元/丙二醇单元。非离子表面活性剂的一些代表性实例是壬基酚-聚乙氧基乙醇、蓖麻油聚乙醇醚、聚丙烯/聚环氧乙烷加成物、三丁基苯氧基聚乙氧基乙醇、聚乙二醇和辛基苯氧基聚乙氧基乙醇。聚乙烯脱水山梨糖醇的脂肪酸酯(例如聚氧乙烯脱水山梨糖醇三油酸酯)、甘油、脱水山梨糖醇、蔗糖和季戊四醇也是合适的非离子表面活性剂。合适的阳离子表面活性剂包括具有4个任选地被卤素、苯基、经取代的苯基或羟基取代的烃基团的季铵盐,特别是卤化物;例如包含作为n-取代基的至少一个c8c
22
烷基基团(例如鲸蜡基、月桂基、棕榈酰基、肉豆蔻基、油烯基等),以及作为另一些取代基的未经取代或卤代的低级烷基、苄基和/或羟基-低级烷基基团的季铵盐。
[0347]
适合于该目的的表面活性剂的更详细描述可见于例如"mccutcheon
′
s detergents and emulsifiers annual"(mc publishing crop.,ridgewood,new jersey,1981),"tensid-taschenbucw
′
,2d ed.(hanser verlag,vienna,1981)和"encyclopaedia of surfactants,(chemical publishing co.,new york,1981)中。根据本发明的肽、其同源物或衍生物(以及其全部包括在术语“活性成分”中的生理学上可接受的盐或药物组合物)可通过适合于待治疗病症和适合于化合物(此处为待施用的蛋白质和片段)的任何途径施用。可行的途径包括区域性、全身性、经口(固体形式或吸入)、直肠、经鼻、表面(包括经眼、口含和舌下)、阴道和肠胃外(包括皮下、肌内、静脉内、皮内、动脉内、鞘内和硬膜外)。优选的施用途径可随着例如接受者的病症或随着待治疗的疾病而变化。如本文中所述,在与制剂的其他成分相容并且对其接受者无害的意义上,载体最佳地是“可接受的”。所述制剂包括适合于以下的制剂:经口、直肠、经鼻、表面(包括口含和舌下)、阴道或肠胃外(包括皮下、肌内、静脉内、皮内、动脉内、鞘内和硬膜外)施用。
[0348]
适合于肠胃外施用的制剂包括可包含抗氧化剂、缓冲剂、抑菌剂和使制剂与预期接受者的血液等张的溶质的水性和非水性无菌注射溶液剂;以及可包含助悬剂和增稠剂的水性和非水性无菌混悬剂。所述制剂可存在于单位剂量或多剂量容器(例如密封的安瓿和小瓶)中,并且可在仅需在使用之前立即添加无菌液体载体(例如注射用水)的冷冻干燥(冻干)条件下储存。临时注射溶液剂和混悬剂可由前述类型的无菌粉末、颗粒剂和片剂制备。
[0349]
典型的单位剂量制剂是包含如本文中以上所记载的每日剂量或单位每日亚剂量的,或其合适分数的活性成分的制剂。应理解,除以上特别提及的成分之外,鉴于所讨论的制剂的类型,本发明的制剂还可包含本领域中的其他常规试剂,例如适合于经口施用的那些可包括矫味剂。根据本发明的肽、其同源物或衍生物可用于提供包含作为活性成分的一种或更多种本发明化合物的控释药物制剂(“控释制剂”),其中活性成分的释放可被控制和调节以允许较少频率的给药或改善给定本发明化合物的药动学或毒性谱。适于经口施用的其中包含一种或更多种本发明化合物的离散单元的控释制剂可根据常规方法制备。另外的成分可包含在内以便控制组合物中活性成分的作用持续时间。因此,可通过选择合适的聚合物载体例如如聚酯、聚氨基酸、聚乙烯吡咯烷酮、乙烯-乙酸乙烯酯共聚物、甲基纤维素、羧甲基纤维素、硫酸鱼精蛋白等来获得控释组合物。药物释放的速率和作用的持续时间也可通过将活性成分并入到聚合物物质,例如微胶囊、微球体、微乳剂、纳米粒、纳米胶囊剂等。根据施用途径,药物组合物可能需要保护性包衣。适合于注射的药物形式包括无菌水溶液剂或分散体以及用于其临时制备的无菌粉末。因此,用于该目的的典型载体包括生物相容性水性缓冲剂、乙醇、甘油、丙二醇、聚乙二醇等,及其混合物。鉴于以下事实:当组合使用
数种活性成分时,它们不一定在待治疗的哺乳动物中同时直接发挥其联合治疗作用,相应的组合物也可以呈以下形式:包含在分开但邻近的贮室或区室中的两种成分的医学药盒或包装。因此,在后一种情况下,每种活性成分可以因此以适合于不同于其他成分之施用途径的施用途径的方式来配制,例如它们之一可以是经口或肠胃外制剂的形式,而另一种是用于静脉内注射的安瓿剂或气雾剂的形式。
[0350]
如在本发明中所获得的溶细胞性cd4+t细胞在mhc-ii类依赖性同源活化之后诱导apc凋亡,影响树突细胞和b细胞二者,如在体外和在体内所表明的,以及(2)在不存在il-10和/或tgf-β的情况下通过接触依赖性机制抑制旁观者t细胞。如wo2008/017517中详细讨论的,溶细胞性cd4+t细胞可区别于天然treg和适应性treg二者。
[0351]
本发明的免疫原性肽包含赋予与cd1d分子结合之能力的疏水性残基。在施用之后,被apc吸收,引导至晚期内体,在此其被装载到cd1d上并呈递在apc表面处。一旦被cd1d分子呈递,肽中的氧化还原酶基序就会增强使nkt细胞活化的能力,从而成为溶细胞性nkt细胞。所述免疫原性肽激活细胞因子(例如ifn-γ)的产生,其将激活其他效应细胞,包括cd4+t细胞和cd8+t细胞。如wo2012/069568中详细讨论的,cd4+和cd8+t细胞二者均可参与消除呈递抗原的细胞。
[0352]
现在将通过以下实施例对本发明进行举例说明,所述实施例在无任何限制意图的情况下提供。此外,本文中所述的所有参考文献均通过引用明确地包含在本文中。
实施例
[0353]
实施例1:具有在2个半胱氨酸之间包含不同数目氨基酸的氧化还原酶基序(c-x
n-c)的免疫原性肽的设计。
[0354]
imcy-0443或imcy-0 189(包含经典氧化还原酶基序(h)cpyc(seq id no 34和35)、接头gw、鼠髓鞘少突胶质细胞糖蛋白(mog)mhcii t细胞表位yrspfsrw(seq id no:36)和侧翼序列hlyr(seq id no:122)的两种免疫原性肽)的不同变体以这样的方式设计和合成:将序列修饰成在氧化还原酶基序的2个半胱氨酸之间具有不同数目的氨基酸(表1)。在n端或在氧化还原酶基序内添加碱性氨基酸(k或r)。还合成了用丙氨酸代替半胱氨酸残基的对照肽(所谓的aa对照)。还设计了imcy-0017(wt mog35-55肽)、imcy-0069(包含经典氧化还原酶基序hcpyc(seq id no:35)和经修饰的鼠前胰岛素原表位的肽)和imcy-0257(包含经典氧化还原酶基序hcpyc(seq id no:35)和dby抗原表位的肽)作为对照(表1)。
[0355]
表1:具有在2个半胱氨酸之间包含不同数目氨基酸的氧化还原酶基序(c-x
n-c)的免疫原性肽。
[0356]
imcy-no序列目的seq id#imcy-0443cpyc-gwyrspfsrvvhlyr-nh2对照37imcy-0189hcpyc-gwyrspfsrvvhlyr-nh2对照38imcy-0190hapya-gwyrspfsrvvhlyr-nh2对照39imcy-0451kcc-gwyrspfsrvvhlyr-nh2测试40imcy-0511kaa-gwyrspfsrvvhlyr-nh2测试41imcy-0452cc-gwyrspfsrvvhlyr-nh2测试42imcy-0453kcrc-gwyrspfsrvvhlyr-nh2测试43
imcy-0513kara-gwyrspfsrvvhlyr-nh2测试44imcy-0454crc-gwyrspfsrvvhlyr-nh2测试45imcy-0512ara-gwyrspfsrvvhlyr-nh2测试46imcy-0455kcrpyc-gwyrspfsrvvhlyr-nh2测试47imcy-0515karpya-gwyrspfsrvvhlyr-nh2测试48imcy-0456crpyc-gwyrspfsrvvhlyr-nh2测试49imcy-0514arpya-gwyrspfsrvvhlyr-nh2测试50imcy-0017mevgwyrspfsrvvhlyrngk-nh2对照51imcy-0257hcpyc-nggfnsnranssrss-nh2对照52imcy-0069hcpyc-l.alwepkptqafvk-nh2对照53
[0357]
实施例2:免疫原性肽的氧化还原酶活性的评估
[0358]
免疫原性肽的氧化还原酶活性使用tomazzolli et al.(2006)anal.biochem.350,105
–
112中所述的荧光测定进行确定。当具有fitc标记的两个肽形成共价二硫键时,它们会变得自猝灭。在被根据本发明的肽还原之后,还原的单独经fitc标记的肽再次发出荧光。活性表示为重复的平均值。结果以相对荧光单位(relative fluorescent unit,rfu)表示。图1示出了肽变体的氧化还原酶活性。正如预期的那样,aa对照没有显示出任何氧化还原酶活性(未示出)。未测试对照肽imcy-0017、imcy-0257和imcy-0069。所有所测试肽均显示出氧化还原酶活性,类似于或低于imcy-0189的活性,或者对于kcc或kcrpyc(seq id no:54)基序活性更高。
[0359]
实施例3:具有在2个半胱氨酸之间包含不同数目氨基酸的氧化还原酶基序(c-x
n-c)的免疫原性肽的预防性施用在小鼠中对实验性自身免疫性脑脊髓炎(experimental auto-immune encephalomyelitis,eae)发生的作用。
[0360]
小鼠组和给药
[0361]
在该研究中,使用c57bl/6雌性小鼠(taconic biosciences,10周龄,在第0天)。在第一注射(第21天)之前,使小鼠适应10天。根据表2将其分配到14组(12只小鼠/组)。在研究开始时(第21天),以平衡的方式进行小鼠分配,以在各组中实现类似的平均重量。根据表2每天一次皮下(s.c.)施用肽。每只小鼠在两个部位接受注射(0.05ml/部位),总共0.1ml/小鼠/给药日,对应于30μg肽/小鼠。
[0362]
肽制备
[0363]
如实施例1中所述设计和合成包含氧化还原酶基序(参见表2)、接头gw、鼠髓鞘少突胶质细胞糖蛋白(mog)mhcii t细胞表位yrspfsrvv(seq id no:36)和侧翼序列hlyr(seq id no:122)的免疫原性肽。
[0364]
每次免疫接种之前进行以下操作。将冻干的肽在室温下从-20℃解冻10分钟。然后,将其以1mg/ml溶解在乙酸钠缓冲液(50mm,ph 5.4)0.9% nacl中,在室温下孵育5分钟并涡旋3秒。将肽以0.6mg/ml在乙酸钠缓冲液(50mm,ph 5.4)0.9% nacl中稀释。将肽与imject
tm
明矾佐剂混合,并在注射之前涡旋5秒。在每次注射时,每只小鼠接受50μl佐剂(2mg氢氧化铝/2mg氢氧化镁)和50μl溶解的肽(30μg)。
[0365]
将阴性对照小鼠用与乙酸钠缓冲液(50mm,ph 5.4)0.9% nacl混合的imject
tm
明矾进行处理(在每次注射时,每只小鼠50μl佐剂和50μl缓冲液)。
[0366]
表2:处理方案
[0367]
[0368][0369]
小鼠中的eae诱导
[0370]
使用以下操作在第0天诱导eae:
[0371]
第0天,第0小时-用包含特异性结合c57bl/6小鼠的mhc-ii i-ab受体的来自小鼠髓鞘少突胶质细胞糖蛋白的t细胞表位(mog
35-55
)的肽进行免疫接种。
[0372]
将小鼠皮下注射hooke kit
tm
mog
35-55
/cfa乳剂ptx(目录号ek-2110,lot#127,hooke laboratories,lawrence ma)的乳剂组分。将肽mog
35-55
(0.2mg/小鼠)以具有cfa的乳剂(1mg mog
35-55
/ml乳剂和2.5mg杀伤的结核分枝杆菌(mycobacterium tuberculosis)h37ra/ml乳剂)施用。在背部的两个不同部位施用乳剂。第一注射部位,即上背部区域,在颈线尾部大约1cm。第二部位,即下背部区域,在尾基部颅侧大约2cm。每个部位的注射体积为0.1ml。
[0373]
第0天,第2小时-注射百日咳毒素
[0374]
在注射乳剂的2小时内,腹膜内施用0.1ml的百日咳毒素(相同试剂盒的组分)。以100ng/剂施用百日咳毒素(批号1008,hooke laboratories)。
[0375]
读出
[0376]
eae评分用作读出。从第7天直至研究结束(第28天),每天对动物进行评分。进行评分的人员对处理和每只小鼠的先前评分(盲法评分)二者均不知情。eae以0至5级评分,如表3中所示。当临床体征落入两个以下定义的评分之间时,则分配中间评分。
[0377]
表3
–
eae评分标准
[0378][0379][0380]
统计学分析
[0381]
通过进行kruskal-wallis检验(非参数单因素anova方法)来分析曲线下面积(area under the curve,auc)和平均最大评分(mean maximal score,mms)。显著性差异如下所示:*p《0.05,**p《0.01,***p《0.001,****p《0.0001。
[0382]
结果
[0383]
imcy-0189组的一只小鼠在研究的第8天被发现患有咬合不正(malocclusion),产生营养不良的风险。对小鼠实施安乐死并将其从研究中排除。
[0384]
通过从第7天开始每天对小鼠进行评分来评价eae发生。为了举例说明该评价,图2a中示出了3个代表性组。明矾组中的小鼠发生了该模型的典型eae。为了量化治疗效力,从第7天至第28天,比较了明矾组与另外两个处理组的小鼠之间的临床评分auc(图2b)。临床评分auc考虑了在整个研究中疾病的严重程度以及任意疾病的发作延迟。疾病发作在经imcy-0189和经imcy-0453处理的小鼠中延迟,但在imcy-0453下,疾病严重程度更低。此外,用imcy-0453处理的小鼠表现出疾病峰值或mms的显著性降低(图2c)。
[0385]
为了量化所有肽处理的效力,对auc和mms进行每组的平均等级(mean rank)与明矾组的平均等级的多重比较。
[0386]
在明矾组与每个经处理组的小鼠之间比较第7天至第28天的临床评分的auc。正如预期的那样,与对照组(阴影条,图3)相比,统计学分析未显示出用aa肽处理的组(白色条,图3)的auc的任何显著性降低。所述肽各自与对照组相比均显示出auc的显著性降低(带点条,图3;表4)。在这种多重比较统计学背景下,在imcy-189下观察到的非统计学显著性是由于该组中的小鼠数目少,其与其他组相比缺少一只小鼠。
[0387]
表4:用不同肽处理的小鼠中auc降低的统计学量化(每种cc肽与明矾组比较获得的p值)。
[0388]
肽制备
[0389]
如实施例1中设计和合成包含氧化还原酶基序(参见表4)、接头gw、鼠髓鞘少突胶质细胞糖蛋白(mog)mhcii t细胞表位yrspfsrvv(seq id no:36)和侧翼序列hlyr(seq id no:122)的免疫原性肽。
[0390]
表4:
[0391][0392]
还比较了明矾组(明矾)与每个经处理组小鼠之间的临床评分mms。正如所预期的,与对照组(阴影条,图4)相比,统计学分析未显示出用aa肽(白色条,图4)处理的组的mms的任何显著性降低。具有基序kcrc(seq id no:11)、kcc、crc或crpyc(seq id no:55)的四种cc肽与对照组相比显示出mms的显著性降低(带点条,图4;表5)。未观察到用包含经典氧化还原酶基序的两种免疫原性肽(imcy-0443或imcy-0189)处理之后mms的显著性降低。
[0393]
表5:用不同肽处理的小鼠中mms降低的统计学量化(每种cc肽与明矾组相比获得的p值)。
[0394]
肽制备
[0395]
如实施例1中设计和合成包含氧化还原酶基序(参见表5)、接头gw、鼠髓鞘少突胶质细胞糖蛋白(mog)mhcii t细胞表位yrspfsrvv(seq id no:36)和侧翼序列hlyr(seq id no:122)的免疫原性肽。
[0396]
表5:
[0397][0398]
实施例4:具有在2个半胱氨酸之间包含不同数目氨基酸的氧化还原酶基序(c-x
n-c)的免疫原性肽的治疗性施用在小鼠中对实验性自身免疫性脑脊髓炎(eae)发生的作用。
[0399]
肽制备
[0400]
如实施例1中设计和合成包含氧化还原酶基序(参见表6)、接头gw、鼠髓鞘少突胶质细胞糖蛋白(mog)mhcii t细胞表位yrspfsrvv(seq id no:36)和侧翼序列hlyr(seq id no:122)的免疫原性肽。
[0401]
小鼠组和给药
[0402]
该研究使用总计64只雌性c57bl/6小鼠(taconic biosciences,9周龄,第0天)。在第一注射之前,使小鼠适应7天。在研究开始时,将小鼠以平衡的方式分组,以在各组之间实现类似的平均重量。下表6示出了向各组施用的处理。
[0403]
表6-处理方案
[0404][0405]
在表6中所示日的每一日以0.05ml/部位的体积对所有小鼠进行给药(s.c.)一次,每只小鼠在两个部位接受注射,总共0.1ml/小鼠/给药日。imcy-0189、imcy-0453或imcy-0455肽的总剂量为30μg/施用。
[0406]
化合物制备
[0407]
对于盐水处理,在每个给药日制备0.9% nacl溶液。如实施例3中所述进行肽的制备。
[0408]
血清神经丝水平测定
[0409]
在第28天,从所有小鼠中收集血液到凝胶凝结活化剂管中并使其在室温下凝结约30分钟。然后将血液以约10000g离心5分钟。将血清转移到eppendorf管中并在-80℃下储存,直至运送至quanterix
tm
。使用nf-light advantage试剂盒对血清神经丝轻链(neurofilament light,nf-l)蛋白水平进行定量,该试剂盒是用于定量确定血清、血浆和csf中nf-l的数字免疫测定。使用的抗体(uman diagnostics,sweden)也与鼠、牛和恒河猴nf-l表位发生交叉反应,并因此,该测定可用于这些物种的研究。所有样品均以40倍的稀释系数一式两份进行测试。
[0410]
末期收集
[0411]
在研究结束时,对所有小鼠实施安乐死,并收集脊(spine)并将其置于10%福尔马林缓冲液中以用于组织学分析。
[0412]
组织学
[0413]
对于每个脊,制备一个经h&e染色的玻片和一个经抗mbp染色的玻片并进行分析。每个玻片包含具有来自腰、胸和颈脊髓的样品(3个样品)的切片。所有分析均由对实验组和所有临床读出不知情的病理学家进行。
[0414]
在每个经h&e染色切片中计数大约20个细胞的炎性焦点。当炎性浸润由多于20个细胞组成时,则估计存在多少个具有20个细胞的焦点。
[0415]
在每个经抗mbp(使用免疫组织化学)染色的切片中对脱髓鞘进行评分。在抗mbp切
c)的免疫原性肽诱导具有裂解特性的特异性cd4+t细胞的能力。
[0440]
2d2转基因小鼠(jackson laboratory)用作cd4+细胞的来源。这些小鼠显示出含有髓鞘少突胶质细胞糖蛋白(mog)特异性、自身反应性t细胞库,这使其成为研究cd4+的同质群对当前实验肽的反应性的合适候选者。在本研究中,使用制造商说明(miltenyi biotec,130-104-454)来纯化2d2-总cd4+细胞,并针对来自c57bl6小鼠(与2d2转基因小鼠相容)的t细胞库使抗原呈递细胞脾细胞耗竭(cd90.2耗竭,miltenyi biotec,130-104-454)。每项研究的对照条件是不添加肽或添加imcy-0017、imcy-0257或imcy-0069(参见实施例1和表1),后两者可与来自c57bl6-apc的mhcii有效结合,但不激活来自2d2转基因cd4+t细胞的tcr。未使用aa对照。
[0441]
比较不同变体接合ag特异性cd4+细胞的能力。首先,通过测量激活标志物cd154+(cd40l)来研究序列的修饰(imcy-0189的变体)是否会影响激活单克隆ag特异性t细胞的总体能力。为了实现该目标,在存在cd40阻断抗体的情况下,将2d2-总cd4+和c57bl6 apc(比率1:1)的共培养物暴露于终浓度为5μm的每种实验肽和对照肽16小时。在孵育之后,通过流式细胞术来确定(pro-19-004-v00)所有实验和对照条件的ag特异性细胞的频率(图11)。这些结果表明,与imcy-0189(图11;虚线)相比,imcy-0189的所有经修饰变体(imcy-0451至imcy-0456)均能够诱导更高百分比的ag特异性细胞(cd4+cd154+)的接合。
[0442]
不同变体在2d2-cd4+细胞中诱导sil2的能力的比较
[0443]
接下来尝试确定不同变体接合ag特异性cd4+细胞的提高的能力是否将导致激活的这些细胞对il2的诱导提高。为此,将2d2-总cd4+和经丝裂霉素c处理的c57bl6 apc(比率1:1)的共培养物暴露于终浓度为5μm的每种实验肽和对照肽24小时。在孵育时间之后,通过添加终止蛋白酶抑制剂混合物(thermo scientific;78430)来收集上清液(supernatant,sn),并将其在-80℃下储存直至使用流式细胞术来测量所有实验和对照条件的所分泌il2(sil2)的量(legendplex小鼠th细胞因子组(13-plex);目录号740005;pro-19-007-v00)。facs结果表明,与imcy-0189相比(图12;虚线),经修饰变体(imcy-0451至imcy-0456)能够诱导更高量的sil2。
[0444]
不同变体在cd4+t细胞上诱导裂解标志物的能力的比较。
[0445]
本领域已知包含mchii t细胞表位和序列cxxc的经典氧化还原酶基序的免疫原性肽诱导具有裂解标志物的cd4+细胞,称为溶细胞性cd4+细胞(ccd4+)。因此,试图确定本发明的肽变体在激活的ag特异性cd4t细胞中是否导致更早和/或更强(百分比或强度)的裂解特性。在这组实验中,用经丝裂霉素c处理的c57bl6 apc(比率1:1)和终浓度为5μm的每种实验肽和对照肽来刺激2d2总cd4+(s1)。在10至14天的间隔之后,在不存在和存在有关肽的情况下,再次刺激来自所有实验和对照条件的所有细胞培养物(s2d0)。在第二刺激之后16小时(s2d1),收集细胞并进行染色以通过流式细胞术(pro-19-014-v00)进行胞内(intracellular,ic)裂解标志物的测量(颗粒酶a和b,cd107a和b)。预期地,对照肽条件(无pep,imcy-0257和imcy-0069)在细胞培养中无法存活(未响应于未添加肽或添加错配tcr肽而扩增),并且无法被包括在s2时的测量中。然后确定imcy-0189的所有变体的facs结果,并从所有其他测量中去除野生型肽(imcy-0017)的测量,以单纯地确定每种经修饰氧化还原酶基序对诱导裂解特性的作用。到目前为止,该结果表明,与imcy-0189相比(图13;虚线),具有较大变化的imcy-0189的经修饰变体(imcy-0451至imcy-0456)能够诱导更高百分比的
裂解标志物。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1