在蛋白质纯化过程中降低宿主细胞蛋白质含量的方法与流程
在蛋白质纯化过程中降低宿主细胞蛋白质含量的方法
1.本发明涉及重组蛋白质制备领域。更具体地,本发明提供了一种用于在将要给病人施用的蛋白质(诸如治疗性或诊断性蛋白质)的制备过程中降低包含在宿主细胞中重组地生产的目的蛋白质的蛋白质制剂中的宿主细胞蛋白质含量的方法目的蛋白质。
2.宿主细胞蛋白质(hcp)是参与细胞的维持和生长及蛋白质的合成和加工的宿主细胞的蛋白质。然而,在治疗性或诊断性蛋白质领域,hcp的存在威胁着产品质量和病人安全,因为它会造成诸如聚集、产品因催化活性和/或免疫原性而碎片化等问题。因此,hcp被视为蛋白质制剂的一个关键质量属性(cqa)。不希望的聚集和产品碎片化的形成要求通过额外的纯化步骤来降低/去除hcp,而这些额外的纯化步骤经常会导致目标蛋白质的产量减少和整体制造制备的增加。
3.从制备过程中消除hcp的挑战,以及改进工艺以降低hcp的尝试已经公开,例如在以下资料中所述的,gilgunn等;goey等,biotechnology advances 36(2018)1223
–
1237;以及current opinion in chemical engineering 2018,22:98
–
4.106.。然而,这些去除hcp的工艺都存在局限性。例如,在某些情况下,这些公开的资料显示了hcp的不完全去除、去除hcp中的工艺不一致导致聚集、想要的蛋白质和hcp的共纯化、产品功能受损、患者的免疫原性问题,和/或削减的药代动力学性质诸如半衰期中的一种或多种。此外,为去除hcp而开发的工艺经常要求例如需要在增加的体积及额外的纯化步骤下操作,常导致制备成本增加及产量减少。在某些情况下,该方法的适用性仅限于特定的分子和/或形式。因此,在治疗性或诊断性蛋白质的纯化过程中,仍需要可用于降低hcp的替代方法。此类替代方法优选在不影响产品稳定性、产量或成本的情况下降低hcp以最终保持产品质量,并可用于大规模制备和确保病人安全。
5.因此,本发明通过提供在制备治疗性或诊断性蛋白质时降低hcp的替代方法来解决上述一或多个问题。本发明的方法提供了可复现的方法,其在去除hcp方面非常有效,同时保持蛋白质的稳定性,减少聚集,维持产品产量,并有降低免疫原性风险的潜力。此类方法可以有效地去除hcp而不要求增加蛋白质的制备体积。令人惊讶地,本发明的方法实现了hcp计量远低于行业《100ppm的可接受的标准。令人惊讶地,在实施方案中,本发明的方法实现了hcp计量《50ppm且同时保持了蛋白质的稳定性,减少了聚集,维持了产品产量。更令人惊讶地,本发明的其它实施方案实现了hcp计量《20ppm且同时保持了蛋白质的稳定性,减少了聚集,维持了产品产量。此外,本发明的实施方案提供的hcp去除方法适用于广泛的分子。本发明的其他实施方案能够消除额外的纯化步骤,从而减少批量处理时间,并降低制备成本。
6.因此,特定的实施方案提供了一种降低包含在宿主细胞中重组地产生的目的蛋白质的蛋白质制剂中的宿主细胞蛋白质含量的方法,所述方法包括,使在宿主细胞中重组地产生的蛋白质制剂经过亲和层析柱,用由一种弱酸和一种强酸组成的酸组合从层析柱中洗脱目的蛋白质,以获得包含目的蛋白质的洗脱液,将洗脱液的ph值提高至约6.0以上,将洗脱液进行深度过滤,并获得经过滤的蛋白质制剂。在一些实施方案中,来自ph值提高至约6.0以上的步骤的洗脱液的离子强度为约10mm至45mm。在一些实施方案中,弱酸具有不多于
一个小于7.0的pka值,强酸具有不多于一个小于7.0的pka值。优选经过滤的蛋白质制剂中的宿主细胞蛋白质含量降低。更优选经过滤的蛋白质制剂中的宿主细胞蛋白质含量降低至低于约100ppm,低于约50ppm,或低于约20ppm。
7.因此,在特定的实施方案中,提供了一种降低包含在宿主细胞中重组地产生的目的蛋白质的蛋白质制剂中的宿主细胞蛋白质含量的方法,所述方法包括,使在宿主细胞中重组地产生的蛋白质制剂经过亲和层析柱,用由一种弱酸和一种强酸组成的酸组合从层析柱中洗脱目的蛋白质,以获得包含目的蛋白质的洗脱液,对洗脱液进行病毒灭活,将洗脱液的ph值提高至约6.0以上,将洗脱液进行深度过滤,并获得经过滤的蛋白质制剂。在一些实施方案中,来自ph值提高至约6.0以上的步骤的洗脱液的离子强度为约10mm至45mm。在一些实施方案中,弱酸具有不多于一个小于7.0的pka值,强酸具有不多于一个小于7.0的pka值。优选经过滤的蛋白质制剂中的宿主细胞蛋白质含量降低。更优选经过滤的蛋白质制剂中的宿主细胞蛋白质含量降低至低于约100ppm,低于约50ppm,或低于约20ppm。
8.因此,在特定的实施方案中,提供了一种降低包含在宿主细胞中重组地产生的目的蛋白质的蛋白质制剂中的宿主细胞蛋白质含量的方法,所述方法包括,使在宿主细胞中重组地产生的蛋白质制剂经过亲和层析柱,用由一种弱酸和一种强酸组成的酸组合从层析柱中洗脱目的蛋白质,以获得包含目的蛋白质的洗脱液,进行病毒灭活,其包括将包含从所述将蛋白质从层析柱中洗脱的步骤中得到的蛋白质洗脱液的ph调整至约4.0以下,其中洗脱液在约ph4.0以下的状态下维持约0分钟至约180分钟,将洗脱液的ph值提高到约6.0以上,将包含蛋白质的洗脱液进行深度过滤,并获得经过滤的蛋白质制剂。在一些实施方案中,来自将ph值提高至约6.0以上的步骤的洗脱液的离子强度为约10mm至45mm。优选经过滤的蛋白质制剂中的宿主细胞蛋白质含量降低。更优选经过滤的蛋白质制剂中的宿主细胞蛋白质含量降低至低于约100ppm,低于约50ppm,或低于约20ppm。
9.因此,在特定的实施方案中,提供了一种降低包含在宿主细胞中重组地产生的目的蛋白质的蛋白质制剂中的宿主细胞蛋白质含量的方法,所述方法包括,使在宿主细胞中重组地产生的蛋白质制剂经过亲和层析柱,用由一种弱酸和一种强酸组成的酸组合从层析柱中洗脱目的蛋白质,以获得包含目的蛋白质的洗脱液,其中所述弱酸是乙酸,所述强酸是磷酸或乳酸,将包含从所述将蛋白质从层析柱中洗脱的步骤中得到的蛋白质洗脱液的ph调整至约4.0以下,其中洗脱液在约ph4.0以下的状态下维持约0分钟至约180分钟,将洗脱液的ph值提高到约6.0以上,将包含蛋白质的洗脱液进行深度过滤,并获得经过滤的蛋白质制剂。在一些实施方案中,来自将ph值提高至约6.0以上的步骤的洗脱液的离子强度为约10mm至45mm。优选经过滤的蛋白质制剂中的宿主细胞蛋白质含量降低。更优选经过滤的蛋白质制剂中的宿主细胞蛋白质含量降低至低于约100ppm,低于约50ppm,或低于约20ppm。
10.在本发明的一些实施方案中,本公开提供了一种降低包含在宿主细胞中重组地产生的目的蛋白质的蛋白质制剂中的宿主细胞蛋白质含量的方法,所述方法包括,使在宿主细胞中重组地产生的蛋白质制剂经过亲和层析柱,用由一种弱酸和一种强酸组成的酸组合从层析柱中洗脱目的蛋白质,以获得包含目的蛋白质的洗脱液,其中所述弱酸是乙酸,所述强酸是磷酸,其中乙酸的浓度约为20mm,磷酸的浓度约为约5mm至约10mm,将包含从所述将蛋白质从层析柱中洗脱的步骤中得到的蛋白质洗脱液的ph调整至约4.0以下,其中洗脱液在约ph4.0以下的状态下维持约0分钟至约180分钟,将洗脱液的ph值提高到约6.0以上,将
包含蛋白质的洗脱液进行深度过滤,并获得经过滤的蛋白质制剂。在一些实施方案中,来自ph值提高至约6.0以上的步骤的洗脱液的离子强度为约10mm至45mm。优选经过滤的蛋白质制剂中的宿主细胞蛋白质含量降低。更优选经过滤的蛋白质制剂中的宿主细胞蛋白质含量降低至低于约100ppm,低于约50ppm,或低于约20ppm。
11.在本发明的一些实施方案中,本公开提供了一种降低包含在宿主细胞中重组地产生的目的蛋白质的蛋白质制剂中的宿主细胞蛋白质含量的方法,所述方法包括,使在宿主细胞中重组地产生的蛋白质制剂经过亲和层析柱,用由一种弱酸和一种强酸组成的酸组合从层析柱中洗脱目的蛋白质,以获得包含目的蛋白质的洗脱液,其中所述弱酸为乙酸,所述强酸为乳酸,其中乙酸的浓度约为20mm,乳酸的浓度为约5mm,将包含从所述将蛋白质从层析柱中洗脱的步骤中得到的蛋白质洗脱液的ph调整至约4.0以下,其中洗脱液在约ph 4.0以下的状态下维持约0分钟至约180分钟,将洗脱液的ph值提高到约ph 6.0以上,将包含蛋白质的洗脱液进行深度过滤,并获得经过滤的蛋白质制剂。在一些实施方案中,来自ph值提高至约6.0以上的步骤的洗脱液的离子强度为约10mm至45mm。优选经过滤的蛋白质制剂中的宿主细胞蛋白质含量降低。更优选经过滤的蛋白质制剂中的宿主细胞蛋白质含量降低至低于约100ppm,低于约50ppm,或低于约20ppm。
12.在一些实施方案中,本公开提供了一种降低包含在宿主细胞中重组地产生的目的蛋白质的蛋白质制剂中的宿主细胞蛋白质含量的方法,所述方法包括,使在宿主细胞中重组地产生的蛋白质制剂经过亲和层析柱,用由一种弱酸和一种强酸组成的酸组合从层析柱中洗脱目的蛋白质,以获得包含目的蛋白质的洗脱液。其中所述弱酸是乙酸,所述强酸是磷酸或乳酸,调整将包含从所述将蛋白质从层析柱中洗脱的步骤中得到的蛋白质洗脱液的ph,其中所述调整洗脱液的ph值的步骤包括向洗脱液中加入约20mm hcl,其中洗脱液的ph值被调整至约ph 3.3至约ph 3.7,其中洗脱液在约ph3.3至ph3.7维持约0分钟至约180分钟,将洗脱液的ph值提高到约ph6.0以上,将包含蛋白质的洗脱液进行深度过滤,并获得经过滤的蛋白质制剂。在一些实施方案中,来自ph值提高至约ph 6.0以上的步骤的洗脱液的离子强度为约10mm至45mm。优选经过滤的蛋白质制剂中的宿主细胞蛋白质含量降低。更优选经过滤的蛋白质制剂中的宿主细胞蛋白质含量降低至低于约100ppm,低于约50ppm,或低于约20ppm。
13.在一些实施方案中,本公开提供了一种降低包含在宿主细胞中重组地产生的目的蛋白质的蛋白质制剂中的宿主细胞蛋白质含量的方法,所述方法包括,使在宿主细胞中重组地产生的蛋白质制剂经过亲和层析柱,用由一种弱酸和一种强酸组成的酸组合从层析柱中洗脱目的蛋白质,以获得包含目的蛋白质的洗脱液。其中所述弱酸是乙酸,所述强酸是磷酸或乳酸,调整将包含从所述将蛋白质从层析柱中洗脱的步骤中得到的蛋白质洗脱液的ph,其中所述调整洗脱液的ph值的步骤包括向洗脱液中加入约20mm hcl,其中洗脱液的ph值被调整至约3.5,其中洗脱液在约ph3.5维持约0分钟至约180分钟,将洗脱液的ph值提高到约ph6.0以上,将包含蛋白质的洗脱液进行深度过滤,并获得经过滤的蛋白质制剂。在一些实施方案中,来自ph值提高至约6.0以上的步骤的洗脱液的离子强度为约10mm至45mm。优选经过滤的蛋白质制剂中的宿主细胞蛋白质含量降低。更优选经过滤的蛋白质制剂中的宿主细胞蛋白质含量降低至低于约100ppm,低于约50ppm,或低于约20ppm。
14.在一些特定的实施方案中,本公开提供了一种降低包含在宿主细胞中重组地产生
的目的蛋白质的蛋白质制剂中的宿主细胞蛋白质含量的方法,所述方法包括,使在宿主细胞中重组地产生的蛋白质制剂经过亲和层析柱,用由一种弱酸和一种强酸组成的酸组合从层析柱中洗脱目的蛋白质,以获得包含目的蛋白质的洗脱液。其中所述弱酸是乙酸,所述强酸是磷酸或乳酸,将包含从所述将蛋白质从层析柱中洗脱的步骤中得到的蛋白质洗脱液的ph调整至约4.0以下,其中洗脱液在约ph4.0以下的状态下维持约0分钟至约180分钟,将洗脱液的ph值提高到约ph 6.5至约ph 7.5,包括向洗脱液中加入约250mm tris buffer,将包含蛋白质的洗脱液进行深度过滤,并获得经过滤的蛋白质制剂。在一些实施方案中,将洗脱液的ph值提高到约ph 6.5至约ph 7.5包括向洗脱液中加入约100mm至约1000mm tris buffer。在一些实施方案中,来自将ph值提高到高于约ph 6.5至约ph 7.5的步骤中的洗脱液的离子强度,为约10mm至约45mm。优选过滤后的蛋白质制剂中的宿主细胞蛋白质含量降低。更优选过滤后的蛋白质制剂中的宿主细胞蛋白质含量降低至低于约100ppm,低于约50ppm,或低于约20ppm。
15.在一些实施方案中,本公开提供了一种降低包含在宿主细胞中重组地产生的目的蛋白质的蛋白质制剂中的宿主细胞蛋白质含量的方法,所述方法包括,使在宿主细胞中重组地产生的蛋白质制剂经过亲和层析柱,用由一种弱酸和一种强酸组成的酸组合从层析柱中洗脱目的蛋白质,以获得包含目的蛋白质的洗脱液,其中所述弱酸是乙酸,所述强酸是磷酸或乳酸,将包含从所述将蛋白质从层析柱中洗脱的步骤中得到的蛋白质洗脱液的ph调整至约4.0以下,其中洗脱液在约ph4.0以下的状态下维持约0分钟至约180分钟,将洗脱液的ph值提高到约ph 7.0,包括向洗脱液中加入约250mm tris buffer,将包含蛋白质的洗脱液进行深度过滤,并获得经过滤的蛋白质制剂。在一些实施方案中,将洗脱液的ph值提高到约ph 6.5至约ph 7.5包括向洗脱液中加入约100mm至约1000mm tris buffer。在一些实施方案中,来自将ph值提高到约ph 7.0的步骤中的洗脱液的离子强度,为约10mm至约45mm。优选过滤后的蛋白质制剂中的宿主细胞蛋白质含量降低。更优选过滤后的蛋白质制剂中的宿主细胞蛋白质含量降低至低于约100ppm,低于约50ppm,或低于约20ppm。
16.在一些实施方案中,本公开提供了一种降低包含在宿主细胞中重组地产生的目的蛋白质的蛋白质制剂中的宿主细胞蛋白质含量的方法,所述方法包括,使在宿主细胞中重组地产生的蛋白质制剂经过亲和层析柱,用由一种弱酸和一种强酸组成的酸组合从层析柱中洗脱目的蛋白质,以获得包含目的蛋白质的洗脱液,其中所述弱酸是乙酸,所述强酸是磷酸或乳酸,将包含从所述将蛋白质从层析柱中洗脱的步骤中得到的蛋白质洗脱液的ph调整至约4.0以下,其中洗脱液在约ph4.0以下的状态下维持约0分钟至约180分钟,将洗脱液的ph值提高到约6.0,将包含蛋白质的洗脱液进行深度过滤,并获得经过滤的蛋白质制剂,其中施用到所述深度过滤的洗脱液具有约10mm至45mm的离子强度。优选经过滤的蛋白质制剂中的宿主细胞蛋白质含量降低。更优选经过滤的蛋白质制剂中的宿主细胞蛋白质含量降低至低于约100ppm,低于约50ppm,或低于约20ppm。
17.在特定的实施方案中,本公开提供了一种降低包含在宿主细胞中重组地产生的目的蛋白质的蛋白质制剂中的宿主细胞蛋白质含量的方法,所述方法包括,使在宿主细胞中重组地产生的蛋白质制剂经过亲和层析柱,用由一种弱酸和一种强酸组成的酸组合从层析柱中洗脱目的蛋白质,以获得包含目的蛋白质的洗脱液,其中所述弱酸是乙酸,所述强酸是磷酸或乳酸,将包含从所述将蛋白质从层析柱中洗脱的步骤中得到的蛋白质洗脱液的ph调
整至约4.0以下,其中洗脱液在约ph4.0以下的状态下维持约0分钟至约180分钟,其中实现了病毒的灭活。
18.本公开提供了一种降低包含在宿主细胞中重组地产生的目的蛋白质的蛋白质制剂中的宿主细胞蛋白质含量的方法,所述方法包括,使在宿主细胞中重组地产生的蛋白质制剂经过亲和层析柱,用由一种弱酸和一种强酸组成的酸组合从层析柱中洗脱目的蛋白质,以获得包含目的蛋白质的洗脱液,其中弱酸包含浓度为约20mm的乙酸,并且其中强酸包含磷酸、甲酸或乳酸中的任一种,并且其中强酸的浓度为约5mm至约10mm,调整包含来自所述将蛋白质从层析柱中洗脱的步骤的蛋白质的洗脱液的ph值,其中所述调整洗脱液的ph值的步骤包括向洗脱液中加入hcl、磷酸、柠檬酸或乙酸加磷酸的组合中的任一种,其中ph值被调整至约4.0以下,其中所述洗脱液在ph值约4.0以下的状态下维持约0分钟至约180分钟,将洗脱液的ph值提高到约ph 6.0至约ph 7.5以上,将包含蛋白质的洗脱液进行深度过滤,并获得经过滤的蛋白质制剂。在一些实施方案中,来自将ph值提高到高于约ph 6.0至ph7.5以上的步骤中的洗脱液的离子强度,为约10mm至约45mm。优选过滤后的蛋白质制剂中的宿主细胞蛋白质含量降低。更优选过滤后的蛋白质制剂中的宿主细胞蛋白含量降低至低于约100ppm。在其他实施方案中,洗脱步骤包括包含乙酸和磷酸、乙酸和乳酸或乙酸和甲酸的酸组合,并且其中所述调整ph值至约4.0以下的步骤包括加入hcl、磷酸、柠檬酸或乙酸和磷酸的组合中的任一种。在其他实施方案中,洗脱步骤包括约20mm乙酸和约10mm磷酸、约20mm乙酸和约5mm磷酸、或约20mm乙酸和约5mm甲酸中的任一种的组合,并且其中将ph值调整到约4.0以下包括加入约20mmhcl、约15mm至约200mm磷酸、约1000mm柠檬酸、或约20mm乙酸和约10mm磷酸的组合中的任一种。在此类实施方案中,将ph值提高到约6.0以上的步骤中的洗脱液的离子强度是约10mm至约45mm。
19.在本发明的一个方面,本发明提供了一种降低包含在宿主细胞中重组地产生的目的蛋白质的蛋白质制剂中的宿主细胞蛋白质含量的方法,所述方法包括步骤:
20.使在宿主细胞中重组地产生的蛋白质制剂经过亲和层析柱;
21.用由一种弱酸和一种强酸组成的酸组合从层析柱中洗脱目的蛋白质,以获得包含目的蛋白质的洗脱液,其中所述弱酸是乙酸,所述强酸是磷酸或乳酸;
22.将包含从所述将蛋白质从层析柱中洗脱的步骤中得到的蛋白质洗脱液的ph调整至约4.0以下,并且其中洗脱液在约ph4.0以下的状态下维持约0分钟至约180分钟;
23.将洗脱液的ph值提高到约6.0以上;
24.将包含蛋白质的洗脱液进行深度过滤,并
25.获得经过滤的蛋白质制剂。
26.优选地,经过滤的蛋白质制剂中的宿主细胞蛋白质含量降低。更优选地,经过滤的蛋白质制剂中的宿主细胞蛋白质含量降低至低于约100ppm,低于约50ppm,或低于约20ppm。
27.在一些实施方案中,所述蛋白质是治疗性或诊断性蛋白质,如抗体、fc融合蛋白、肽类、免疫黏附素、酶、生长因子、受体、激素、调控因子、细胞因子、抗原、肽或结合剂。在一些实施方案中,所述蛋白质是抗体,例如单克隆抗体、嵌合抗体、人源化抗体、人抗体、双特异性抗体或抗体片段。在一些实施方案中,所述蛋白质是igg1抗体或含有igg1抗体的fc段。在一些实施方案中,所述蛋白质是一种抗sars-cov-2抗体。
28.在本发明的另一个方面,本发明提供了一种降低在宿主细胞中重组地产生的抗
sars-cov-2抗体制剂中宿主细胞蛋白质含量的方法,包括以下步骤:
29.将在宿主细胞中重组地产生的抗sars-cov-2抗体经过亲和层析柱,例如蛋白a亲和层析柱;
30.用包含乙酸和磷酸或乙酸和乳酸的组合的酸组合洗脱抗sars-cov-2抗体,以获得包含抗sars-cov-2抗体的洗脱液;
31.通过加入约20mm hcl调整包含抗sars-cov-2抗体的洗脱液的ph值,其中ph值调整到约ph 3.3至约ph 3.7,且其中洗脱液在约ph 3.3至约ph 3.7状态下维持约0分钟至约180分钟;
32.通过加入约250mm的tris buffer将包含抗sars-cov-2抗体的洗脱液的ph值提高到约ph 6.5至约ph 7.5;且
33.将包含抗sars-cov-2抗体的洗脱液进行深度过滤,并获得经过滤的抗sars-cov-2抗体制剂。
34.其中深度过滤后,经过滤的抗sars-cov-2抗体制剂中的宿主细胞蛋白质含量降低到约0ppm至约100ppm,且其中抗sars-cov-2抗体是igg1抗体。
35.在本发明的一些实施方案中,本公开提供了一种降低在宿主细胞中重组地产生的抗sars-cov-2抗体制剂中宿主细胞蛋白质含量的方法,所述方法包括,将在宿主细胞中重组地产生的抗sars-cov-2抗体经过蛋白a层析柱,用包含约20mm乙酸和约5mm磷酸的酸组合,或包含约20mm乙酸和约10mm磷酸的酸组合,或包含约20mm乙酸和约5mm乳酸的酸组合,从层析柱洗脱抗sars-cov-2抗体,以获得包含抗sars-cov-2抗体的洗脱液;通过加入约20mm hcl调整包含抗sars-cov-2抗体的洗脱液的ph值,其中ph值降低到约ph 3.3至约ph 3.7,且其中洗脱液在约ph 3.3至约ph 3.7状态下维持约0分钟至约180分钟;通过加入约250mm的tris buffer将包含抗sars-cov-2抗体的洗脱液的ph值提高,其中ph被提高到约ph 6.5至约ph 7.5,将包含抗sars-cov-2抗体的洗脱液进行深度过滤,并获得经过滤的抗sars-cov-2抗体制剂。其中经过滤的抗sars-cov-2抗体制剂中的宿主细胞蛋白质含量降低到约0ppm至约100ppm,且其中抗sars-cov-2抗体是igg1抗体。在一些实施方案中,将洗脱液的ph值提高到约ph 6.5至约ph 7.5包括向洗脱液中添加约100mm至约1000mm tris缓冲液。
36.在本发明的一些实施方案中,本公开提供了一种降低在宿主细胞中重组地产生的抗sars-cov-2抗体制剂中宿主细胞蛋白质含量的方法,所述方法包括,将在宿主细胞中重组地产生的抗sars-cov-2抗体经过蛋白a层析柱,用包含约20mm乙酸和约5mm磷酸的酸组合,或包含约20mm乙酸和约10mm磷酸的酸组合,或包含约20mm乙酸和约5mm乳酸的酸组合,从层析柱洗脱抗sars-cov-2抗体,以获得包含抗sars-cov-2抗体的洗脱液;用约20mm hcl调整包含抗sars-cov-2抗体的洗脱液的ph值,其中ph值调整到约ph 3.5,且其中洗脱液在约ph 3.5状态下维持约0分钟至约180分钟;用约250mm的tris buffer将包含抗sars-cov-2抗体的洗脱液的ph值提高,其中ph被提高到约ph 6.5至约ph 7.5,将包含抗sars-cov-2抗体的洗脱液进行深度过滤,并获得经过滤的抗sars-cov-2抗体制剂。其中经过滤的抗sars-cov-2抗体制剂中的宿主细胞蛋白质含量降低到约0ppm至约100ppm,且其中抗sars-cov-2抗体是igg1抗体。在一些实施方案中,将洗脱液的ph值提高到约ph 6.5至约ph 7.5包括向洗脱液中添加约100mm至约1000mm tris缓冲液。
37.在本发明的一些实施方案中,本公开提供了一种降低在宿主细胞中重组地产生的
抗sars-cov-2抗体制剂中宿主细胞蛋白质含量的方法,所述方法包括,将在宿主细胞中重组地产生的抗sars-cov-2抗体经过蛋白a层析柱,用包含约20mm乙酸和约5mm磷酸的酸组合,或包含约20mm乙酸和约10mm磷酸的酸组合,或包含约20mm乙酸和约5mm乳酸的酸组合,从层析柱洗脱抗sars-cov-2抗体,以获得包含抗sars-cov-2抗体的洗脱液;通过加入约20mm hcl调整包含抗sars-cov-2抗体的洗脱液的ph值,其中ph值降低到约ph 3.5,且其中洗脱液在约ph 3.5状态下维持约0分钟至约180分钟,其中实现了病毒灭活。
38.在本发明的一些实施方案中,本公开提供了一种降低在宿主细胞中重组地产生的抗sars-cov-2抗体制剂中宿主细胞蛋白质含量的方法,所述方法包括,将在宿主细胞中重组地产生的抗sars-cov-2抗体经过蛋白a层析柱,用包含约20mm乙酸和约5mm磷酸的酸组合,或包含约20mm乙酸和约10mm磷酸的酸组合,或包含约20mm乙酸和约5mm乳酸的酸组合,从层析柱洗脱抗sars-cov-2抗体,以获得包含抗sars-cov-2抗体的洗脱液;通过加入约20mm hcl调整包含抗sars-cov-2抗体的洗脱液的ph值,其中ph值降低到约ph 3.3至约ph 3.7,且其中洗脱液在约ph 3.3至约ph 3.7状态下维持约0分钟至约180分钟;用约250mm的tris buffer将包含抗sars-cov-2抗体的洗脱液的ph值提高,其中ph被提高至约ph 7.25,将包含抗sars-cov-2抗体的洗脱液进行深度过滤,并获得经过滤的抗sars-cov-2抗体制剂。其中经过滤的抗sars-cov-2抗体制剂中的宿主细胞蛋白质含量降低到约0ppm至约100ppm,且其中抗sars-cov-2抗体是igg1抗体。在一些实施方案中,将洗脱液的ph值提高至约ph 7.25包括向洗脱液中添加约100mm至约1000mm tris缓冲液。
39.在本发明的一些实施方案中,本公开提供了一种降低在宿主细胞中重组地产生的抗sars-cov-2抗体制剂中宿主细胞蛋白质含量的方法,所述方法包括,将在宿主细胞中重组地产生的抗sars-cov-2抗体经过蛋白a层析柱,用包含约20mm乙酸和约5mm磷酸的酸组合,或包含约20mm乙酸和约5mm磷酸的酸组合,或包含约20mm乙酸和约5mm乳酸的酸组合,从层析柱洗脱抗sars-cov-2抗体,以获得包含抗sars-cov-2抗体的洗脱液;通过加入约20mm hcl调整包含抗sars-cov-2抗体的洗脱液的ph值,其中ph值降低到约ph 3.5,且其中洗脱液在约ph 3.5状态下维持约0分钟至约180分钟;通过添加约250mm的tris buffer将包含抗sars-cov-2抗体的洗脱液的ph值提高,其中ph被提高至约ph7.25,将包含抗sars-cov-2抗体的洗脱液进行深度过滤,并获得经过滤的抗sars-cov-2抗体制剂。其中经过滤的抗sars-cov-2抗体制剂中的宿主细胞蛋白质含量降低到约0ppm至约100ppm,且其中抗sars-cov-2抗体是igg1抗体。在一些实施方案中,将洗脱液的ph值提高至约ph 7.25包括向洗脱液中添加约100mm至约1000mm tris缓冲液。
40.在一些实施方案中,本发明提供了一种降低在宿主细胞中重组地产生的抗sars-cov-2抗体制剂中的宿主细胞蛋白质含量的方法,
41.在一些实施方案中,抗sars-cov-2抗体是巴姆拉尼单抗(bamlanivimab)。在一些实施方案中,抗sars-cov-2抗体包含包含seq id no:1的氨基酸序列的可变重链和包含seq id no:2的氨基酸序列的可变轻链。在一些实施方案中,抗sars-cov-2抗体包含包含seq id no:3的氨基酸序列的重链和包含seq idno:4的氨基酸序列的轻链。在其他实施方案中,抗sars-cov-2抗体是埃特司韦单抗(etesevimab)。在仍然其他实施方案中,抗sars-cov-2抗体包含包含seq id no:5的氨基酸序列的可变重链和包含seq id no:6的氨基酸序列的可变轻链。在仍然更多的实施方案中,抗sars-cov-2抗体包含包含seq id no:7的氨基酸序列
plus(90zb08a)。
49.在一些实施方案中,本公开提供了一种降低包含在宿主细胞中重组产生的目的蛋白质的蛋白质制剂中的宿主细胞蛋白质的含量的方法,其中来自将ph值提高至约6.0以上的步骤的洗脱液的离子强度为约10mm至45mm。在一些实施方案中,离子强度小于约30mm。在一些实施方案中,离子强度小于约20mm。在其他实施方案中,离子强度小于约15mm。
50.在一些实施方案中,本发明提供了方法,其中包含在宿主细胞中重组地产生的目的蛋白质的蛋白质制剂经过层析柱。在一些实施方案中,层析柱是亲和柱、离子交换柱、疏水作用柱、羟基磷灰石柱或混合模式柱中的一或多种。在一些实施方案中,亲和层析柱是蛋白a柱、蛋白g柱或蛋白l柱。在其他实施方案中,离子交换层析柱是阴离子交换柱或阳离子交换柱。在一些实施方案中,本发明提供了方法,其中hcp充分地从最终产品中去除。
51.在一些实施方案中,提供了降低包含在宿主细胞中重组地产生的目的蛋白质的蛋白质制剂中的宿主细胞蛋白质的含量的方法,其中所述蛋白质是治疗性或诊断性蛋白。在另外的实施方案中,所述治疗性或诊断性蛋白是抗体、fc融合蛋白、免疫粘附素、酶、生长因子、受体、激素、调控因子、细胞因子、抗原或结合剂。在其他实施方案中,所述抗体是单克隆抗体、嵌合抗体、人源化抗体、人抗体、双特异性抗体,或抗体片段。
52.在另一方面,本文提供了包含本文所描述的蛋白质制剂、核酸或载体的药物组合物。在其他方面,本公开提供了一种通过如本文所描述的方法产生的组合物。在仍然其他实施方案中,本公开提供了通过如本文所描述的方法产生的组合物,其中所述组合物中的宿主细胞蛋白质含量低于约100ppm。
53.术语"宿主细胞蛋白质"(hcp)是指宿主细胞中参与细胞维持、生长及蛋白质合成和加工的蛋白质。例如,此类hcp包括来自中国仓鼠卵巢(cho)细胞的hcp,如磷脂酶b样2(plbl2)、vlpl(脂蛋白脂肪酶)、vlal(溶酶体酸性脂肪酶、溶酶体脂肪酶、lipa)、vpla2(磷脂酶a2)、vppt1(棕榈酰蛋白硫酯酶1)、plbd2和/或过氧化物还原酶(peroxiredoxin)。
54.术语"弱酸"是指具有最低pka》~4的酸。弱酸的实例包括但不限于乙酸、琥珀酸和2-(n-吗啉基)乙磺酸。
55.术语"强酸"是指具有最低pka《~4的酸。强酸的实例包括但不限于磷酸、乳酸、甲酸、苹果酸、丙二酸、乙醇酸、柠檬酸、酒石酸及盐酸。
56.术语"深度过滤器"是指使用多孔过滤介质的过滤元件,它在整个介质中(包括介质内和介质上)而不是仅仅在介质表面保留颗粒。深度过滤器还可能额外具有因其组成材料的化学特性而产生的吸附能力。市售的深度过滤器的实例包括但不限于x0sp、c0sp、x0hc、emphaze
tm
aex hybrid purifier、zeta plus(60zb05a)、zeta plus(90zb05a)和zeta plus(90zb08a)。术语“深度过滤”是指将可能是异质或同质的液体材料通过深度过滤器的动作。在一些实施方案中,所述液体材料包含包含目的蛋白质的蛋白质制剂。
57.当提到溶液时,术语"离子强度"指的是溶液中离子浓度的量度。离子强度(i)是所有离子种类的离子浓度ci,和净电荷zi的函数。为了确定离子强度,可以使用公式1。
[0058][0059]“蛋白质制剂”是为纯化过程或方法提供的材料或溶液,其含有目的治疗性或诊断性蛋白质,且其还可能含有各种杂质。非限制性实例可包括但不限于,例如收获的细胞培养
液(harvested cell culture fluid,hccf)、收获的细胞培养材料、澄清的细胞培养液、澄清的细胞培养材料、捕获池、回收池和/或在一个或多个离心步骤、和/或过滤步骤后的含有目的治疗性或诊断性蛋白的收集池、捕获池、回收的蛋白池和/或在一个或多个纯化步骤后的含有目的治疗性或诊断性蛋白的收集池。
[0060]
术语"杂质"是指与所需蛋白质产品不同的材料。杂质包括但不限于:宿主细胞材料,如宿主细胞蛋白质、chop;浸出的蛋白a;核酸;所需蛋白质的变体、尺寸变体、片段、聚集体或衍生物;其他蛋白质;内毒素;病毒污染物;细胞培养基成分等。
[0061]
术语"蛋白质"和"多肽"在本文中可互换使用,指任意长度的氨基酸的聚合物。该聚合物可以是线性的或支链的,它可以包括被修饰的氨基酸,也可以被非氨基酸打断。这些术语还包括已经自然或通过干预进行修饰的氨基酸聚合物;例如,形成二硫键、糖基化、脂化、乙酰化、磷酸化或任何其他操作或修饰,如与标记成分的结合。定义中还包括,例如,含有一个或多个氨基酸类似物(包括例如,非天然氨基酸等)的蛋白质,以及本领域中已知的其他修饰。蛋白质的实例包括但不限于:抗体、肽、酶、受体、激素、调控因子、抗原、结合剂、细胞因子、fc融合蛋白、免疫黏附素分子等。
[0062]
本文所用的术语"抗体"是指结合抗原的免疫球蛋白分子。抗体的实例包括单克隆抗体、多克隆抗体、人抗体、人源化抗体、嵌合抗体、双特异性或多特异性抗体、或偶联的抗体。抗体可以是任何类别(如igg、ige、igm、igd、iga),以及任何亚类(如igg1、igg2、igg3、igg4)。
[0063]
本公开的一个示例性抗体是由四条多肽链组成的免疫球蛋白g(igg)型抗体:通过链间二硫键交联的两条重链(hc)和两条轻链(lc)。四条多肽链的每一条的氨基端部分包含约100-125个或更多氨基酸的可变区,主要负责抗原识别。四条多肽链的每一条的羧基端部分都包含恒定区域,主要负责效应子功能。每条重链都包含一个重链可变区(vh)和一个重链恒定区。每条轻链都包含一个轻链可变区(vl)和一个轻链恒定区。igg同种型可进一步划分为亚类(如igg1、igg2、igg3和igg4)。
[0064]
vh和vl区域可以进一步细划为高变区,又称互补决定区域(cdrs),散布在更保守的区域(又称骨架区fr)中。cdr暴露在蛋白质的表面,是抗原抗体特异性结合的重要区域。每个vh和vl由三个cdr和四个fr组成,从氨基端到羧基端按以下顺序排列:fr1、cdr1、fr2、cdr2、fr3、cdr3、fr4。在此,重链的三个cdr又称为"hcdr1、hcdr2、hcdr3",轻链的三个cdr又称为"lcdr1、lcdr2和lcdr3"。cdr包含大部分与抗原形成特异性相互作用的残基。cdr上氨基酸残基的分配可以根据公知的方案进行,如kabat(kabat等人,“sequences of proteins of immunological interest,”national institutes of health,bethesda,md.(1991))、chothia(chothia等人,“canonical structures for the hypervariable regions of immunoglobulins”,journal of molecular biology,196,901-917(1987);al-lazikani等人,“standard conformations for the canonical structures of immunoglobulins”,journal of molecular biology,273,927-948(1997))、north(north等人,“a new clustering of antibody cdr loop conformations”,journal of molecular biology,406,228-256(2011))、或imgt(国际immunogenetics数据库,可获自www.imgt.org;参见lefranc等人,nucleic acids res.1999;27:209-212)所述。
[0065]
本公开的实施方案还包括抗体片段或抗原结合片段,如本文所用,其包含至少一
部分的抗体,所述部分抗体保持与抗原或抗原表位特异性相互作用的能力,如fab、fab'、f(ab')2、fv片段、scfv抗体片段、scfab、二硫键连接的fvs(sdfv)、fd片段。
[0066]
本文所用的术语"抗sars-cov2抗体"是指与sars-cov-2的刺突(s)蛋白结合的抗体。sars-cov-2刺突(s)蛋白的氨基酸序列已有过描述,如genbank登录号:yp_009724390.1。
[0067]
术语"超滤"或"过滤"是一种膜过滤的形式,其中静水压力迫使液体对抗半透膜。悬浮的固体和高分子量的溶质被保留下来,而水和低分子量的溶质则透过膜。在一些实例中,超滤膜的孔径在1μm到100μm之间。术语"超滤膜""超滤过滤器""过滤膜"和"过滤滤器"可以互换使用。过滤膜的实例包括但不限于聚偏氟乙烯(pvdf)膜、醋酸纤维素、硝酸纤维素、聚四氟乙烯(ptfe,teflon)、聚氯乙烯、聚醚砜、玻璃纤维或其他适合在cgmp生产环境下使用的过滤材料。
[0068]
如本文所用,数字范围包括定义范围的数字。
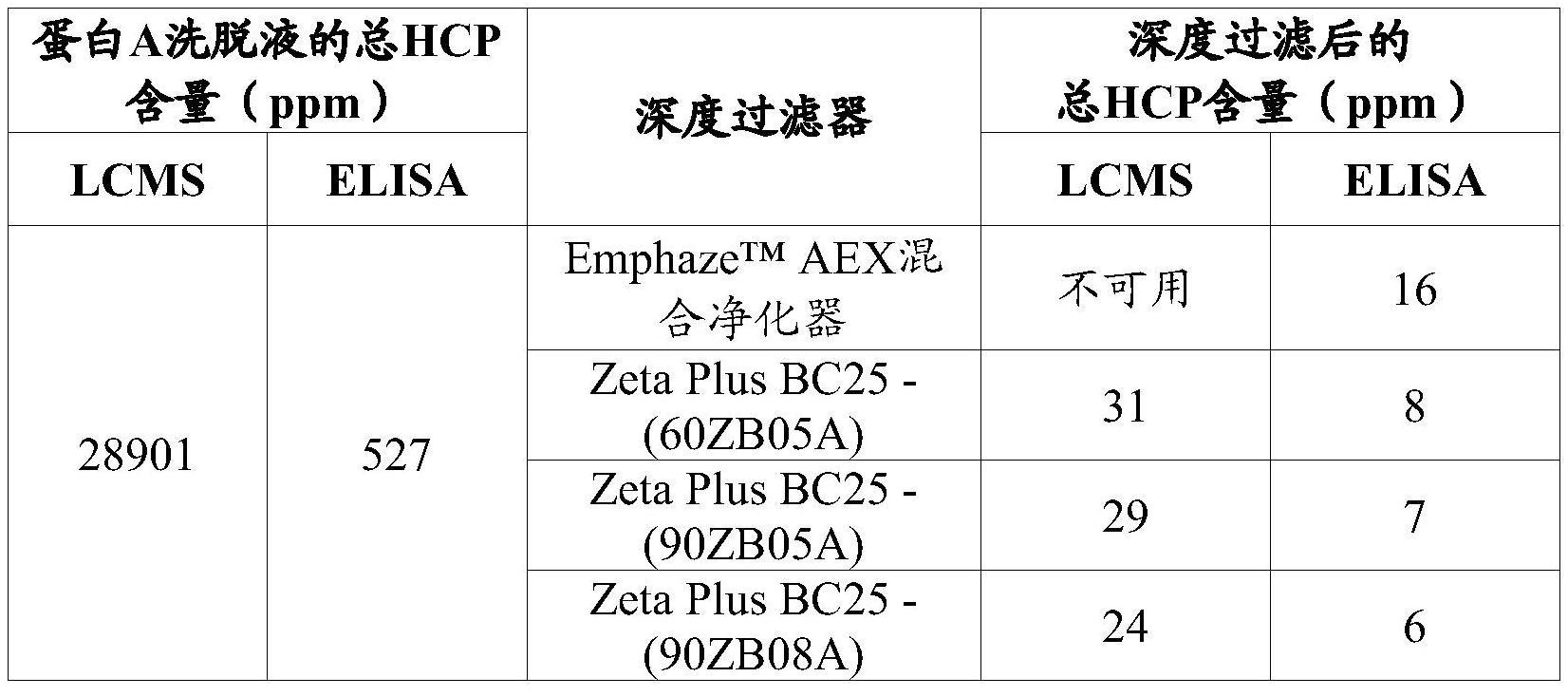
[0069]
本领域认可的术语"eu编号"是指对免疫球蛋白分子的氨基酸残基进行编号的体系。eu编号描述在,例如,kabat等,sequences of proteins of immunological interest,5th ed.public health service,national institutes of health,bethesda,md.(1991);edelman,g.m等,proc.natl.acad.usa,63,78-85(1969);以及
[0070]
http://www.imgt.org/imgtscientificchart/numbering/hu_ighgnber.html#refs。本领域认可的术语"kabat编号"是指对重链和轻链可变区中比其他氨基酸残基更易变(即超变)的氨基酸残基进行编号的体系(参见,例如kabat等,ann.ny acad.sci.190:382-93(1971);kabat等,sequences of proteins of immunological interest,fifth edition,u.s.department of health and human services,nih publication no.91-3242(1991))。术语"north编号",是指对重链和轻链可变区中比其他氨基酸残基更易变(即超变)的氨基酸残基进行编号的体系,其至少部分基于用大量晶体结构的亲和力传播聚类,如描述在north等,a new clustering of antibody cdr loop conformations,journal of molecular biology,406:228-256(2011)。
[0071]
如本文所用,术语“亲和层析”是指基于生物分子之间特异的、可逆的相互作用来分离生物化学混合物(如蛋白质和非所需的生物分子种类)的层析方法。亲和层析的示例性实例包含蛋白a亲和、蛋白g亲和、蛋白l亲和、κ亲和配体层析(如captureselect
tm
、kappaxl
tm
、kappaselect
tm
、kappaxp
tm
)或λ亲和配体层析。
[0072]
本公开的蛋白质可被纳入药物组合物中,所述药物组合物可通过本领域公知的方法制备,且其包含括本公开的蛋白质和一种或多种药学上可接受的载体和/或稀释剂(如,remington,the science and practice of pharmacy,22
nd edition,loyd v.,ed.,pharmaceutical press,2012,其提供了从业者普遍知晓的制剂技术汇编)。适用于药物组合物的载体包括与所述蛋白质结合时能保持分子的活性且不与患者的免疫系统发生反应的任何材料。
[0073]
能够指导与之以可操作的方式连接的基因的表达的表达载体在本领域是公知的。表达载体可以编码一个信号肽,以促进多肽从宿主细胞分泌。所述信号肽可以是免疫球蛋白信号肽或异源信号肽。每种表达的多肽可以根据不同的启动子独立表达,它们在一个载体中与之以可操作方式连接;或者多肽在多个载体中与不同的启动子以可操作方式链接,
实现独立表达。表达载体通常可以作为游离基因或作为宿主染色体dna的一个组成部分在宿主机体内复制。通常,表达载体会含有选择标记,如四环素、新霉素和二氢叶酸还原酶,以便检测经过所需dna序列转化的细胞。
[0074]
宿主细胞是指能用表达本公开的一种或多种蛋白质的一种或多种表达载体稳定或瞬时转染、转化、转导或感染的细胞。创建和分离产生本公开的蛋白质的宿主细胞系可以使用本领域已知的标准技术来完成。哺乳动物细胞是表达本公开的蛋白质的优选宿主细胞。具体的哺乳动物细胞包括hek 293、ns0、dg-44和cho。优选地,蛋白质被分泌到培养宿主细胞的培养基中,可以通过例如使用常规技术从其中回收或纯化蛋白质。例如,可以使培养基经过蛋白a亲和层析柱和/或κ亲和配体或λ亲和配体层析柱,并从其中洗脱出来。非所需的生物分子种类,包括可溶性聚合体和多聚体,可以通过常规技术有效去除,包括尺寸排阻、疏水作用、离子交换或羟基磷灰石层析法。产品可以立即冷冻,例如在-℃冷冻或冻干。可以采用多种蛋白质纯化方法,且此类方法在本领域是已知且被描述,例如,在deutscher,methods in enzymology182:83-89(1990)和scopes,protein purification:principles and practice,第3版,springer,ny(1994)中。
实施例
[0075]
通过lcms测量宿主细胞蛋白(hcp):为了评估下文实施例中纯化对宿主细胞蛋白质(hcp)水平的影响,经由例如耦合到thermo scientific质谱分析仪的超高效液相色谱(uplc),通过肽谱分析(peptide mapping)/lc-ms/ms hcp剖析(profiling)来分析样品。在此分析中,样品经过胰蛋白酶消化,用二硫苏糖醇(dtt)还原/沉淀,然后将上清液酸化并转移至hplc小瓶中,以进行lc-ms/ms分析。lc-ms/ms数据由proteome discoverer针对cho-k1蛋白数据库进行分析,其中加入了抗体、刺突蛋白和对照蛋白质序列。hcp的含量,以每个样品中hcp的总百万分率(parts per million,ppm)来报告,用于总hcp含量(例如,例如ng hcp/mg产物)。此外,还提供磷脂酶b-样2(plbl2)的含量。
[0076]
通过elisa法测量hcp:在下文实施例中,还在使用cho-hcp kit 1(cygnus technologies,按制造商说明进行)的elisa测定法之后评估样品中的hcp含量。hcp的含量,以每个样品中hcp的总百万分率(ppm)来报告,用于总hcp含量。
[0077]
实施例1
‑‑
mab1(埃特司韦单抗)纯化过程中的hcp的降低蛋白质捕获步骤:将经过消毒的蛋白a柱(mabselect sure蛋白a介质)进行平衡,将mab1(etesevimab)无细胞生物反应器收获物上样到蛋白a层析柱,使用20mm tris(ph7.0)作为最后一次清洗来对蛋白a柱进行三次清洗。使用5个柱体积(cv)的20mm乙酸+5mm磷酸将mab1从柱上洗脱。通过在前方(frontside)及后方(backside)使用基于吸光度的峰切分,将主要产物级分收集到一个单一主体级分。
[0078]
低ph值病毒灭活步骤及中和步骤:通过加入20mm盐酸而将收集到的含有mab1的主要产物级分(蛋白质捕获洗脱液主体级分)的ph值调整到3.30至3.60之间,从而进行病毒灭活。混合物在18℃至25℃下孵育约180分钟。然后用250mm tris碱的ph值未调整的缓冲液将混合物中和至ph值约为7.0。
[0079]
深度过滤步骤。用注射用水(wfi)冲洗深度过滤器(x0sp,millipore)。从低ph值病毒灭活步骤及中和步骤中获得的mab1混合物,以1200克/米2(mab克数/深度过滤膜面积平
方米)的负载量应用于深度过滤器。用wfi冲洗加载的深度过滤器。深度过滤器的滤液,任选地包含加载后的wfi冲洗液在内,用250mm tris碱的ph值未调整的缓冲液中和至ph值为8.0。
[0080]
阴离子交换(aex)层析步骤;用2个cv的20mm tris(ph 8.0)平衡消毒过的层析柱(q sepharose fast flow anion exchange chromatography media,或qff)。从深度过滤步骤中获得的mab1溶液以每升树脂25克至100克的装载量上样到柱子,并用平衡缓冲液进行一次额外的洗涤。通过在由未结合级分加额外洗涤形成的峰的前方及后方进行基于吸光度的峰切分来收集mab1。
[0081]
结果:使用所述的纯化过程,通过lc-ms测量的总hcp水平是:
[0082]
·
蛋白a洗脱后为23299ppm;
[0083]
·
在x0sp深度过滤后为13ppm;
[0084]
·
在aex层析后为2ppm。
[0085]
mab1的深度过滤器组1评估:基本如上所述,mab1通过蛋白a、低ph值病毒灭活、中和、深度过滤等步骤处理。四种不同的深度过滤器:emphaze
tm
aex hybrid purifier、zeta plus bc25
ꢀ‑
60zb05a、zeta plus bc25-90zb05a和zeta plus bc25-90zb08a(3m)在2000克/米2的负载下进行测试,如表1所示。表1结果显示,与蛋白a洗脱液通过lcms(28901ppm)及elisa(527ppm)检测的总hcp含量相比,经4种过滤器深度过滤后,通过lcms(24至31ppm)和elisa(6至16ppm)检测的总hcp含量显著降低。
[0086]
表1.深度过滤前后mab1的总hcp含量
[0087][0088]
实施例2
‑‑
mab2(bamlanivimab)纯化过程中的hcp的降低蛋白a洗脱缓冲液比较:mab2(bamlanivimab)的制备基本与上述实施例1中的mab1相同,但有以下例外:1)使用表2所列的缓冲液组合从蛋白a捕获柱中洗脱mab2,2)在低ph值病毒灭活步骤后和深度过滤步骤前,使用250mm tris碱的ph值未调整的缓冲液将mab2溶液中和至7.25而不是7.0,以及3)使用poros xq树脂进行aex层析。经过如表2和表3所列的纯化单元操作后,经由lcms评估hcp含量(总hcp含量和plbl2含量两者)。
[0089]
表2和表3的结果显示,对于测试的3种酸组合,总hcp和plbl2含量在深度过滤步骤后都有降低。具体来说,与20mm乙酸+5mm柠檬酸的组合相比,20mm乙酸+5mm磷酸与20mm乙酸+5mm l-乳酸的组合在深度过滤后,总hcp含量大幅下降至小于20ppm。此外,经深度过滤步骤后,20mm乙酸+5mm磷酸和20mm乙酸+5mm l-乳酸组合的plbl2含量降低到定量限制以下。
[0090]
表2.使用不同蛋白a洗脱缓冲液的mab2总hcp含量
[0091][0092]
表3.使用不同蛋白a洗脱缓冲液的mab2 plbl2含量
[0093][0094][0095]
深度过滤组2的评估:mab2的制备基本与上述的mab1相同,但有以下例外:
[0096]
1)在低ph值病毒灭活步骤之后和深度过滤步骤之前,用250mm tris碱的ph值未调整的缓冲液将mab2溶液中和到7.25而不是7.0,以及2)深度过滤步骤用表4所示的深度过滤器进行。
[0097]
表4中的结果显示,在用所有负载1500g/m2的3种组2的深度过滤器(x0sp、c0sp、x0hc、(millipore))进行深度过滤后,总hcp和plbl2含量降低至低于20ppm。
[0098][0099]
实施例3
‑‑
在mab3(bebtelovimab)纯化过程中hcp含量的降低
[0100]
使用蛋白质捕获、低ph值病毒灭活、中和以及深度过滤等步骤制备mab3(bebtelovimab),基本上与实施例1中对mab1的描述相同,除了使用了x0sp深度过滤器,负载为900g/m2。使用所述的纯化过程,通过lcms测量的总hcp水平:
[0101]
·
蛋白a洗脱后为179964ppm。
[0102]
·
经x0sp(millipore)深度过滤后为77ppm。
[0103]
实施例4
‑‑
双特异性抗体(mab4)纯化过程中hcp含量的降低使用与实施例1中对mab1描述的基本相同的蛋白质捕获步骤制备双特异性抗体mab4,除了使用蛋白l亲和捕获柱(cytiva),和用表5所示的缓冲液系统洗脱。总的hcp含量是通过elisa测定的,其范围约为1300至约2500ppm。蛋白质捕获后,除了使用表5中列出的滴定剂外,低ph值病毒灭活基本上按照实施例1中对mab1的描述进行,然后使用500mm tris碱的ph值未调整的缓冲液中和至ph7.0。深度过滤步骤基本按照实施例1中mab1的描述进行,使用x0sp深度过滤器,负载量为1200g/m2.,深度过滤后通过elisa测量hcp含量。
[0104]
表5中的结果显示,深度过滤后条目1至7的总hcp含量明显降低至少于50ppm,其中应用于深度过滤器的混合物的离子强度低于约45mm。此外,观察到应用于深度过滤器的混合物的离子强度与深度过滤后的总hcp含量之间存在关联。此外,条目2显示尽管可以通过稀释缓冲液来降低离子强度,在深度过滤后提供低hcp含量,然而稀释带来的体积增加对制造工艺是不利的。
[0105]
表5.蛋白l层析洗脱和深度过滤后mab4制剂中的hcp水平
[0106][0107]
*在低ph值病毒灭活后,用500mm tris中和至ph7.0,用2份水稀释mab4溶液(mab4溶液:h
2 o的比例为1:2)
[0108]
实施例5
‑‑
mab5纯化过程中hcp含量的降低
[0109]
使用与实施例1中对mab1描述的基本相同的蛋白质捕获步骤制备mab5,除了洗脱步骤是用表6所示的缓冲液系统进行。总的hcp含量是通过elisa测定的,其范围约为2800至3200ppm。蛋白质捕获后,低ph值的病毒灭活步骤基本上按照实施例1中对mab1的描述进行,然后使用500mm tris碱的ph值未调整的缓冲液在ph5.0或ph7.0下进行中和步骤。深度过滤步骤基本按照实施例1中对mab1的描述进行,使用x0sp深度过滤器,负载为1000g/m2。深度
过滤步骤后的hcp含量通过elisa测量。
[0110]
表6的结果显示,当应用于深度过滤器的混合物的ph值为7.0时,在深度过滤后mab5的总hcp含量明显降低至≤50ppm。当应用于深度过滤器的混合物的ph值为5.0时,总hcp含量降低至较低程度。
[0111]
表6.蛋白a洗脱和深度过滤后mab5制剂中的hcp水平
[0112][0113]
实施例6—用于生物大分子纯化过程中离子强度的方法
[0114]
本文描述了一种基于生物大分子纯化单元过程中已知的缓冲液成分来估算离子强度的方法。溶液的离子强度(i)是该溶液中离子浓度的一种度量,是所有离子种类的种类浓度ci,和净电荷zi的函数。为了确定离子强度,使用公式1。
[0115][0116]
强电解质:对于低浓度下的强电解质(例如50mm以下),假设完全解离。在完全解离的情况下,成分很容易计算,使离子强度的计算变得简单明了。例如,50mm的nacl溶液解离出50mm的na
+
和cl-,离子强度为0.5
×
[50mm
×12
+50mm
×
(-1)2]=50mm。再比如,50mm的na
2 so4,解离出100mm的na
+
和50mm的so
42-,产生离子强度为0.5
×
[100mm
×12
+50mm
×
(-2)2]=150mm。由于没有缓冲的种类,在这些计算中预计会出现接近中性的ph值,因此水解离产生的离子浓度对离子强度没有有意义的贡献。水的解离常数看作为kw=[h
+
][oh-]=10-14
,并且[h
+
]=10-ph
,其中方括号内表示浓度。为了本文的计算,没有必要对h
+
离子进行物理解释(例如相对于水合氢离子),同样,也没有必要区分h
+
浓度和活度。
[0117]
缓冲体系:对于缓冲体系不能假设完全解离。缓冲剂酸和碱形式的比例需要通过缓冲剂的酸解离常数来确定。对于一般的酸,ha,解离成h
+
和a-。公式2与酸的解离常数ka及离子浓度有关。
[0118][0119]
酸解离常数通常以pka=-log
10
(ka)的对数形式使用。热力学pka,表示为pk
a,0
,在许多目的缓冲剂的相关文献中都有记载。然而,缓冲剂的有效pka与热力学值有偏差,除非是在非常稀的溶液中由于活度系数偏离同一(deviation from unity)。对于本公开中考虑的中等稀释溶液,使用扩展的debye方程或davies方程来计算非同一(non-unity)活度系数。文献中发现的一些常数的值可能略有不同,但在本公开中的目的离子强度值范围内给出了类似的结果。扩展的debye h
ü
ckel方程如公式3提供:
[0120][0121]
davies方程如公式4提供:
[0122][0123]
其中n=2z-1,且z是用于计算n的酸性缓冲形式的净电荷(scopes,protein purification:principles and practices,2013)
[0124]
因为pka是离子强度的函数,因此组成和离子强度不能独立地确定,而是一个方程系统的一部分。方程系统包括前述的离子强度方程、每种缓冲液的酸解离常数和每种缓冲液的pka方程,还包括每个缓冲液的电中性条件和总的种类平衡。用这个方程系统,可以估算出几个数值。例如,已知的溶液ph值可以用来估算缓冲液配方的酸碱比例,或者反过来,酸碱比例可以用来估计溶液的ph值和相应的滴定体积。在任意这些应用中,离子强度都可以被估算,以帮助指导合理选择洗脱剂和滴定剂。
[0125]
为了计算与本公开的缓冲系统有关的离子强度,例如用于深度过滤的进料(feed material),需要该溶液的缓冲液组成。该组成可以基于工艺中使用的缓冲液和滴定剂的体积和成分进行合理的估计。本领域已知的离子测量技术也可用于估算该组成。
[0126]
作为估计溶液组成的起点,一种可能的方法学是假设亲和柱洗脱池具有与洗脱液相同的缓冲液组成,不同之处是在洗脱池所测量ph值下进行缓冲。例如,如果目的蛋白质是用20mm乙酸和5mm乳酸从蛋白a柱中洗脱出来的,且洗脱池所测量的ph值为4.2,则可以作出假设,洗脱池的缓冲液组成为20mm乙酸盐、5mm乳酸盐和足量的naoh,以使ph值达到4.2;这相当于约8.2mm naoh。因为只有总的钠阳离子na
+
含量在计算中重要,所以无论假设洗脱液中的钠是来自醋酸钠、磷酸钠、氢氧化钠还是它们的任何组合,都不产生影响,所以为了方便起见,使用将钠归于naoh的惯例。
[0127]
在使用洗脱液组成和洗脱液ph值来估计洗脱液的缓冲液组成后,再考虑溶液的滴定。例如,估计的洗脱液的组成为20mm乙酸盐,5mm乳酸盐,~8.2mm naoh,ph值为4.2,如果将ph值降低到病毒减活的目标值3.45所需的20mm hcl的体积等于起始体积的0.305倍,那么ph值为3.45的该过程中间物的成分将从稀释中得知。乙酸盐、乳酸盐和naoh将以其各自初始值的1/1.305倍存在(即
[0128]
~15.3mm乙酸盐、~3.8mm乳酸盐和~6.2mm naoh),hcl以其在滴定剂中的值的0.305/1.305存在(~4.7mm hcl)。类似地,对于用250mm tris碱中和,如果将ph值提高到目标值7.0的比例是ph 3.45溶液体积的0.0743倍,将应用1/1.0743和0.0743/1.0743的比率来找到中和溶液中的最终浓度(~14.3mm乙酸,~3.6mm乳酸,~5.8mm naoh,~4.4mm hcl,以及~17.3mm tris)。所有的已知值被插入方程系统(公式5至15)以计算离子强度。
[0129][0130]
[h
+
]+[na
+
]+[trish
+
]=[oh-]+[acetate-]+[acetate-]+[cl-]
ꢀꢀꢀꢀꢀꢀ
(6)
[0131][0132][0133]
[0134][0135][0136][0137]
total tris=[tris]+[trish
+
]
ꢀꢀꢀꢀꢀꢀꢀ
(13)
[0138]
total acetate=[hacetate]+[acetate-]
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
(14)
[0139]
total lactate=[hlactate]+[lactate-]
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
(15)
[0140]
其中认为tris、乙酸盐和乳酸盐的各自pk
a,o
值在22℃时看作是8.15、4.76和3.86。由此估算深度过滤进料的离子强度为22.1mm。
[0141]
如本发明所述,蛋白质产品的缓冲能力不是直接模型化的。因此,当使用强酸或强碱进行滴定时,计算结果和经验滴定结果之间会出现一些偏差。例如,当将蛋白a层析洗脱液滴定到低ph值用于病毒灭活时,缓冲液的计算结果通常对所需的20mm盐酸的经验量估计不足;所需的经验量可能比计算的估计结果多出50%。解释这种差异的一种方式是在较高的ph值下建立亲和柱洗脱材料的模型,凭经验调整该值,直到估计的滴定量与实验值相符。例如,在上述实例中,如果20mm盐酸的量比最初估算的0.305比例高50%,那么蛋白a洗脱液将被模型化为大约为ph 4.45而不是ph4.2。对模型进行该经验性调整后,本例中估算的离子强度会有定向降低,但仅为少量的降低:从最初估计的22.1mm下降到21.9mm。因此,可以得出结论,任何一种方法都足以估计离子强度,以推导出本公开的优选实施例。
[0142]
替代方法:离子含量测量方法可用于确定深度过滤进料的缓冲液组成,以计算离子强度。这需要确认测量方法给出的结果与任何已知量(如加入的滴定剂的量)自相一致。由于假定亲和柱洗脱液的缓冲液组成等效于ph值不同的洗脱液的缓冲液组成,因此真实组成的差异可以通过离子含量测量来确定。例如,基于一个洗脱液组成的量或一个测量值,均可以用于计算洗脱液中缓冲剂成分的离子强度。
[0143]
序列
[0144]
以下核酸和/或氨基酸序列在本公开资料中有提及,并提供在下方供参考。
[0145]
seq id no:1-巴姆拉尼单抗重链可变区(vh)
[0146]
qvqlvqsgaevkkpgssvkvsckasggtfsnyaiswvrqapgqglewmgriipilgianyaqkfqgrvtitadkststaymelsslrsedtavyycargyyearhyyyyyamdvwgqgtavtvss
[0147]
seq id no:2-巴姆拉尼单抗轻链可变区(vl)
[0148]
diqmtqspsslsasvgdrvtitcrasqsissylswyqqkpgkapklliyaasslqsgvpsrfsgsgsgtdftltitslqpedfatyycqqsystprtfgqgtkveik
[0149]
seq id no:3-巴姆拉尼单抗重链(hc)
[0150]
qvqlvqsgaevkkpgssvkvsckasggtfsnyaiswvrqapgqglewmgriipilgianyaqkfqgrvtitadkststaymelsslrsedtavyycargyyearhyyyyyamdvwgqgtavtvssastkgpsvfplapsskstsggtaalgclvkdyfpepvtvswnsgaltsgvhtfpavlqssglyslssvvtvpssslgtqtyicnvnhkpsntkvdkrvepkscdkthtcppcpapellggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqvytlppsreemtknqvsltclv
kgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspgk
[0151]
seq id no:4-巴姆拉尼单抗轻链(lc)
[0152]
diqmtqspsslsasvgdrvtitcrasqsissylswyqqkpgkapklliyaasslqsgvpsrfsgsgsgtdftltitslqpedfatyycqqsystprtfgqgtkveikrtvaapsvfifppsdeqlksgtasvvcllnnfypreakvqwkvdnalqsgnsqesvteqdskdstyslsstltlskadyekhkvyacevthqglsspvtksfnrgec
[0153]
seq id no:5-埃特司韦单抗重链可变区(vh)
[0154]
evqlvesggglvqpggslrlscaasgftvssnymswvrqapgkglewvsviysggstfyadsvkgrftisrdnsmntlflqmnslraedtavyycarvlpmygdyldywgqgtlvtvss
[0155]
seq id no:6-埃特司韦单抗轻链可变区(vl)
[0156]
divmtqspsslsasvgdrvtitcrasqsisrylnwyqqkpgkapklliyaasslqsgvpsrfsgsgsgtdftltisslqpedfatyycqqsystppeytfgqgtkleikrtv
[0157]
seq id no:7-埃特司韦单抗重链(hc)
[0158]
evqlvesggglvqpggslrlscaasgftvssnymswvrqapgkglewvsviysggstfyadsvkgrftisrdnsmntlflqmnslraedtavyycarvlpmygdyldywgqgtlvtvssastkgpsvfplapsskstsggtaalgclvkdyfpepvtvswnsgaltsgvhtfpavlqssglyslssvvtvpssslgtqtyicnvnhkpsntkvdkrvepkscdkthtcppcpapeaaggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqvytlppsreemtknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspgk
[0159]
seq id no:8-埃特司韦单抗轻链(lc)
[0160]
divmtqspsslsasvgdrvtitcrasqsisrylnwyqqkpgkapklliyaasslqsgvpsrfsgsgsgtdftltisslqpedfatyycqqsystppeytfgqgtkleikrtvaapsvfifppsdeqlksgtasvvcllnnfypreakvqwkvdnalqsgnsqesvteqdskdstyslsstltlskadyekhkvyacevthqglsspvtksfnrgec
[0161]
seq id no:9-贝特洛韦单抗重链可变区(vh)
[0162]
qitlkesgptlvkptqtltltctfsgfslsisgvgvgwlrqppgkalewlaliywdddkryspslksrltiskdtsknqvvlkmtnidpvdtatyycahhsistifdhwgqgtlvtvss
[0163]
seq id no:10-贝特洛韦单抗轻链可变区(vl)
[0164]
qsaltqpasvsgspgqsitisctatssdvgdynyvswyqqhpgkapklmifevsdrpsgisnrfsgsksgntasltisglqaedeadyycssyttssavfgggtkltvl
[0165]
seq id no:11-贝特洛韦单抗重链(hc)
[0166]
qitlkesgptlvkptqtltltctfsgfslsisgvgvgwlrqppgkalewlaliywdddkryspslksrltiskdtsknqvvlkmtnidpvdtatyycahhsistifdhwgqgtlvtvssastkgpsvfplapsskstsggtaalgclvkdyfpepvtvswnsgaltsgvhtfpavlqssglyslssvvtvpssslgtqtyicnvnhkpsntkvdkrvepkscdkthtcppcpapellggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqvytlppsreemtknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspgk
[0167]
seq id no:12-贝特洛韦单抗轻链(lc)
[0168]
qsaltqpasvsgspgqsitisctatssdvgdynyvswyqqhpgkapklmifevsdrpsgisnrfsgsksgntasltisglqaedeadyycssyttssavfgggtkltvlgqpkaapsvtlfppsseelqankatlvclisdfypga
vtvawkadsspvkagvetttpskqsnnkyaassylsltpeqwkshrsyscqvthegstvektvaptecs
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1