T细胞制造组合物和方法与流程
背景技术:
1、肿瘤疫苗通常由肿瘤抗原和免疫刺激分子(例如佐剂、细胞因子或tlr配体)组成,它们共同作用以诱导识别和裂解肿瘤细胞的抗原特异性细胞毒性t细胞(ctl)。此类疫苗含有共享的组织限制性肿瘤抗原,或以全肿瘤细胞制剂的形式含有共享抗原和患者特异性抗原的混合物。共享的组织限制性肿瘤抗原是理想的免疫原性蛋白,在许多个体的肿瘤中选择性表达,通常作为合成多肽或重组蛋白递送给患者。相比之下,全肿瘤细胞制剂是作为自体辐照细胞、细胞裂解物、细胞融合物、热休克蛋白制剂或总mrna递送给患者。由于全肿瘤细胞是从自体患者身上分离出来的,因此这些细胞可包括患者特异性肿瘤抗原以及共享的肿瘤抗原。最后,还有第三类肿瘤抗原,即新抗原(可能是患者特异性的,也可能是共享的),这类抗原很少用于疫苗,其由具有导致氨基酸序列改变的肿瘤特异性突变的蛋白质组成。此类突变的蛋白质:(a)由于突变及其相应的蛋白质只存在于肿瘤中,因此对肿瘤细胞来说是独一无二的;(b)避免中枢性耐受,并因此更有可能具有免疫原性;(c)为包括体液免疫和细胞免疫在内的免疫识别提供了优良的靶点。
2、过继性免疫疗法或过继性细胞疗法(act)是将淋巴细胞转移到对象以治疗疾病。过继性免疫疗法尚未实现其治疗包括癌症、传染病、自身免疫性疾病、炎症性疾病和免疫缺陷在内的各种疾病的潜力。然而,大多数(即使不是全部)过继性免疫疗法策略都需要t细胞激活和扩增步骤,以产生临床上有效的治疗剂量的t细胞。由于活细胞培养固有的复杂性和患者间的差异性,因此目前用于产生治疗剂量的t细胞(包括工程改造的t细胞)的技术仍然受限于繁琐的t细胞制造工艺。现有的t细胞制造工艺不易扩展、不具重复性、不可靠且效率低,而且往往产生劣质的t细胞产品,该产品容易耗竭和丧失细胞的免疫效应功能。迄今为止,工程改造的t细胞过继性免疫疗法只取得了有限的成果,并且经常表现出不同的临床活性。因此,此类疗法不适合在临床上广泛使用。因此,仍然需要开发用于扩增和诱导具有良好表型和功能的抗原特异性t细胞的组合物和方法。
3、迄今为止,成功的细胞疗法的施用依赖于大量的抗原特异性t细胞。不幸的是,不是所有的表位在离体刺激后都能产生大量的抗原特异性细胞。因此,抗原特异性t细胞的富集和后续扩增可能是获得有效产物所必需的。
技术实现思路
1、本文提供了一种用于生产治疗性t细胞群体的方法,其包括:(a)在包括抗原呈递细胞(apc)的第一细胞培养基中培养来自对象的生物样品的t细胞以生产第一t细胞群体,其中所述apc呈递与mhc蛋白质复合的肽抗原的表位;(b)任选地,在第二细胞培养基中培养所述第一t细胞群体以生产第二t细胞群体;(c)从所述第一t细胞群体或所述第二t细胞群体中富集表达cd137(4-1bb)的t细胞和/或表达cd69的t细胞以生产第三t细胞群体;以及(d)在第三细胞培养基中扩增所述第三t细胞群体以获得包括抗原特异性t细胞的治疗性t细胞群体。
2、在一些实施方案中,所述方法包括:在第二细胞培养基中培养所述第一t细胞群体以生产所述第二t细胞群体,以及从所述第二t细胞群体中富集表达cd137(4-1bb)的t细胞和/或表达cd69的t细胞以生产所述第三t细胞群体。
3、本文提供了一种用于生产治疗性t细胞群体的方法,其包括:(a)在包括抗原呈递细胞(apc)的第一细胞培养基中培养来自对象的生物样品的t细胞,其中所述apc呈递与mhc蛋白质复合的肽抗原的表位;(b)在第二细胞培养基中培养第一t细胞群体以生产第二t细胞群体;(c)任选地,从所述第二t细胞群体中富集表达cd137(4-1bb)的t细胞和/或表达cd69的t细胞以生产第三t细胞群体;以及(d)在第三细胞培养基中扩增所述第二t细胞群体或所述第三t细胞群体以获得包括抗原特异性t细胞的治疗性t细胞群体;其中所述第三培养基中的所述肽抗原的浓度是所述第一培养基和/或所述第二培养基中的所述肽抗原的浓度的至多1/2。
4、在一些实施方案中,所述方法包括:从所述第二t细胞群体中富集表达cd137(4-1bb)的t细胞和/或表达cd69的t细胞以生产第三t细胞群体。
5、在一些实施方案中,在开始所述在第一细胞培养基中培养来自对象的生物样品的t细胞后10、11、12、13、14、15、16、17或18天,开始从所述第二t细胞群体中富集表达cd137(4-1bb)的t细胞和/或表达cd69的t细胞。
6、在一些实施方案中,所述apc(i)包括编码所述肽抗原的多核苷酸序列,或(ii)负载所述肽抗原表位。
7、在一些实施方案中,将所述肽抗原直接添加到所述第一细胞培养基。
8、在一些实施方案中,所述第一细胞培养基包括第一肽抗原浓度。
9、在一些实施方案中,所述方法进一步包括:向所述第一细胞培养基补充一定量的所述肽抗原,使得所述第一细胞培养基包括第一肽抗原浓度。
10、在一些实施方案中,所述肽抗原的所述第一浓度是1nm至100μm或100nm至10μm。
11、在一些实施方案中,所述肽抗原的所述第一浓度是约1μm、2μm、3μm、4μm或5μm。
12、在一些实施方案中,所述第二细胞培养基包括第二浓度的所述肽抗原。
13、在一些实施方案中,所述方法进一步包括:向所述第二细胞培养基补充一定量的所述肽抗原,使得所述第二细胞培养基包括第二浓度的所述肽抗原。
14、在一些实施方案中,所述肽抗原的所述第二浓度高于、低于或约等于所述肽抗原的所述第一浓度。
15、在一些实施方案中,所述肽抗原的所述第二浓度是1nm至100μm或100nm至10μm。
16、在一些实施方案中,所述肽抗原的所述第二浓度是约1μm、2μm、3μm、4μm或5μm。
17、在一些实施方案中,在开始所述在第一细胞培养基中培养来自对象的生物样品的t细胞后9、10、11、12、13、14、15、16或17天,开始在所述第二细胞培养基中培养所述第一t细胞群体。
18、在一些实施方案中,所述第三细胞培养基包括第三浓度的所述肽抗原。
19、在一些实施方案中,所述方法进一步包括:向所述第三细胞培养基补充一定量的所述肽抗原,使得所述第三细胞培养基包括第三浓度的所述肽抗原。
20、在一些实施方案中,所述肽抗原的所述第三浓度是所述肽抗原的所述第一浓度的至多1/2。
21、在一些实施方案中,所述肽抗原的所述第三浓度是所述肽抗原的所述第二浓度的至多1/2。
22、在一些实施方案中,所述肽抗原的所述第三浓度是所述肽抗原的所述第一浓度的至多1/3、1/4、1/5、1/6、1/7、1/8、1/9或1/10。
23、在一些实施方案中,所述肽抗原的所述第三浓度是所述肽抗原的所述第二浓度的至多1/3、1/4、1/5、1/6、1/7、1/8、1/9或1/10。
24、在一些实施方案中,所述肽抗原的所述第三浓度是0.1nm至10μm。
25、在一些实施方案中,所述肽抗原的所述第三浓度是约0.1nm、0.5,nm、1nm、10nm、25nm、50nm、100nm、150nm、200nm、300nm、400nm、500nm、1μm或10μm。
26、在一些实施方案中,在开始所述在第一细胞培养基中培养来自对象的生物样品的t细胞后11、12、13、14、15、16、17、18或19天,开始在所述第三细胞培养基中扩增所述第二t细胞群体或所述第三t细胞群体。
27、在一些实施方案中,在从所述第二t细胞群体中富集表达cd137(4-1bb)的t细胞和/或表达cd69的t细胞后1、2、3 4或5天,开始在所述第三细胞培养基中扩增所述第二t细胞群体或所述第三t细胞群体。
28、在一些实施方案中,在第三细胞培养基中扩增所述第二t细胞群体或所述第三t细胞群体包括在所述肽抗原的浓度增加的情况下扩增所述第二t细胞群体或所述第三t细胞群体。
29、在一些实施方案中,在所述肽抗原的浓度增加的情况下扩增所述第二t细胞群体或所述第三t细胞群体包括在第四细胞培养基中扩增所述第二t细胞群体或所述第三t细胞群体,所述第四细胞培养基包括第四浓度的所述肽抗原。
30、在一些实施方案中,在所述肽抗原的浓度增加的情况下扩增所述第二t细胞群体或所述第三t细胞群体包括向所述第三细胞培养基补充一定量的所述肽抗原,使得所述第三细胞培养基包括第四浓度的所述肽抗原,其中所述肽抗原的所述第四浓度是所述肽抗原的所述第三浓度的至少1.1倍。
31、在一些实施方案中,所述肽抗原的所述第四浓度是所述肽抗原的所述第三浓度的至少2、3、4、5、6、7、8、9或10倍。
32、在一些实施方案中,所述肽抗原的所述第四浓度是1nm至50μm。
33、在一些实施方案中,所述肽抗原的所述第四浓度是约1nm、10nm、25nm、50nm、100nm、150nm、200nm、300nm、400nm、500nm、600nm、700nm、800nm、900nm、1μm、10μm、25μm或50μm。
34、在一些实施方案中,在开始所述在第一细胞培养基中培养来自对象的生物样品的t细胞后12、13、14、15、16、17、18、19或20天,开始在包括第四浓度的所述肽抗原的第四细胞培养基中扩增所述第二t细胞群体或所述第三t细胞群体,或者向所述第三细胞培养基补充一定量的所述肽抗原,使得所述第三细胞培养基包括第四浓度的所述肽抗原。
35、在一些实施方案中,在开始在包括第三浓度的所述肽抗原的第三细胞培养基中扩增所述第二t细胞群体或所述第三t细胞群体后1、2、3、4或5天,或者在向所述第三细胞培养基补充一定量的所述肽抗原以使得所述第三细胞培养基包括第三浓度的所述肽抗原后1、2、3、4或5天,开始在包括第四浓度的所述肽抗原的第四细胞培养基中扩增所述第二t细胞群体或所述第三t细胞群体,或者向所述第三细胞培养基补充一定量的所述肽抗原,使得所述第三细胞培养基包括第四浓度的所述肽抗原。
36、在一些实施方案中,在所述肽抗原的浓度增加的情况下扩增所述第二t细胞群体或所述第三t细胞群体包括在第五细胞培养基中扩增所述第二t细胞群体或所述第三t细胞群体,所述第五细胞培养基包括第五浓度的所述肽抗原。
37、在一些实施方案中,在所述肽抗原的浓度增加的情况下扩增所述第二t细胞群体或所述第三t细胞群体包括向所述第四细胞培养基补充一定量的所述肽抗原,使得所述第四细胞培养基包括第五浓度的所述肽抗原,其中所述肽抗原的所述第五浓度是所述肽抗原的所述第四浓度的至少1.1倍。
38、在一些实施方案中,所述肽抗原的所述第五浓度是所述肽抗原的所述第三浓度和/或所述肽抗原的所述第四浓度的至少2、3、4、5、6、7、8、9或10倍。
39、在一些实施方案中,所述肽抗原的所述第五浓度是10nm至100μm。
40、在一些实施方案中,所述肽抗原的所述第五浓度是约10nm、25nm、50nm、100nm、150nm、200nm、300nm、400nm、500nm、600nm、700nm、800nm、900nm、1μm、10μm、25μm、50μm、75μm或100μm。
41、在一些实施方案中,在开始所述在第一细胞培养基中培养来自对象的生物样品的t细胞后13、14、15、16、17、18、19、20或21天,开始在包括第五浓度的所述肽抗原的第五细胞培养基中扩增所述第二t细胞群体或所述第三t细胞群体或者向所述第四细胞培养基补充一定量的所述肽抗原,使得所述第四细胞培养基包括第五浓度的所述肽抗原。
42、在一些实施方案中,在包括第四浓度的所述肽抗原的第四细胞培养基中扩增所述第二t细胞群体或所述第三t细胞群体后1、2、3、4或5天,或者在向所述第四细胞培养基补充一定量的所述肽抗原以使得所述第四细胞培养基包括第四浓度的所述肽抗原后1、2、3 4或5天,开始在包括第五浓度的所述肽抗原的第五细胞培养基中扩增所述第二t细胞群体或所述第三t细胞群体或者向所述第四细胞培养基补充一定量的所述肽抗原,使得所述第四细胞培养基包括第五浓度的所述肽抗原。
43、在一些实施方案中,在包括第三浓度的所述肽抗原的第三细胞培养基中扩增所述第二t细胞群体或所述第三t细胞群体后2、3、4、5或6天,或者在向所述第三细胞培养基补充一定量的所述肽抗原以使得所述第三细胞培养基包括第三浓度的所述肽抗原后2、3、4、5或6天,开始在包括第五浓度的所述肽抗原的第五细胞培养基中扩增所述第二t细胞群体或所述第三t细胞群体或者向所述第四细胞培养基补充一定量的所述肽抗原,使得所述第四细胞培养基包括第五浓度的所述肽抗原。
44、在一些实施方案中,所述第二t细胞群体或所述第三t细胞群体中抗原特异性t细胞的数目大于所述第一t细胞群体中抗原特异性t细胞的数目。
45、在一些实施方案中,所述第二t细胞群体或所述第三t细胞群体中抗原特异性t细胞的频率大于所述第一t细胞群体中抗原特异性t细胞的频率,其中t细胞群体中抗原特异性t细胞的频率是[所述群体中抗原特异性t细胞的数目]/[所述群体中t细胞的总数目]x100。
46、在一些实施方案中,所述治疗性t细胞群体中抗原特异性t细胞的频率大于所述第一t细胞群体中抗原特异性t细胞的频率,其中t细胞群体中抗原特异性t细胞的频率是[所述群体中抗原特异性t细胞的数目]/[所述群体中t细胞的总数目]x100。
47、在一些实施方案中,所述治疗性t细胞群体中抗原特异性t细胞的频率大于所述第二t细胞群体中抗原特异性t细胞的频率,其中t细胞群体中抗原特异性t细胞的频率是[所述群体中抗原特异性t细胞的数目]/[所述群体中t细胞的总数目]x100。
48、在一些实施方案中,所述治疗性t细胞群体中抗原特异性t细胞的频率大于所述第三t细胞群体中抗原特异性t细胞的频率,其中所述t细胞群体中抗原特异性t细胞的频率是[所述群体中抗原特异性t细胞的数目]/[所述群体中t细胞的总数目]x100。
49、在一些实施方案中,所述第一t细胞群体的培养进行5至25天、7至16天、13至15天、或约13或14天的时间段。
50、在一些实施方案中,所述第二t细胞群体的培养进行1、2、3或4天的时间段。
51、在一些实施方案中,所述第二t细胞群体的培养进行5至25天、7至14天、11至13天、21天或更少、或约12天的时间段。
52、在一些实施方案中,所述第二t细胞群体或所述第三t细胞群体扩增进行5至25天、7至14天、11至13天、21天或更少、或约12天的时间段。
53、在一些实施方案中,所述第二t细胞群体或所述第三t细胞群体扩增进行4至24天、6至13天、10至12天、20天或更少、或约11天的时间段。
54、在一些实施方案中,所述方法扩增抗原特异性t细胞。
55、在一些实施方案中,所述方法扩增来自所述第一t细胞群体的幼稚t细胞。
56、在一些实施方案中,所述方法扩增来自所述第一t细胞群体的已成为抗原特异性t细胞的幼稚t细胞。
57、在一些实施方案中,所述方法包括扩增抗原特异性t细胞。
58、在一些实施方案中,在第一细胞培养基中培养来自对象的生物样品的t细胞扩增抗原特异性t细胞。
59、在一些实施方案中,在第二细胞培养基中培养所述第一t细胞群体扩增了抗原特异性t细胞。
60、在一些实施方案中,在第三细胞培养基中扩增所述第二t细胞群体或所述第三t细胞群体扩增了抗原特异性t细胞。
61、在一些实施方案中,所述第一t细胞群体不是从肿瘤浸润淋巴细胞(til)样品获得的。
62、在一些实施方案中,所述第一培养基和所述第二培养基是相同的。
63、在一些实施方案中,所述第一培养基和所述第二培养基是不同的。
64、在一些实施方案中,所述第一培养基包括gm-csf、il-4、flt3l、tnf-α、il-1β、pge1、il-6、il-7、il-12、ifn-α、r848、lps、ss-rna40、poly i:c或其任何组合。
65、在一些实施方案中,所述第二培养基包括可溶性抗cd3抗体、缀合至珠的抗cd3抗体、可溶性抗cd28抗体、缀合至珠的抗cd28抗体、胰岛素、一种或多种非必需氨基酸、葡萄糖、谷氨酰胺、il-2、il-7、il-15、il-12、cd137激动剂、akt抑制剂、mem维生素溶液、丙酮酸钠或其任何组合。
66、在一些实施方案中,所述第一培养基包括fms样酪氨酸激酶3受体配体(flt3l)。
67、在一些实施方案中,所述第二培养基包括flt3l。
68、在一些实施方案中,所述第二培养基不包括附加的apc。
69、在一些实施方案中,存在于所述第二培养基或所述第三培养基中的apc的数目少于存在于所述第一细胞培养基中的apc的数目。
70、在一些实施方案中,补充不包括补充apc。
71、在一些实施方案中,所述方法包括在(a)之后和(b)之前从所述第二t细胞群体中富集表达cd137的t细胞。
72、在一些实施方案中,富集包括使用包括抗cd137试剂的富集试剂进行富集。
73、在一些实施方案中,所述富集试剂是抗体或其结合片段。
74、在一些实施方案中,所述富集试剂偶联至固体表面。
75、在一些实施方案中,富集包括免疫沉淀。
76、在一些实施方案中,向所述第二培养基和/或所述第三培养基补充t细胞激活剂。
77、在一些实施方案中,所述t细胞激活剂包括可溶性cd3和/或cd28包被的珠。
78、在一些实施方案中,所述方法进一步包括收获包括抗原特异性t细胞的所述治疗性t细胞群体。
79、在一些实施方案中,所述方法进一步包括将所述收获的包括抗原特异性t细胞的治疗性t细胞群体转移到输液袋中。
80、在一些实施方案中,所述方法进一步包括向所述对象施用包括抗原特异性t细胞的所述治疗性t细胞群体。
81、在一些实施方案中,所述对象患有疾病或病况。
82、在一些实施方案中,所述疾病或病况是癌症。
83、在一些实施方案中,所述癌症是实体癌。
84、在一些实施方案中,所述癌症是黑色素瘤、胰腺导管腺癌(pdac)、结直肠癌(crc)或非小细胞肺癌(nsclc)。
85、在一些实施方案中,所述癌症是不可切除的黑色素瘤或ras突变的pdac。
86、在一些实施方案中,所述对象是人类。
87、在一些实施方案中,所述对象先前已接受pd-1抑制剂、pd-l1抑制剂、ctla-4抑制剂或其任何组合。
88、在一些实施方案中,所述对象的疾病进展。
89、在一些实施方案中,所述对象已接受或目前正在接受pd-1抑制剂或pd-l1抑制剂至少3个月。
90、在一些实施方案中,所述对象患有稳定疾病或无症状进行性疾病。
91、在一些实施方案中,所述方法进一步包括在(a)之前从所述生物样品中耗尽cd14+细胞。
92、在一些实施方案中,所述方法进一步包括在(a)之前从所述生物样品中耗尽cd25+细胞。
93、在一些实施方案中,所述方法进一步包括在(a)之前从所述生物样品中耗尽cd56+细胞。
94、在一些实施方案中,所述生物样品是外周血单核细胞(pbmc)样品。
95、在一些实施方案中,所述生物样品是经洗涤和/或冷冻保存的外周血单核细胞(pbmc)样品。
96、在一些实施方案中,所述扩增的t细胞群体或所述第三t细胞群体包括1x107至1x1011个总细胞。
97、在一些实施方案中,所述apc包括编码所述肽抗原的所述表位的多核苷酸。
98、在一些实施方案中,所述多核苷酸是mrna。
99、在一些实施方案中,所述apc已经与包括所述肽抗原的多肽接触过。
100、在一些实施方案中,所述肽抗原是ras肽抗原。
101、在一些实施方案中,所述方法包括通过包括以下项的方法选择表位:
102、从包括获自所述对象的癌细胞的第一生物样品生成癌细胞核酸,以及从包括获自同一对象的非癌细胞的第二生物样品生成非癌细胞核酸;
103、通过全基因组测序或全外显子组测序对所述癌细胞核酸进行测序,从而获得包括癌细胞核酸序列的第一多个核酸序列,以及通过全基因组测序或全外显子组测序对所述非癌细胞核酸进行测序,从而获得包括非癌细胞核酸序列的第二多个核酸序列;
104、从所述第一多个核酸序列中识别癌症特异性核酸序列,所述癌症特异性核酸序列(i)编码含有癌症特异性突变的表位,(ii)是所述癌细胞特有的,以及(ii)不包括来自所述第二多个核酸序列的核酸序列;
105、通过hla肽结合分析,预测或计算或测量哪些表位与由同一对象的hla等位基因编码的蛋白质形成复合体;以及
106、选择在(d)中预测或计算或测量的以小于500nm的ic50与由同一对象的hla等位基因编码的所述蛋白质结合的表位。
107、在一些实施方案中,培养第一t细胞群体包括在富集表达cd137(4-1bb)的t细胞之前,在扩增所述第二t细胞群体之前添加脉冲量的所述肽抗原。
108、在一些实施方案中,在富集表达cd137(4-1bb)的t细胞之前,在扩增所述第二t细胞群体之前至多约2天,添加所述脉冲量的所述肽。
109、在一些实施方案中,所述肽的所述脉冲量高于所述肽抗原的第一量。
110、在一些实施方案中,所述ras肽抗原是ras肽新抗原或衍生自ras突变的抗原。
111、一种用于生产治疗性t细胞群体的方法,其包括:
112、在包括抗原呈递细胞(apc)的第一细胞培养基中培养来自对象的生物样品的第一t细胞群体以生产第二t细胞群体,其中所述apc呈递与mhc蛋白质复合的肽抗原的表位;
113、在包括第一量的所述肽抗原的第二细胞培养基中扩增所述第二t细胞群体以生产第三t细胞群体;
114、向所述第二细胞培养基补充第二量的所述肽抗原,其中所述肽抗原的所述第二量高于所述肽抗原的所述第一量;以及
115、扩增所述第三t细胞群体以获得包括抗原特异性t细胞的治疗性t细胞群体。
116、一种用于生产治疗性t细胞群体的方法,其包括:
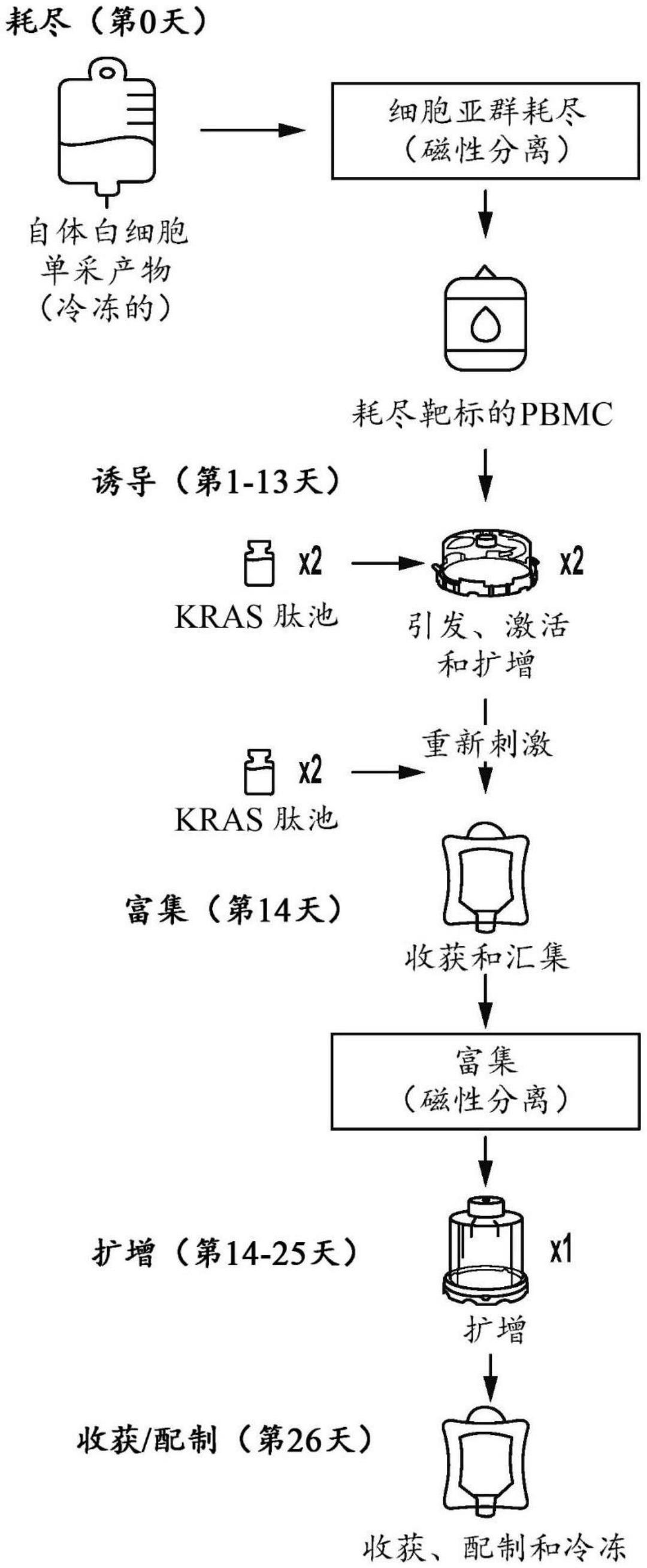
117、在包括抗原呈递细胞(apc)的第一细胞培养基中培养来自对象的生物样品的第一t细胞群体以生产第二t细胞群体,其中所述apc呈递与mhc蛋白质复合的肽抗原的表位;
118、富集表达cd137(4-1bb)的t细胞和/或表达cd69的t细胞以生产富集的第二t细胞群体;
119、在补充有增加浓度的所述肽抗原的脉冲的第二培养基中培养所述富集的t细胞群体,所述脉冲从低于所述第一培养基中存在的剂量的剂量开始;以及
120、在第二细胞培养基中扩增所述富集的第二t细胞群体以获得包括抗原特异性t细胞的治疗性t细胞群体。
121、本文还提供了一种药物组合物,所述药物组合物包括根据本文所述方法生产的包括抗原特异性t细胞的治疗性t细胞群体。
122、本文提供了用于生产用作治疗剂的t细胞的方法,所述方法使用幼稚t细胞应答的初步离体诱导或记忆t细胞应答的扩增,然后使用肽脉冲以优先上调抗原特异性t细胞上的激活标志。本文还公开了用于生产用作治疗剂的t细胞的方法,所述方法使用基于所使用的特异性富集标志优化的通过实验方法定义的扩增方案。本文还公开了用于生产用作治疗剂的t细胞的方法,所述方法在扩增阶段期间以指数方式增加肽脉冲,以优先重新刺激抗原特异性t细胞。本文提供的方法可以涉及使用刺激方案来初步诱导和扩增针对特定抗原的抗原特异性细胞,从而可以重新富集t细胞应答。然后确定,以这种方式诱导和扩增的细胞能够通过简单地重新引入诱导肽而不是使用抗原呈递细胞来上调细胞表面的激活标志。当以这种方式刺激时,所述激活标志在所述抗原特异性细胞上具体地和瞬时性地增加,使其可以用基于珠的富集进行富集。目前存在许多用于t细胞扩增的方法,这些方法侧重于使用细胞因子(例如il-2)或激活t细胞上共刺激分子(例如cd3/cd28)的珠来进行刺激。这些方法用于扩增培养基中的所有细胞,而无需考虑抗原特异性。由于抗原特异性细胞的频率一般较低,因此需要一种方法来优先扩增抗原特异性细胞。经由以指数方式增加肽剂量来单独扩增抗原特异性细胞是尚未广泛研究的新型概念。实际上,该策略已经在t细胞引发情况和疫苗接种方面进行了研究。这些策略侧重于t细胞发育的早期阶段。
123、经由指数方式的肽定量给料进行t细胞的抗原特异性扩增是在初步培养后,在例如三天的时间里,向pbmc给予增加量的肽的过程。例如,如果pbmc针对kras g12表位引发,则扩增将由用指数增加剂量的相同kras g12表位对富集的pbmc进行脉冲组成。此策略模拟了体内病毒感染的自然过程,并且可以一次性对一个或多个免疫原进行处理。为了应用此过程,可以用预先制造的、对患者的hla和肿瘤突变有特异性的免疫原来对富集的刺激产物进行脉冲。免疫原可以是i类或ii类表位。据发现,富集和扩增抗原特异性t细胞的过程大大增加了抗原特异性细胞的数目,所述抗原特异性细胞构成最终细胞疗法产物并且可以由cd8和cd4 t细胞构成。虽然此方法已经使用kras作为新抗原模型进行了构思和验证,但是其可适用于所有诱导的t细胞应答。
124、本公开提供了用于临床开发和使用的新型和改进的t细胞疗法。虽然自体t细胞疗法使用起来很安全,但要达到治疗标准,还需要进行一些重大改进,该领域的发展既迅速又充满了困难。申请人先前公开的申请提供了用于癌症的t细胞疗法的组合物和方法的标志性发展,(参见wo2019/094642和pct/us2020/031898,其中每一者通过引用以其整体并入本文)。本技术源于惊人的发现,在离体免疫细胞制备的不同阶段表达特异性标志的某些细胞的富集提供了高免疫原性细胞组合物。本公开还部分地来源于发现新型和改进的抗原刺激方法,从而改进了用于治疗开发的细胞组合物。本文提供了新型方法和组合物,其中至少部分地,在离体刺激和细胞扩增期间增加添加的肽的量提供了新型治疗组合物和改进的方法。
125、本文提供了一种将来自对象的t细胞扩增成治疗性抗原特异性t细胞群体的方法,其包括:(a)在包括抗原呈递细胞(apc)的第一细胞培养基中培养来自对象的生物样品的第一t细胞群体,以生产第二t细胞群体,其中所述apc呈递与mhc蛋白质复合的肽抗原的表位;(b)在包括第一量的所述肽抗原的第二细胞培养基中扩增所述第二t细胞群体以生产第三t细胞群体;(c)向所述第二细胞培养基补充第二量的所述肽抗原,其中所述肽抗原的所述第二量高于所述肽抗原的所述第一量;以及(d)扩增所述第三t细胞群体以获得扩增的t细胞群体。
126、本文还提供了一种将来自对象的t细胞扩增成治疗性抗原特异性t细胞群体的方法,其包括:(a)在包括抗原呈递细胞(apc)的第一细胞培养基中培养来自对象的生物样品的第一t细胞群体以生产第二t细胞群体,其中所述apc呈递与mhc蛋白质复合的肽抗原的表位;(b)富集表达cd137(4-1bb)的t细胞以生产富集的第二t细胞群体;以及(c)在第二细胞培养基中扩增所述富集的第二t细胞群体以获得第三t细胞群体。
127、本文还提供了一种将来自对象的t细胞扩增成治疗性抗原特异性t细胞群体的方法,其包括:(a)在包括抗原呈递细胞(apc)的第一细胞培养基中培养来自对象的生物样品的第一t细胞群体以生产第二t细胞群体,其中所述apc呈递与mhc蛋白质复合的肽抗原的表位;(b)富集表达cd69的t细胞以生产富集的第二t细胞群体;以及(c)在第二细胞培养基中扩增所述富集的第二t细胞群体以获得第三t细胞群体。
128、在一些实施方案中,所述方法进一步包括:向所述第二细胞培养基补充第二量的所述肽抗原,其中所述肽抗原的所述第二量高于所述肽抗原的所述第一量。
129、在一些实施方案中,所述方法进一步包括:在1至20天的第三时间段内扩增所述第三t细胞群体以获得扩增的t细胞群体。
130、在一些实施方案中,在5至25天、7至16天、13至15天、或约14天的第一时间段内培养所述第一t细胞群体以获得所述第二t细胞群体。
131、在一些实施方案中,所述第二t细胞群体中抗原特异性t细胞的数目在数目上大于所述第一t细胞群体中抗原特异性t细胞的数目。
132、在一些实施方案中,在5至25天、7至14天、11至13天、21天或更少、或约12天的第二时间段内培养所述富集的第二t细胞群体以获得所述第三t细胞群体。
133、在一些实施方案中,扩增所述第三t细胞群体包括在4至24天、6至13天、10至12天、20天或更少、或约11天的第三时间段内扩增所述第三t细胞群体以获得扩增的t细胞群体。
134、在一些实施方案中,所述方法优先地或具体地扩增抗原特异性t细胞。
135、在一些实施方案中,所述方法优先地或具体地扩增来自所述第一t细胞群体的幼稚t细胞。
136、在一些实施方案中,所述方法优先地或具体地扩增来自所述第一t细胞群体的已成为抗原特异性t细胞的幼稚t细胞。
137、在一些实施方案中,所述第三t细胞群体或所述扩增的t细胞群体是治疗性抗原特异性t细胞群体。
138、在一些实施方案中,扩增所述第二t细胞群体、扩增所述富集的第二t细胞群体或扩增第三t细胞群体包括扩增抗原特异性t细胞。
139、在一些实施方案中,培养所述第一t细胞群体包括扩增抗原特异性t细胞。
140、在一些实施方案中,扩增所述第二t细胞群体包括扩增抗原特异性t细胞。
141、在一些实施方案中,所述第一t细胞群体不是从肿瘤浸润淋巴细胞(til)样品获得的。
142、在一些实施方案中,所述第一培养基和所述第二培养基是相同的。
143、在一些实施方案中,所述第一培养基和所述第二培养基是不同的。
144、在一些实施方案中,所述第一培养基包括gm-csf、il-4、flt3l、tnf-α、il-1β、pge1、il-6、il-7、ifn-α、r848、lps、ss-rna40、poly i:c或其任何组合。
145、在一些实施方案中,所述第二培养基包括可溶性抗cd3抗体、缀合至珠的抗cd3抗体、可溶性抗cd28抗体、缀合至珠的抗cd28抗体、胰岛素、一种或多种非必需氨基酸、葡萄糖、谷氨酰胺、il-2、il-7、il-15、il-12、cd137激动剂、akt抑制剂、mem维生素溶液、丙酮酸钠或其任何组合。
146、在一些实施方案中,所述第一培养基包括fms样酪氨酸激酶3受体配体(flt3l)。
147、在一些实施方案中,所述第二培养基包括flt3l。
148、在一些实施方案中,所述第二培养基不包括附加的apc。
149、在一些实施方案中,在补充步骤添加的apc的数目少于存在于所述第一细胞培养基中的apc的数目。
150、在一些实施方案中,补充不包括补充apc。
151、在一些实施方案中,所述方法进一步包括在(a)之后和(b)之前从所述第二t细胞群体中富集表达cd137的t细胞或表达cd69的t细胞。
152、在一些实施方案中,富集包括使用包括抗cd69试剂或抗cd137试剂的富集试剂进行富集。
153、在一些实施方案中,所述富集试剂是抗体或其结合片段。
154、在一些实施方案中,所述富集试剂偶联至固体表面。
155、在一些实施方案中,富集包括免疫沉淀。
156、在一些实施方案中,所述肽抗原的所述第二量是所述肽抗原的所述第一量的至少1.1、1.5、2、3、4、5、6、7、8、9或10倍。
157、在一些实施方案中,所述方法进一步包括:向所述第二细胞培养基补充第三量的肽抗原,其中所述肽抗原的所述第三量高于所述肽抗原的所述第二量。
158、在一些实施方案中,所述肽抗原的所述第三量是所述肽抗原的所述第二量的至少1.1、1.5、2、3、4、5、6、7、8、9或10倍。
159、在一些实施方案中,所述方法进一步包括收获所述扩增的t细胞群体或所述第三t细胞群体。
160、在一些实施方案中,所述方法进一步包括将所述收获的t细胞群体转移到输液袋中。
161、在一些实施方案中,所述方法进一步包括向所述对象施用所述扩增的t细胞群体或所述第三t细胞群体。
162、在一些实施方案中,所述对象患有疾病或病况。
163、在一些实施方案中,所述疾病或病况是癌症。
164、在一些实施方案中,所述癌症是实体癌。
165、在一些实施方案中,所述癌症是黑色素瘤、胰腺导管腺癌(pdac)、结直肠癌(crc)或非小细胞肺癌(nsclc)。
166、在一些实施方案中,所述癌症是不可切除的黑色素瘤或ras突变的pdac。
167、在一些实施方案中,所述对象是人类。
168、在一些实施方案中,所述对象先前已接受pd-1抑制剂、pd-l1抑制剂、ctla-4抑制剂或其任何组合。
169、在一些实施方案中,所述对象的疾病进展。
170、在一些实施方案中,所述对象已接受或目前正在接受pd-1抑制剂或pd-l1抑制剂至少3个月。
171、在一些实施方案中,所述对象患有稳定疾病或无症状进行性疾病。
172、在一些实施方案中,所述方法进一步包括在(a)之前从所述生物样品中耗尽cd14+细胞。
173、在一些实施方案中,所述方法进一步包括在(a)之前从所述生物样品中耗尽cd25+细胞。
174、在一些实施方案中,所述生物样品是外周血单核细胞(pbmc)样品。
175、在一些实施方案中,所述生物样品是经洗涤和/或冷冻保存的外周血单核细胞(pbmc)样品。
176、在一些实施方案中,所述扩增的t细胞群体或所述第三t细胞群体包括1x107至1x1011个总细胞。
177、在一些实施方案中,所述apc包括编码所述肽抗原的所述表位的多核苷酸。
178、在一些实施方案中,所述多核苷酸是mrna。
179、在一些实施方案中,所述apc已经与包括所述肽抗原的多肽接触过。
180、在一些实施方案中,所述肽抗原是ras肽抗原,如表1至14中的任一个的ras肽抗原。
181、在一些实施方案中,所述ras肽抗原是ras肽新抗原或衍生自ras突变的抗原。
182、在一些实施方案中,所述方法包括通过以下方法选择表位,包括:(a)从包括获自所述对象的癌细胞的第一生物样品生成癌细胞核酸,以及从包括获自同一对象的非癌细胞的第二生物样品生成非癌细胞核酸;(b)通过全基因组测序或全外显子组测序对所述癌细胞核酸进行测序,从而获得包括癌细胞核酸序列的第一多个核酸序列,以及通过全基因组测序或全外显子组测序对所述非癌细胞核酸进行测序,从而获得包括非癌细胞核酸序列的第二多个核酸序列;(c)从所述第一多个核酸序列中识别癌症特异性核酸序列,所述癌症特异性核酸序列(i)编码含有癌症特异性突变的表位,(ii)是所述癌细胞特有的,以及(ii)不包括来自所述第二多个核酸序列的核酸序列;(d)通过hla肽结合分析,预测或计算或测量哪些表位与由同一对象的hla等位基因编码的蛋白质形成复合体;以及(e)选择在(d)中预测或计算或测量的以小于500nm的ic50与由同一对象的hla等位基因编码的所述蛋白质结合的表位。
183、在一些实施方案中,培养第一t细胞群体包括在扩增所述第二t细胞群体之前、在富集表达cd137(4-1bb)的t细胞之前、或在富集表达cd69的t细胞之前,添加脉冲量的所述肽抗原。
184、在一些实施方案中,在扩增所述第二t细胞群体之前、在富集表达cd137(4-1bb)的t细胞之前、或在富集表达cd69的t细胞之前的至多约2天,添加所述脉冲量的所述肽。
185、在一些实施方案中,所述肽的所述脉冲量高于所述肽抗原的第一量。
186、本文还提供了一种药物组合物,所述药物组合物包括根据本文所述方法生产的治疗性抗原特异性t细胞群体。
- 还没有人留言评论。精彩留言会获得点赞!