新的缓慢释放前药的制作方法
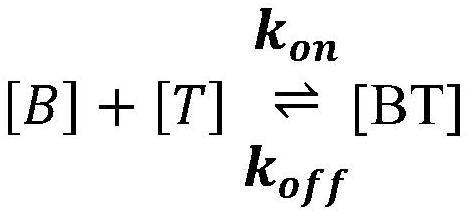
本发明涉及包含结合部分和药物分子的组合物,其中所述结合部分可逆地结合所述药物分子以形成前药复合物,该前药复合物在施用后在体内缓慢释放该药物分子。本发明还涉及形成这种组合物的方法和使用这种组合物的治疗方法。还描述了结合部分、编码所述结合部分的核酸以及使用宿主细胞制备这些核酸的方法。
背景技术:
1、显然,可行的药物候选物需要满足某些功效标准,但药物候选物具有可接受的安全概况也是重要的。许多药物分子具有一些不良的脱靶(off-target)和/或靶上(on-target)副作用,并且一些药物分子也可能由于对药物分子的预期靶标的夸大的和不良的药理学作用而导致不利的靶上作用。对于某些药物种类,不良作用不能避免,因此它们必须被减轻。对此有几种选择。例如,非类固醇类抗炎药(nsaid)可损害胃的内层,因此它们通常与保护胃的药剂(诸如质子泵抑制剂奥美拉唑(omeprazole))共施用。对于其他药物分子,不良作用或其风险可使用特定剂量方案来减轻,使得药物以多剂量或在较长时间内连续地施用于患者。这种情况的示例可以包括每天多次服用药物,或静脉内(iv)输注药物。
2、尽管分次剂量和iv药物输注是公认的和可接受的给药方式,但它们并非没有缺点。对患者而言繁重的剂量方案,诸如在相对短的时间段内需要多次用药的那些剂量方案,与差的患者依从性以及因此更差的治疗结果相关。尽管iv输注方法不太可能遭受差的患者依从性,但患者必须在医疗护理下。这对于患者是破坏性的,并且导致对医疗保健系统增加的负担。因此,本领域需要减轻不良药物作用的改进方式。
3、与使用各种药物相关的特别成问题的不良作用是细胞因子释放综合征(crs)和高细胞因子血症,也称为“细胞因子风暴”。例如,crs或高细胞因子血症可在用某些免疫疗法(诸如单克隆抗体和car-t细胞)治疗后发生。高细胞因子血症通常在第一剂药物后迅速发生,其特征在于体内细胞因子的不受控制的过量释放。虽然细胞因子释放是正常免疫功能的关键部分,但是过多的细胞因子过快地释放到血液中会导致诸如高热、发炎、严重疲劳、恶心以及有时甚至是多器官衰竭和死亡的症状。在参与者发展出严重的高细胞因子血症后,不得不放弃意欲用于治疗b细胞慢性淋巴细胞白血病和类风湿关节炎的药物西拉利珠单抗(theralizumab)的临床试验。症状的发作在给药一小时内发生,并且试验中的所有参与者都需要紧急的医院护理。crs还由受免疫疗法影响的免疫细胞向血液中大量、快速释放细胞因子引起。crs的症状包括发烧、恶心、头痛、皮疹、快速心跳、低血压和呼吸困难。有时,crs可能是严重的或威及生命的。
4、已知与crs相关的一类药物是t细胞接合剂(tce)。tce也与全身性内皮活化和大量淋巴细胞再分布以及神经毒性相关,特别是在首次剂量施用后(velasquez,blood,2018,131(1),30-38)。这些毒性经常影响临床试验设计和剂量递增策略,并且已经证明尤其是在具有高疾病负荷的患者中,由于严重程度而具有剂量限制。也可能需要预先用药和/或主动干预,最终导致复杂的临床试验设计。
5、已经设计了几种策略用于与施用药物(如t细胞接合剂)相关的crs的临床管理。这些策略包括逐步给药(逐步剂量递增)、用类固醇(尤其是地塞米松(dexamethasone))预治疗或用托珠单抗(tocilizumab)(抗il6受体抗体)治疗(参见例如aldoss等人currentoncology reports,2019,21:4)。用类固醇的预治疗延迟了治疗的开始,这对于侵袭性疾病状态是不推荐的,并且在具有高体重指数(bmi)和/或血压的患者中使用类固醇可能是禁忌的。fda在2017年批准用托珠单抗治疗以避免crs。然而,这种药物的免疫抑制作用可使患者易受其他感染性疾病的伤害。
6、总之,仍然需要新的或改进的方法来避免、减少或减轻用于治疗疾病(包括癌症)的药物分子的不良作用或其风险。
技术实现思路
1、本技术寻求提供一种避免或减轻施用药物分子后的不良作用或其风险的新方法。本发明提供一种在施用药物产品后将活性药物分子缓慢释放到体内的方法。该方法使用所谓的“缓慢释放”组合物(在本文中也称为前药复合物),其在延长的时间段内将活性药物分子释放到体内,从而避免施用后不久体内活性药物分子浓度的峰值。该方法的有益应用的示例是使用包含tce的缓慢释放组合物降低施用tce后的crs风险。
2、通常采用前药策略来减轻与特定药物如何被吸收、分布、代谢和排泄相关的问题。许多通常可获得的前药含有体内水解的小部分(诸如酯和酰胺基团),或在施用后将被磷酸化或去磷酸化的基团。
3、在本技术中,我们描述了使用结合部分的新的前药方法,该结合部分可逆地结合至药物分子并且当结合时抑制药物分子的生物活性。药物分子的这种生物活性可以是例如药物分子与生物靶标的结合。本发明的前药复合物包含可逆地结合至药物分子的这种结合部分。结合部分与药物分子的结合性质允许药物分子随着时间变化而释放。随着时间变化的药物分子的这种释放可以例如在将本发明的前药复合物施用于受试者(包括人)后发生。本发明的结合部分对药物分子具有高亲和力和/或从药物分子的低解离速率。本发明的结合部分包括具有不同结构的分子,诸如免疫球蛋白分子或非免疫球蛋白分子。结合部分包括抗体、替代性支架(诸如工程化支架)和多肽。这种工程化支架的示例是经设计的锚蛋白重复结构域。
4、总之,本发明提供了包含结合部分和药物分子的缓慢释放组合物、制备这种组合物的方法和使用这种组合物的治疗方法。本发明还提供了新的结合部分、编码所述结合部分的核酸以及使用宿主细胞制备这些核酸的方法。
5、基于本文提供的公开内容,本领域技术人员将认识到或仅能够使用常规实验来确定本文所述的本发明的具体实施方案的许多等同物。此类等同物旨在由以下实施方案(e)涵盖。
6、1.在第一实施方案中,本发明涉及一种组合物,该组合物包含(i)结合部分和(ii)药物分子;其中所述结合部分可逆地结合至所述药物分子;并且其中所述结合部分当结合时抑制所述药物分子的生物活性。
7、2.在第二实施方案中,本发明涉及根据实施方案1所述的组合物,其中所述结合部分包含抗体、替代性支架或多肽。
8、3.在第三实施方案中,本发明涉及根据实施方案1或2所述的组合物,其中所述结合部分包含免疫球蛋白分子或其片段。
9、4.在第四实施方案中,本发明涉及根据实施方案1或2所述的组合物,其中所述结合部分包含非免疫球蛋白分子。
10、5.在第五实施方案中,本发明涉及根据实施方案1至4中任一项所述的组合物,其中所述结合部分包含衍生自单克隆抗体、多克隆抗体、重组抗体、嵌合抗体、人抗体、人源化抗体、单结构域抗体、重链可变结构域(vh)、轻链可变结构域(vl)或可变结构域(vhh)的抗原结合结构域。
11、6.在第六实施方案中,本发明涉及根据实施方案1至4中任一项所述的组合物,其中所述结合部分包含抗原结合结构域,该抗原结合结构域衍生自以下或与以下相关:阿德耐汀(adnectin)、单抗体、亲和体(affibody)、阿菲林(affilin)、阿菲默(affimer)、适体、阿非汀(affitin)、α抗体(alphabody)、抗运载蛋白(anticalin)、重复蛋白结构域、犰狳重复结构域、阿去默(atrimer)、阿维默(avimer)、锚蛋白重复结构域、非诺莫(fynomer)、打结素(knottin)、库尼兹结构域(kunitzdomain)或t细胞受体(tcr)。
12、6a.在实施方案6a中,本发明涉及根据实施方案1至4中任一项所述的组合物,其中所述结合部分包含衍生自阿德耐汀或与其相关的抗原结合结构域。
13、6b.在实施方案6b中,本发明涉及根据实施方案1至4中任一项所述的组合物,其中所述结合部分包含衍生自单抗体或与其相关的抗原结合结构域。
14、6c.在实施方案6c中,本发明涉及根据实施方案1至4中任一项所述的组合物,其中所述结合部分包含衍生自亲和体或与其相关的抗原结合结构域。
15、6d.在实施方案6d中,本发明涉及根据实施方案1至4中任一项所述的组合物,其中所述结合部分包含衍生自阿菲林或与其相关的抗原结合结构域。
16、6e.在实施方案6e中,本发明涉及根据实施方案1至4中任一项所述的组合物,其中所述结合部分包含衍生自阿菲默或与其相关的抗原结合结构域。
17、6f.在实施方案6f中,本发明涉及根据实施方案1至4中任一项所述的组合物,其中所述结合部分包含衍生自适体或与其相关的抗原结合结构域。
18、6g.在实施方案6g中,本发明涉及根据实施方案1至4中任一项所述的组合物,其中所述结合部分包含衍生自阿非汀或与其相关的抗原结合结构域。
19、6h.在实施方案6h中,本发明涉及根据实施方案1至4中任一项所述的组合物,其中所述结合部分包含衍生自α抗体或与其相关的抗原结合结构域。
20、6i.在实施方案6i中,本发明涉及根据实施方案1至4中任一项所述的组合物,其中所述结合部分包含衍生自重复蛋白结构域或与其相关的抗原结合结构域。
21、6j.在实施方案6j中,本发明涉及根据实施方案1至4中任一项所述的组合物,其中所述结合部分包含衍生自犰狳重复结构域或与其相关的抗原结合结构域。
22、6k.在实施方案6k中,本发明涉及根据实施方案1至4中任一项所述的组合物,其中所述结合部分包含衍生自阿去默或与其相关的抗原结合结构域。
23、6l.在实施方案6l中,本发明涉及根据实施方案1至4中任一项所述的组合物,其中所述结合部分包含衍生自阿维默或与其相关的抗原结合结构域。
24、6m.在实施方案6m中,本发明涉及根据实施方案1至4中任一项所
25、述的组合物,其中所述结合部分包含衍生自锚蛋白重复结构域或与其相关的抗原结合结构域。
26、6n.在实施方案6n中,本发明涉及根据实施方案1至4中任一项所述的组合物,其中所述结合部分包含衍生自非诺莫或与其相关的抗原结合结构域。
27、6o.在实施方案6o中,本发明涉及根据实施方案1至4中任一项所述的组合物,其中所述结合部分包含衍生自打结素或与其相关的抗原结合结构域。
28、6p.在实施方案6p中,本发明涉及根据实施方案1至4中任一项所述的组合物,其中所述结合部分包含衍生自库尼兹结构域或与其相关的抗原结合结构域。
29、6q.在实施方案6q中,本发明涉及根据实施方案1至4中任一项所述的组合物,其中所述结合部分包含衍生自t细胞受体(tcr)或与其相关的抗原结合结构域。
30、7.在第七实施方案中,本发明涉及根据任一前述实施方案所述的组合物,其中所述药物分子的所述生物活性是所述药物分子与生物靶标的结合。
31、8.在第八实施方案中,本发明涉及根据任一前述实施方案所述的组合物,其中所述药物分子的所述生物活性是酶活性。
32、9.在第九实施方案中,本发明涉及根据任一前述实施方案所述的组合物,其中所述结合部分对所述药物分子的结合亲和力允许在将所述组合物施用于哺乳动物后随着时间变化释放药物分子。
33、10.在第十实施方案中,本发明涉及根据实施方案9所述的组合物,其中所述哺乳动物是人。
34、11.在第十一实施方案中,本发明涉及根据任一前述实施方案所述的组合物,其中所述结合部分以小于10nm(诸如小于10nm、小于1nm、小于100pm、小于10pm或小于1pm)的解离常数(kd)结合所述药物分子。
35、12.在第十二实施方案中,本发明涉及根据任一前述实施方案所述的组合物,其中所述结合部分与所述药物分子的解离速率(koff)介于约1×10-8s-1与约1×10-4s-1之间、介于约1×10-8s-1与约1×10-5s-1之间、介于约1×10-8s-1与约1×10-6s-1之间、介于约1×10-8s-1与约1×10-7s-1之间、介于约1×10-7s-1与约1×10-4s-1之间、介于约1×10-7s-1与约1×10-5s-1之间、介于约1×10-7s-1与约1×10-6s-1之间、介于约1×10-6s-1与约1×10-4s-1或介于约1×10-6s-1与约1×10-5s-1之间。
36、13.在第十三实施方案中,本发明涉及根据实施方案11或12所述的组合物,其中所述解离常数(kd)或解离速率(koff)是在磷酸盐缓冲盐水(pbs)中测量。
37、14.在第十四实施方案中,本发明涉及根据任一前述实施方案所述的组合物,其中所述结合部分当与所述药物分子复合时具有阻断半衰期(t1/2),其中所述阻断半衰期根据下式计算:
38、阻断
39、15.在第十五实施方案中,本发明涉及根据实施方案14所述的组合物,其中所述阻断半衰期(t1/2)为至少约2小时、至少约3小时、至少约4小时、至少约5小时、至少约6小时、至少约7小时、至少约8小时、至少约9小时、至少约10小时、至少约15小时、至少约20小时,诸如至少约20小时、至少约25小时、至少约30小时、至少约35小时、至少约40小时、至少约45小时、至少约50小时、至少约55小时或至少约60小时。
40、16.在第十六实施方案中,本发明涉及根据任一前述实施方案所述的组合物,其中所述结合部分包含经设计的锚蛋白重复结构域。
41、17.在第十七实施方案中,本发明涉及根据实施方案16所述的组合物,其中所述经设计的锚蛋白重复结构域包含锚蛋白重复模块,该锚蛋白重复模块包含选自由以下组成的组的氨基酸序列:(1)seq id no:30至51,以及(2)其中seq id no:30至51中的任一者中的至多9个氨基酸被另一氨基酸取代的序列。
42、18.在第十八实施方案中,本发明涉及根据实施方案16所述的组合物,其中所述经设计的锚蛋白重复结构域包含选自由以下组成的组的氨基酸序列:(1)seq id no:1至10,以及(2)与seq id no:1至10中任一者具有至少85%氨基酸序列同一性的序列。
43、19.在第十九实施方案中,本发明涉及根据任一前述实施方案所述的组合物,其中所述药物分子包含抗体、替代性支架或多肽。
44、20.在第二十实施方案中,本发明涉及根据任一前述实施方案所述的组合物,其中所述药物分子包含免疫球蛋白分子或其片段。
45、21.在第二十一实施方案中,本发明涉及根据任一前述实施方案所述的组合物,其中所述药物分子包含非免疫球蛋白分子。
46、22.在第二十二实施方案中,本发明涉及根据任一前述实施方案所述的组合物,其中所述药物分子包含衍生自单克隆抗体、多克隆抗体、重组抗体、嵌合抗体、人抗体、人源化抗体、单结构域抗体、重链可变结构域(vh)、轻链可变结构域(vl)或可变结构域(vhh)的抗原结合结构域。
47、23.在第二十三实施方案中,本发明涉及根据任一前述实施方案所述的组合物,其中所述药物分子包含抗原结合结构域,该抗原结合结构域衍生自以下或与以下相关:阿德耐汀、单抗体、亲和体、阿菲林、阿菲默、适体、阿非汀、α抗体、抗运载蛋白、重复蛋白结构域、犰狳重复结构域、阿去默、阿维默、锚蛋白重复结构域、非诺莫、打结素、库尼兹结构域或t细胞受体(tcr)。
48、23a.在实施方案23a中,本发明涉及根据任一前述实施方案所述的组合物,其中所述结合部分包含衍生自阿德耐汀或与其相关的抗原结合结构域。
49、23b.在实施方案23b中,本发明涉及根据任一前述实施方案所述的组合物,其中所述结合部分包含衍生自单抗体或与其相关的抗原结合结构域。
50、23c.在实施方案23c中,本发明涉及根据任一前述实施方案所述的组
51、合物,其中所述结合部分包含衍生自亲和体或与其相关的抗原结合结构域。
52、23d.在实施方案23d中,本发明涉及根据任一前述实施方案所述的组
53、合物,其中所述结合部分包含衍生自阿菲林或与其相关的抗原结合结构域。
54、23e.在实施方案23e中,本发明涉及根据任一前述实施方案所述的组
55、合物,其中所述结合部分包含衍生自阿菲默或与其相关的抗原结合结构域。
56、23f.在实施方案23f中,本发明涉及根据任一前述实施方案所述的组
57、合物,其中所述结合部分包含衍生自适体或与其相关的抗原结合结构域。
58、23g.在实施方案23g中,本发明涉及根据任一前述实施方案所述的组
59、合物,其中所述结合部分包含衍生自阿非汀或与其相关的抗原结合结构域。
60、23h.在实施方案23h中,本发明涉及根据任一前述实施方案所述的组
61、合物,其中所述结合部分包含衍生自α抗体或与其相关的抗原结合结构域。
62、23i.在实施方案23i中,本发明涉及根据任一前述实施方案所述的组
63、合物,其中所述结合部分包含衍生自重复蛋白结构域或与其相关的抗原结合结构域。
64、23j.在实施方案23j中,本发明涉及根据任一前述实施方案所述的组
65、合物,其中所述结合部分包含衍生自犰狳重复结构域或与其相关的抗原结合结构域。
66、23k.在实施方案23k中,本发明涉及根据任一前述实施方案所述的组
67、合物,其中所述结合部分包含衍生自阿去默或与其相关的抗原结合结构域。
68、23l.在实施方案23l中,本发明涉及根据任一前述实施方案所述的组
69、合物,其中所述结合部分包含衍生自阿维默或与其相关的抗原结合结构域。
70、23m.在实施方案23m中,本发明涉及根据任一前述实施方案所述的组合物,其中所述结合部分包含衍生自锚蛋白重复结构域或与其相关的抗原结合结构域。
71、23n.在实施方案23n中,本发明涉及根据任一前述实施方案所述的组合物,其中所述结合部分包含衍生自非诺莫或与其相关的抗原结合结构域。
72、23o.在实施方案23o中,本发明涉及根据任一前述实施方案所述的组合物,其中所述结合部分包含衍生自打结素或与其相关的抗原结合结构域。
73、23p.在实施方案23p中,本发明涉及根据任一前述实施方案所述的组合物,其中所述结合部分包含衍生自库尼兹结构域或与其相关的抗原结合结构域。
74、23q.在实施方案23q中,本发明涉及根据任一前述实施方案中任一项所述的组合物,其中所述结合部分包含衍生自t细胞受体(tcr)或与其相关的抗原结合结构域。
75、24.在第二十四实施方案中,本发明涉及根据任一前述实施方案所述的组合物,其中所述药物分子对cd3具有结合特异性。
76、25.在第二十五实施方案中,本发明涉及根据任一前述实施方案所述的组合物,其中所述药物分子还包含至少一个对肿瘤相关抗原(taa)具有结合特异性的结合结构域。
77、25a.在实施方案25a中,本发明涉及根据实施方案25所述的组合物,其中所述肿瘤相关抗原(taa)是cd33。
78、25b.在实施方案25b中,本发明涉及根据实施方案25所述的组合物,其中所述肿瘤相关抗原(taa)是cd123。
79、26.在第二十六实施方案中,本发明涉及根据任一前述实施方案所述的组合物,其中所述药物分子是t细胞接合剂药物分子(tce)。
80、27.在第二十七实施方案中,本发明涉及根据任一前述实施方案所述的组合物,其中该药物分子包含经设计的锚蛋白重复结构域。
81、28.在第二十八实施方案中,本发明涉及根据实施方案27所述的组合物,其中所述经设计的锚蛋白重复结构域包含选自以下组成的组的氨基酸序列:(1)seq id no:12至15,以及(2)与seq id no:12至15中的任一者具有至少85%氨基酸序列同一性的序列。
82、29.在第二十九实施方案中,本发明涉及根据任一前述实施方案所述的组合物,其中所述药物分子包含抗体。
83、30.在第三十实施方案中,本发明涉及根据实施方案29所述的组合物,其中所述药物分子是作为t细胞接合剂药物分子(tce)的抗体。
84、31.在第三十一实施方案中,本发明涉及根据实施方案30所述的组合物,其中所述tce包含结合至cd3的结合结构域并且还包含结合肿瘤相关抗原(taa)的结合结构域。
85、31a.在实施方案31a中,本发明涉及根据实施方案31所述的组合物,其中所述肿瘤相关抗原(taa)是cd33。
86、31b.在实施方案31b中,本发明涉及根据实施方案31所述的组合物,其中所述肿瘤相关抗原(taa)是cd123。
87、32.在第三十二实施方案中,本发明涉及根据实施方案24至31b中任一项所述的组合物,其中所述结合部分与所述tce药物分子的结合抑制所述tce药物分子与t细胞的结合和/或t细胞的活化。
88、33.在第三十三实施方案中,本发明涉及根据实施方案24至28和30至32中任一项所述的组合物,其中所述tce是双特异性抗体。
89、34.在第三十四实施方案中,本发明涉及根据任一前述实施方案所述的组合物,其中所述结合部分是所述药物分子的抗独特型结合物。
90、35.在第三十五实施方案中,本发明涉及根据任一前述实施方案所述的组合物,该组合物另外包含药学上可接受的载体或赋形剂。
91、36.在第三十六实施方案中,本发明涉及根据任一前述实施方案所述的组合物,该组合物用于疗法。
92、37.在第三十七实施方案中,本发明涉及根据实施方案36使用的组合物,该组合物用于治疗增殖性疾病,任选地其中所述增殖性疾病是癌症。
93、38.在第三十八实施方案中,本发明涉及一种治疗方法,该方法包括向有需要的受试者施用根据实施方案1至35中任一项所定义的组合物的步骤。
94、39.在第三十九实施方案中,本发明涉及根据实施方案38所述的方法,其中所述方法是治疗增殖性疾病的方法,任选地其中所述增殖性疾病是癌症。
95、40.在第四十实施方案中,本发明涉及有需要的受试者中t细胞活化的方法,该方法包括向所述受试者施用根据实施方案24至28和30至32中任一项所述的组合物的步骤,任选地其中所述组合物另外包含药学上可接受的载体或赋形剂。
96、41.在第四十一实施方案中,本发明涉及控制活性药物分子在体内释放的方法,该方法包括向有需要的受试者施用根据实施方案1至35中任一项所述的组合物。
97、42.在第四十二实施方案中,本发明涉及根据实施方案38至41中任一项所述的方法,其中所述受试者是人。
98、43.在第四十三实施方案中,本发明涉及制备控释制剂的方法,该方法包括以下步骤:
99、(i)提供根据实施方案1至6、9和11至18中任一项所定义的结合部分;
100、(ii)提供根据实施方案19至23中任一项所定义的药物分子;以及
101、(iii)使所述结合部分和活性药物分子达到平衡,使得基本上所有所述药物分子都被所述结合部分结合。
102、44.在第四十四实施方案中,本发明涉及控制药物分子的生物活性的方法,该方法包括将根据实施方案1至6、9和11至18中任一项所定义的结合部分与根据实施方案19至23中任一项所定义的药物分子组合以形成组合物,并向有需要的患者施用所述组合物。
103、45.在第四十五实施方案中,本发明涉及根据实施方案44所述的方法,其中所述药物分子的所述生物活性是所述药物分子与生物靶标的结合。
104、46.在第四十六实施方案中,本发明涉及根据实施方案45所述的方法,其中所述药物分子的所述生物活性是酶活性。
105、47.在第四十七实施方案中,本发明涉及对药物分子具有结合特异性的结合部分,其中当与所述药物分子结合时,所述结合部分抑制所述药物分子的生物活性。
106、48.在第四十八实施方案中,本发明涉及根据实施方案47所述的结合部分,其中所述结合部分与所述药物分子的结合形成可逆地抑制所述药物分子的生物活性的复合物。
107、49.在第四十九实施方案中,本发明涉及根据实施方案47或48中任一项所述的结合部分,其中所述药物分子的所述生物活性是所述药物分子与生物靶标的结合。
108、50.在第五十实施方案中,本发明涉及根据实施方案47至49中任一项所述的结合部分,其中所述药物分子的所述生物活性是酶活性。
109、51.在第五十一实施方案中,本发明涉及根据实施方案47至50中任一项所述的结合部分,该结合部分对所述药物分子具有小于10nm、诸如小于10nm、小于1nm、小于100pm、小于10pm或小于1pm的结合亲和力(kd)。
110、52.在第五十二实施方案中,本发明涉及根据实施方案47至51中任一项所述的结合部分,其中所述结合部分与所述药物分子的解离速率(koff)介于约1×10-8s-1与约1×10-4s-1之间、介于约1×10-8s-1与约1×10-5s-1之间、介于约1×10-8s-1与约1×10-6s-1之间、介于约1×10-8s-1与约1×10-7s-1之间、介于约1×10-7s-1与约1×
111、10-4s-1之间、介于约1×10-7s-1与约1×10-5s-1之间、介于约1×10-7s-1与约1×10-6s-1之间、介于约1×10-6s-1与约1×10-4s-1或介于约1×10-6s-1与约1×10-5s-1之间。
112、53.在第五十三实施方案中,本发明涉及根据实施方案51或52所述的结合部分,其中所述解离常数(kd)或解离速率(koff)是在磷酸盐缓冲盐水(pbs)中测量。
113、54.在第五十四实施方案中,本发明涉及根据实施方案47至53中任一项所述的结合部分,其中所述结合部分在与所述药物分子复合时具有阻断半衰期(t1/2),并且其中所述阻断半衰期根据下式计算:
114、阻断
115、55.在第五十五实施方案中,本发明涉及根据实施方案54所述的结合部分,其中所述阻断半衰期(t1/2)为至少约2小时、至少约3小时、至少约4小时、至少约5小时、至少约6小时、至少约7小时、至少约8小时、至少约9小时、至少约10小时、至少约15小时、至少约20小时,诸如至少约20小时、至少约25小时、至少约30小时、至少约35小时、至少约40小时、至少约45小时、至少约50小时、至少约55小时或至少约60小时。
116、56.在第五十六实施方案中,本发明涉及根据实施方案47至55中任一项所述的结合部分,其中所述结合部分包含抗体、替代性支架或多肽。
117、57.在第五十七实施方案中,本发明涉及根据实施方案47至56中任一项所述的结合部分,其中所述结合部分包含免疫球蛋白分子或其片段。
118、58.在第五十八实施方案中,本发明涉及根据实施方案47至56中任一项所述的结合部分,其中所述结合部分包含非免疫球蛋白分子。
119、59.在第五十九实施方案中,本发明涉及根据实施方案47至58中任一项所述的结合部分,其中所述结合部分包含衍生自单克隆抗体、多克隆抗体、重组抗体、嵌合抗体、人抗体、人源化抗体、单结构域抗体、重链可变结构域(vh)、轻链可变结构域(vl)或可变结构域(vhh)的抗原结合结构域。
120、60.在第六十实施方案中,本发明涉及根据实施方案47至59中任一项所述的结合部分,其中所述结合部分包含抗原结合结构域,该抗原结合结构域衍生自以下或与以下相关:阿德耐汀、单抗体、亲和体、阿菲林、阿菲默、适体、阿非汀、α抗体、抗运载蛋白、重复蛋白结构域、犰狳重复结构域、阿去默、阿维默、锚蛋白重复结构域、非诺莫、打结素、库尼兹结构域或t细胞受体(tcr)。
121、60a.在实施方案60a中,本发明涉及根据实施方案47至59中任一项
122、所述的组合物,其中所述结合部分包含衍生自阿德耐汀或与其相关的抗原结合结构域。
123、60b.在实施方案60b中,本发明涉及根据实施方案47至59中任一项
124、所述的组合物,其中所述结合部分包含衍生自单抗体或与其相关的抗原结合结构域。
125、60c.在实施方案60c中,本发明涉及根据实施方案47至59中任一项
126、所述的组合物,其中所述结合部分包含衍生自亲和体或与其相关的抗原结合结构域。
127、60d.在实施方案60d中,本发明涉及根据实施方案47至59中任一项
128、所述的组合物,其中所述结合部分包含衍生自阿菲林或与其相关的抗原结合结构域。
129、60e.在实施方案60e中,本发明涉及根据实施方案47至59中任一项
130、所述的组合物,其中所述结合部分包含衍生自阿菲默或与其相关的抗原结合结构域。
131、60f.在实施方案60f中,本发明涉及根据实施方案47至59中任一项
132、所述的组合物,其中所述结合部分包含衍生自适体或与其相关的抗原结合结构域。
133、60g.在实施方案60g中,本发明涉及根据实施方案47至59中任一项
134、所述的组合物,其中所述结合部分包含衍生自阿非汀或与其相关的抗原结合结构域。
135、60h.在实施方案60h中,本发明涉及根据实施方案47至59中任一项
136、所述的组合物,其中所述结合部分包含衍生自α抗体或与其相关的抗原结合结构域。。
137、60i.在实施方案60i中,本发明涉及根据实施方案47至59中任一项
138、所述的组合物,其中所述结合部分包含衍生自重复蛋白结构域或与其相关的抗原结合结构域。
139、60j.在实施方案60j中,本发明涉及根据实施方案47至59中任一项
140、所述的组合物,其中所述结合部分包含衍生自犰狳重复结构域或与其相关的抗原结合结构域。
141、60k.在实施方案60k中,本发明涉及根据实施方案47至59中任一项所述的组合物,其中所述结合部分包含衍生自阿去默或与其相关的抗原结合结构域。
142、60l.在实施方案60l中,本发明涉及根据实施方案47至59中任一项所述的组合物,其中所述结合部分包含衍生自阿维默或与其相关的抗原结合结构域。
143、60m.在实施方案60m中,本发明涉及根据实施方案47至59中任一项所述的组合物,其中所述结合部分包含衍生自锚蛋白重复结构域或与其相关的抗原结合结构域。
144、60n.在实施方案60n中,本发明涉及根据实施方案47至59中任一项所述的组合物,其中所述结合部分包含衍生自非诺莫或与其相关的抗原结合结构域。
145、60o.在实施方案60o中,本发明涉及根据实施方案47至59中任一项所述的组合物,其中所述结合部分包含衍生自打结素或与其相关的抗原结合结构域。
146、60p.在实施方案60p中,本发明涉及根据实施方案47至59中任一项所述的组合物,其中所述结合部分包含衍生自库尼兹结构域或与其相关的抗原结合结构域。
147、60q.在实施方案60q中,本发明涉及根据实施方案47至59中任一项所述的组合物,其中所述结合部分包含衍生自t细胞受体(tcr)或与其相关的抗原结合结构域。
148、61.在第六十一实施方案中,本发明涉及根据实施方案47至60中任一项所述的结合部分,其中所述结合部分是经设计的锚蛋白重复结构域。
149、62.在第六十二实施方案中,本发明涉及根据实施方案61所述的结合部分,其中所述经设计的锚蛋白重复结构域包含锚蛋白重复模块,该锚蛋白重复模块包含选自由以下组成的组的氨基酸序列:(1)seq id no:30至51,以及(2)其中seq id no:30至51中的任一者中的至多9个氨基酸被另一氨基酸取代的序列。
150、63.在第六十三实施方案中,本发明涉及根据实施方案61或62中任一项所述的结合部分,其中所述经设计的锚蛋白重复结构域包含选自由以下组成的组的氨基酸序列:(1)seq id no:1至10,以及(2)与seq id no:1至10中任一者具有至少85%氨基酸序列同一性的序列。
151、64.在第六十四实施方案中,本发明涉及编码根据实施方案47至60中任一项所述的结合部分的核酸。
152、65.在第六十五实施方案中,本发明涉及编码实施方案61至63中任一项的经设计的锚蛋白重复结构域的核酸。
153、66.在第六十六实施方案中,本发明涉及包含根据实施方案64或65所述的核酸分子的宿主细胞。
154、67.在第六十七实施方案中,本发明涉及制备根据实施方案47至63中任一项所述的结合部分的方法,该方法包括在其中表达所述结合部分的条件下培养根据实施方案66所述的宿主细胞。
155、68.在第六十八实施方案中,本发明涉及根据实施方案67所述的方法,其中所述宿主细胞是原核宿主细胞。
156、69.在第六十九实施方案中,本发明涉及根据实施方案67所述的方法,其中所述宿主细胞是真核宿主细胞。
- 还没有人留言评论。精彩留言会获得点赞!