一种含有嘧啶二酮酰基多取代哌嗪类衍生物及其制备方法与应用
1.本发明属于有机化合物合成与医药应用技术领域,具体涉及一种含有嘧啶二酮酰基多 取代哌嗪类衍生物及其制备方法与应用。
背景技术:
2.目前,由急性呼吸道综合征冠状病毒2(severe acute respiratory syndrome coronavirus2,sars-cov-2)引起的新型冠状病毒肺炎(covid-19)仍在全球范围内大规模爆发,严 重威胁人类生命健康。与以往的冠状病毒相比,sars-cov-2传播性更强、潜伏期更长、无 症状感染者更多。尽管已成功研发出疫苗,但目前仍需要更多确切有效的上市药物来治疗 新冠肺炎。
3.sars-cov-2为单股正链rna,其复制周期包括吸附、融合、转录和翻译、表达、组 装和释放等环节,而sars-cov-2的主蛋白酶(main protease,m
pro
)是一种以半胱氨酸为 活性中心的蛋白酶,在病毒的生命周期中起关键作用,同时m
pro
为冠状病毒相似性极高的 共有蛋白酶,且其催化活性位点相对保守;与此同时,人体内没有m
pro
的同源蛋白酶,降 低了该靶点抑制剂的毒性与副作用,这使得m
pro
成为一个理想的抗sars-cov-2药物靶标。 m
pro
的活性中心由s1'、s1、s2和s4四个空腔组成,各空腔周围氨基酸残基情况如图1所 示。s1'位点由his41和cys145组成,是m
pro
的催化位点。
4.目前现有的主蛋白酶抑制剂大多数为拟肽类共价抑制剂,但也能抑制人体半胱氨酸组 织蛋白酶l和b,因此存在选择性较差的问题。此外,目前报道的非共价抑制剂虽然毒性 低,但是大多活性较弱,处在临床研究的非共价主蛋白酶抑制剂寥寥无几。因此有必要以 在冠状病毒生命周期起关键作用的主蛋白酶为靶点研发高活性、低毒性的非共价抑制剂。
5.文献报道新骨架类型的嘧啶二酮类化合物7(mcule-5948770040)对sars-cov-2主蛋 白酶有抑制活性(ic
50
=4.2μm),共晶结构(pdb id:7ltj)显示7属于非共价主蛋白酶 抑制剂,结合模式分析为进一步结构优化以提高活性提供了重要启发。
6.
技术实现要素:
7.针对现有技术的不足,本发明提供了一种含有嘧啶二酮酰基多取代哌嗪类衍生物及其 制备方法,本发明还提供上述化合物作为sars-cov-2m
pro
抑制剂的活性筛选结果及其应 用。
8.本发明的技术方案如下:
9.1.含有嘧啶二酮酰基多取代哌嗪类衍生物
10.含有嘧啶二酮酰基多取代哌嗪类衍生物,或其药学上可接受的盐、酯或前药,具有通 式i所示的结构:
[0011][0012]
其中,
[0013]
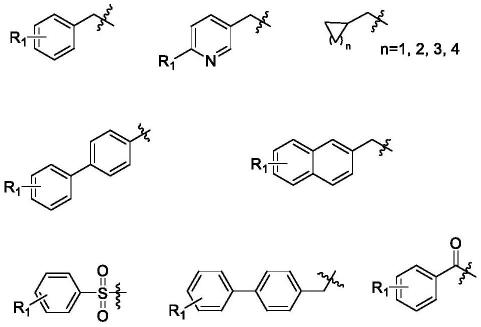
r为:取代苄基、取代联苯基、甲基萘、取代芳杂环甲基、环烷基甲基、取代苯磺酰 基;所述的取代基选自甲基、氟、氯、硝基、氰基、三氟甲基;
[0014]
x为:氧原子、硫原子;
[0015]
化合物构型为消旋体、r或s构型。
[0016]
根据本发明优选的,r为下列取代基的任意一种:
[0017][0018]
其中,r1为h、cl、f、br、f3c、cn、no2、硼酸酯;
[0019]
根据本发明进一步优选的,r为下列取代基的任意一种:
[0020][0021]
根据本发明更进一步优选的,含有嘧啶二酮酰基多取代哌嗪类衍生物是下列化合物之 一:
[0022]
表1.目标化合物嘧啶二酮酰基多取代哌嗪类衍生物的结构
[0023]
[0024]
[0025][0026]
本发明中所述的“药学上可接受的盐”是指在可靠的医药评价范围内,化合物的盐类 适于与人或较低等动物的组织相接触而无不适当的毒性、刺激及过敏反应等,具有相当合 理的收益与风险比例,通常是水或油可溶的或可分散的,并可有效地用于其预期的用途。 包括药学上可接受的酸加成盐和药学上可接受的碱加成盐,在这里是可做预期的用途并与 式i、ii化合物的化学性质相容的。适宜的盐的列表参见s.m.birge等,j.pharm.sci.,1977, 66,1-19页。
[0027]
本发明中所述的“前药”是指药学上可接受的衍生物,以便这些衍生物所得的生物转 换产物是如式i化合物所定义的活性药物。
[0028]
2.含有嘧啶二酮酰基多取代哌嗪类衍生物的制备方法
[0029]
含有嘧啶二酮酰基多取代哌嗪类衍生物的制备方法,步骤如下:以3,4-二氯苯硼酸(1) 和1-(叔丁基)2-甲基哌嗪-1,2-二甲酸酯(2)为起始原料,二氯甲烷作为反应溶剂,在醋 酸铜催化下通过耦联反应得中间体3;然后将中间体3溶解在适量的二氯甲烷中,经三氟 乙酸脱保护得中间体4;随后中间体4在缩合剂hatu的作用下与乳清酸缩合得到关键中 间体5;中间体5再经氢氧化锂水解甲酯得到中间体6,然后中间6再在hatu的作用下 与各类胺在二氯甲烷中进行酰胺缩合得到目标产物。
[0030]
合成路线如下:
[0031][0032]
试剂及条件:(i)hatu,n,n-二异丙基乙胺,二氯甲烷,室温;(ii)氢氧化锂,甲醇,四氢 呋喃,水,室温;(iii)呋喃甲胺或噻吩甲胺,hatu,二异丙基乙胺,二氯甲烷,室温; (iv)三氟乙酸,二氯甲烷,室温;(v)碳酸钾,各类溴代试剂,甲醇,室温;(vi)各类 硼酸试剂,醋酸酮,氧气,吡啶,二氯甲烷,室温。
[0033]
其中,r2如上述r中的溴代烃所述结构,r3为联苯硼酸或3,4-二氯联苯硼酸;化合 物2为消旋体或者单一构型;x为氧原子或硫原子;
[0034]
本发明所述的室温为20-30℃。
[0035]
根据本发明优选的,含有嘧啶二酮酰基多取代哌嗪类衍生物的制备方法,具体步骤如 下:
[0036]
(1)将乳清酸(1)与2-(7-氮杂苯并三氮唑)-n,n,n',n'-四甲基脲六氟磷酸酯(hatu) 加入到二氯甲烷中,活化20min后加入n,n-二异丙基乙胺和1-(叔丁基)2-甲基哌嗪-1,2
‑ꢀ
二甲酸酯(2),转至室温反应20小时,溶液变为棕黑色,tlc检测反应;有机相经饱和 氯化钠溶液洗涤,分出有机相,依次经无水硫酸钠干燥、过滤、减压浓缩,所得粗品经硅胶 柱层析ea/pe=1:30,v/v,分离纯化得中间体3,为淡黄色泡沫状固体;
[0037]
(2)中间体3溶于甲醇与四氢呋喃混合液中,冰浴下滴加氢氧化锂的水溶液,室温反 应,搅拌10h后减压浓缩部分有机溶剂;在冰浴下向剩余的水溶液中滴加1m稀盐酸溶液, 将ph调至2-3,有大量乳白色固体析出;过滤、洗涤、干燥得中间体4,为白色粉末状固 体;
[0038]
(3)冰浴下,将中间体4与2-(7-氮杂苯并三氮唑)-n,n,n',n'-四甲基脲六氟磷酸酯 (hatu)加入到二氯甲烷中,活化20min后,加入二异丙基乙胺和呋喃甲胺或者噻吩甲 胺,室温反应20小时,溶液变为深黄色,tlc监测反应完全,加水和1m hcl酸化至ph 至3-4,分液,水相再用二氯甲烷萃取1遍,合并有机相,然后依次经饱和碳酸氢钠、饱和 氯化钠溶液洗涤、无水硫酸钠干燥;抽滤,减压浓缩得中间体5,所得浅黄色油状物经柱层 析纯化得白色固体中间体5;
[0039]
(4)在冰水浴下将中间体5溶于二氯甲烷中,逐滴加入三氟乙酸与二氯甲烷的混合溶 液。滴加结束后,转至室温反应;约6h后反应液减压浓缩,得到浅棕色油状物;加入乙酸 乙酯后,析出大量白色固体;过滤,固体用乙酸乙酯洗涤,干燥;得目标产物中间体6的 三氟乙酸盐;
[0040]
(5)将中间体6的三氟乙酸盐与碳酸钾加入到甲醇中,搅拌10min后加入各类溴代 试剂室温反应12h,tlc监测;反应完全后向反应体系中加水和1m稀盐酸调至ph为2
‑ꢀ
3,分液得有机相,然后经饱和氯化钠水溶液洗涤、无水硫酸钠干燥、减压浓缩,硅胶柱色 谱分离,得gf系列终产物(gf-1至gf-7和gf-10至gf-17);
[0041]
(6)将中间体6与联苯硼酸或3,4-二氯联苯硼酸加入二氯甲烷,在溶液中一次性加入 无水醋酸铜与2当量吡啶;混悬均匀后在氧气气氛下反应20h,tlc检测反应;后处理: 在体系中加水淬灭反应,搅拌后分液,以蒸馏水反复洗涤有机相至无蓝色;有机相经饱和 氯化钠溶液洗涤,分出有机相,依次经无水硫酸钠干燥、过滤、减压浓缩,所得粗品经硅胶 柱层析分离纯化得gf-8或gf-9。
[0042]
3.含嘧啶二酮酰基多取代哌嗪类衍生物的靶标活性及应用
[0043]
本发明公开了含嘧啶二酮酰基多取代哌嗪类抑制主蛋白酶的活性筛选结果及其作为主 蛋白酶抑制剂的首次应用。通过实验证明本发明的含嘧啶二酮酰基多取代哌嗪类衍生物可 作为主蛋白酶抑制剂用于制备抗冠状病毒药物。本发明还提供上述化合物在制备抗冠状病 毒药物中的应用。
[0044]
目标化合物的抗sars-cov-2主蛋白酶活性实验
[0045]
对按照上述方法合成的一类含嘧啶二酮酰基多取代哌嗪类衍生物进行了sars-cov-2 主蛋白酶抑制活性测试,活性数据列于表2中,以文献报道的主蛋白酶抑制剂化合物7。
[0046]
本发明新合成的含嘧啶二酮酰基多取代哌嗪类衍生物部分呈现出显著的主蛋白酶抑制 活性。例如,化合物gf-3、gf-3s、gf-13s,其中gf-13s的活性尤为突出(ic
50
=0.35
±ꢀ
0.10μm),其抑制主蛋白酶的活性较先导化合物提高了近20倍;因此,含嘧啶二酮酰基 多取代哌嗪类衍生物具有进一步研发的价值,可作为抗sars-cov-2的先导化合物加以利 用。
[0047]
本发明的一类含有嘧啶二酮酰基多取代哌嗪类衍生物可作为sars-cov-2主蛋白酶抑 制剂应用,具体地说,作为sars-cov-2抑制剂用于制备抗新冠病毒药物。
[0048]
一种抗sars-cov-2药物组合物,包括本发明的一类含嘧啶二酮酰基多取代哌嗪类衍 生物和一种或多种药学上可接受载体或赋形剂。
[0049]
本发明提供了结构全新的含嘧啶二酮酰基多取代哌嗪类sars-cov-2主蛋白酶抑制剂 及其制备方法,本发明还提供了化合物抗sars-cov-2主蛋白酶活性筛选结果及其在抗病 毒领域中的首次应用。经过试验证明,本发明的含嘧啶二酮酰基多取代哌嗪类衍生物可作 为sars-cov-2主蛋白酶抑制剂应用。具体地说,本发明通过结构优化发现了活性更高的 结构新颖的主蛋白酶抑制剂,可作为sars-cov-2主蛋白酶抑制剂用于制备抗新冠药物。
附图说明
[0050]
图1是m
pro
的活性位点
[0051]
图2是以sars-cov-2m
pro
为靶点的药物筛选原理图。
具体实施方式
[0052]
通过下述实施例有助于理解本发明,但是不能限制本发明的内容,所述百分比数均为 质量百分比。
[0053]
实施例1:关键中间体4-(2,6-二氧基-1,2,3,6-四氢嘧啶-4-羰基)-n-(呋喃-2-基甲基)哌 嗪-2-甲酰胺(6)的制备
[0054]
(1)将乳清酸(3.52g,22.55mmol,1.1eq.)与2-(7-氮杂苯并三氮唑)-n,n,n',n'-四甲基脲 六氟磷酸酯(hatu,11.67g,30.7mmol,1.5eq.)加入到100ml二氯甲烷中,活化20 min后加入二异丙基乙胺(dipea,7.9g,61.4mmol,3.0eq.)和1-(叔丁基)-2-甲基哌 嗪-1,2-二甲酸酯(2,5.0g,20.5mmol,1.0eq.),转至室温反应20小时,溶液变为棕黑色, tlc检测反应。有机相经饱和氯化钠溶液洗涤,分出有机相,依次经无水硫酸钠干燥、过 滤、减压浓缩,所得粗品经硅胶柱层析ea/pe=1:30,v/v,分离纯化得色油状液体中间体3 约5.2g,收率为67.3%;1h nmr(400mhz,dmso-d6)δ11.23(d,j=20.4hz,2h),5.50(s, 1h),4.87
–
4.53(m,1h),4.15(dd,j=51.1,10.1hz,1h),3.93
–
3.73(m,1h),3.67(s,3h),3.14 (d,j=7.8hz,1h),3.07
–
2.66(m,2h),1.41(d,j=17.7hz,9h).esi-ms:m/z 383.2[m+h]
+
. c
16h22
n4o7(382.1).
[0055]
(2)中间体3(5.0g,12.9mmol,1.0eq.)溶于甲醇与四氢呋喃混合液中,冰浴下滴加氢 氧化锂(2.17g,90.3mmol,7.0eq.)的水溶液,室温反应,搅拌10h后减压浓缩部分有机 溶剂。在冰浴下向剩余的水溶液中滴加1m稀盐酸溶液,将ph调至2-3,有大量白色固体 析出。过滤、洗涤、干燥得白色粉末状固体中间体4约4.2g,收率88.4%;1h nmr(400 mhz,dmso-d6)δ13.15(s,1h),11.28(s,2h),5.47(s,1h),4.60(d,j=23.5hz,1h),4.25
–
4.06 (m,1h),3.85
–
3.71(m,1h),3.33(s,2h),3.16(d,j=9.4hz,2h),1.40(d,j=14.0hz,9h)
.esi
‑ꢀ
ms:m/z 367.1[m-h]-.c
15h20
n4o7(368.1).熔点246-248℃。
[0056]
(3)冰浴下,将中间体4(4.0g,10.87mmol,1.0eq.)与2-(7-氮杂苯并三氮唑)
‑ꢀ
n,n,n',n'-四甲基脲六氟磷酸酯(hatu,6.2g,16.3mmol,1.5eq.)加入到二氯甲烷中,活 化20min后加入二异丙基乙胺(dipea,4.2g,32.61mmol,3.0eq.)和呋喃甲胺(1.26g, 13.04mmol,1.2eq.)或者噻吩甲胺(1.47g,13.04mmol,1.2eq.),转至室温反应20小 时,溶液变为深黄色,tlc监测;反应完全后,后处理加水和1m hcl酸化至ph至3-4, 分液,水相再用二氯甲烷萃取一遍,合并有机相,然后依次经饱和碳酸氢钠、饱和氯化钠 水溶液洗涤、无水硫酸钠干燥。抽滤,减压浓缩得中间体5,所得浅黄色油状物经柱层析纯 化得中间体5,3.6g,收率74%。esi-ms:m/z 448.1[m+h]
+
.c
20h25
n5o7(447.18).
[0057]
(4)在冰水浴下将中间体5(3.6g,8.05mmol,1.0eq.)溶于100ml二氯甲烷中,逐滴 加入5ml三氟乙酸与25ml二氯甲烷的混合溶液。加毕,转至室温反应。6-8h后tlc检 测反应完,减压浓缩反应液,得到紫红色油状物。加入50ml乙酸乙酯后,析出大量白色 固体。过滤,固体用30ml乙酸乙酯洗涤2次,真空干燥。得目标产物中间体6的三氟乙 酸盐3.0g,收率83.3%。1h nmr(400mhz,dmso-d6)δ11.25(s,2h),9.77
–
9.03(m,3h), 7.50(s,1h),6.37(d,j=40.9hz,2h),5.62(s,1h),4.59(dd,j=81.7,12.4hz,1h),4.35(s,1h), 4.23(d,j=15.7hz,1h),4.09(s,1h),3.93(t,j=15.7hz,1h),3.57(s,1h),3.39(d,j=11.5hz, 1h),3.26(s,1h),3.11
–
2.94(m,1h).esi-ms:m/z 348.1[m+h]
+
.c
15h17
n5o5(347.12).
[0058]
实施例2.目标产物gf-1至gf-17的合成
[0059]
(5)将关键中间体6的三氟乙酸盐(0.1g,0.22mmol,1.0eq.)与碳酸钾(0.092g, 0.66mmol,3.0eq.)加入到5ml甲醇中,搅拌10min后加入各类溴代试剂,室温反应12 h,tlc监测;反应完全后过滤反应液并减压浓缩,以硅胶柱色谱分离,得目标产物gf-1 至gf-7及gf-10至gf-15;
[0060][0061]
产物为白色固体,收率:50%,熔点169-171℃。
[0062]1h nmr(600mhz,dmso-d6)δ11.39
–
10.93(m,2h),8.55(dt,j=54.1,5.8hz,1h),7.53(d, j=9.1hz,1h),7.50
–
7.42(m,1h),7.39(d,j=9.9hz,1h),7.27(dd,j=8.2,2.1hz,1h),6.37 (d,j=8.8hz,1h),6.22(dd,j=16.7,3.3hz,1h),5.51(s,1h),4.40
–
4.18(m,2h),3.77
–
3.50 (m,4h),3.45(d,j=13.8hz,1h),3.31
–
3.25(m,1h),3.20
–
3.02(m,1h),2.99
–
2.79(m,1h), 2.24(dd,j=25.5,10.5hz,1h).
13
c nmr(150mhz,dmso-d6)δ171.13,163.90,161.92,160.27, 152.38,151.59,147.71,143.52,132.57,129.61,125.82,116.34,116.16,111.33,106.86,98.70, 63.98,50.95,47.95,46.22,43.93,35.90.esi-ms:m/z 490.2[m+h]
+
.c
22h21
clfn5o5(489.12).
[0063][0064]
操作步骤同gf-1,所不同的是使用3-氟-4-氯溴苄。产物为白色固体,收率:55%,熔 点161-163℃。1h nmr(600mhz,dmso-d6)δ11.17(d,j=15.4hz,2h),8.61(dt,j=45.5, 5.8hz,1h),7.52(t,j=8.1hz,2h),7.41(t,j=10.1hz,1h),7.18(t,j=9.2hz,1h),6.36(d,j =9.0hz,1h),6.21(dd,j=16.3,3.2hz,1h),5.51(d,j=8.4hz,1h),4.31(dddd,j=43.8,20.8, 15.6,5.8hz,2h),3.79
–
3.61(m,2h),3.55(dd,j=13.4,7.3hz,1h),3.39(d,j=32.1hz,1h), 3.27(dd,j=32.2,13.6hz,2h),3.08(ddd,j=57.9,8.2,3.7hz,1h),2.84(dd,j=70.0,11.4hz, 1h),2.29
–
2.15(m,1h).
13
c nmr(150mhz,dmso-d6)δ170.70,163.25,161.31,157.23, 153.39,151.56,149.00,142.51,131.14,130.13,125.55,118.51,117.54,111.35,107.18,101.33, 63.12,57.61,48.79,46.22,44.36,35.89.esi-ms:m/z 490.1[m+h]
+
.c
22h21
clfn5o5(489.12).
[0065][0066]
操作步骤同gf-1,所不同的是使用2,4-二氯溴苄。产物为白色固体,收率:63%,熔点 176-177℃。1h nmr(600mhz,dmso-d6)δ11.30
–
11.15(m,2h),8.55(dt,j=68.4,5.8hz, 1h),7.63
–
7.56(m,2h),7.51(d,j=5.1hz,1h),7.42(dd,j=8.3,2.2hz,1h),6.40
–
6.30(m, 1h),6.19(dd,j=13.0,3.2hz,1h),5.52(d,j=2.9hz,1h),4.39
–
4.15(m,2h),3.98
–
3.70(m, 1h),3.69
–
3.52(m,3h),3.51(s,1h),3.50
–
3.38(m,1h),3.28
–
3.12(m,1h),3.03
–
2.81(m, 1h),2.30(dt,j=32.5,8.1hz,1h).
13
c nmr(150mhz,dmso-d6)δ170.15,164.26,161.35, 152.46,151.54,147.47,142.58,135.14,134.48,132.85,129.10,127.77,110.89,107.30,99.12, 98.74,63.16,55.04,49.04,46.23,43.87,35.88.esi-ms:m/z 528.1[m+na]
+
.c
22h21
cl2n5o
5 (505.09).
[0067][0068]
操作步骤同gf-1,所不同的是使用2-硝基-4-氯溴苄。产物为白色固体,收率:
53%, 熔点186-188℃。1h nmr(600mhz,dmso-d6)δ11.19(s,1h),10.73(s,1h),8.75(dt,j= 63.4,5.5hz,1h),8.17(d,j=2.0hz,2h),7.93(d,j=8.2hz,1h),7.49(d,j=15.7hz,1h), 6.35(d,j=16.2hz,1h),6.22(s,1h),5.52(d,j=10.2hz,1h),4.39
–
4.20(m,2h),3.95(dd,j =149.5,13.2hz,1h),3.76
–
3.65(m,1h),3.58(d,j=6.6hz,1h),3.46(d,j=14.2hz,1h), 3.32
–
3.26(m,2h),3.20(d,j=7.5hz,1h),2.79(d,j=12.2hz,1h),2.26(q,j=12.1,10.0hz, 1h).
13
c nmr(150mhz,dmso-d6)δ164.24,160.53,152.37,151.52,149.03,147.47,143.30, 142.50,135.36,134.36,130.12,122.17,110.90,107.27,99.09,98.72,64.27,49.77,46.21,43.83, 35.91,27.02.esi-ms:m/z 517.1[m+h]
+
.c
22h21
cln6o7(516.12).
[0069][0070]
操作步骤同gf-1,所不同的是使用2-氯-5-溴甲基吡啶。产物为白色固体,收率:59%, 熔点202-204℃。1h nmr(600mhz,dmso-d6)δ11.24(s,1h),11.18(d,j=14.6hz,1h), 8.64(dt,j=51.5,5.8hz,1h),8.34(d,j=9.1hz,1h),7.81(t,j=8.3hz,1h),7.52(d,j=10.2 hz,1h),7.48(d,j=8.2hz,1h),6.37(d,j=9.4hz,1h),6.22(dd,j=16.9,3.2hz,1h),5.52 (d,j=7.2hz,1h),4.31(dddd,j=46.1,20.9,15.6,5.8hz,2h),3.78
–
3.61(m,2h),3.54(dd,j =13.4,7.9hz,1h),3.45(d,j=13.9hz,1h),3.25(dd,j=27.6,13.5hz,2h),3.08(ddd,j=61.8, 8.1,3.7hz,1h),2.96
–
2.75(m,1h),2.30
–
2.15(m,1h).
13
c nmr(150mhz,dmso-d6)δ 170.14,164.26,161.32,152.44,151.57,150.60,149.63,147.70,142.55,140.78,133.40,124.38, 110.94,107.29,98.70,64.17,63.73,55.10,48.04,43.86,35.90.esi-ms:m/z 473.1[m+h]
+
. c
21h21
cln6o5(472.13).
[0071][0072]
操作步骤同gf-1,所不同的是使用β-溴甲基萘。产物为白色固体,收率:61%,熔点 230-232℃。1h nmr(600mhz,dmso-d6)δ11.25(s,1h),11.19(d,j=25.0hz,1h),8.63(dt, j=49.3,5.9hz,1h),7.91
–
7.82(m,3h),7.77(d,j=9.4hz,1h),7.52(dd,j=24.0,8.1hz, 4h),6.37(d,j=10.3hz,1h),6.25(dd,j=21.0,3.2hz,1h),5.52(d,j=10.5hz,1h),4.43
–ꢀ
4.26(m,2h),3.90(t,j=12.0hz,1h),3.78
–
3.63(m,1h),3.58
–
3.38(m,2h),3.33
–
3.21(m, 2h),3.11(ddd,j=50.7,8.2,3.7hz,1h),3.00
–
2.80(m,1h),2.24(dt,j=35.0,9.0hz,1h).
13cꢀꢀ
nmr(150mhz,dmso-d6)δ170.32,164.24,161.28,152.68,151.53,147.66,142.57,135.79, 133.31,132.89,128.21,128.05,127.97,127.79,126.54,126.24,110.94,
107.24,99.08,98.72, 64.43,58.79,49.63,46.29,44.32,35.92.esi-ms:m/z 488.2[m+h]
+
.c
26h25
n5o5(487.19).
[0073][0074]
操作步骤同gf-1,所不同的是使用4-三氟甲基溴苄。产物为白色固体,收率:67%, 熔点210-216℃。1h nmr(600mhz,dmso-d6)δ11.18(s,1h),11.12(d,j=17.3hz,1h), 8.55(dt,j=48.6,5.8hz,1h),7.61(d,j=7.8hz,2h),7.52
–
7.43(m,3h),6.29(d,j=9.5hz, 1h),6.14(dd,j=16.4,3.2hz,1h),5.45(d,j=7.4hz,1h),4.30
–
4.14(m,2h),3.73(t,j=14.7 hz,1h),3.68
–
3.54(m,1h),3.54
–
3.38(m,2h),3.26
–
3.17(m,2h),3.03(ddd,j=54.1,8.1, 3.7hz,1h),2.78(dd,j=72.9,12.9hz,1h),2.15(dt,j=18.8,8.6hz,1h).
13
c nmr(150mhz, dmso-d6)δ170.18,164.24,161.28,152.57,151.54,147.67,143.33,142.55,130.09,128.43, 125.49,123.92,110.92,107.20,99.08,64.22,58.02,46.26,43.93,41.04,35.89.esi-ms:m/z 528.2 [m+na]
+
.c
23h22
f3n5o5(505.16).
[0075][0076]
操作步骤同gf-1,所不同的是使用溴甲基环己烷。产物为白色固体,收率:58%,熔 点144-146℃。1h nmr(600mhz,dmso-d6)δ11.56
–
11.10(m,1h),8.48
–
8.31(m,1h), 7.61
–
7.51(m,1h),6.43
–
6.34(m,1h),6.23(ddd,j=23.4,7.8,3.2hz,1h),5.73
–
5.56(m, 1h),4.39
–
4.22(m,2h),3.99
–
3.79(m,1h),3.68
–
3.42(m,3h),3.39(s,1h),3.30
–
3.13(m, 2h),3.04(ddd,j=66.7,12.9,9.4hz,1h),2.95
–
2.66(m,2h),1.60(dd,j=32.9,6.0hz,7h), 1.11(s,4h).
13
c nmr(150mhz,dmso-d6)δ170.37,163.04,161.01,152.60,151.80,142.55, 130.13,110.91,107.17,100.19,57.63,50.40,47.65,43.49,37.17,35.93,30.43,29.54,26.25,25.76. esi-ms:m/z 444.2[m+h]
+
.c
22h29
n5o5(443.22).
[0077]
[0078]
操作步骤同gf-1,所不同的是使用溴甲基环戊烷。产物为白色固体,收率:60%,熔 点138-140℃。1h nmr(600mhz,dmso-d6)δ11.44(d,j=26.7hz,1h),11.12(s,1h),8.47
ꢀ–
8.22(m,1h),7.61
–
7.49(m,1h),6.38(dp,j=8.8,2.1hz,1h),6.22(ddd,j=20.4,8.8,3.2 hz,1h),5.71
–
5.45(m,1h),4.36
–
4.19(m,2h),3.74
–
3.48(m,2h),3.23
–
2.79(m,3h),2.23
ꢀ–
1.94(m,2h),1.74
–
1.38(m,7h),1.23(s,4h).
13
c nmr(150mhz,dmso-d6)δ170.71,162.39, 160.26,152.68,151.70,142.03,130.13,110.91,107.30,100.09,56.91,49.20,47.65,44.27,43.45, 35.92,30.66,30.30,29.77,25.11,24.73.esi-ms:m/z 430.2[m+h]
+
.c
21h27
n5o5(429.20).
[0079][0080]
操作步骤同gf-1,所不同的是使用4-苯基溴苄。产物为白色固体,收率:66%,熔点 208-210℃。1h nmr(600mhz,dmso-d6)δ11.21(t,j=23.3hz,2h),8.60(dd,j=43.2,5.9 hz,1h),7.66(d,j=7.2hz,2h),7.61(d,j=7.7hz,2h),7.55(d,j=11.0hz,1h),7.49
–
7.44 (m,2h),7.43
–
7.34(m,3h),6.38(d,j=11.9hz,1h),6.24(d,j=13.6hz,1h),5.52(d,j=8.6 hz,1h),4.43
–
4.24(m,2h),4.10
–
3.72(m,2h),3.67
–
3.39(m,2h),3.31
–
3.21(m,2h),3.08 (ddd,j=55.2,8.2,3.7hz,1h),2.89(ddd,j=68.2,8.0,4.4hz,1h),2.22(dt,j=29.2,9.1hz, 1h).
13
c nmr(150mhz,dmso-d6)δ169.22,164.24,161.26,152.66,151.53,148.07,142.05, 140.44,138.99,138.01,130.18,130.07,129.40,127.83,127.08,110.94,107.20,99.07,64.49, 58.55,49.60,48.19,46.29,35.92.esi-ms:m/z 512.2[m-h]-.c
28h27
n5o5(513.20).
[0081][0082]
操作步骤同gf-1,所不同的是使用4-(2-氰基苯基)溴苄。产物为白色固体,收率:55%, 熔点222-224℃。1h nmr(600mhz,dmso-d6)δ11.18(d,j=22.3hz,2h),8.64(dt,j=43.3, 5.8hz,1h),7.95(d,j=7.9hz,1h),7.79(t,j=7.7hz,1h),7.63(d,j=7.8hz,1h),7.58(t,j =7.6hz,1h),7.56
–
7.51(m,3h),7.49(t,j=8.9hz,2h),6.37(dt,j=10.2,2.4hz,1h),6.23 (dd,j=16.6,3.2hz,1h),5.53(d,j=14.6hz,1h),4.43
–
4.23(m,2h),4.12
–
3.76(m,2h), 3.67(d,j=13.4hz,1h),3.62
–
3.53(m,1h),3.45(d,j=13.4hz,1h),
3.31
–
3.22(m,2h),3.12 (ddd,j=58.6,8.2,3.7hz,1h),2.96(d,j=13.0hz,1h),2.84(d,j=12.1hz,1h),2.30
–
2.16 (m,1h).
13
c nmr(150mhz,dmso-d6)δ169.69,166.64,161.69,151.56,144.78,142.55,137.15, 134.39,134.02,130.58,129.80,129.68,129.03,128.63,119.10,111.86,109.95,107.26,101.27, 64.11,57.72,48.63,46.26,44.33,34.73.esi-ms:m/z 539.1[m+h]
+
.c
29h26
n6o5(538.20).
[0083][0084]
操作步骤同gf-1,所不同的是使用4-溴甲基-2-氯苯硼酸频那醇酯。产物为白色固体, 收率:65%,熔点156-158℃。1h nmr(600mhz,dmso-d6)δ11.31
–
11.10(m,2h),8.81 (dt,j=47.4,5.9hz,1h),7.57(dd,j=7.7,3.6hz,1h),7.41(s,1h),7.37
–
7.32(m,1h),7.26 (dd,j=10.7,8.0hz,1h),7.01
–
6.90(m,2h),5.52(d,j=12.5hz,1h),4.56
–
4.40(m,2h), 3.93(s,1h),3.78
–
3.63(m,2h),3.59
–
3.50(m,1h),3.27
–
3.13(m,2h),3.03(ddd,j=56.0, 8.4,3.5hz,1h),2.88
–
2.82(m,1h),2.76
–
2.71(m,1h),2.23
–
2.10(m,1h),1.30(s,6h),1.07 (s,6h).
13
c nmr(150mhz,dmso-d6)δ170.12,164.24,162.03,151.55,146.88,143.46,142.81, 138.90,136.73,130.91,127.99,127.13,125.86,125.48,98.24,84.37,74.01,65.12,58.64,49.78, 44.50,38.47,25.42,25.03.esi-ms:m/z 614.1[m+h]
+
.c
28h33
bcln5o6s(613.19).
[0085][0086]
将关键中间体6的三氟乙酸盐(0.1g,0.22mmol,1.0eq.)与碳酸钾(0.092g,0.66 mmol,3.0eq.)加入到8ml二氯甲烷中,搅拌10min后逐滴加入2,4-二氯苯甲酰氯(0.069 mg,0.33mmol,1.5eq.),室温反应2h,tlc监测;反应完全后向反应体系中加水和1m 稀盐酸调至ph为4-5,分液得有机相,然后经饱和氯化钠水溶液洗涤、无水硫酸钠干燥、 减压浓缩,硅胶柱色谱分离,得目标产物gf-16;
[0087]
产物为白色固体,收率:62%,熔点215-218℃。1h nmr(600mhz,dmso-d6)δ11.21(t, j=19.4hz,2h),8.74(q,j=37.1,33.4hz,1h),7.78(s,1h),7.60
–
7.25(m,3h),6.96(d,j= 5.0hz,2h),5.41(d,j=63.9hz,1h),5.09(t,j=27.9hz,1h),4.73
–
4.52(m,1h),4.32(d,j= 15.5hz,1h),4.14(dd,j=32.6,13.4hz,1h),3.67
–
3.45(m,2h),3.22(p,j=13.4,12.6hz, 1h),3.10(q,j=7.3hz,1h).
13
c nmr(150mhz,dmso-d6)δ166.78,164.16,161.89,
151.52, 147.38,141.46,135.14,134.47,130.74,130.12,129.70,128.47,127.21,127.11,126.12,125.04, 99.53,55.35,53.74,42.06,38.05.esi-ms:m/z 536.05[m+h]
+
.c
22h19
cl2n5o5s(535.05).
[0088][0089]
将关键中间体6的三氟乙酸盐(0.1g,0.22mmol,1.0eq.)与碳酸钾(0.092g,0.66 mmol,3.0eq.)加入到10ml二氯甲烷中,搅拌10min后逐滴加入对氯苯磺酰氯(0.071 mg,0.33mmol,1.5eq.)的二氯甲烷溶液,室温反应10h,tlc监测;反应完全后向反应 体系中加水和1m稀盐酸调至ph为4-5,分液得有机相,然后经饱和氯化钠水溶液洗涤、 无水硫酸钠干燥、减压浓缩,硅胶柱色谱分离,得目标产物gf-17;
[0090]
产物为白色固体,收率:72%,熔点236-238℃。
[0091]1h nmr(600mhz,dmso-d6)δ11.18(m,2h),8.68(dt,1h),7.76(dd,j=22.7,8.2hz,2h), 7.61(d,j=7.8hz,2h),7.41(d,j=5.1hz,1h),7.01
–
6.86(m,2h),5.31(s,1h),4.58
–
4.40 (m,2h),4.21(d,j=12.3hz,1h),4.14
–
3.99(m,1h),3.83
–
3.70(m,1h),3.63(s,1h),3.04(d, j=12.5hz,1h),2.72(t,j=11.9hz,1h).
13
c nmr(150mhz,dmso-d6)δ179.65,165.10, 155.17,151.33,150.11,145.18,138.65,129.87,129.42,127.77,123.91,120.50,119.15,101.76, 65.01,51.46,48.78,47.52,44.66.esi-ms:m/z 538.05[m+h]
+
.c
21h20
cln5o6s2(537.05).
[0092]
实施例3.目标产物gf-3s的合成
[0093]
gf-3s和gf-13s合成路线如下:
[0094][0095]
试剂及条件:(i)hatu,二异丙基乙胺,二氯甲烷,室温;(ii)氢氧化锂,甲醇/四氢呋喃/ 水,室温;(iii)呋喃甲胺或噻吩甲胺,hatu,二异丙基乙胺,二氯甲烷,室温;(iv) 三氟乙酸,二氯甲烷,室温;(v)碳酸钾,3,4-二氯溴苄,甲醇,室温。
[0096][0097]
操作步骤同gf-3,产物为白色固体,收率:62%,熔点186-188℃。
[0098]1h nmr(600mhz,dmso-d6)δ11.31
–
11.14(m,2h),8.56(d,j=69.2hz,1h),7.66
–
7.54 (m,2h),7.51(d,j=6.7hz,1h),7.42(d,j=10.5hz,1h),6.36(s,1h),6.19(d,j=12.7hz,1h), 5.52(s,1h),4.38
–
4.17(m,2h),3.98
–
3.71(m,1h),3.70
–
3.47(m,4h),3.48(s,1h),3.28
–ꢀ
3.11(m,1h),3.03
–
2.80(m,1h),2.40
–
2.19(m,1h).
13
c nmr(150mhz,dmso-d6)δ170.15, 164.25,161.32,152.91,151.53,147.65,142.56,135.13,134.48,132.85,132.66,129.07,127.77, 110.89,107.19,98.74,63.85,54.15,48.21,43.87,41.02,35.88.esi-ms:m/z 528.1[m+na]
+
. c
22h21
cl2n5o5(505.09).
[0099]
实施例4.目标产物gf-13s的合成
[0100][0101]
操作步骤同gf-3,产物为白色固体,收率:62%,熔点232-234℃。
[0102]
1h nmr(600mhz,dmso-d6)δ11.19(d,j=19.3hz,2h),8.73(dt,j=63.6,5.8hz,1h),7.67
–
7.53(m,2h), 7.41(dd,j=8.4,2.2hz,1h),7.38
–
7.30(m,1h),6.93(d,j=17.2hz,2h),5.53(s,1h),4.56
–
4.34(m,2h),3.87 (dd,j=158.4,13.8hz,1h),3.73
–
3.57(m,3h),3.57
–
3.50(m,1h),3.46
–
3.36(m,1h),3.26
–
3.10(m,1h), 3.00
–
2.80(m,1h),2.35
–
2.22(m,1h).13c nmr(150mhz,dmso-d6)δ171.97,163.53,161.35,152.16, 148.39,143.53,134.90,132.85,132.15,128.71,127.77,127.11,125.85,125.49,106.12,64.11,53.96,49.01, 48.02,43.90,37.62.esi-ms:m/z 522.1[m+h]
+
.c
22h21
cl2n5o4s(521.07).
[0103]
实施例5:目标化合物抗新冠病毒主蛋白酶(m
pro
)活性的实验
[0104]
实验原理:
[0105]
采用的荧光共振能量转移(fluorescence resonance energy transfer,fret)法,底物结 构为:mca-avlqsgfr-lys(dnp)-lys-nh2,其中mca是荧光供体,dnp是荧光受体或称 为荧光淬灭基团,完整的序列即含有荧光基团,又含有荧光淬灭基团,由于两个基团空间 距离较近,淬灭基团的抑制作用使得荧光基团不会产生荧光。当加入sars-cov-2主蛋白 酶m
pro
后,由于主蛋白酶能够在氨基酸q和s之间进行切割,使得荧光基团远离淬灭基 团,在激发光为320nm,发射波长为405nm下产生荧光,通过测定荧光来检测m
pro
的活 性,进而间接反应化合物的抑制活性(见附图2)(dai wenhao,et al.,science.368(6497):1331
‑ꢀ
1335,2020.qiao jingxin,et al.,science.371(6536):1374-1378,2021.)。
[0106]
实验方法:
[0107]
使用荧光共振能量转移法,测试了目标化合物的对主蛋白酶的抑制活性。使用mca
‑ꢀ
avlqsgfr-lys(dnp)-lys-nh2为反应底物。在避光条件下,将0.6μm的sars-cov-2m
pro
, 0.25μm的底物和10μm的化合物加入96孔板中进行初筛,37℃下孵育10分钟,使用多 功能酶标仪检测每组的荧光强度,激发波长为320nm,发射波长为405nm。实验分为空白 对照组,阳性对照组和实验组。以化合物7作为实验阳性对照组,将10μm浓度下抑制率》 60%的化合物进行复筛。实验初筛结果如表2所示。
[0108]
表2.目标化合物(含嘧啶二酮酰基多取代哌嗪类衍生物)抑制sars-cov-2主蛋白酶的 初筛结果
[0109]
[0110]
[0111][0112]
复筛:选取1.5μm的sars-cov-2m
pro
,500μm的底物和四个浓度梯度(0.5μm,1 μm,5μm,10μm)测试化合物的ic
50
。每组设置3个复孔,37℃下反应10分钟,使用 多功能酶标仪检测每组的荧光强度,激发波长为320nm,发射波长405nm,每隔10s测一 次,测10min,获取荧光强度。首先根据标准曲线将荧光强度值换算成单位时间内荧光强 度的增加量。取用第一分钟的数据来获取速率用反应初速率的变化来表示抑制剂对酶活力 的抑制程度是研究酶抑制作用,空白对照的反应初速率为v0,添加抑制剂后为vi,则酶活 力的抑制程度可用如下方程式:
[0113]
i%=(1-vi)/v0×
100%
[0114]
最后根据不同浓度下的抑制率利用graphpad prism 5进行ic
50
的计算。
[0115]
实验结果如表3所示。
[0116]
表3.代表性目标化合物抑制sars-cov-2主蛋白酶的复筛结果
[0117][0118]aic
50
(μm):对酶的抑制达到50%时,所需化合物浓度,即半数抑制浓度;化合物7:已报道的一个sars
‑ꢀ
cov-2主蛋白酶抑制剂,作为阳性对照。
[0119]
实验结论分析:
[0120]
新合成的含嘧啶二酮酰基多取代哌嗪类衍生物呈现出显著的抗sars-cov-2m
pro
活性。 经初步的活性筛选,3个化合物gf-3、gf-3s、gf-13s的sars-cov-2m
pro
抑制率》70%。 进一步对这三个化合物进行复筛,结果显示三个化合物抑制主蛋白酶的活性均优于先导化 合物7,其中gf-13s的活性尤为突出(ic
50
=0.35
±
0.10μm);另外由gf-3和gf-3s可 知,该系列化合物优势构型为s构型。因此,含嘧啶二酮酰基多取代哌嗪类衍生物具有进 一步研发的价值。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1