一种手性共价有机框架材料、制备方法及应用
1.本发明具体涉及一种手性共价有机框架材料、制备方法及应用,属于手性共价有机框架材料领域。
背景技术:
2.手性共价有机框架(ccof)是化学和材料领域新的生长点,其在异相不对称催化领域的应用研究方兴未艾。因此,ccof材料是构建新型手性异相催化体系的理想模型,有望突破传统不对称催化“以牺牲产率获取高ee值”的技术瓶颈。在手性共价有机框架构筑过程中,必须平衡共价有机框架结晶性、稳定性与手性结构之间的关系,手性共价有机框架的高效构建仍存在诸多问题:手性单体的合成往往比较复杂,手性后修饰效率偏低、手性诱导策略缺乏普适性等。因此,为了进一步完善手性共价有机框架的构筑策略,探索以非手性单体为建筑块的手性共价有机框架合成新方法、深入研究分子以上层次手性共价有机框架的组装与结构,探索手性产生、传递、放大和调控的机制与规律,是绿色不对称合成化学中亟待解决的重大科学问题。
技术实现要素:
3.为了克服现有技术的缺陷,本发明目的是提供一种简单高效制备手性共价有机框架的方法,即以非手性单体为原料、手性吡咯烷为催化剂,采用不对称催化聚合的策略,构筑一系列具有螺旋桨手性的手性共价有机框架材料。
4.为了实现上述目的,本发明采用的技术方案为:
5.以1,3,5-三甲酰基-2,4,6-间苯三酚、氨基化合物为原料,以手性吡咯烷为催化剂,在反应溶剂中进行溶液反应,得到的固体产物经离心分离、洗涤、干燥得到相应的手性共价有机框架材料。
6.所述1,3,5-三甲酰基-2,4,6-间苯三酚与氨基化合物的摩尔比为:2:3;
7.所述氨基化合物为对苯二胺、1,4-二甲基对苯二胺或水合肼;
8.所述的手性吡咯烷为r-2-甲基吡咯烷和s-2-甲基吡咯烷中的一种,分别得到δ-和λ-型螺旋桨结构的手性共价有机框架材料;
9.所述催化剂的用量占单体1,3,5-三甲酰基-2,4,6-间苯三酚基团摩尔量的5.0
–
30%;优选的,催化剂的用量占单体基团摩尔量的20
–
30%;
10.所述的反应溶剂为n,n-二甲基甲酰胺、三氯甲烷、二氯甲烷、乙腈、二甲基亚砜、邻二氯苯、正丁醇、均三甲苯、1,4-二氧六环中的一种或几种;优选的,反应溶剂为二氯甲烷、1,4-二氧六环中的一种;
11.反应体系中,单体1,3,5-三甲酰基-2,4,6-间苯三酚质量浓度为10
–
25wt%;
12.所述的反应温度为25
–
120℃;优选的,反应温度为25
–
50℃;
13.所述的反应时间为1
–
7d;优选的,反应时间为5
–
7d;
14.所述的固体产物的洗涤过程中,所用洗涤溶剂为二氯甲烷、乙醇及丙酮;
15.所述的真空干燥条件为60
–
100℃、12
–
36h;优选的,真空干燥条件为80℃、24h。
16.所制备的手性共价有机框架材料简写为λ-tppa-1、δ-tppa-1、λ-tppa-2、δ-tppa-2、λ-nus-1、δ-nus-1,具体结构式如下:
[0017][0018]
其中,
[0019]
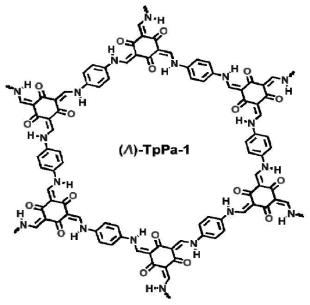
i:λ-tppa-1是以1,3,5-三甲酰基-2,4,6-间苯三酚和对苯二胺为原料、以s-2-甲基吡咯烷为催化剂构筑的具有逆时针螺旋桨结构的手性共价有机框架材料;
[0020]
ii:δ-tppa-1是以1,3,5-三甲酰基-2,4,6-间苯三酚和对苯二胺为原料、以r-2-甲基吡咯烷为催化剂构筑的具有顺时针螺旋桨结构的手性共价有机框架材料;
[0021]
λ-tppa-1和δ-tppa-1的合成反应式为:
[0022][0023]
iii:λ-tppa-2是以1,3,5-三甲酰基-2,4,6-间苯三酚和1,4-二甲基对苯二胺为
原料、以s-2-甲基吡咯烷为催化剂构筑的具有逆时针螺旋桨结构的手性共价有机框架材料;
[0024]
iv:δ-tppa-2是以1,3,5-三甲酰基-2,4,6-间苯三酚和1,4-二甲基对苯二胺为原料、以r-2-甲基吡咯烷为催化剂构筑的具有顺时针螺旋桨结构的手性共价有机框架材料;
[0025]
λ-tppa-2和δ-tppa-2的合成反应式为:
[0026][0027]
v:λ-nus-1是以1,3,5-三甲酰基-2,4,6-间苯三酚和水合肼为原料、以s-2-甲基吡咯烷为催化剂构筑的具有逆时针螺旋桨结构的手性共价有机框架材料;
[0028]
vi:δ-nus-1是以1,3,5-三甲酰基-2,4,6-间苯三酚和水合肼为原料、以r-2-甲基吡咯烷为催化剂构筑的具有顺时针螺旋桨结构的手性共价有机框架材料;
[0029]
λ-nus-1和δ-nus-1的合成反应式为:
[0030][0031]
本发明目的之二是实现所制备的手性共价有机框架材料在不对称a
3-偶联反应中的高效应用。
[0032]
为了实现上述目的,本发明采用的技术方案为:
[0033]
i:二价铜离子的负载。将手性共价有机框架材料、三氟甲磺酸铜溶解分散到溶剂中,进行固相浸渍反应,反应结束后,固体产物经离心分离、乙醇洗涤、真空干燥,即可得到负载二价铜离子的手性催化剂;
[0034]
类似地,以δ-tppa-1为原料,采用相同方法进行二价铜离子的负载,得到cu(ii)@δ-tppa-1;
[0035]
所述的,手性共价有机框架材料与三氟甲磺酸铜的摩尔比为:1:(3
–
10);所述的手性共价有机框架材料可为λ-tppa-1或δ-tppa-1;所述的,溶剂为乙醇、甲醇、乙腈中的一种;所述的,手性共价有机框架材料在溶剂中的质量浓度为20
–
30wt%;所述的,反应温度为25
–
60℃;所述的,反应时间为8
–
24h;所述的,真空干燥条件为60℃、12h。
[0036]
ii:将上述负载二价铜离子的手性催化剂用于催化醛、胺及炔基化合物之间的不对称a
3-偶联反应,具体为将醛、胺、炔基化合物、负载二价铜离子的手性催化剂在溶剂中混
合进行催化反应,反应后反应液经离心分离、过柱层析得到催化产物,计算催化产物分离产率,用手性液相色谱计算产物的ee值;
[0037]
所述的,催化反应中,醛:胺:炔基化合物的用量分别为:1.0mmol、1.2mmol、1.5mmol;所述的,醛为苯甲醛、4-溴苯甲醛、4-氯苯甲醛、2-甲氧基苯甲醛中的一种;所述的,胺为苯胺、4-氯苯胺、4-甲氧基苯胺中的一种;所述的,炔基化合物为苯乙炔、环丙乙炔、4-甲基苯乙炔中的一种;
[0038]
所述的,负载二价铜离子的手性催化剂为cu(ii)@λ-tppa-1或cu(ii)@δ-tppa-1,即负载二价铜离子的λ-tppa-1或负载二价铜离子的δ-tppa-1,用量占单体1,3,5-三甲酰基-2,4,6-间苯三酚摩尔百分比为1.0
–
3.0%;
[0039]
所述的,催化反应中溶剂为1,4-二氧六环、甲苯、甲醇、乙醇、乙腈、三氯甲烷、二氯甲烷中的一种;所述的,反应温度为25
–
80℃;
[0040]
所述的,柱层析洗脱剂为:石油醚/二氯甲烷,v/v=2:1;所述的,手性液相色谱检测条件为:采用diacel chiralcel od-h手性液相色谱,正己烷:异丙醇(v/v=99:1),流速为1ml/min,λ=254nm)。
[0041]
iii:将cu(ii)@(λ)-tppa-1与壳聚糖进行复合,制备cu(ii)@(λ)-tppa-1/壳聚糖复合气凝胶材料。用作釜式反应器、实现不对称a
3-偶联催化反应的克级放大。
[0042]
所述的,cu(ii)@(λ)-tppa-1/壳聚糖复合气凝胶材料的制备工艺为:将50毫升去离子水中加入0.5克的cu(ii)@(λ)-tppa-1、0.5克壳聚糖、0.5毫升醋酸以及0.5毫升交联剂1,4-丁二醇二缩水甘油醚,室温超声,分散均匀。然后将其转移进冰箱进行冻结8
–
12h,最后将其转移进入冻干机,在-50℃下真空冻干24
–
26h。
[0043]
放大催化反应为:将苯甲醛、苯胺、苯乙炔和cu(ii)@(λ)-tppa-1/壳聚糖复合气凝胶材料混合,在25℃条件下进行催化反应36h,反应后反应液经倾倒分离、洗涤、过柱层析,得到催化产物,计算催化产物分离产率,用手性液相色谱计算产物的ee值。其中,苯甲醛、苯胺、苯乙炔用量分别为20mmol、24mmol、30mmol,cu(ii)@(λ)-tppa-1/壳聚糖复合气凝胶材料用量1.0g,,相当于1.5mol%cu(cu的质量为19.1mg)。
[0044]
本发明采用手性吡咯烷作为催化剂,特别选择r-2-甲基吡咯烷和s-2-甲基吡咯烷,探索了手性吡咯烷作为催化剂在合成手性共价有机框架中的新应用,成功制备得到δ-和λ-型螺旋桨结构的ccof产物,该合成方法简单高效,产物具有高ee值。
[0045]
本发明的有益效果为:(1)发展了手性共价有机框架合成新方法,实现了金属催化剂和手性限域功能在手性共价有机框架平台上的合理集成,制备了具有高产量、高立体选择性、可重复利用的手性催化材料;(2)将手性共价有机框架催化材料与聚合物进行复合,解决了框架催化材料的成型加工及装置化问题,建立了可重复利用的放大实验模型,为实现手性化学品的规模化清洁生产开辟了新途径。
附图说明
[0046]
构成本发明一部分的说明书附图用来提供对本发明的进一步理解,本发明的示意性实施例及其说明用于解释本发明,并不构成对本发明的不当限定。
[0047]
图1为本发明实施例1产物的结构式;图2为本发明实施例1产物的粉末衍射图;图3为本发明实施例1产物的圆二色谱图;图4为本发明实施例1产物的扫描电镜sem图;图5为本
发明实施例1产物的红外光谱图;图6为本发明实施例1产物的宏观照片;图7为本发明实施例2产物的结构式;图8为本发明实施例2产物的粉末衍射图;图9为本发明实施例2产物的圆二色谱图;图10为本发明实施例2产物的扫描电镜sem图;图11为本发明实施例2产物的红外光谱图;图12为本发明实施例2产物的宏观照片;图13为本发明实施例3产物的结构式;图14为本发明实施例3产物的粉末衍射图;图15为本发明实施例3产物的圆二色谱图;图16为本发明实施例3产物的扫描电镜sem图;图17为本发明实施例3产物的红外光谱图;图18为本发明实施例3产物的宏观照片;图19为本发明实施例4产物的结构式;图20为本发明实施例4产物的粉末衍射图;图21为本发明实施例4产物的圆二色谱图;图22为本发明实施例4产物的扫描电镜sem图;图23为本发明实施例4产物的红外光谱图;图24为本发明实施例4产物的宏观照片;图25为本发明实施例5产物的结构式;图26为本发明实施例5产物的粉末衍射图;图27为本发明实施例5产物的圆二色谱图;图28为本发明实施例5产物的扫描电镜sem图;图29为本发明实施例5产物的红外光谱图;图30为本发明实施例5产物的宏观照片;图31为本发明实施例6产物的结构式;图32为本发明实施例6产物的粉末衍射图;图33为本发明实施例6产物的圆二色谱图;图34为本发明实施例6产物的扫描电镜sem图;图35为本发明实施例6产物的红外光谱图;图36为本发明实施例6产物的宏观照片;图37为本发明实施例7产物的光电子能谱谱图;图38为本发明实施例7产物的圆二色谱图;图39为本发明实施例8产物的光电子能谱谱图;图40为本发明实施例8产物的圆二色谱图;图41为本发明实施例9产物的核磁谱图;图42为本发明实施例9产物的液相谱图;图43为本发明实施例10产物的核磁谱图;图44为本发明实施例10产物的液相谱图;图45为本发明实施例11的宏观照片;图46为本发明实施例11的扫描电镜sem图;图47为本发明实施例12的液相光谱谱图;图48为本发明实施例13产物的核磁谱图;图49为本发明实施例13产物的液相谱图;图50为本发明实施例14产物的核磁谱图;图51为本发明实施例14产物的液相谱图;图52为本发明实施例15产物的核磁谱图;图53为本发明实施例15产物的液相谱图;图54为本发明实施例16产物的核磁谱图;图55为本发明实施例16产物的液相谱图;图56为本发明实施例17产物的核磁谱图;图57为本发明实施例17产物的液相谱图;图58为本发明实施例18产物的核磁谱图;图59为本发明实施例18产物的液相谱图;图60为本发明实施例19产物的核磁谱图;图61为本发明实施例19产物的液相谱图。
具体实施方式
[0048]
下面将对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅是本发明的一部分实施例,而不是全部实施例。基于本发明的实施例,本领域技术人员在没有做出创造性劳动前提下所获得的所有其它实施例,都属于本发明保护的范围。
[0049]
实施例1:本实施例提供一种制备手性共价有机框架材料(λ)-tppa-1的方法,具体步骤如下,1,3,5-三甲酰基-2,4,6-间苯三酚(63.0mg,0.30mmol)、对苯二胺(48.6mg,0.45mmol)、s-2-甲基吡咯烷(7.7mg,0.09mmol),溶解分散于二氯甲烷(6.0ml),室温反应7天。反应结束后,离心得到砖红色粉末,用二氯甲烷洗涤至清液无色,然后用乙醇、丙酮、乙醚分别依次洗涤一次,60℃真空干燥12小时,即得到手性共价有机框架材料(λ)-tppa-1。实施例1的结构式见图1,粉末衍射pxrd见图2,圆二色cd光谱见图3,扫描电镜sem见图4,红外光谱见图5,宏观照片见图6。
[0050]
实施例2:本实施例提供一种制备手性共价有机框架材料(δ)-tppa-1的方法,具体步骤如下,1,3,5-三甲酰基-2,4,6-间苯三酚(63.0mg,0.30mmol)、对苯二胺(48.6mg,0.45mmol)、r-2-甲基吡咯烷(7.7mg,0.09mmol),溶解分散于二氯甲烷(6.0ml),室温反应7天。反应结束后,离心得到砖红色粉末,用二氯甲烷洗涤至清液无色,然后用乙醇、丙酮、乙醚分别依次洗涤一次,60℃真空干燥12小时,即得到手性共价有机框架材料(δ)-tppa-1。实施例2的结构式见图7,粉末衍射pxrd见图8,圆二色cd光谱见图9,扫描电镜sem见图10,红外光谱见图11,宏观照片见图12。
[0051]
实施例3:本实施例提供一种制备手性共价有机框架材料(λ)-tppa-2的方法,具体步骤如下,1,3,5-三甲酰基-2,4,6-间苯三酚(63.0mg,0.30mmol)、对苯二胺(61.0mg,0.45mmol)、s-2-甲基吡咯烷(7.7mg,0.09mmol),溶解分散于二氯甲烷(6.0ml),室温反应7天。反应结束后,离心得到砖红色粉末,用二氯甲烷洗涤至清液无色,然后用乙醇、丙酮、乙醚分别依次洗涤一次,60℃真空干燥12小时,即得到手性共价有机框架材料(λ)-tppa-2。实施例3的结构式见图13,粉末衍射pxrd见图14,圆二色cd光谱见图15,扫描电镜sem见图16,红外光谱见图17,宏观照片见图18。
[0052]
实施例4:本实施例提供一种制备手性共价有机框架材料(δ)-tppa-2的方法,具体步骤如下,1,3,5-三甲酰基-2,4,6-间苯三酚(63.0mg,0.30mmol)、对苯二胺(61.0mg,0.45mmol)、r-2-甲基吡咯烷(7.7mg,0.09mmol),溶解分散于二氯甲烷(6.0ml),室温反应7天。反应结束后,离心得到砖红色粉末,用二氯甲烷洗涤至清液无色,然后用乙醇、丙酮、乙醚分别依次洗涤一次,60℃真空干燥12小时,即得到手性共价有机框架材料(δ)-tppa-2。实施例4的结构式见图19,粉末衍射pxrd见图20,圆二色cd光谱见图21,扫描电镜sem见图22,红外光谱见图23,宏观照片见图24。
[0053]
实施例5:本实施例提供一种制备手性共价有机框架材料(λ)-nus-2的方法,具体步骤如下,1,3,5-三甲酰基-2,4,6-间苯三酚(63.0mg,0.30mmol)、水合肼(22.5mg,0.45mmol)、s-2-甲基吡咯烷(7.7mg,0.09mmol),溶解分散于二氯甲烷(6.0ml),室温反应7天。反应结束后,离心得到砖红色粉末,用二氯甲烷洗涤至清液无色,然后用乙醇、丙酮、乙醚分别依次洗涤一次,60℃真空干燥12小时,即得到手性共价有机框架材料(λ)-nus-2。实施例5的结构式见图25,粉末衍射pxrd见图26,圆二色cd光谱见图27,扫描电镜sem见图28,红外光谱见图29,宏观照片见图30。
[0054]
实施例6:本实施例提供一种制备手性共价有机框架材料(δ)-nus-2的方法,具体步骤如下,1,3,5-三甲酰基-2,4,6-间苯三酚(63.0mg,0.30mmol)、水合肼(22.5mg,0.45mmol)、r-2-甲基吡咯烷(7.7mg,0.09mmol),溶解分散于二氯甲烷(6.0ml),室温反应7天。反应结束后,离心得到砖红色粉末,用二氯甲烷洗涤至清液无色,然后用乙醇、丙酮、乙醚分别依次洗涤一次,60℃真空干燥12小时,即得到手性共价有机框架材料(δ)-nus-2。实施例6的结构式见图31,粉末衍射pxrd见图32,圆二色cd光谱见图33,扫描电镜sem见图34,红外光谱见图35,宏观照片见图36。
[0055]
实施例7:本实施例提供一种制备手性共价有机框架材料cu(ii)@(λ)-tppa-1的方法,具体步骤如下,手性共价有机框架材料(λ)-tppa-1(106mg,1.0mmol)在五十毫升乙醇中超声分散均匀,然后向该分散液中加入无水三氟甲磺酸铜(723mg,2.0mmol),超声使铜盐完全溶解。将混合体系在50℃下搅拌24小时,离心分离固体,并用乙醇洗涤,真空干燥,得
到cu(ii)@(λ)-tppa-1为红色粉末状固体。icp测定表明,cu(ii)@(λ)-tppa-1中cu的包封量为4wt%。实施例7的xps光谱见图37,圆二色cd光谱见图38。
[0056]
实施例8:本实施例提供一种制备手性共价有机框架材料cu(ii)@(δ)-tppa-1的方法,具体步骤如下,手性共价有机框架材料(δ)-tppa-1(106mg,1.0mmol)在五十毫升乙醇中超声分散均匀,然后向该分散液中加入无水三氟甲磺酸铜(723mg,2.0mmol),超声使铜盐完全溶解。将混合体系在50℃下搅拌24小时,离心分离固体,并用乙醇洗涤,真空干燥,得到cu(ii)@(δ)-tppa-1为红色粉末状固体。icp测定表明,cu(ii)@(δ)-tppa-1中cu的包封量为4.2wt%。实施例8的xps光谱见图39,圆二色cd光谱见图40。
[0057]
实施例9:本实施例为cu(ii)@(λ)-tppa-1作为催化剂制备(r)-n-(1-苯基-3-苯基-2-丙炔基)苯胺((r)-n-(1-phenyl-3-phenyl-2-propynyl)aniline),具体过程如下,苯甲醛(102μl,1mmol)、苯胺(110μl,1.2mmol)、苯乙炔(150μl,1.5mmol)和cu(ii)@(λ)-tppa-1(50mg,3.0mol%cu)在ch2cl2(10毫升)溶液中溶解分散,在室温下搅拌,直至反应完全,点板监控反应进程。产物经硅胶柱层析(石油醚/二氯甲烷,v/v=2:1)纯化,得到模型化合物(r)-n-(1-苯基-3-苯基-2-丙炔基)苯胺,无色固体,收率为99%。高效液相色谱(diacel chiralcel od-h,正己烷:异丙醇(v/v=99:1),流速为1ml/min,λ=254nm)测定ee值为98%。实施例9的核磁谱图见图41,液相谱图见图42。
[0058]
实施例10:本实施例为cu(ii)@(δ)-tppa-1作为催化剂制备(s)-n-(1-苯基-3-苯基-2-丙炔基)苯胺((s)-n-(1-phenyl-3-phenyl-2-propynyl)aniline),具体过程如下,苯甲醛(102μl,1mmol)、苯胺(110μl,1.2mmol)、苯乙炔(150μl,1.5mmol)和cu(ii)@(δ)-tppa-1(46mg,3.0mol%cu)在ch2cl2(10毫升)溶液中溶解分散,在室温下搅拌,直至反应完全,点板监控反应进程。产物经硅胶柱层析(石油醚/二氯甲烷,v/v=2:1)纯化,得到模型化合物(s)-n-(1-苯基-3-苯基-2-丙炔基)苯胺,无色固体,收率为98%。高效液相色谱(diacel chiralcel od-h,正己烷:异丙醇(v/v=99:1),流速为1ml/min,λ=254nm)测定ee值为97%。实施例10的核磁谱图见图43,液相谱图见图44。
[0059]
实施例11:本实施例为cu(ii)@(λ)-tppa-1/壳聚糖复合气凝胶的制备。具体过程如下,将0.5g壳聚糖粉末、500微升醋酸溶解分散于50毫升去离子水。超声,形成透明溶液,加入0.5g cu(ii)@(λ)-tppa-1粉末,超声分散均匀。然后向其中加入500微升的1,4-丁二醇二缩水甘油醚作为交联剂,强烈搅拌和超声分散。获得的粘稠溶液立即转移到烧瓶模具中,然后将其整个转移进-25℃冰箱中冷冻24h。最后,将冷冻好的样品在-50℃条件下在冻干机中真空冻干约36小时,形成干燥的cu(ii)@(λ)-tppa-1/壳聚糖复合气凝胶整体,负载约50%的cu(ii)@(λ)-tppa-1。将所得的cu(ii)@(λ)-tppa-1/壳聚糖复合气凝胶应用于催化。实施例11的宏观照片见图45,扫描电镜图见图46。
[0060]
实施例12:本实施例为cu(ii)@(λ)-tppa-1/壳聚糖复合气凝胶在催化中的应用。具体步骤如下,将苯甲醛(2.02ml,20mmol)、苯胺(2.2ml,24mmol)、苯乙炔(3.06ml,30mmol)的混合物在ch2cl2(150ml)中搅拌,室温(25℃)下在含有cu(ii)@(λ)-tppa-1@壳聚糖复合气凝胶(1.0g,1.5mol%cu当量)的烧瓶(250ml)中搅拌。反应结束后,通过简单的倾倒和ch2cl2洗涤,实现产物与催化剂的分离。粗产物经柱层析(洗脱液为二氯甲烷/石油醚,其体积比=1/2)得到预期手性化合物的分离收率98%,手性高效液相色谱法测定了催化产物的ee值为98%。实施例12的液相谱图见图47。
[0061]
实施例13:本实施例为cu(ii)@(λ)-tppa-1作为催化剂在制备(r)-n-[1-(4-溴苯基)-3-苯基-2-丙炔基]-苯胺((r)-n-[1-(4-bromo phenyl)-3-phenyl-2-propynyl]-aniline)的应用,具体过程如下,苯甲醛(102μl,1mmol)、苯胺(110μl,1.2mmol)、苯乙炔(150μl,1.5mmol)和cu(ii)@(λ)-tppa-1(50mg,3.0mol%cu)在ch2cl2(10毫升)溶液中溶解分散,在室温下搅拌,直至反应完全,点板监控反应进程。产物经硅胶柱层析(石油醚/二氯甲烷(v/v)=2:1)纯化,得到模型化合物(r)-n-[1-(4-溴苯基)-3-苯基-2-丙炔基]-苯胺,无色固体,收率为97%。高效液相色谱(diacel chiralcel od-h,正己烷:异丙醇(v/v=99:1),流速为1ml/min,λ=254nm)测定ee值为98%。实施例13的核磁谱图见图48,液相谱图见图49。
[0062]
实施例14:本实施例为cu(ii)@(λ)-tppa-1作为催化剂制备(r)-n-[1-(4-氯苯基)-3-苯基-2-丙炔基]-苯胺((r)-n-[1-(4-chloro phenyl)-3-phenyl-2-propynyl]-aniline),具体过程如下,苯甲醛(102μl,1mmol)、苯胺(110μl,1.2mmol)、苯乙炔(150μl,1.5mmol)和cu(ii)@(λ)-tppa-1(50mg,3.0mol%cu)在ch2cl2(10毫升)溶液中溶解分散,在室温下搅拌,直至反应完全,点板监控反应进程。产物经硅胶柱层析(石油醚/二氯甲烷,v/v=2:1)纯化,得到模型化合物(r)-n-[1-(4-氯苯基)-3-苯基-2-丙炔基]-苯胺,无色固体,收率为97%。高效液相色谱(diacel chiralcel od-h,正己烷:异丙醇(v/v=99:1),流速为1ml/min,λ=254nm)测定ee值为99%。实施例14的核磁谱图见图50,液相谱图见图51。
[0063]
实施例15:本实施例为cu(ii)@(λ)-tppa-1作为催化剂制备(r)-n-[1-(2-甲氧基苯基)-3-苯基-2-丙炔基]-苯胺((r)-n-[1-(2-metho xyphenyl)-3-phenyl-2-propynyl]-aniline),具体过程如下,苯甲醛(102μl,1mmol)、苯胺(110μl,1.2mmol)、苯乙炔(150μl,1.5mmol)和cu(ii)@(λ)-tppa-1(50mg,3.0mol%cu)在ch2cl2(10毫升)溶液中溶解分散,在室温下搅拌,直至反应完全,点板监控反应进程。产物经硅胶柱层析(石油醚/二氯甲烷,v/v=2:1)纯化,得到模型化合物(r)-n-[1-(2-甲氧基苯基)-3-苯基-2-丙炔基]-苯胺,无色固体,收率为97%。高效液相色谱(diacel chiralcel od-h,正己烷:异丙醇(v/v=99:1),流速为1ml/min,λ=254nm)测定ee值为99%。实施例15的核磁谱图见图52,液相谱图见图53。
[0064]
实施例16:本实施例为cu(ii)@(λ)-tppa-1作为催化剂制备(r)-n-(1-苯基-3-苯基-2-丙炔基)-4-氯苯胺((r)-n-(1-phenyl-3-phenyl-2-propynyl)-4-chloroaniline),具体过程如下,苯甲醛(102μl,1mmol)、4-氯苯胺(153mg,1.2mmol)、苯乙炔(150μl,1.5mmol)和cu(ii)@(λ)-tppa-1(50mg,3.0mol%cu)在ch2cl2(10毫升)溶液中溶解分散,在室温下搅拌,直至反应完全,点板监控反应进程。产物经硅胶柱层析(石油醚/二氯甲烷,v/v=2:1)纯化,得到模型化合物(r)-n-(1-苯基-3-苯基-2-丙炔基)-4-氯苯胺,无色固体,收率为97%。高效液相色谱(diacel chiralcel od-h,正己烷:异丙醇(v/v=99:1),流速为1ml/min,λ=254nm)测定ee值为99%。实施例16的核磁谱图见图54,液相谱图见图55。
[0065]
实施例17:本实施例为cu(ii)@(λ)-tppa-1作为催化剂制备(r)-n-(1-苯基-3-苯基-2-丙炔基)-4-甲氧基-胺((r)-n-(1-phenyl-3-phenyl-2-propynyl)-4-methoxy-amine),具体过程如下,苯甲醛(102μl,1mmol)、4-甲氧基苯胺(148mg,1.2mmol)、苯乙炔(150μl,1.5mmol)和cu(ii)@(λ)-tppa-1(50mg,3.0mol%cu)在ch2cl2(10毫升)溶液中溶解分散,在室温下搅拌,直至反应完全,点板监控反应进程。产物经硅胶柱层析(石油醚/二氯甲烷,v/v=2:1)纯化,得到模型化合物(r)-n-(1-苯基-3-苯基-2-丙炔基)-4-甲氧基-胺,
无色固体,收率为97%。高效液相色谱(diacel chiralcel od-h,正己烷:异丙醇(v/v=99:1),流速为1ml/min,λ=254nm)测定ee值为99%。实施例17的核磁谱图见图56,液相谱图见图57。
[0066]
实施例18:本实施例为cu(ii)@(λ)-tppa-1作为催化剂制备(r)-n-(1-苯基-3-环丙基-2-丙炔基)-苯胺((r)-n-(1-phenyl-3-cyclopropyl-2-propynyl)-aniline),具体过程如下,苯甲醛(102μl,1mmol)、苯胺(110μl,1.2mmol)、环丙乙炔(99mg,1.5mmol)和cu(ii)@(λ)-tppa-1(50mg,3.0mol%cu)在ch2cl2(10毫升)溶液中溶解分散,在室温下搅拌,直至反应完全,点板监控反应进程。产物经硅胶柱层析(石油醚/二氯甲烷,v/v=2:1)纯化,得到模型化合物(r)-n-(1-苯基-3-环丙基-2-丙炔基)-苯胺,无色固体,收率为97%。高效液相色谱(diacel chiralcel od-h,正己烷:异丙醇(v/v=99:1),流速为1ml/min,λ=254nm)测定ee值为99%。实施例18的核磁谱图见图58,液相谱图见图59。
[0067]
实施例19:本实施例为cu(ii)@(λ)-tppa-1作为催化剂制备(r)-n-[1-苯基-3-(4-甲基苯基)-2-丙炔基]-苯胺((r)-n-[1-phenyl-3-(4-methylphenyl)-2-propynyl]
–
aniline),具体过程如下,苯甲醛(102μl,1mmol)、苯胺(110μl,1.2mmol)、4-甲基苯乙炔(174mg,1.5mmol)和cu(ii)@(λ)-tppa-1(50mg,3.0mol%cu)在ch2cl2(10毫升)溶液中溶解分散,在室温下搅拌,直至反应完全,点板监控反应进程。产物经硅胶柱层析(石油醚/二氯甲烷,v/v=2:1)纯化,得到模型化合物(r)-n-[1-苯基-3-(4-甲基苯基)-2-丙炔基]-苯胺,无色固体,收率为97%。高效液相色谱(diacel chiralcel od-h,正己烷:异丙醇(v/v=99:1),流速为1ml/min,λ=254nm)测定ee值为99%。实施例19的核磁谱图见图60,液相谱图见图61。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1