一种流感病毒检测试剂盒及其应用的制作方法
1.本发明属于病毒疫病诊断技术领域,具体涉及一种流感病毒检测试剂盒及其应用。
背景技术:
2.流行性感冒病毒简称流感病毒,主要分为甲(a)、乙(b)、丙(c)三型。流感病毒可引起人、禽、猪、马、蝙蝠等多种动物感染和发病,是人流感、禽流感、猪流感、马流感等人与动物疫病的病原。流感的典型临床症状是急性高热、全身疼痛、显著乏力和呼吸道症状。流感病毒主要通过空气中的飞沫、易感者与感染者之间的接触或与被污染物品的接触而传播。人流感主要是甲型流感病毒和乙型流感病毒引起的。甲型流感病毒经常发生抗原变异,可以进一步分为h1n1、 h3n2、h5n1、h7n9等亚型(其中的h和n分别代表流感病毒两种表面糖蛋白)。
[0003][0004]
甲型h1n1病毒属于正粘病毒科、甲型流感病毒属,为单股负链rna病毒,基因组约为13.6kb。典型病毒颗粒呈球状,直径为80nm~120nm,有囊膜。囊膜上有许多放射状排列的突起糖蛋白,分别是血凝素ha、神经氨酸酶na和m2 蛋白。病毒颗粒内为核衣壳,呈螺旋状对称,直径为10nm。甲型h1n1病毒的 8个基因节段共编码11种蛋白,其中第4节段rna编码的ha蛋白是病毒表面最主要的糖蛋白,具有较强的免疫原性,可以激发体液免疫和细胞免疫,诱导机体产生针对流感病毒的中和抗体,是决定病毒毒力的主要因素,也是甲型h1n1病毒诊断的主要靶蛋白之一。
技术实现要素:
[0005]
为了弥补现有技术的不足,本发明的目的之一,提供一种甲型h1n1病毒 ha蛋白的单克隆抗体及其制备方法;本发明的目的之二,提供了一种使用本发明制备的单克隆抗体制备甲型h1n1病毒检测试剂盒。
[0006]
因此,本发明一方面公开了一种组合产品,所述组合产品为两种甲型h1n1 病毒ha蛋白的抗体或其抗原结合片段的组合,包含单抗抗体1和单克隆抗体2;所述的单克隆抗体1的的重链可变区序列为:
[0007]
mlyllfclvtfpscvlsqvqlkqsgpglvqpsqslsitctvtefvsvtsygvh wirqlpekglewlgviwsggsqdynaafdshtwiskdnskqefffkvnslkp adtaiyycaragdynydgqaywgqgtlvtvsa;
[0008]
所述的单克隆抗体1的轻链可变区序列为:
[0009]
mwnvqifsasvilsrgqivdeqspaimsaspgkkvtmtcsgqvsvsfmywyq qrpgssprlliydtsnlasgvpvrfsgsgsgtsysgtirrmeaedaasfgcqp wstypltfgagskle lkse;
[0010]
所述的单克隆抗体2的的重链可变区序列为:
[0011]
mertyqvqlkesgfglvapsqklwvfrctksgpsnsrysvhwvrqppfkgl ewlgmiwggsetdwnsalksrlsfskdnshsqvfdfvmgdlqtddtamyy cardgfffddyapdywgqg tsvtvsse;
[0012]
所述的单克隆抗体2的轻链可变区序列为:
[0013]
mghfsddiqweqntsslsaslgarrtiscrasqdisfgvpwyqqkpdgtvkll ifftsrlaiggpsrfsgsgsgtdyslaisnleqediatyfcqqglt。
[0014]
优选地,本发明所述的单克隆抗体1的重链可变区分为cdr-h1、cdr-h2、 cdr-h3、fr-h1、fr-h2、fr-h3、fr-h4;
[0015]
所述的cdr-h1的氨基酸序列为tsygvh,
[0016]
所述的cdr-h2的氨基酸序列为viwsggsqdynaafds,
[0017]
所述的cdr-h3的氨基酸序列为agdynydgqay,
[0018]
所述的fr-h1的氨基酸序列为qvqlkqsgpglvqpsqslsitctvtefvsv,
[0019]
所述的fr-h2的氨基酸序列为wirqlpekglewlg,
[0020]
所述的fr-h3的氨基酸序列为htwiskdnskqefffkvnslkpadtaiyycar,
[0021]
所述的fr-h4的氨基酸序列为wgqgtlvtvsa。
[0022]
优选地,本发明所述的所述的单克隆抗体1的轻链可变区分为cdr-l1、cdr-l2、cdr-l3、fr-l1、fr-l2、fr-l3、fr-l4;
[0023]
所述的cdr-l1的氨基酸序列为sgqvsvsfmy,
[0024]
所述的cdr-l2的氨基酸序列为dtsnlas,
[0025]
所述的cdr-l3的氨基酸序列为qpwstyplt,
[0026]
所述的fr-l1的氨基酸序列为qivdeqspaimsaspgkkvtmtc,
[0027]
所述的fr-l2的氨基酸序列为wyqqrpgssprlliy,
[0028]
所述的fr-l3的氨基酸序列为gvpvrfsgsgsgtsysgtirrmeaedaasfgc,
[0029]
所述的fr-l4的氨基酸序列为fgagsklelk。
[0030]
优选地,本发明所述的单克隆抗体2的重链可变区分为cdr-h1、cdr-h2、 cdr-h3、fr-h1、fr-h2、fr-h3、fr-h4;
[0031]
所述的cdr-h1的氨基酸序列为rysvh,
[0032]
所述的cdr-h2的氨基酸序列为miwggsetdwnsalks,
[0033]
所述的cdr-h3的氨基酸序列为dgfffddyapdy,
[0034]
所述的fr-h1的氨基酸序列为qvqlkesgfglvapsqklwvfrctksgpsns,
[0035]
所述的fr-h2的氨基酸序列为wvrqppfkglewlg,
[0036]
所述的fr-h3的氨基酸序列为
[0037]
rlsfskdnshsqvfdfvmgdlqtddtamyycar,
[0038]
所述的fr-h4的氨基酸序列为wgqgtsvtvss。
[0039]
优选地,本发明所述的单克隆抗体2的轻链可变区分为cdr-l1、cdr-l2、 cdr-l3、fr-l1、fr-l2、fr-l3;
[0040]
所述的cdr-l1的氨基酸序列为rasqdisfgvp,
[0041]
所述的cdr-l2的氨基酸序列为ftsrlai,
[0042]
所述的cdr-l3的氨基酸序列为qqgl,
[0043]
所述的fr-l1的氨基酸序列为diqweqntsslsaslgarrtisc,
[0044]
所述的fr-l2的氨基酸序列为wyqqkpdgtvkllif,
[0045]
所述的fr-l3的氨基酸序列为ggpsrfsgsgsgtdyslaisnleqediatyfc,
[0046]
所述的fr-l4的氨基酸序列为fgagsklelk。
[0047]
优选地,本发明所述的单克隆抗体1结合的抗原表位位于优化后的甲型 h1n1病毒ha蛋白的aa98~aa164位,所述优化后的甲型h1n1病毒ha蛋白的 aa98~aa164位氨基酸序列为:
[0048]
yeelreqlssvssferfeifpkesswpnhtvtgvsascshngkssfyrnllwl tgknglypnlsksy。
[0049]
优选地,本发明所述的单克隆抗体2的抗原表位位于优化后的甲型h1n1病毒ha蛋白的aa364~aa409位,所述优化后的甲型h1n1病毒ha蛋白的aa364~aa409位氨基酸序列为:
[0050]
qkstqnaingitnkvnsviekmntqftavgkefnrle rrmenlnkk。
[0051]
另一方面,本发明还公开了一种用于检测甲型h1n1病毒的试剂盒,所述试剂盒包括有效量的权利要求1所述的组合产品;以及配套的检测试剂。
[0052]
优选地,本发明所述试剂盒为胶体金检测试纸条,所述胶体金检测试纸条包括包含有单克隆抗体1和单克隆抗体2的试纸条以及样品稀释液。
[0053]
优选地,本发明所述试剂盒为双抗体夹心elisa检测试剂盒,所述双抗体夹心elisa检测试剂盒包括包被有单克隆抗体1的酶标板和hrp标记的单克隆抗体2以及配套的检测试剂。
[0054]
本发明制备的甲型h1n1病毒ha蛋白适用于制备不同的甲型h1n1病毒诊断试剂,如胶体金、elisa、化学发光检测试剂盒等。本发明制备的抗甲型h1n1 病毒ha蛋白的单克隆抗体1和单克隆抗体2具有良好的特异性和敏感性,适用于制备不同的甲型h1n1病毒诊断试剂,如胶体金、elisa、化学发光等检测试剂盒。
[0055]
本发明所提供的甲型h1n1病毒检测试剂盒适用于血清、组织、全血、抗凝血和体液等甲型h1n1病毒的检测,其特异性强、灵敏度高、稳定性好、检测速度快。可用于甲型h1n1病毒的早期筛查流行病学调查等。
附图说明
[0056]
图1甲型h1n1病毒ha蛋白纯化后sds-page图,1是纯化后的甲型h1n1 病毒ha蛋白。
[0057]
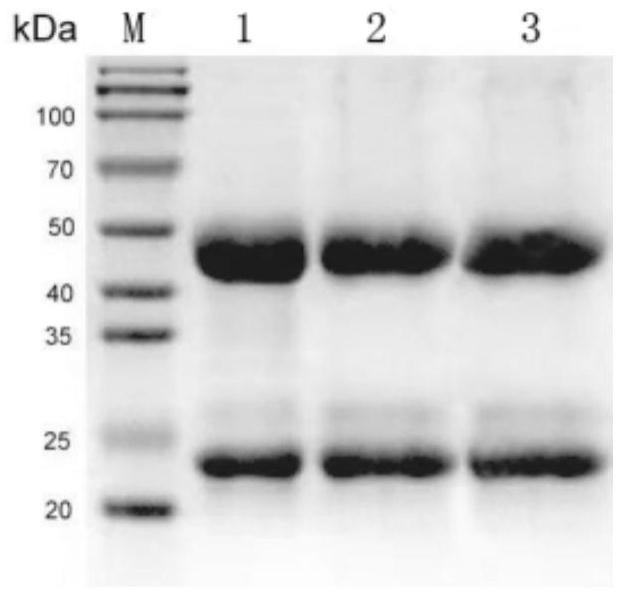
图2单克隆抗体纯化后sds-page图,1、2和3分别是纯化后的单克隆抗体1、单克隆抗体2和单克隆抗体5。
[0058]
图3甲型h1n1病毒ha蛋白二级结果预测结果图,其中代表helix,代表coil,代表strand。
[0059]
图4甲型h1n1病毒ha蛋白固有无序区域预测结果图,其中分值越高代表该位置为无序区的概率越大,0.5作为是否为无序区的分界线。
[0060]
图5甲型h1n1病毒ha蛋白跨膜区预测结果图,其中inside表示胞内区, inside数值越大,表示该氨基酸位于胞内区的可能性越大;outside表示胞外区, outside数值越大,表示该氨基酸位于胞外区的可能性越大;transmembrane表示跨膜区,transmembrane数值越大,表示该氨基酸在跨膜区的可能性越大。
[0061]
图6单克隆抗体与多肽的elisa检测结果图。
[0062]
图7胶体金检测试纸条组装模式图。
[0063]
图8胶体金检测试纸条检测结果图。
具体实施方式
[0064]
除非另有定义,本文所使用的所有的技术和科学术语与属于本发明的技术领域的技术人员通常理解的含义相同。本文中在本发明的说明书中所使用的术语只是为了描述具体的实施例的目的,不是旨在于限制本发明。本文所使用的术语“和 /或”包括一个或多个相关的所列项目的任意的和所有的组合。
[0065]
术语“互补性决定区”或“cdr”是指免疫球蛋白的重链和轻链的高度可变区。本技术采用kabat编号系统对cdr进行定义。有三种重链cdr和三种轻链cdr。此处,取决于情况,术语“cdr”和“cdrs”用于指包含一种或多种或者甚至全部的对抗体与其识别的抗原或表位的结合亲和力起作用的主要氨基酸残基的区域。在另一具体实施方式中,cdr区或cdr是指imgt定义的免疫球蛋白的重链和轻链的高度可变区。
[0066]
除非特别说明,本发明采用的试剂、方法和设备为本技术领域常规试剂、方法和设备。除非特别说明,以下实施例所用试剂和材料均为市购。
[0067]
实施例1:甲型h1n1病毒ha蛋白的制备
[0068]
为确保蛋白的可溶性表达以及去除不必要的序列,如信号肽等,将甲型h1n1 病毒ha蛋白(genbank:dq415318.1)的n端去除17个氨基酸、c端去除26个氨基酸,剩余序列(522aa)进行密码子优化,将密码子优化后的甲型h1n1病毒ha蛋白的核苷酸序列(如seq id no.1所示)克隆到原核表达载体中,并进行蛋白表达纯化。所述方法为常规方法,载体构建可以为自己构建,也可以委托专业的生物公司制备,如南京金斯瑞生物科技有限公司。在此不在赘述!
[0069]
取制备的蛋白,用sds-page凝胶电泳进行检测,结果在59.4kda左右有一条清晰条带,纯度>90%(具体见图1)。再用bca试剂盒(购自thermo公司)检测蛋白含量,根据标准曲线计算蛋白浓度为1.12mg/ml,分装(0.2ml/管),置于-15℃以下保存待用。
[0070]
实施例2:抗甲型h1n1病毒ha蛋白单克隆抗体的制备
[0071]
使用制备的甲型h1n1病毒ha蛋白免疫适龄balb/c小鼠,使用甲型h1n1 病毒ha蛋白通过elisa检测小鼠血清(如尾静脉血)效价(具体检测方法见“小鼠血清效价检测”),直至效价达到105时停止免疫(一般免疫需要2~3次免疫),取出小鼠脾脏,处理后与小鼠骨髓瘤细胞sp2/0进行融合,并进而通过有限稀释法进行克隆化筛选,筛选出抗体效价高、形态良好的细胞株继续采用有限稀释法进行克隆,直至获得单克隆细胞,将单克隆细胞扩大培养并保存于液氮中。经过多轮检测和筛选,最终获得3株较好的阳性杂交瘤细胞,将其编为杂交瘤细胞1、杂交瘤细胞2、杂交瘤细胞5。
[0072]
小鼠血清效价检测:使用制备的ha蛋白包被酶标板,100ng/孔,0.1ml/孔, 4℃包被过夜,洗涤后,使用5%的脱脂奶封闭,37℃孵育2h,洗涤后存于-15℃以下备用;采集小鼠血清,用pbs 10倍系列稀释(10~107)后加到包被的酶标板中,0.1ml/孔,37℃孵育1h;洗涤后,加入1:10000倍稀释的hrp标记的羊抗鼠igg二抗,0.1ml/孔,37℃孵育30min;洗涤后,加入0.1ml tmb单组分显色液,37℃孵育10min;加入终止液(2m硫酸),测定od450nm值;当od450nm 值大于0.1时判定为阳性。
[0073]
腹水制备:取6~8周龄balb/c雌性小鼠经腹腔注射降植烷,0.5ml/只,7 日后每只
小鼠分别注射相对应的杂交瘤细胞(1、2、5)1~1.5
×
106个,7~10日后,抽取小鼠腹水,4℃12000rpm离心10min,收集上清液,将上清液进行分装, 10ml/管,-15℃以下保存备用。
[0074]
实施例3:抗甲型h1n1病毒ha蛋白单克隆抗体的纯化和检测
[0075]
使用辛酸-硫酸铵沉淀法纯化单克隆抗体,简述如下:取腹水上清10ml,解冻后用滤纸过滤去除脂质,滤液用4倍体积的60mm醋酸缓冲液(ph 4.0)稀释后,调整ph至4.5;混合均匀后在室温下逐滴加入0.33ml辛酸,一滴溶解后再加一滴,室温搅拌30分钟后,4℃静置2小时以上,使其充分沉淀;4℃12000rpm 离心30min,收集上清;上清液经滤纸过滤后,记滤液体积并在冰浴下缓慢加入相同体积4℃保存的饱和硫酸铵溶液,搅拌均匀后,4℃静置过夜;过夜后4℃ 13000rpm离心30min,收集沉淀;用5ml pbs溶解沉淀后用1l pbs透析过夜;透析好的液体用0.22μm滤膜过滤除菌,分装,0.1ml/管,即为纯化的单克隆抗体,置于-15℃以下保存备用。
[0076]
取20μl单克隆抗体用sds-page凝胶电泳进行检测,3株单克隆抗体均有两条清晰条带,纯度均大于90%(图2),再用bca试剂盒对单克隆抗体进行浓度检测,3株单克隆抗体的检测结果分别为1.17mg/ml、1.23mg/ml、1.09mg/ml。
[0077]
实施例4:单克隆抗体的检测
[0078]
亚类测定:用小鼠单克隆抗体亚型鉴定试剂盒(sigma,mouse monoclonalantibody isotyping kit)对单抗的亚型进行鉴定,鉴定结果显示3株单克隆抗体重链恒定区均为lgg1型,轻链恒定区均为kappa型。
[0079]
hrp标记效价测定:使用改良的过碘酸钠法对3株单克隆抗体进行标记,并使用直接elisa方法[使用制备的ha蛋白包被酶标板,100ng/孔,0.1ml/孔, 4℃包被过夜,洗涤后,使用5%的脱脂奶封闭,37℃孵育2h,洗涤后存于-15℃以下备用;将标记的单克隆抗体用pbs从1:5000开始进行倍比稀释,0.1ml/孔, 37℃孵育30min;洗涤后,加入0.1ml tmb单组分显色液,37℃孵育10min;加入终止液(2m硫酸),测定od450nm值;od450nm值≥1.0时判阳性]进行检测,结果显示,3株单克隆抗体的效价依次为1:10000、1:10000、1:20000。说明 3株单克隆抗体的标记效价很好。
[0080]
单克隆抗体配对验证:将筛选的3株单克隆抗体分别按照1μg/ml、100μl/孔包被酶标板,4℃包被过夜,洗涤后,使用5%的脱脂奶封闭,37℃孵育2h,洗涤后存于-15℃以下备用;使用制备的甲型h1n1病毒ha蛋白作为样品(稀释到50ng/ml,每孔100μl),37℃孵育30min;洗涤后加入配对的hrp标记的单克隆抗体(单克隆抗体1、2、5的稀释倍数分别为1:10000、1:10000、1:20000), 37℃孵育30min,洗涤后加tmb单组分显色液,37℃孵育10min;加入终止液 (2m硫酸),测定od450nm值。结果显示,1号抗体包被、2号抗体检测时, od450值最高,说明此时的反应最好,故选择1号包被、2号检测作为后续检测的配对抗体。具体结果见表1所示。
[0081]
表1单克隆抗体配对检测结果
[0082][0083]
实施例5:单克隆抗体序列测定
[0084]
使用trizol试剂(thermo公司),按照说明书提取杂交瘤细胞的总rna。然后按照中国发明专利(cn 113354734a)的方法对制备的单克隆抗体1和单克隆抗体2进行重链可变区和轻链可变区的测定。经过检测和分析,单克隆抗体1的重链可变区和轻链可变区的序列如表2所示,单克隆抗体2的重链可变区和轻链可变区的序列如表3所示。
[0085]
表2单克隆抗体1可变区序列信息
[0086][0087]
表3单克隆抗体2可变区序列信息
[0088]
[0089]
实施例6:单克隆抗体识别抗原表位的确定
[0090]
为研究单克隆抗体的识别区域,将表达的甲型h1n1病毒ha蛋白的二级结构、无序区域和跨膜区进行预测,结果(图3、图4和图5)所示,该蛋白基本没有无序区域,且没有跨膜区。因此,根据蛋白二级结构预测结果,将蛋白分为 8段,覆盖整个甲型h1n1病毒ha蛋白。多肽段氨基酸序列如表4所示。
[0091]
表4甲型h1n1病毒ha蛋白多肽设计结果
[0092][0093]
用合成的多肽和ha蛋白(100ng/ml,0.1ml/孔)包被酶标板,4℃包被过夜,洗涤后,使用5%的脱脂奶封闭,37℃孵育2h,洗涤后存于-15℃以下备用;以本发明获得的hrp标记的单克隆抗体1和2分别作为一抗(均为1:10000倍稀释)进行直接elisa试验,37℃孵育30min;洗涤后加tmb单组分显色液,37℃孵育10min;加入终止液(2m硫酸),测定od450nm值。结果显示(具体见图6),单克隆抗体1与p2发生特异性反应,单克隆抗体2与p6发生特异性反应,说明单克隆抗体的抗原识别位点位于p2,单克隆抗体2的抗原识别位点位于p6。
[0094]
实施例7:甲型h1n1病毒的检测(胶体金检测试纸条)
[0095]
试纸条制备:使用制备的单克隆抗体1标记乳胶微球(购于上海辉质,粒径为300nm,按照说明书进行标记),1%bsa封闭后均匀的铺在已处理好的的乳胶微球垫上,置37℃烘箱20小时,室温干燥保存备用;单克隆抗体2在硝酸纤维素膜上划线为t线(检测线),c线(质控线)为羊抗小鼠igg抗体,制备硝酸纤维素膜,c线靠近吸收垫,两线距离约5mm,置37℃烘箱20小时,室温干燥保存备用;将处理好的样品垫,乳胶微球垫,硝酸纤维素膜,吸水垫依次粘贴到pvc底板的相应位置,使乳胶微球垫、吸水垫分别与硝酸纤维素膜部分接触,样品垫与乳胶微球垫部分接触,制成大板(图7);用切条机将大板切成3mm 宽的试纸条,装上外壳,室温避光贮存备用。
[0096]
样品稀释液制备:pbs溶液中加入终浓度为0.1%的proclin300、0.5%的 tween-20、1%的bsa、5%的海藻糖,混合均匀后,定量分装(1ml/管),室温保存。
[0097]
试纸条检测:将待检样品(含全血、抗凝血、血清、血浆和组织上清液等) 滴加于检测孔(约30~40μl),立即加入等量的样品稀释液(也可以将样品稀释液与待检样品1:1混匀后再用于检测,加样量约为60~80μl);加样完成后将试纸条平放在桌面上,10分钟左右观察结果[出现两条条带(t:检测线,c:质控线),判为阳性;仅出现一条条带(c:质控线),判为阴性;质控线处不出现条带,判为无效]。
[0098]
试纸条检测结果:
[0099]
(1)特异性:将甲型h1n1流感病毒裂解疫苗、h1n2病毒鸡胚培养物、 h3n2病毒鸡胚培养物、乙型流感病毒鸡胚培养物灭活后用pbs稀释10倍后分别作为待检样品,进行检测。结果显示(图8-1),除甲型h1n1流感病毒裂解疫苗为阳性为,其它均为阴性。
[0100]
(2)灵敏度:用pbs将制备的甲型h1n1病毒ha蛋白稀释为10ng/ml、 5ng/ml、2.5ng/ml、1ng/ml,共4个梯度,使用制备的试纸条进行检测。结果显示(图8-2),10ng/ml、5ng/ml、2.5ng/ml检测结果均为阳性,1ng/ml检测结果为阴性,说明该试纸条的最低检测限能达到2.5ng/ml。
[0101]
(3)重复性:将(2)中制备的4个梯度的ha蛋白溶液,用试纸条连续检测10次。结果显示,10次检测结果均一致,即10ng/ml、5ng/ml、2.5ng/ml检测结果均为阳性,1ng/ml检测结果为阴性。
[0102]
实施例8:甲型h1n1病毒的检测(elisa法)
[0103]
试剂盒检测:使用单克隆抗体1包被酶标板(包被液为0.05m的碳酸盐缓冲液,ph9.6),100ng/孔,0.1ml/孔,4℃包被过夜,洗涤后,使用含2%bsa的 pbst封闭,37℃孵育2h,洗涤后存于-15℃以下备用;使用实施例7中的样品稀释液将待检样品稀释10倍,混匀后加到包被的酶标板中,0.1ml/孔,37℃孵育1h;洗涤后,加入用样品稀释液1:10000倍稀释的hrp标记的单克隆抗体2,0.1ml/ 孔,37℃孵育30min;洗涤后,加入0.1ml tmb单组分显色液,37℃孵育10min;加入终止液(2m硫酸),测定od450nm值,当p/n值>2.1时判为阳性,否则为阴性,其中p为样品od450nm值,n为空白对照od450nm值。
[0104]
试剂盒检测结果:
[0105]
(1)特异性:将甲型h1n1流感病毒裂解疫苗、h1n2病毒鸡胚培养物、 h3n2病毒鸡胚培养物、乙型流感病毒鸡胚培养物灭活后用pbs稀释10倍后分别作为待检样品,进行检测。结果(表5)显示,除甲型h1n1流感病毒裂解疫苗为阳性为,其它均为阴性。
[0106]
表5特异性检测结果
[0107][0108]
(2)灵敏度:用pbs将制备的甲型h1n1病毒ha蛋白稀释为10ng/ml、 5ng/ml、2.5ng/ml、1ng/ml,共4个梯度,使用制备的试剂盒进行检测。结果显示(表6),4个梯度检测结果均为阳性,说明该试剂盒的最低检测限能达到 1ng/ml。
[0109]
表6灵敏度检测结果
[0110][0111]
(3)重复性:将(2)中制备的4个梯度的ha蛋白溶液,用试剂盒连续检测10次。结果显示(表7),10次检测结果均一致,且cv值均小于10%,说明试剂盒的重复性很好。
[0112]
表7重复性检测结果
[0113][0114][0115]
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1