一种可降解dsRNA纳米载体的制备方法
一种可降解dsrna纳米载体的制备方法
技术领域
1.本发明涉及农药纳米载体技术领域,具体来说是一种可降解dsrna纳米载体的制 备方法。
背景技术:
2.传统化学农药由于利用效率低,它的过度使用严重威胁着生态系统和人类健康。 rna干扰(rnai)作为一种新兴的技术被认为有望取代传统化学农药,但是由于其自 身的特性导致双链rna(dsrna)易被酶解且难以穿透细胞膜,因此开发和利用功能 性纳米载体对dsrna进行运载、保护和靶向释放来提高rnai效率效果是当前纳米农 药领域发展的重要研究方向。
3.目前,laisney等(acs appl.mater.interfaces 2020,12,23,25645
–
25657)通过纳米 材料运载dsrna实现在草地贪夜蛾sf9细胞中的rnai,以草地贪夜蛾sf9稳定细胞株 (sf 9_luc)荧光素酶基因的rna干扰(rnai)为模型系统,研究了与不同纳米系统(聚 l-精氨酸和聚l-精氨酸功能化的金纳米粒子)结合的dsrna和裸露dsrna进入细胞能 力的比较,结果表明,与未结合的纳米系统相比,结合到不同纳米系统的dsrna具有 良好的进入细胞的能力。但纳米载体运载dsrna进入目标细胞内如何及时有效地将 dsrna释放的问题仍未被很好的解决。
4.本项目的研究目标内容为:合成可降解的新型两亲性高分子,并以此为基础构建一 种新型的具有atp响应性的可降解dsrna纳米载体。
技术实现要素:
5.本发明所要解决的技术问题在于如何制备可降解dsrna纳米载体,使纳米载体运 载dsrna进入目标细胞内可及时有效地将dsrna释放。
6.本发明通过以下技术手段实现解决上述技术问题的:
7.一种可降解dsrna纳米载体的制备方法,包括以下步骤:
8.(1)制备cdi:称取β-环糊精、三苯基膦和碘备用,先用溶剂溶解三苯基膦,再 将碘缓慢加入到上述溶液中,然后在65~75℃下加入β-环糊精,在氮气的保护下反应 22~24小时后,冰水浴下加入甲醇钠,过滤洗涤干燥固体得到cdi;
9.(2)制备cdcho:先用溶剂溶解cdi,再加入对羟基苯甲醛和催化剂,并在75~85℃ 下反应22~24h,然后在甲醇中沉降,过滤、洗涤、干燥固体得到cdcho;
10.(3)制备cdbr:分别将cdcho和催化剂溶解在溶剂中,6-溴己酰氯溶解在溶剂 中,再将6-溴己酰氯溶液缓慢滴入cdcho和催化剂的混合溶液中,然后在45~55℃反 应18~20小时,纯化后得到cdbr;
11.(4)制备cdn3:分别称取cdbr和叠氮化钠溶于溶剂中,加入催化剂,在55~65℃ 下反应22~24h,纯化后得到cdn3;
12.(5)制备cdman:分别称取cdn3、二价铜、催化剂和炔基化甘露糖溶在溶剂中, 向溶
液中加入零价铜,在氮气保护下,55~65℃反应12~14小时,后处理得到cdman;
13.(6)制备man-rh:称取cdman用溶剂溶解,称取14~21当量重的rh(酰胺化罗 丹明b)用乙醇溶解,两种溶液混合后室温反应1.5~2.5小时,加入还原剂后处理得到 man-rh;
14.(7)构建man-rh组装体:称取man-rh溶于共溶剂中,向溶液中加入水,后处理 得到man-rh组装体。
15.有益效果:首先经过步骤1、2的化学合成手段在β-环糊精原来外侧7个羟基的位 置上修饰醛基,经过步骤3、4的反应在原来内腔的14个羟基上修饰叠氮基团,然后在 步骤5中利用炔基化的甘露糖与叠氮基团的click点击反应将亲水性甘露糖接到β-环糊 精上,步骤6中酰胺化罗丹明b与醛基的形成亚胺后,用硼氢化钠将亚胺还原成胺得到 结构明确的两亲性高分子man-rh,最后通过步骤7构建man-rh组装体,即为可降解 dsrna纳米载体,该纳米载体具有良好的生物相容性,进入目标细胞内可及时有效地将 dsrna释放。
16.进一步方案,所述步骤1中的β-环糊精、三苯基膦、碘的当量重量比为1:12~14: 13~16。
17.优选的,所述步骤1~6中的溶剂选用n,n-二甲基甲酰胺。
18.进一步方案,所述步骤2中的催化剂选用碳酸钾。
19.优选的,cdi、对羟基苯甲醛、碳酸钾的当量重量比为1:10~15:6~8。
20.有益效果:反应过程中会产生酸,催化剂碳酸钾可以中和。
21.进一步方案,所述步骤3中的催化剂选用三乙胺。
22.优选的,cdcho、三乙胺、6-溴己酰氯的当量重量比为1:18~20:24~30。
23.有益效果:反应过程中会生成氯化氢,催化剂三乙胺成弱碱性,可以中和。
24.进一步方案,所述步骤4中的催化剂选用四丁基碘化铵。
25.优选的,cdbr、四丁基碘化铵、叠氮化钠的当量重量比为1:0.1~0.2:45~50。
26.进一步方案,所述步骤3和步骤4中的纯化方法采用柱层析法,采用乙酸乙酯和石 油醚为溶剂,且乙酸乙酯、石油醚体积比为1:1-10。
27.进一步方案,所述步骤5中的二价铜选用溴化铜、零价铜选用铜丝、催化剂选用五 甲基二乙烯三胺。
28.优选的,cdn3、溴化铜、五甲基二乙烯三胺和炔基化甘露糖的当量重量比为1:5~6: 40~45:20~28。
29.优选的,所述后处理方法为减压除去溶剂,再经透析、冻干得到cdman。
30.有益效果:炔基和叠氮的点击反应需要一价铜的催化,选用溴化铜和铜丝,利用催 化剂二价铜和零价铜的歧化反应在氮气氛围下形成一价铜。
31.进一步方案,所述步骤6中rh的制备方法为:分别称取1当量重的罗丹明和10~20 当量重的二乙烯三胺;将罗丹明和二乙烯三胺用乙醇溶解后,70℃回流反应24小时后 处理得到rh。
32.有益效果:二乙烯三胺通过与罗丹明b产生一个螺旋的内酰胺环,进而破环了其共 轭结构,抑制了罗丹明b荧光的发生。
33.进一步方案,所述步骤6中的溶剂选用n,n-二甲基甲酰胺、还原剂选用硼氢化钠。
34.优选的,cdman与rh的当量重量比为1:14~21。
35.优选的,n,n-二甲基甲酰胺与乙醇的体积比为2~3:1。
36.有益效果:所选溶剂的比例为n,n-二甲基甲酰胺和乙醇的比例为2:1,醛基和氨基 反应形成的亚胺动态共价键酸性条件下易裂解,选用硼氢化钠将亚胺还原成胺。
37.进一步方案,所述步骤7中的共溶剂选用dmso(二甲基亚砜)。
38.优选的,所述后处理方法为减压除去溶剂。
39.本发明的优点在于:
40.1.本发明利用炔基与叠氮基团的click点击反应和醛基与氨基反应形成动态共价键 得到结构明确的新型两亲性高分子。并以此构建新型dsrna纳米载体,该纳米载体进 入目标细胞内可及时有效地将dsrna释放。
41.2.本发明相较于传统的纳米载体,本发明利用atp的磷酸基团与多个氨基之间的氢 键作用来打开螺旋内酰胺环,使得该纳米载体具有很好的atp响应特性,可以用于其在 细胞内的定位跟踪。
42.3.本发明所构筑的dsrna纳米载体解决了传统纳米载体的释放问题,由于生物体内 都存在着大量atp,而本发明的dsrna纳米载体与atp结合会裂解,从而将包裹的物 质释放出来。
附图说明
43.图1为本技术实施例1中cdcho的核磁氢谱。
44.图2为本技术实施例1中cdbr的核磁氢谱。
45.图3为本技术实施例1中cdn3的核磁氢谱。
46.图4为本技术实施例1中cdman的核磁氢谱。
47.图5为本技术实施例1中man-rh的核磁氢谱。
48.图6为本技术实施例2中cdi、cdcho、cdbr和cdn3的傅里叶变换光谱。
49.图7为本技术实施例2中cdn3、cdman和man-rh的凝胶渗透色谱。
50.图8为本技术实施例2中cdn3、cdman、rh和man-rh的傅里叶红外光谱。
51.图9为本技术实施例2中man-rh的动态光散射曲线。
52.图10为本技术实施例3中man-rh、atp和man-rh+atp的傅里叶红外光谱。
53.图11为本技术实施例3中atp和atp加入到man-rh后的核磁磷谱的变化。
54.图12为本技术实施例3中man-rh随着加入不同摩尔量atp后的紫外和荧光的光 谱变化。
55.图13为本技术实施例3中man-rh荧光纳米载体在20℃、30℃、40℃加入atp后 的紫外和荧光随着时间的变化情况以及在560nm处的紫外和荧光变化曲线。
56.图14为本技术实施例4中man-rh随着加入不同浓度dsrna后zeta电位变化情况。
57.图15为本技术实施例4中man-rh包载dsrna的凝胶电泳图定量数据。
58.图16为本技术实施例4中man-rh、man-rh+rna和man-rh+atp的透射电镜图。
具体实施方式
59.为使本发明实施例的目的、技术方案和优点更加清楚,下面将结合本发明实施例, 对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例是本发明 一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在 没有
作出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
60.一种可降解dsrna纳米载体的制备方法,包括以下步骤:
61.(1)制备cdi:称取1当量重的β-环糊精、12~14当量重的三苯基膦和13~16当 量重的碘备用,先用n,n-二甲基甲酰胺溶解三苯基膦,再将碘缓慢加入到上述溶液中, 然后在65~75℃下加入β-环糊精,在氮气的保护下反应22~24小时后,冰水浴下加入甲 醇钠,过滤洗涤干燥固体得到cdi。
62.(2)制备cdcho:先用n,n-二甲基甲酰胺溶解1当量重的cdi,再加入10~15 当量重的对羟基苯甲醛和6~8当量重的碳酸钾,并在75~85℃下反应22~24h,然后在甲 醇中沉降,过滤、洗涤、干燥固体得到cdcho。
63.(3)制备cdbr:分别将1当量重的cdcho和18~20当量重的三乙胺溶解在n,n
‑ꢀ
二甲基甲酰胺中,24~30当量重的6-溴己酰氯溶解在n,n-二甲基甲酰胺中,再将6-溴己 酰氯溶液缓慢滴入cdcho和三乙胺的混合溶液中,然后在45~55℃反应18~20小时, 使用柱层析法(v
乙酸乙酯
:v
石油醚
=1:1-10)进行纯化,得到cdbr。
64.(4)制备cdn3:分别称取1当量重的cdbr和45~50当量重的叠氮化钠溶于n,n
‑ꢀ
二甲基甲酰胺中,加入0.1~0.2当量重的四丁基碘化铵,在55~65℃下反应22~24h,使 用柱层析法(v
乙酸乙酯
:v
石油醚
=1:1-10)进行纯化,得到cdn3。
65.(5)制备cdman:分别称取1当量重的cdn3、6当量重的溴化铜、40-45当量重 的五甲基二乙烯三胺和20-28当量重的炔基化甘露糖溶在n,n-二甲基甲酰胺中,向溶液 中加入0.2~0.4克铜丝,在氮气保护下,55~65℃反应22~24小时,然后减压除去n,n
‑ꢀ
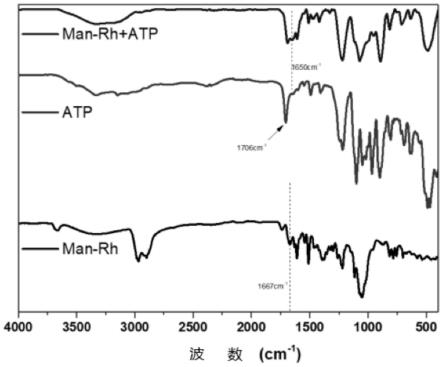
二甲基甲酰胺,经透析、冻干得到cdman。
66.(6)制备man-rh:分别称取1当量重的罗丹明和10~20当量重的二乙烯三胺;将 罗丹明和二乙烯三胺用乙醇溶解后,70℃回流反应24小时;加入h2o终止反应后,将 混合物溶液倒入分液漏斗中加入二氯甲烷取有机层;在所得溶液中加入无水硫酸镁除水, 然后过滤除去无水硫酸镁,利用旋蒸除去二氯甲烷,再使用柱层析法(v
甲醇
:v
二氯甲烷
=1:2-8) 进行纯化,得到单体rh(酰胺化罗丹明b)。
67.称取1当量重的cdman用n,n-二甲基甲酰胺溶解,称取14~21当量重的rh用乙 醇溶解,n,n-二甲基甲酰胺与乙醇的比例为2~3:1,两种溶液混合后室温反应1.5~2.5小 时,加入硼氢化钠后处理得到man-rh。
68.(7)构建man-rh组装体:称取man-rh溶于dmso中,向溶液中加入水,经透 析袋透析处理得到man-rh组装体。
69.实施例1
70.本技术实施例公开一种可降解dsrna纳米载体的制备方法,包括以下步骤:
71.(1)制备cdi:称取18.36g三苯基膦溶解在100ml的n,n-二甲基甲酰胺中,再 称取17.77g碘用10分钟时间缓慢加入到上述溶液中,将溶液升温至70℃,然后向深棕 色溶液中加入5.68g干燥的β-环糊精,在氮气环境下70℃反应24h,将得到的溶液减压 蒸发,直至除去60ml的n,n-二甲基甲酰胺;然后在冰水浴下加入30ml 3.0m的甲醇 钠溶液,再将反应混合物倒入500ml的甲醇中沉降,过滤,用甲醇、水和丙酮将沉淀 洗至无色,然后在70℃真空干燥箱中干燥12小时得到白色固体产物,即为cdi。
72.(2)制备cdcho:称3.8g的cdi溶解在80ml的n,n-二甲基甲酰胺中,再分别 称取
3.66g对羟基苯甲醛和1.93g碳酸钾加入到溶液中,在80℃条件下反应24h;然后 将反应后的溶液吹干后得到粘稠状粗产物,加入甲醇得到沉淀,过滤并用二氯甲烷和水 充分洗涤;最后在70℃真空干燥箱中干燥,并对干燥产物进行核磁共振分析。根据图1 的核磁氢谱,合成的产物为cdcho。
73.(3)制备cdbr:将0.93g的cdcho和1.01g的三乙胺溶于40ml的n,n-二甲基 甲酰胺中,再称取7.47g的6-溴己酰氯溶解在10mln,n-二甲基甲酰胺中,在室温下用 滴液漏斗将其缓慢滴入混合溶液中,在50℃条件下反应19h。减压除去30ml的n,n
‑ꢀ
二甲基甲酰胺,然后用100ml的二氯甲烷和30ml水萃取三次,用无水硫酸镁除去有机 相中的水,过滤旋干。使用柱层析法(v
乙酸乙酯
:v
石油醚
=1:5)进行纯化,并对纯化产物 进行核磁共振分析。根据图2的核磁氢谱,合成的产物为cdbr。
74.(4)制备cdn3:分别称取434mg的cdbr和325mg的叠氮化钠溶解于10ml的 n,n-二甲基甲酰胺中,加入7.4mg的四丁基碘化铵,在60℃条件下反应24h。减压除去 30ml的n,n-二甲基甲酰胺,然后用100ml的二氯甲烷和30ml水萃取三次,用无水硫 酸镁除去有机相中的水,过滤旋干。使用柱层析法(v
乙酸乙酯
:v
石油醚
=1:5)进行纯化, 并对纯化产物进行核磁共振分析。根据图3的核磁氢谱,合成的产物为cdn3。
75.(5)制备cdman:
76.称取190mg的cdn3、78mg的溴化铜、390mg的五甲基二乙烯三胺和286mg的炔 基化甘露糖溶于10ml的n,n-二甲基甲酰胺中,再加入0.3g用盐酸浸泡后的铜丝;在 氮气氛围下60℃反应24h;减压除去8ml的n,n-二甲基甲酰胺;用截留分子量为3500 的透析袋透析48小时,其过程中至少换6次水,然后将透析产物冻干,并进行核磁共 振分析。根据图4的核磁氢谱,合成的产物为cdman。
77.(6)制备man-rh:
78.称取4g罗丹明b加入250ml圆底烧瓶中,并用50ml的乙醇溶解,待完全溶解后, 量取20ml二乙烯三胺加入圆底烧瓶中,在70℃条件下回流反应24h;加入100ml的 h2o终止反应,并将混合物溶液倒入分液漏斗中加入二氯甲烷取有机层;然后在所得溶 液中加入无水硫酸镁除水,然后过滤除去无水硫酸镁;利用旋蒸除去二氯甲烷,再使用 柱层析法(v
甲醇
:v
二氯甲烷
=1:5)进行纯化,得到单体rh。
79.将20mg的cdman溶解在2ml的n,n-二甲基甲酰胺中,称取30mg的rh溶解在1ml乙醇中,将两种溶液混合在室温下反应2小时,加入50mg硼氢化钠反应十分钟后 用截留分子量7000的透析袋透析48小时,期间至少更换6次水,然后将透析产物冻干, 并进行核磁共振分析。根据图5的核磁氢谱,合成的产物为man-rh。
80.(7)构建man-rh组装体:将10mg的man-rh溶解在1ml的dmso中,然后缓 慢加入5ml水,轻轻搅拌10分钟,将混合物用截留分子量7000的透析袋透析24小时。 最后,将溶液稀释到0.5mg/ml,激光笔照射能观察到明显的丁达尔效应,说明在水溶 液中形成了稳定的组装体,即为可降解的dsrna纳米载体。
81.实施例2
82.①
在实施例1的制备过程中,对步骤1~4中制备的产物进行傅里叶变换光谱分析, 分析结果如图6所述。
83.图6为cdi、cdcho、cdbr和cdn3的傅里叶变换光谱,1682cm-1
处醛基特征峰 的出现、
1742cm-1
处酯键特征峰的出现以及3328cm-1
处羟基特征峰的消失和2095cm-1
处叠氮基团特征峰的出现分别证明了cdcho、cdbr和cdn3的成功合成。
84.②
对步骤4~6中制备的产物进行凝胶渗透色谱分析和傅里叶红外光谱分析,分析结 果如图7、8所示。图7为cdn3、cdman和man-rh的凝胶渗透色谱,曲线左移意味 着分子量的增加,证明了反应的发生。
85.图8为cdn3、cdman、rh和man-rh的傅里叶红外光谱,2095cm-1
处叠氮基团的 消失意味着cdman的合成,man-rh中1682cm-1
醛基特征峰的消失和1667cm-1
处酰胺 键的出现表明反应的发生。
86.③
对步骤7制备的产物进行动态光散射分析,分析结果如图9所示。图9为man-rh 的动态光散射曲线,man-rh组装体的动力学直径为12nm,表明形成了稳定的组装体。
87.实施例3
88.向实施例1制备的man-rh组装体加入atp。
89.①
对man-rh、atp和man-rh+atp进行傅里叶红外光谱分析,对atp和atp加 入到man-rh后进行核磁磷谱分析,分析结果如图10、11所示。
90.图10为man-rh、atp和man-rh+atp的傅里叶红外光谱,1706cm-1
处出现了atp 中的峰以及酰胺键从1667cm-1
到1650cm-1
处的偏移表明形成氢键。图11为atp和atp 加入到man-rh后的核磁磷谱的变化,化学位移发生了偏移,说明形成了氢键。
91.纳米载体材料的结构及其与atp作用机理如下:
[0092][0093]
man-rh纳米载体结构
[0094][0095]
man-rh纳米载体与atp结合
[0096]
由此可见,本发明利用atp的磷酸基团与多个氨基之间的氢键作用来打开螺旋内酰 胺环,使得本纳米载体具有很好的atp响应特性,可以用于其在细胞内的定位跟踪。
[0097]
②
向man-rh中加入不同摩尔量atp,并进行紫外和荧光的光谱分析,分析结果如 图12所示。图12为man-rh随着加入不同摩尔量atp后的紫外和荧光的光谱变化,随 着atp的增加,形成氢键的数量增加,伴随着荧光和紫外强度的增强,直至达到饱和, 说明该材料对于atp具有响应性。
[0098]
③
man-rh荧光纳米载体在20℃、30℃、40℃加入atp后以及在560nm处的紫外 和荧光变化进行分析,分析结果如图13所示。图13为man-rh荧光纳米载体在20℃、 30℃、40℃加入atp后的紫外和荧光随着时间的变化情况以及在560nm处的紫外和荧 光变化曲线,温度越高,反应进行的越迅速,说明man-rh与atp的反应速率可以由温 度进行调控。
[0099]
实施例4
[0100]
向实施例1制备的man-rh组装体中加入rna。
[0101]
①
向man-rh中加入不同浓度的rna,并监测zeta电位的变化情况,分析结果如 图14所示。图14为man-rh随着加入不同浓度rna后zeta电位的变化情况。man-rh 的浓度为0.1mg/ml,zeta电位由正转负,说明man-rh与rna发生了结合。
[0102]
②
对man-rh包载rna进行凝胶电泳定量分析,分析结果如图15所示。图15为 man-rh包载rna的凝胶电泳图定量数据,从图中可以看出,当rna与man-rh的质 量比为1:320时,载体可以对rna完全包裹,表明本技术制备的man-rh载体对dsrna 具有很好的包裹能力,。
[0103]
③
对man-rh、man-rh+rna和man-rh+atp进行透射电镜分析,分析结果如图16 所示。图16为man-rh、man-rh+rna和man-rh+atp的透射电镜图,man-rh加入 rna前后均为蠕虫状形貌,加入atp后组装结构被破坏。
[0104]
以上结果表明,由于生物体内都存在着大量atp,而本发明的dsrna纳米载体与 atp结合会裂解,从而将包裹的物质释放出来。
[0105]
使用原理及优点:通过在β-环糊精原来外侧7个羟基的位置上修饰醛基,在原来内 腔的14个羟基上修饰叠氮基团,然后利用炔基化的甘露糖与叠氮基团的click点击反应 将亲水性甘露糖接到β-环糊精上,酰胺化罗丹明b与醛基形成亚胺后,用硼氢化钠将亚 胺还原成胺得到结构明确的两亲性高分子man-rh,并构建man-rh组装体,以此制备 得到的可降解dsrna纳米载体,具有良好的生物相容性,进入目标细胞内可及时有效 地将dsrna释放。
[0106]
以上实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述实施例对 本发明进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述各实施 例所记载的技术方案进行修改,或者对其中部分技术特征进行等同替换;而这些修改或 者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的精神和范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1