一种高通量快速检测体液宏基因组病原微生物的方法与流程
1.本发明涉及生物技术领域,具体涉及宏基因组病原微生物的提取及得到核酸提取物,并对其核酸进行文库的构建,最终进行宏基因组测序。
背景技术:
2.游离dna(circulatingfreednaorcellfreedna,cfdna),循环游离dna或者细胞游离dna,是释放到血浆中的降解的dna片段。cfdna存在于人体的各种体液中,随组织损伤、癌症和炎症反应等发生浓度变化。正常人体的cfdna主要通过细胞凋亡过程中产生的小而均匀的185-200bp小片段dna。在某些疾病和特殊状态下,其他细胞也会释放游离dna入血,包括来源于肿瘤细胞的循环肿瘤dna(ctdna)和来源于胎儿的cfdna等,导致产生大小不同且大于200bp的大片段dna。血液不是可用于液体活检的唯一体液,例如尿液、粪便、脑脊液(csf)、唾液、胸水和腹水都是潜在来源,可从中获得某些疾病或感染的核酸物质(包括cfdna)。
3.游离核酸的提取成为检测的关键步骤,传统提取使用的试剂沉淀法需要用到酚,氯仿等存在一定的毒性的试剂,实验过程中需要配置的试剂量多,存在较大的污染风险,且核酸提取浓度较低;常规的文库检测无法得知罕见病原,且对于片段长度的检测存在一定局限,为后续的临床检测带来难度。
4.近年来随着高通量测序技术的不断发展,尤其是新二代测序仪的出现,使宏基因组学发展尤为迅速。测序技术成本低、通量高、速度快,单次运行产出的数据量大,能够同时对几十万到几百万条dna分子进行测序,测序片段较为广泛,可以检测临床常规手段无法预知的病原微生物。
技术实现要素:
5.为解决现有技术问题,本发明的目的是提供一种快速检测体液宏基因组病原微生物的方法。针对体液样本建立高效的核酸提取方法,并对提取的核酸产物进行文库的构建。
6.为了实现上述目的,本发明提供如下技术方案:
7.一种高通量快速检测体液宏基因组病原微生物的方法,该方法中优化了细胞裂解液和洗涤液的配方,其中裂解液lsbuffer成分包括:乙二胺四乙酸的浓度为10-30mmol/l,氯化钠的浓度为100-350mmol/l,曲拉通x-100的浓度为3-10%体积分数,异硫氰酸胍的浓度为1-8mol/l、5~8wt%tween20。裂解结合液lbbuffer的成分包括:50-300g/l的异硫氰酸胍、2-8g/l的氯化钠、体积占比20%-50%的曲拉通x-100、体积占比5%-40%的异丙醇、5-15g/l的柠檬酸、三羟甲基氨基甲烷。洗涤液h1的成分包括:乙二胺四乙酸的浓度为5-100mmol/l,氯化钠的浓度为100-300mmol/l,无水乙醇的浓度为20-60%体积分数,异丙醇的浓度为25%-80%体积分数,曲拉通x-100的浓度为2-5%体积分数;3~7mol/l盐酸胍、1~10wt%tween20。二次洗涤液h2的成分包括:75%的乙醇。洗脱液的成分包括:10~20mmol/ltris-hcl和0.5~1.5mmol/ledta。
8.一种高通量快速检测体液宏基因组病原微生物的方法,包括体液样本中分离提取dna,得到核酸提取物,并对其核酸进行文库构建,最终进行宏基因组测序,得到所述样本相关的宏基因组测序结果。其整个检测步骤如下:
9.s1样本前处理:将所得样本进行离心处理,将上清转移到15ml新的离心管中。
10.s2细胞裂解:向s1中的离心管中加入proteinaseksolution和裂解液lsbuffer,最大速度涡旋混匀。涡旋后的离心管放入恒温水浴锅中进行孵育20-40min。孵育后静置10-15min。
11.s3微生物的裂解与结合:向s2的离心管中加入磁珠与裂解结合液lbbuffer,颠倒混匀,并于室温连续混匀5-20min。将离心管置于磁力分离架上,室温等待至溶液变得完全澄清,磁珠完全吸附于管内一侧;保持吸附状态,小心吸除上清,吸除所有上清后,移除磁力分离架。
12.s4一次洗涤:加入一次洗涤液h1,涡旋混匀3-7min;把离心管置于磁力分离架上,室温等待至磁珠完全吸附于管内一侧。保持吸附状态,小心吸除上清并移除磁力分离架;重复此步骤一次。
13.s5二次洗涤:加入二次洗涤液h2,涡旋混匀3-7min;把离心管置于磁力分离架上,室温等待至磁珠完全吸附于管内一侧。保持吸附状态,小心吸除上清并移除磁力分离架;重复此步骤一次。
14.s6干燥磁珠:把离心管置于磁力分离架上20-30min,以干燥磁珠。
15.s7dna洗脱:向离心管内加入50-100ul洗脱液,涡旋充分重悬磁珠,室温放置3-7min。
16.s8dna收集:把离心管置于磁力分离架上,室温等待至溶液变得完全澄清,磁珠完全吸附于管内一侧。小心转移上清dna产物至1.5ml离心管。
17.s9浓度测定:用equalbitdsdnahskit试剂与qubit仪器测定样本dna浓度。
18.s10利用聚合酶对游离的dna片段进行末端修复和5’端进行磷酸化和3’端加da尾,得到dna加a产物。对于测定提取浓度≦0.517ng/ul的样本建库时采取引入外源基因,提高建库质量。
19.s11使用连接酶,将步骤s10中的dna加a产物与dna接头连接在一起,得到含有接头形式的dna片段。
20.s12将步骤s11得到dna片段进行纯化处理。
21.s13将步骤s12纯化后的dna片段作为模板进行pcr扩增。
22.s14将步骤s13中pcr扩增后的产物进行分选。
23.s15将步骤s14中分选后得到的产物进行纯化,得到最终产物。
24.所述步骤s1中的样本类型如果为血液,应进行1000-3000rpm,5-10min,将离心后得到的上清液转移到新的15ml离心管中进行再次进行离心,离心条件为10000-16000g,5-10min。转移上清1-6ml到新的15ml离心管中,备用。如果为非血液样本,直接进行10000-16000g,5-10min离心,将上清转移到新的15ml离心管中,备用。
25.所述步骤s2中proteinaseksolution的加入量为10-30ul。
26.所述步骤s2中裂解液lsbuffer的成分包括,乙二胺四乙酸的浓度为10-30mmol/l,氯化钠的浓度为100-350mmol/l,曲拉通x-100的浓度为3-10%体积分数,异硫氰酸胍的浓
度为1-8mol/l、5~8wt%tween20。
27.所述步骤s3中裂解结合液lbbuffer的成分为50-300g/l的异硫氰酸胍、2-8g/l的氯化钠、体积占比20%-50%的曲拉通x-100、体积占比5%-40%的异丙醇、5-15g/l的柠檬酸、三羟甲基氨基甲烷。
28.所述步骤s4中洗涤液h1的成分为乙二胺四乙酸的浓度为5-100mmol/l,氯化钠的浓度为100-300mmol/l,无水乙醇的浓度为20-60%体积分数,异丙醇的浓度为25%-80%体积分数,曲拉通x-100的浓度为2-5%体积分数;3~7mol/l盐酸胍、1~10wt%tween20。
29.所述步骤s5中二次洗涤液h2的成分为75%的乙醇。
30.所述步骤s7中洗脱液的成分为10~20mmol/ltris-hcl和0.5~1.5mmol/ledta。
31.所述步骤s10中如果样本提取浓度显示低时,则向提取产物中引入20ng的外源基因进行建库。
32.所述步骤s105’端进行磷酸化和3’端加da尾的反应条件为10-20℃,15-20min,55-65℃,15-20min。
33.所述步骤s11中pcr反应条件为15-20℃,10-17min。
34.所述步骤s13中pcr扩增反应条件为95℃,3min;98℃,20s;60℃,15s;72℃,30s;72℃,5min,循环数依据建库的数据量来决定。
35.该方法为提取步骤优化了细胞裂解液、裂解结合液、一次洗涤液和二次洗涤液的配方,可以更好地释放样本核酸;建库步骤优化了低样本量建库的实验方法,保证实验样本顺利上机并获得准确数据量。与现有技术相比,本发明的有益效果为,样本的提取的时间较以往的提取时间明显减短,且提取浓度较为均一,纯度较好,至少可以满足50ng建库,如果建库量极低,例如≦20ng建库则引入外源基因共同建库,避免使用未知建库量进行后续建库操作。本发明优化了体液样本提取的裂解液、裂解结合液、一次洗涤液、二次洗涤液的配方,充分释放了体液样本中的遗传物质;且病原微生物建库过程中解决了低样本量建库的实验方法。
具体实施方式
36.以下对本发明的优选实施例进行说明,应当理解,此处所描述的优选实施例仅用于说明和解释本发明,并不用于限定本发明。
37.实施例1
38.一种高通量快速检测体液宏基因组病原微生物的方法,其特征在于,包括以下步骤:
39.(1)样本前处理:将所得样本进行离心处理,将上清转移到15ml新的离心管中。
40.(2)细胞裂解:向(1)中的离心管中加入proteinaseksolution和裂解液lsbuffer,最大速度涡旋混匀。涡旋后的离心管放入恒温水浴锅中进行孵育30min。孵育后静置10min。
41.(3)微生物的裂解与结合:向(2)的离心管中加入磁珠与裂解结合液lbbuffer,颠倒混匀,并于室温连续混匀10min。将离心管置于磁力分离架上,室温等待至溶液变得完全澄清,磁珠完全吸附于管内一侧;保持吸附状态,小心吸除上清,吸除所有上清后,移除磁力分离架。
42.(4)一次洗涤:加入一次洗涤液h1,涡旋混匀5min;把离心管置于磁力分离架上,室
温等待至磁珠完全吸附于管内一侧。保持吸附状态,小心吸除上清并移除磁力分离架;重复此步骤一次。
43.(5)二次洗涤:加入二次洗涤液h2,涡旋混匀5min;把离心管置于磁力分离架上,室温等待至磁珠完全吸附于管内一侧。保持吸附状态,小心吸除上清并移除磁力分离架;重复此步骤一次。
44.(6)干燥磁珠:把离心管置于磁力分离架上25min,以干燥磁珠。
45.(7)dna洗脱:向离心管内加入50-100ul洗脱液,涡旋充分重悬磁珠,室温放置5min。
46.(8)dna收集:把离心管置于磁力分离架上,室温等待至溶液变得完全澄清,磁珠完全吸附于管内一侧。小心转移上清dna产物至1.5ml离心管。
47.(9)浓度测定:用equalbitdsdnahskit试剂与qubit仪器测定样本dna浓度。
48.对比例1
49.(1)1-10ml体液样本,于3000-5000
×
g离心5-10min后取上清置干净的离心管中,于10000-16000rpm高速离心5-10min后收集上清液。
50.(2)向收集的上清液中加入蛋白酶k和未经优化的裂解缓冲液bufferls,混匀后进行孵育处理得到裂解混合物。
51.(3)向裂解混合物中加入混有异丙醇的吸附结合液bufferlb,混匀后冰浴3-5min,将混合溶液转入硅胶吸附柱进行负压抽滤;
52.(4)抽滤完成后,依次使用未经优化的第一次清洗液bufferh1和第二次清洗液bufferh2和无水乙醇对硅胶吸附柱进行洗涤,离心处理后在室温条件下晾干,得到去除杂质的吸附有cfdna的硅胶吸附柱;
53.(5)加入20-150ul洗脱液对硅胶吸附柱进行洗脱,离心收集洗脱液,得到cfdna。
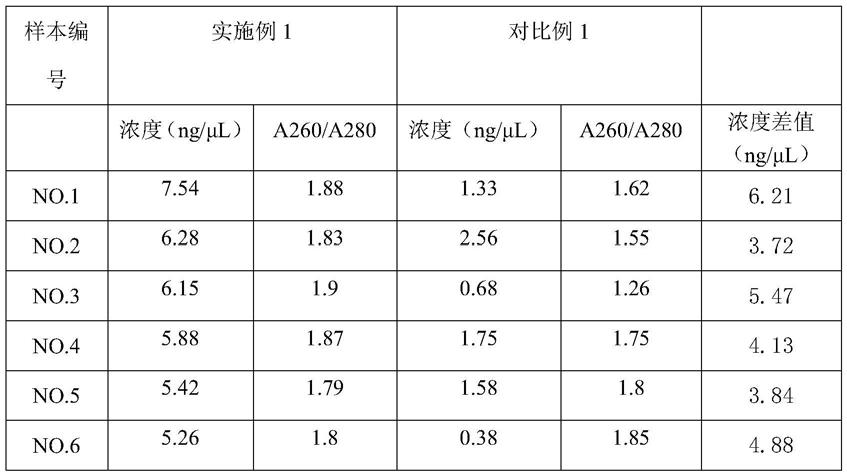
54.实验结果如表1:
55.表1体液宏基因组病原微生物提取浓度效果对比
[0056][0057]
注:对比例1为未经优化细胞裂解液和洗涤液成分的提取效果。
[0058]
表1结果显示经优化提取试剂盒中细胞裂解液和洗涤液成分后所得的体液样本
dna浓度均高于传统的实验方法,且浓度均一,可以满足100ng建库,a260/a280比值均在1.8-2.0范围内。
[0059]
实施例2
[0060]
(1)将提取浓度低的样本中加入20ng外源基因,之后利用末端修复酶进行末端修复和dna的5’端磷酸化以及3’端加a,得到dna加a产物。
[0061]
(2)使用连接酶,将步骤(1)中的dna加a产物与dna接头连接在一起,得到含有接头形式的dna片段。
[0062]
(3)将步骤(2)得到dna片段进行纯化处理。
[0063]
(4)将步骤(3)纯化后的dna片段作为模板进行pcr扩增。
[0064]
(5)将步骤(4)中pcr扩增后的产物进行分选。
[0065]
(6)将步骤(5)中分选后得到的产物进行纯化,得到最终产物。
[0066]
对比例2
[0067]
(1)将提取浓度低的样本直接用末端修复酶进行末端修复和dna的5’端磷酸化以及3’端加a,得到dna加a产物。
[0068]
(2)使用连接酶,将步骤(1)中的dna加a产物与dna接头连接在一起,得到含有接头形式的dna片段。
[0069]
(3)将步骤(2)得到dna片段进行纯化处理。
[0070]
(4)将步骤(3)纯化后的dna片段作为模板进行pcr扩增。
[0071]
(5)将步骤(4)中pcr扩增后的产物进行分选。
[0072]
(6)将步骤(5)中分选后得到的产物进行纯化,得到最终产物。实验结果如表2:
[0073]
表2体液宏基因组病原微生物建库浓度效果对比
[0074][0075][0076]
注:对比例2为提取浓度低,建库时未引入外源基因的实验结果。
[0077]
表2结果显示实施例2中引入20ng外源基因后样本建库浓度均一且稳定性较好,而对比例2中没有加入外源基因的低浓度样本,建库浓度不均一,有的过高、有的过低,过高的浓度会导致高reads背景菌,过低的浓度会导致无法上机的风险。
[0078]
以上所述,仅是本发明的较佳实施例,任何熟悉本领域的技术人员均可能利用上
述阐述的技术方案对本发明加以修改或将其修改为等同的技术方案。因此,依据本发明的技术方案所进行的任何简单修改或等同置换,尽属于本发明要求保护的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1