一种甲壳素的制备方法
1.本发明涉及工业生产的技术领域,具体为一种甲壳素的制备方法。
背景技术:
2.甲壳素,化学名称为β-(1,4)-2-乙酰氨基-2-脱氧-d-吡喃葡聚糖,由n-乙酰氨基葡萄糖以β-1,4糖苷键缩合而成,又名甲壳质、几丁质、壳多糖等,是地球上存在量仅次于纤维素的多糖,也是自然界中除蛋白质外数量最大的含氮天然有机高分子化合物。甲壳素广泛存在于虾蟹等甲壳动物及各类昆虫的表面和乌贼、贝类等软体动物的骨骼以及蘑菇和菌类的细胞壁中。蟹壳中含有丰富的甲壳素,含量高达蟹壳的三分之一。
3.甲壳素易脱乙酰基为壳聚糖,壳聚糖是一种良好的抗菌剂,可以抑制多种细菌、真菌的生长,可抑制大肠杆菌、沙门菌属、金黄色葡萄球菌、产气单胞菌属及某些真菌等的生长。甲壳素和壳聚糖都有很好的生物降解性。甲壳素能够被溶菌酶、乙酰氨基葡萄糖苷酶和脂肪酶降解,壳聚糖可通过化学(酸解)或酶法被生物降解。除此之外,壳聚糖具有良好的生物相容性,对动植物都有良好的适应性,对生物体无刺激性,炎症反应小,在日本、意大利和芬兰等国家,壳聚糖被批准用于食品中,fda也批准壳聚糖用于伤口敷料。
4.在食品工业中,全世界每年丢弃的蟹类废弃物约为600-800万吨,大多废弃物被填埋或焚烧,不仅造成相当大的环境二次污染问题,还不能充分利用这些废弃物的价值。蟹壳中富含甲壳素、蛋白质等有机质以及钙等无机质。蟹壳中碳酸钙的含量高达20%-50%,蛋白质含量高达20%-40%,除了碳酸钙及蛋白质,蟹壳中最主要的成分即为甲壳素,在蟹壳中的含量有15%-40%。
5.从蟹壳中提取甲壳素的方法有酸碱法、酶法以及生物法。最常见的甲壳素提取方法是酸碱法,该方法用酸去除碳酸钙等无机盐,用碱脱蛋白,再脱色素得到甲壳素。传统的酸碱法操作方便,应用广泛,但是在生产过程中会产生大量酸碱废液,对环境造成很大的污染,并且需要对废液进行处理这就加大了生产成本。相比之下,生物法不但环保,且不需要高昂的成本,但是生产周期较长、发酵效率太低,因此寻找一种低廉、便捷、高效的方式来提高发酵效率具有深远的意义。
6.乳酸菌是一种益生菌能够将碳水化合物发酵成乳酸,可用于甲壳素的制备。乳酸菌发酵时产生的乳酸由葡萄糖分解产生,从而形成抑制腐败微生物生长的低ph条件。乳酸与碳酸钙反应形成的乳酸钙沉淀可通过洗涤除去;虾蟹废物的脱蛋白通过菌株产生的蛋白水解酶水解,故而可以用来去除蟹壳中的矿物质和蛋白质。除此之外,乳酸菌通过发酵产生的有机酸、特殊酶系、酸菌素等物质具有特殊生理功能。大量研究资料表明,乳酸菌能促进动物生长,调节胃肠道正常菌群、维持微生态平衡,从而改善胃肠道功能、提高食物消化率和生物效价、降低血清胆固醇、控制内毒素、抑制肠道内腐败菌生长、提高机体免疫力等,与人的健康密切相关。乳酸菌广泛存在于我们的生活之中,许多食物中都含有乳酸菌,例如酸奶、活性乳酸菌饮料、泡菜等。乳酸菌不仅可以改善食品的风味,还能提高食品的营养价值,使食品的储存期延长,赋予食品更高的利用价值。
技术实现要素:
7.本发明的目的在于,研究和设计了一种低强度超声促进生物法发酵甲壳素的制备方法,解决了现有技术中甲壳素制备存在的成本高、不环保等问题。
8.为了解决上述技术问题,本发明采用如下技术方案:
9.一种甲壳素的制备方法,包括如下步骤:
10.a、筛选乳杆菌,确定发酵能力最强的单菌,选为发酵乳酸菌;
11.b、将所述发酵乳酸菌接种到培养基中,培养后获得菌液;
12.c、将已灭菌的蟹壳配置在糖水中,形成蟹壳-糖水混合物,备用;
13.d、将所述菌液接种到所述蟹壳-糖水混合物中,进行超声处理发酵,获得初级发酵液;
14.e、在所述初级发酵液加入强酸处理,之后再加入强碱处理,漂白后,获得不溶性甲壳素。
15.本发明充分利用食品工业废弃物螃蟹壳,从中提取甲壳素。运用生物发酵结合酸碱法生产甲壳素,在反应的初期采用生物发酵的方法,从而大幅度减少酸碱的使用(减少量达到70~80%),减少污染的同时降低成本。在反应的后期,生物发酵趋于缓慢,因此采用酸碱法辅助完整最后阶段的甲壳素提取,保证了较高的生产效率,且生物发酵结合酸碱法生产的甲壳素纯度达到90%,是理想的工业生产方法。
16.优选的,包括如下步骤:
17.a、筛选乳杆菌,确定发酵能力最强的单菌,选为所述发酵乳酸菌;
18.b、将所述发酵乳酸菌以5~10%的接种量接种到液体培养基中,恒温培养8~12h,培养后获得所述菌液;
19.c、将已灭菌的蟹壳粉末按质量体积比1g:2~6ml配置在糖水中,所述糖水中糖的质量浓度为5~25%,形成所述蟹壳-糖水混合物,备用
20.将所述菌液以5~10%的菌液接种量接种到所述蟹壳-糖水混合物中,进行超声处理,恒温发酵32~72h,获得初级发酵液;
21.d、在所述初级发酵液加入1mol/l-1
的hcl溶液处理,之后再加入8%的naoh溶液处理,漂白后,获得所述不溶性甲壳素。
22.优选的,步骤c中,所述超声处理为单时间点间歇超声,具体为:在发酵开始时进行第一次超声5~20min之后每间隔8h超声5~20min,超声功率为0.167w/cm2,超声频率为40khz,超声温度为37℃。
23.超声波是一种频率超过人类听阈的声波。它是一种由超声换能器产生的振动能量,能产生加热作用、机械传质作用和空化作用,超声作为一种绿色和经济的食品加工技术,具有方向性好、穿透力强、还有一系列的反应效应、乳化效应、热学效应、力学效应等等,这种无危害、无化学添加的非热处理手段使其在许多食品加工应用中的潜在应用开辟了可能性。根据强度可将超声分为高强度超声和低强度超声,不同强度的超声波对微生物可产生不同程度的影响。低强度超声处理产生的空化效应对细胞的损伤较小,可以改善膜的通透性,从而加快物质的转移并促进细胞的生长繁殖,并可以提高代谢物产量,因此超声技术在微生物发酵工程上具有广阔的应用前景。本发明在研究中发现,在蟹壳发酵制备甲壳素的过程中,采用超声处理,特别是单时间点间歇超声处理,能有效地提高反应效率和发酵质
量。
24.优选的,在发酵开始时进行第一次超声10min之后每间隔8h超声10min。
25.优选的,步骤c中,将已灭菌的蟹壳按质量体积比1g:3ml配置在所述糖水中;所述糖水为葡萄糖水,所述糖水中糖的质量浓度为15%。
26.优选的,步骤a中,所述发酵乳酸菌为副干酪乳杆菌,其ncbi号为nr_025880.1。
27.优选的,步骤a筛选乳杆菌的具体操作为:将复合乳酸菌进行分离纯化,挑出若干个单菌落,将得到的单菌分别发酵蟹壳,确定发酵能力最强的单菌,进行菌种鉴定,确定所述发酵乳酸菌。
28.优选的,使用平板划线法进行分离纯化,使用16s rdna鉴定进行菌种鉴定。
29.筛选一种发酵蟹壳产甲壳素的乳酸菌,包括以下步骤:
30.步骤一、配置培养基:于电子天平称量1.08g mrs营养肉汤粉末,倒入锥形瓶中,加入20ml蒸馏水,摇匀后盖好锥形瓶塞于121℃高压灭菌锅15min,得到20ml mrs液体培养基。之所以选用mrs液体培养基,是因为该培养基对乳酸菌选择性培养,适合培养分离乳酸菌。
31.步骤二、接菌培养:经过高压灭菌后的mrs液体培养基冷却至室温后,从冰箱取出-20℃保存的复合乳酸菌粉,以接种量4%的复合乳酸菌粉接种于mrs液体培养基中于37℃恒温培养箱中培养8h,得到浑浊的复合乳酸菌液。
32.步骤三、平板划线法培养:将培养所需的平板包好,固体培养基配置好后于121℃高压灭菌锅灭菌15min。共灭了4个平板,100ml固体培养基,100ml的固体培养基需要5.4g mrs营养肉汤粉末、2g琼脂、100ml蒸馏水。在超净台中,将灭菌完成的固体培养基趁热倒入灭菌后的平板,每个平板大约需要20ml左右的固体培养基,在室温下冷凝20-40min至培养基凝固。
33.在超净台中,把每个平板划分为4个区域。将接种环的金属丝在酒精灯外焰灼烧至通红,然后略倾斜接种环,灼烧金属杆,冷却后用接种环取一环复合乳酸菌液,进行平板划线,将接种完毕的平板包上封口膜,然后于37℃恒温培养箱中培养48h。
34.步骤四、挑菌:将平板从培养箱移入超净台,准备好事先已灭菌的mrs液体培养基,接种环灼烧后冷却,用接种环从平板中选取大而饱满、未与其他菌落重叠的单菌落于液体培养基中。共挑取了7个单菌落,分别于不同的试管中,然后移入37℃恒温培养箱静置培养8h。
35.步骤五、发酵:将培养得到的菌液分别留种,标清楚序号于冰箱-20℃保存。并用这7个菌分别发酵蟹壳,发酵72h之后用edta法测量发酵液中的钙含量,计算脱钙率,选取发酵液中钙含量最高的单菌。
36.步骤六、菌种鉴定:通过发酵选取出发酵能力最强的单菌,对该菌16s rdna菌株鉴定。鉴定结果为该菌为副干酪乳杆菌,该菌的ncbi号为nr_025880.1。
37.优选的,步骤d中,漂白的具体操作为:采用质量浓度为30%过氧化氢常温反应1h完成脱色处理。
38.优选的,步骤b中,培养基为mrs液体培养基;步骤c中,蟹壳灭菌的具体操作为在灭菌锅中,121℃条件下灭菌10~30min。
39.与现有技术相比较,实施本发明,具有如下有益效果:
40.本发明一方面节约了大量的强酸碱的使用量,达到保护环境的目的。另一方面,使
用“单时间点间歇超声法”促进发酵,并在发酵72h后结合酸碱法完成甲壳素的提取,在保护环境的前提下提高了甲壳素的提取效率,同时提高了获得的甲壳素的纯度,适合于在工业上进行大规模生产。本发明运用生物发酵结合酸碱法生产甲壳素,降低成本并保证了生产效率,同时甲壳素纯度得到有效提高,达到90%以上,是理想的工业生产方法。
附图说明
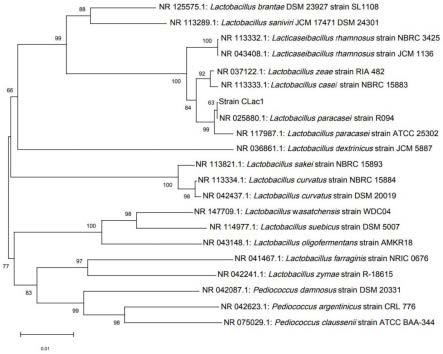
41.图1是本发明复合乳酸菌分离纯化得到的菌经16s rdna鉴定得到的菌种进化树示意图。
42.图2是本发明的不同培养条件对发酵液中钙含量的影响,其中:a——葡萄糖添加量、b——菌接种量、c——培养方式、d——固液比不同对发酵液中钙含量的影响。
43.图3是本发明的不同间歇超声时长(5min,10min,20min)、超声方式(单时间点间歇超声、一直超声)对副干酪乳杆菌发酵蟹壳脱钙的影响。
44.图4是本发明的低强度超声在不同时期对发酵脱钙的影响。
45.图5是本发明在最佳发酵条件下,低强度超声对发酵脱蛋白的影响。
46.图6是本发明的低强度超声在不同培养环境下对副干酪乳杆菌od
600
的影响。其中:a为mrs培养基下、b为15%葡萄糖下低强度超声对副干酪乳杆菌od
600
的影响。
47.图7是本发明的低强度超声对副干酪乳杆菌活菌数的影响。
48.图8是本发明的低强度超声对副干酪乳杆菌ph的影响。
49.图9是本发明的不同处理方式的蟹壳的扫描电镜图,其中:a为蟹壳、b为单独对蟹壳进行超声、c为在最适发酵条件下发酵蟹壳得到的残渣、d为0.167w/cm2间歇超声10min协同发酵得到的残渣的扫描电镜图。
50.图10是本发明的蟹壳发酵残渣的固体核磁共振光谱图,其中:a代表1hnmr谱、b代表
13
c nmr光谱图,而灰色和黑色分别代表在最佳发酵条件下通过发酵蟹壳获得的残渣的nmr光谱图和用低强度超声波间歇处理10min得到的残渣的nmr光谱图。
51.图11是本发明的不同处理方式的蟹壳的红外光谱图,其中:a为蟹壳、b为单独对蟹壳进行超声、c为在最适发酵条件下发酵蟹壳得到的残渣、d为0.167w/cm2间歇超声10min协同发酵得到的残渣的红外光谱图。
具体实施方式
52.为使本发明的目的、技术方案和优点更加清楚,下面将结合附图对本发明作进一步地详细描述,但本发明的实施方式不限于此。
53.实施例1:
54.复合乳酸菌中分离出副干酪乳杆菌
55.本发明将复合乳酸菌在mrs固体培养基中通过平板划线法培养,然后将单菌落挑出于mrs液体培养基中培养得到纯的单菌,对该菌16s rdna鉴定,鉴定结果为该菌为副干酪乳杆菌,该菌的ncbi号为nr_025880.1。具体操作为:
56.步骤一、配置培养基:于电子天平称量1.08g mrs营养肉汤粉末,倒入锥形瓶中,加入20ml蒸馏水,摇匀后盖好锥形瓶塞于121℃高压灭菌锅15min,得到20ml mrs液体培养基。之所以选用mrs液体培养基,是因为该培养基对乳酸菌选择性培养,适合培养分离乳酸菌。
57.步骤二、接菌培养:经过高压灭菌后的mrs液体培养基冷却至室温后,从冰箱取出-20℃保存的复合乳酸菌粉,以接种量4%,即称量0.8g复合乳酸菌粉接种于mrs液体培养基中于37℃恒温培养箱中培养8h,得到浑浊的复合乳酸菌液。
58.步骤三、平板划线法培养:将培养所需的平板包好,固体培养基配置好后于121℃高压灭菌锅灭菌15min。共灭了4个平板,100ml固体培养基,固体培养基的配置相较于液体培养基,需要多加2%的琼脂,即100ml的固体培养基需要5.4g mrs营养肉汤粉末、2g琼脂、100ml蒸馏水。另外,固体培养基需要在搪瓷缸中加热至微沸后倒入锥形瓶才能灭菌,加热时为避免培养基加热不均,需要一直用玻璃棒搅拌。在超净台中,将灭菌完成的固体培养基趁热倒入灭菌后的平板,每个平板大约需要20ml左右的固体培养基,在室温下冷凝20-40min至培养基凝固。值得注意的是,固体培养基若不能及时倒板,不可放置室温备用,因为培养基会冷凝在锥形瓶中,可放置在60℃的烘箱或者恒温水浴锅中备用避免培养基凝固。
59.在超净台中,把每个平板划分为4个区域。将接种环的金属丝在酒精灯外焰灼烧至通红,然后略倾斜接种环,灼烧金属杆,冷却后用接种环取一环复合乳酸菌液,进行平板划线。每一区划完后都要灼烧接种环,后一区要求与前一区首尾相连,但不得与其他区域搭在一起。由于乳酸菌是兼性厌氧菌,于是将接种完毕的平板包上封口膜,利于乳酸菌的生长,然后于37℃恒温培养箱中培养48h。
60.步骤四、挑菌:将平板从培养箱移入超净台,准备好事先已灭菌的mrs液体培养基,接种环灼烧后冷却,用接种环从平板中选取大而饱满、未与其他菌落重叠的单菌落于液体培养基中。共挑取了7个单菌落,分别于不同的试管中,然后移入37℃恒温培养箱静置培养8h。
61.步骤五、发酵:将培养得到的菌液分别留种于已灭菌的1.5ml离心管中,标清楚序号于冰箱-20℃保存。并用这7个菌分别发酵蟹壳,发酵48h之后用edta法测量发酵液中的钙含量,计算脱钙率,选取发酵液中钙含量最高的单菌。由于乳酸菌发酵产乳酸,乳酸会与蟹壳中碳酸钙反应生成溶于水的钙盐,发酵液中钙含量越高,说明发酵的脱钙率越高,即产生的乳酸越高,即该菌的发酵能力越强。
62.步骤六、菌种鉴定:通过发酵选取出发酵能力最强的单菌,对该菌16s rdna菌株鉴定。6s rdna鉴定是指利用细菌16s rdna序列测序的方法对细菌进行种属鉴定。包括细菌基因组dna提取、16s rdna特异引物pcr扩增、扩增产物纯化、dna测序、细菌比对等步骤,获得了大量的dna序列信息,保守序列区域能反映生物物种间的亲缘关系,而高变序列区域则能体现物种间的差异。16s rdna菌株鉴定首先需要提取基因组dan,主要包括以下步骤:(1)将菌液在室温下4000
×
g离心10min以沉淀细菌,然后加入te buffer重悬细菌。(2)加入lysozyme在37℃水浴10min使细菌完全破壁。(3)加入btl buffer和proteinase k solution涡旋混匀后,在55℃水浴1h以完全裂解细菌,水浴期间,每隔20min涡旋一次。(4)加入rnase a,孵育5min后离心取上清,加bdt buffer涡旋混匀后在65℃孵育10min。(5)洗脱基因组dna。其次利用27f:5'-agagtttgatcctggctcag-3和27f:5'-agagtttgatcctggctcag-3引物对样品dna进行扩增,扩增过程有35个循环,每个循环包括:98℃变性10s,55℃退火8s,68℃延伸2s。再用1%琼脂糖凝胶电泳验证扩增产物,用sanger法对pcr产物进行双向引物测序,测序结果用mnaman软件拼接处理。将测序得到的16s rdna序列在ncbi上进行blas比对,即可获知与该序列同源性较高的已知序列,为确定菌种的分
类学地位提供依据。如图1所示,鉴定结果为该菌为副干酪乳杆菌,该菌的ncbi号为nr_025880.1。
63.实施例2
64.副干酪乳杆菌发酵蟹壳产甲壳素最佳条件的确定
65.用副干酪乳杆菌对蟹壳进行发酵,通过测发酵液中的钙含量得到脱钙率选取最佳发酵条件,使用edta法测定钙含量。
66.包括以下步骤:
67.步骤一、称量:称量1.00g蟹壳、2-6ml蒸馏水、5-25%糖于试管中待用;
68.步骤二、灭菌:将称量好的蟹壳等、液体培养基、包好的200μl枪头于灭菌锅中高压高温灭菌10-30min;
69.步骤三、培养:将液体培养基冷却至室温后,从冰箱拿出-20℃保存的乳酸菌,这里选用的是是实施例1筛选出的ncbi号为nr_025880.1的副干酪乳杆菌(可购于北京兰博利德生物技术有限公司),在超净台以5-10%的接种量将菌液接种到液体培养基中,于培养箱恒温培养8-12h;
70.步骤四、接菌发酵:将培养好的菌液从培养箱取出放置超净台,以5-10%的菌液接种量接种到蟹壳中,于培养箱恒温培养32-72h。
71.步骤五、酸碱法:得到的粗甲壳素还含有钙以及蛋白质这些杂质,因此继续采用强酸碱进一步脱除剩余的钙和蛋白质。
72.步骤六、脱色素:常用的脱色素方法是用强氧化剂如高锰酸钾、双氧水等进行漂白处理。本发明采用质量浓度为30%过氧化氢常温反应1h完成脱色处理,并洗净沥干,即得到不溶性甲壳素。
73.如图2所示,葡萄糖的含量增加时,脱钙率逐渐增加,葡萄糖添加量为15%时脱钙率最高即发酵能力最强。后续增加葡萄糖的添加量——15%,20%,20%,发现仍然是15%的葡萄糖添加量发酵能力最强,这有可能是过多的糖抑制了微生物生长。固液比1:3为副干酪乳杆菌的发酵能力较强,另外,接菌量对发酵的影响不大,选择5%的接菌量即可,且由于副干酪乳杆菌是兼性厌氧菌,因此选择静置发酵。故而确定发酵条件为:葡萄糖含量15%,固液比1:3,接菌量5%,37℃静置发酵72h。且发酵时间达到72h后,发酵速度较慢,因此选用72h发酵脱除大部分蛋白,为了提高甲壳素的提取效率,进一步采用酸碱法制备得到甲壳素。采用1.0mol/l-1
的hcl在50℃反应1h脱除剩余的钙,用8%的naoh在90℃反应1h脱除剩余的蛋白质。
74.实施例3
75.确定副干酪乳杆菌(ncbi号为nr_025880.1)发酵蟹壳的最佳超声条件在已确定的最优发酵条件下发酵蟹壳,并且在不同生长时期进行超声刺激。
76.首先,对发酵一直施加超声功率为0.167w/cm2,超声温度为37℃,超声频率为40khz的低强度超声处理,以不施加超声处理为对照组,发现一直低强度超声处理对副干酪乳杆菌的发酵提高28.75%的脱钙效率。这一实验表明低强度超声能够促进副干酪乳杆菌的生长代谢,从而产生更多的乳酸,辅助其发酵蟹壳制备甲壳素,提高发酵效率。但超声波作为一种外界物理场,作用于微生物时能够对微生物产生一定的胁迫作用,微生物自身对于外界胁迫都可产生一定抵抗力,在达到亚致死状态时,会产生一定的促进作用,但是该过
程复杂多变。因此,需要筛选适宜的超声条件。一直超声处理一方面容易造成超声作用过强从而对微生物产生抑制作用,另一方面,还大大浪费了能量,不符合节能环保的理念。因此,多采用短时间、间歇的超声处理,通过低能耗的手段达到促进副干酪乳杆菌的生长与代谢从而促进其发酵具有研究意义。
77.于是,单次在潜伏期、对数期、稳定期进行低强度超声处理5min,实验表明单次低强度超声对发酵无影响,这可能是因为发酵周期长,单次超声产生作用的菌很快被更新换代代谢掉,因此选用间歇超声来促进副干酪乳杆菌的发酵。从发酵开始进行第一次超声,之后间歇8h超声蟹壳,超声功率为0.167w/cm2,超声温度为37℃,超声频率为40khz,超声的时长分别为5min,10min,20min。由图3可知,超声发酵相较于未超声发酵,能提高脱钙效率,发酵速度明显加快,发酵能力明显增强,且间歇8h超声处理10min对发酵具有最好的促进作用,能提高48.03%的脱钙效率。而一直超声只能提高28.75%的脱钙效率。
78.之所以选用发酵开始进行第一次超声的原因是该时期为副干酪乳杆菌生长的潜伏期,实验证明在副干酪乳杆菌生长的潜伏期用低强度超声刺激菌液对副干酪乳杆菌的生长具有最好的促进作用,在生长对数期对副干酪乳杆菌施加低强度超声处理对菌液的生长影响不大,可能原因是生长对数期菌液的生长能力强,在对数期施加超声处理对菌液的影响不大,生长繁殖能力不会有很大程度的提升。每隔8h进行一次间歇低强度刺激是因为副干酪乳杆菌在8h后进入生长稳定期,这时候开始产生明显的菌丝沉淀,说明副干酪乳杆菌逐渐进入衰旺期,因此此时施加超声处理来增强副干酪乳杆菌的生长。
79.这可以看出,间歇超声促进发酵相比于普通的一直超声促进发酵,节约了大量超声所需能量的同时(一直超声需要超声72h,间歇超声的总时长只有90min),还能提高对发酵的促进作用,可能原因是超声作用所产生的空化与机械作用可使细胞膜产生短暂的声穿孔,由声穿孔引起的通透性变化是暂时的和可逆的,因此在超声处理后短时间内生物可恢复正常的生理防御机制,使物质成功运输而不会造成永久性的细胞损伤,因此超声发酵对副干酪乳杆菌发酵蟹壳具有促进作用,但是一直超声处理可能对细胞造成永久性损伤,于是对发酵的促进作用反而不如间歇超声。
80.实施例4
81.微生物发发酵及酸碱法结合提取甲壳素
82.一共取72管蟹壳于试管中,分成两批,每批36管,一批进行8h单时间点间歇超声5min,另一批不超声作为对照。每隔8h分别从两批中取出3管,用edta法测发酵液中的钙含量,以此来研究在不同时期超声对发酵的影响。由图4可知,在发酵前期,低强度超声刺激对副干酪乳杆菌发酵并没有明显的促进作用,且还有微弱的抑制作用,直到发酵24h后超声刺激对副干酪乳杆菌发酵才有明显的促进作用。这可能是由于发酵前期,超声波产生空化现象,副干酪乳杆菌及其细菌膜在其作用下会产生周期性的膨胀和收缩,细菌不能适应超声条件,细菌细胞膜被低强度超声破坏,导致内容物泄露细胞死亡,后期菌逐渐适应了超声条件,且副干酪乳杆菌的代谢被超声波改变,生长繁殖加快,发酵率提高。从图中还可看出发酵时间达到72h后,副干酪乳杆菌发酵速度大大减缓,因此选用72h发酵脱除大部分的钙和蛋白。
83.为了提高甲壳素的提取效率,进一步采用酸碱法制备得到甲壳素。采用1.0mol/l-1
的hcl在50℃反应1h脱除剩余的钙,用8%的naoh在90℃反应1h脱除剩余的蛋白质。
84.同时,分别使用微生物发酵法、单时间点超声促进微生物发酵法、单时间点超声促进微生物发酵法结合酸碱法完成对蟹壳中钙和蛋白质的脱除,结果如表1所示。
85.表1不同甲壳素提取方法所需时长及其对甲壳素纯度的影响
[0086][0087]
由表1可看出,单时间点超声促进微生物发酵法能显著减少发酵时长,但酸碱法结合发酵有更高的甲壳素提取效率,相比于单时间点超声促进发酵节省了43.94%的时间,相比于普通发酵节省了61.46%的时间,且相比于酸碱法大大减少了强酸、强碱的使用量。另外,间歇超声发酵法结合酸碱法提取得到的甲壳素相比于发酵法具有更高的甲壳素纯度。
[0088]
实施例5:
[0089]
凯氏定氮法测蛋白
[0090]
将发酵结束后的蟹壳残渣用蒸馏清洗,采用离心的方式进行固液分离,弃上清,重复清洗3-4次,在60℃烘箱干燥24h。采用凯氏定氮法测量其中的蛋白含量,分别计算超声发酵与未超声发酵的脱蛋白率。将样品放入消化管中,加入0.4g硫酸铜、6g硫酸钾及20ml硫酸于石墨消解仪进行消化,当消化炉温度达到420℃后继续消化1h,此时消化管中的液体呈绿色透明状,冷却至室温后在50ml容量瓶定容后于自动凯氏定氮仪上实现自动加液(使用前加入氢氧化钠溶液、蒸馏水以及含有混合指示剂的硼酸溶液),再用0.01mol/l hcl滴定记录数据,从而计算蛋白质含量,结果可见图5。由图5可见,间歇发酵的蛋白质脱除率相比于未超声发酵提升了64.57%,一直超声的蛋白脱除率相比于未超声发酵提升了54.78%。
[0091]
据此可计算出低强度超声促进微生物发酵可减少的酸碱使用量,见表2。
[0092]
表2发酵后强酸碱使用减少量
[0093][0094]
从表2可以看出,运用生物发酵结合酸碱法生产甲壳素,能大幅度减少酸碱的使用,特别是间歇超声发酵,强酸减少量达到84.97%,强碱减少量达到70.6%,相比与普通发酵和超声发酵,能更好地减少成本并保护环境。
[0095]
实施例6:
[0096]
低强度超声对副干酪乳杆菌生长的影响
[0097]
将副干酪乳杆菌接种到灭菌完的液体mrs培养基中,于37℃培养箱培养12h,每隔2h测一次600nm下的吸光度,通过吸光度绘制菌的生长曲线,从而得到菌液的潜伏期、对数期。同时,设置实验组用低强度超声刺激菌液,研究低强度超声对副干酪乳杆菌生长的影
响。
[0098]
另外,为了研究低强度超声对发酵中副干酪乳杆菌生长的影响,特地选择研究在发酵条件下即15%葡萄糖溶液中,低强度超声对副干酪乳杆菌od
600
的影响。将副干酪乳杆菌接种到灭菌完的15%葡萄糖溶液中,于37℃培养箱培养12h,每隔2h测一次600nm下的吸光度。
[0099]
由于副干酪乳杆菌能产生乳酸,乳酸与蟹壳中的碳酸钙反应完成钙的脱除,因此研究低强度超声对副干酪乳杆菌菌液的ph的影响在一定程度上能够反应其对副干酪乳杆菌具有促进作用。
[0100]
从图6中可以观察到,副干酪乳杆菌在前2h处于潜伏期,2-8h为生长对数期,后面逐渐进入生长稳定期。经过低强度超声处理的副干酪乳杆菌od
600
较大,活菌数较多(图7),ph较低(图8),这说明低强度超声促进了副干酪乳杆菌的生长繁殖。
[0101]
实施例7:
[0102]
扫描电镜
[0103]
将未发酵未超声的原始蟹壳、未发酵只进行间歇超声的蟹壳、未超声的副干酪乳杆菌发酵残渣、超声刺激副干酪乳杆菌发酵残渣在冻干机冻干24h,得到的干燥样品观察在扫描电镜下的形态。由于是干燥的固体粉末,直接粘在电导胶上喷金即可拍摄,拍摄的图片均为放大10000倍,拍摄结果见图9。由图9可见,a为原始的蟹壳形态,b为蟹壳对蟹壳进行超声后的形态,两者没有明显差异,蟹壳上都有空洞结构,从而推断单纯对蟹壳超声蟹壳的形态没有明显变化,可认为超声对蟹壳的结构没有影响。c是发酵得到的蟹壳残渣形态,d为低强度超声促进发酵得到的蟹壳残渣形态,可以看出c中有明显的丝状结构,d图则没有,这可能是由于超声使菌液发酵蟹壳起了作用,使蟹壳的丝状结构断裂。
[0104]
实施例8:
[0105]
核磁共振
[0106]
对发酵得到的甲壳素以及经过低强度超声处理促进发酵得到的甲壳素在bruker 400m做高分辨率固态核磁共振(nmr)谱,其mas自旋速率为10khz,回收时间为4s,所用于采集的脉冲程序为cp,预扫描延迟为6.5μs,采用4mm的转子进行固体核磁共振的测试。采用cp mas nmr(交叉极化魔角旋转核磁共振)测试碳谱(
13
c),采用ddmas nmr(偶极去耦魔角旋转核磁共振)测试氢谱(1h)。
[0107]
通过固体核磁共振对发酵产物即甲壳素表征,结果显示,发酵组与超声发酵组发酵残渣的氢谱几乎重叠(图10a),图中异头质子(h-1)在4.5-5.5ppm区间出现信号峰。其中4.51ppm处为glcn残基的h-1的信号峰,3.41ppm处为glcn残基的h-3的信号峰,1.38ppm处为glcn残基的h-2的信号峰,这些均为甲壳素的特征氢吸收峰。发酵组与超声发酵组残渣的碳谱图也几乎一致(图10b),其中172.84ppm及22.69ppm的吸收峰分别为乙酰基c=o和ch3碳的共振吸收峰,而
13
c信号包括54.97ppm(c2),73.46ppm(c5),75.60ppm(c3),83.06ppm(c4),103.7 9ppm(c1),128.30ppm(酰胺cn),这些吸收光谱也与甲壳素的吸收光谱相似。甲壳素构型没有发生转变,这是因为甲壳素的分子链排列方式,可以形成稳定的氢键结构,不会被超声波改变其构型。此外,核磁共振光谱中,α-甲壳素和γ-甲壳素均在73和75ppm左右有两个吸收峰(mi-kyeong jang),因此,从核磁共振图谱上并不能判断发酵产物是-甲壳素还是γ-甲壳素,因此,需要利用红外光谱对它们的结构进一步的探索。
[0108]
实施例9:
[0109]
红外光谱图
[0110]
将溴化钾、样品均于60℃烘箱干燥至恒重,然后将溴化钾与样品以100:1加入研钵中进行研磨,研磨要顺着一个方向,避免样品发生转基因。另外,研磨过程中尽量不要对其呼吸、讲话,避免产生的co2进入样品中产生额外的吸收峰,将溴化钾与样品的混合样研磨至无肉眼可见的明显颗粒即可。然后就可以进行压片,片尽量平整而透明,置于红外光下拍摄光谱图。
[0111]
图11分别为蟹壳、间歇超声蟹壳、发酵后蟹壳残渣、间歇超声发酵后蟹壳残渣的红外光谱图,由图12可知,低强度超声并不能该改变甲壳素的化学结构。其主要吸收峰中可以证实甲壳素的存在,在3443cm-1
和3412cm-1
处的吸收峰可能是甲壳素中的-oh或n-h伸缩振动引起的,在1121cm-1处可能是甲壳素中c-o-c的伸缩振动引起的,1616cm-1
处的吸收峰可能是由甲壳素中酰胺i的c=o变形震动引起的。超声辅助副干酪乳杆菌处理后的红外谱图在约3497cm-1
和3439cm-1
处有两个峰,分别对应于甲壳素o h(6)
···
o c和o h(3)
··
o-5分子内氢键,羰基区域的强吸收峰是α-甲壳素的典型特征,α-甲壳素的红外吸收光谱在1662cm-1
和1629cm-1
处有两个独立的峰,分别为分子间氢键co
···
hn和分子内氢键co
···
hoch2。在3261cm-1
处由酰胺基nh引起的谱带属于分子内键nh基团的振动,也证实发酵产物是α-甲壳素。已有研究报道蟹壳中甲壳素为α-甲壳素,证实超声辅助副干酪乳杆菌处理下不能改变甲壳素的构型。
[0112]
以上所揭露的仅为本发明的较佳实施例而已,当然不能以此来限定本发明之权利范围,因此依本发明权利要求所作的等同变化,仍属本发明所涵盖的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1