一种高效表达禽白血病P27蛋白的方法及其应用与流程
一种高效表达禽白血病p27蛋白的方法及其应用
技术领域
1.本发明涉及生物技术技术领域,具体涉及一种高效表达禽白血病p27蛋白的方法及其应用。
背景技术:
2.禽白血病是一类由禽白血病病毒(avian leukosis virus,alv)引起的禽类不同组织良性和恶性肿瘤病的总称。该病毒为反转录病毒科的α反转录病毒属,可分为a~j共10个亚群。alv主要引起感染鸡在性成熟前后发生肿瘤死亡,感染率和发病死亡率高低不等,死亡率最高可达20%。一些鸡感染后虽不发生肿瘤,但可造成产蛋性能下降甚至免疫抑制。控制此类疾病主要是通过种群净化来切断垂直传播,种鸡群一旦发alv现阳性,应及时淘汰以阻断水平传播。
3.p27蛋白是禽白血病病毒重要的蛋白,是禽白血病检测试剂盒研发、生产和质检的必须材料,通常采用基因工程菌株三角摇瓶小规模表达p27蛋白。表达禽白血病p27蛋白有过很多报道,应用的表达系统有大肠杆菌、杆状病毒表达系统,但是均是小量表达,单位体积一般在300ml~1000ml,表达量在40mg/l左右;表达浓度低;经过纯化后,产量最该仅能达到80mg/批次;并且存在较大的批间差异,每次表达量和产量都不稳定,不仅耗时费力且产品满足不了试剂盒生产和质检的需求。
技术实现要素:
4.本发明的目的在于提供一种表达浓度高、表达量大、蛋白产量高、表达量和产量稳定、生产周期短且成本低的一种高效表达禽白血病p27蛋白的方法及其应用。
5.为实现上述目的,本发明采用的技术方案为:
6.一种高效表达禽白血病p27蛋白的方法,所述的方法包括:
7.s101菌种培养:
8.重组大肠埃希杆菌bl21菌种涂板于lb平板,35~40℃培养过夜;
9.挑取培养平板上的单菌落于10ml lb液体培养基37℃,培养10~12h,得一级种子;
10.一级种子按1~3%接种量(v:v)接种于液体lb培养基中,37.0℃,培养10~12h,得二级种子;
11.s102接种:
12.二级种子按接种量(v:v)3~7%接种于发酵罐培养基中;
13.s103扩繁:
14.接种后的发酵罐调节温度35~40℃,转速300~600rpm,ph为7.0,溶氧量25~35%,培养4~6h;
15.s104诱导表达:
16.扩繁后的发酵罐中加入诱导剂,35~40℃,培养4~6h;
17.s105破碎离心:
18.诱导表达结束后,发酵罐中的菌液进行细胞破碎,破碎后的菌液4℃、12000rpm/min离心40min,上清液过滤后干燥,即得禽白血病p27蛋白。
19.进一步的,所述的重组大肠埃希杆菌bl21为重组大肠埃希杆菌bl21(de3)-pet-30a-p27。
20.进一步的,所述的发酵罐培养基的组成为:1%酵母粉、1%胰蛋白胨、1%甘油、0.4%kh2po4、0.2%k2hpo4、0.7%na2hpo4·
12h2o、0.1%mgso4、0.3%nh4cl、0.02%1000
×
微量元素混合液。
21.进一步的,所述的1000
×
微量元素混合液为1m cacl
2 2ml、1m mnso
4 1ml、1m zncl
2 1ml、0.2m cocl
2 1ml、0.1m cuso
4 2ml、0.2m niso
4 1ml、0.1m na2moo
4 2ml、0.1m na2seo
3 2ml、0.1m h3bo
3 2ml混合后121℃、20min高压灭菌后与过滤除菌后的0.1m fecl
3 50ml混合即得。
22.进一步的,所述的诱导剂为iptg,其在发酵液中的终浓度为0.8~1.2mmol/l。
23.进一步的,所述的步骤s103扩繁中,菌种培养至2h流加补料培养基一,流加速度为3ml/min,连续流加至培养结束;
24.所述的补料培养基一为10~30%的甘油。
25.进一步的,所述的步骤s103扩繁中,菌种培养至3.5~4h流加补料培养基二,流加速度为3ml/min,连续流加至培养结束;
26.所述的补料培养基二的组成为10~30%蛋白胨和10~30%酵母粉。
27.本发明还提供另外一种高效表达禽白血病p27蛋白的方法。
28.一种高效表达禽白血病p27蛋白的方法,所述的方法包括:
29.s201菌种培养:
30.重组大肠埃希杆菌bl21为重组大肠埃希杆菌bl21(de3)-pet-30a-p27菌种涂板于lb平板,35~40℃培养过夜;
31.挑取培养平板上的单菌落于lb液体培养基35~40℃摇床培养过夜;
32.摇床培养液按1%接种量(v:v)接种于lb液体培养基,35~40℃,200r/min培养4h,得种子液;
33.s202扩繁:
34.种子液按接种量(v:v)3~7%接种于lb液体培养基中,振荡培养至od
600nm
值为0.6-0.8;
35.s203诱导表达:
36.向扩繁液中加入终浓度为0.8~1.2mmol/l的iptg诱导剂,调节ph至6.8~7.2,35~40℃培养诱导表达4~6h;
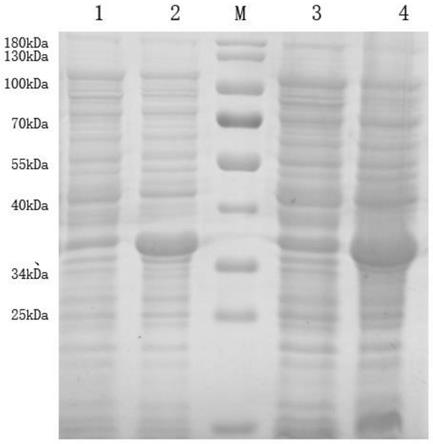
37.s204破碎离心:
38.诱导表达结束后,菌液进行细胞破碎,破碎后的菌液4℃、12000rpm/min离心40min,上清液过滤后干燥,即得禽白血病p27蛋白。
39.进一步的,所述的lb平板、lb培养基和发酵罐培养基含有硫酸卡那霉素,硫酸卡那霉素在培养基/培养液中的终浓度为0.5g/l。
40.本发明还提供一种高效表达禽白血病p27蛋白方法的应用。
41.一种高效表达禽白血病p27蛋白的方法,用于高效表达禽白血病p27蛋白。
42.本发明还提供另一种高效表达禽白血病p27蛋白方法的应用。
43.一种高效表达禽白血病p27蛋白的方法,用于禽白血病检测试剂盒研发、生产和质检。
44.本发明提供的一种高效表达禽白血病p27蛋白的方法利用重组大肠埃希杆菌bl21(de3)-pet-30a-p27作为菌种,建立了表达p27蛋白的重组大肠杆菌高密度表达的培养工艺,并对表达产物进行了亲和层系纯化,成功制备了p27蛋白。在高密度发酵阶段,菌体密度的大小直接影响最终目的产物的产量,因为菌体生长期累计的菌体量越高,到达诱导期后,单位体积内具有表达目的的外源蛋白的细胞就越多,使得外源蛋白的产量比低菌体量时会有显著提高。使用甘油作为碳源以减少副产物乙酸对发酵过程产生的不利影响。
45.本发明提供的一种高效表达禽白血病p27蛋白的方法在发酵罐中实现了重组大肠杆菌的高密度培养,培养过程中菌体密度达到109g/l以上,是摇瓶培养的70倍以上。
46.本发明提供的一种高效表达禽白血病p27蛋白的方法,在菌体量己达到一定水平后(发酵4~6h),为了有利于细胞内目的蛋白的高效表达,控制菌体的生长,使得菌体量保持在一个相对恒定的范围内,并添加诱导剂。诱导时间的长短是影响诱导期蛋白产量的最主要的因素,诱导时间过短,蛋白的表达不完全,蛋白的积累量低;诱导时间过长,由于细胞中蛋白酶的存在,会使可溶性目的蛋白降解,最终目的蛋白含量下降,所以适宜的诱导时间是获得最高蛋白产量的关键。本发明提供的方法可溶性目的蛋白(禽白血病p27蛋白)的含量高,批次产量较摇瓶培养阶段提高了200倍以上。
47.本发明提供的一种高效表达禽白血病p27蛋白的方法,使用发酵罐,用基因工程菌大肠杆菌bl21(de3)-p27株实现了禽白血病p27蛋白的高效表达,菌体密度达到≥109g/l;禽白血病p27蛋白表达量≥30%;禽白血病p27蛋白表达浓度≥1000mg/l。将制备的蛋白用于试剂盒的生产和检验,提高试剂盒的稳定性。解决了禽白血病试剂盒生产过程中对p27蛋白产量、质量及稳定性的要求。
48.利用摇床三角瓶制备重组大肠杆菌表达的目的产物时,所得的蛋白产量低,制备时间长,很难实现规模化生产。本发明提供的一种高效表达禽白血病p27蛋白的方法,能够大大提高菌体的发酵密度,进而提高比生产率,缩短生产周期,降低生产成本,顺应了生物制品行业的工业化生产需求。本发明提供的方法,发酵罐培养基中以甘油作为碳源,减少了代谢产物乙酸对菌体生长的影响,发酵罐培养基中有较为稳定的ph缓冲系统,并补充了适当的铵盐及微量元素,p和s用于合成细胞中的核蛋白类、蛋白质、维生素和类脂。p又起着能量调节作用。金属元素有ca、mg、fe、cu、co、mn等,都是合成一些重要酶类的组成成分。mg、k对核酸、核糖体和细胞膜起稳定作用,mg还能控制细胞膜的透性和细胞质的胶体特性,能影响蛋白质的合成。发酵罐培养基中提供了十余种微量元素以供细菌发酵和蛋白质合成。发酵罐培养基经通气搅拌培养,使用两步补料的培养策略,实现了p27蛋白的高效表达。
49.与现有技术相比,本发明提供的一种一种高效表达禽白血病p27蛋白的方法及其应用的优点:
50.(1)禽白血病p27蛋白表达浓度高、表达量大。
51.(2)禽白血病p27蛋白产量高、表达量和产量稳定。
52.(3)生产周期短且成本低,生产效率高。
53.(4)稳定性和重复性好,适于规模化生产。
附图说明
54.图1是本发明实施例2禽白血病p27蛋白诱导表达sds凝胶电泳试验结果。
55.图2是本发明实施例3禽白血病p27蛋白诱导表达sds凝胶电泳试验结果。
56.图3是本发明实施例4禽白血病p27蛋白诱导表达sds凝胶电泳试验结果。
57.图1、图2和图3中,m:maker;1:实施例2诱导前;2:实施例2诱导后;3:实施例3诱导前;4:实施例3诱导后;5:实施例4诱导前;6:实施例4诱导后。
58.图4是本发明发酵罐(实施例4)和摇床制备(实施例1)的禽白血病p27蛋白比较sds凝胶电泳试验结果。
59.图4中,1:摇床制备p27诱导前10倍浓缩;2:摇床制备p27诱导后10倍浓缩;m:marker;3:发酵罐制备p27诱导前原倍;4:发酵罐制备p27诱导后原倍。
60.图5为本发明提供的发酵罐(实施例2)和摇床制备(实施例1)的禽白血病p27蛋白纯化sds凝胶电泳试验结果。
61.图6为本发明提供的发酵罐(实施例3)和摇床制备(实施例1)的禽白血病p27蛋白纯化sds凝胶电泳试验结果。
62.图7为本发明提供的发酵罐(实施例4)和摇床制备(实施例1)的禽白血病p27蛋白纯化sds凝胶电泳试验结果。
63.图5、图6和图7中,m:maker;1:实施例2批次制备纯化后p27蛋白;2:摇床制备(实施例1)纯化后p27蛋白;3:实施例3批次制备纯化后p27蛋白;4:摇床制备(实施例1)纯化后p27蛋白;5:实施例4批次制备纯化后p27蛋白;6:摇床制备(实施例1)纯化后p27蛋白。
具体实施方式
64.为使本领域的技术人员更好地理解本发明的技术方案,以下实施例对本发明的作进一步详细描述,以下实施例仅用于说明发明,但不用来限制本发明的范围。
65.一种高效表达禽白血病p27蛋白的方法,所述的方法包括:
66.s101菌种培养:
67.重组大肠埃希杆菌bl21菌种涂板于lb平板,35~40℃培养过夜;
68.挑取培养平板上的单菌落于10ml lb液体培养基37℃,培养10~12h,得一级种子;
69.一级种子按1~3%接种量(v:v)接种于液体lb培养基中,37.0℃,培养10~12h,得二级种子;
70.s102接种:
71.二级种子按接种量(v:v)3~7%接种于发酵罐培养基中;
72.s103扩繁:
73.接种后的发酵罐调节温度35~40℃,转速300~600rpm,ph为7.0,溶氧量25~35%,培养4~6h;
74.s104诱导表达:
75.扩繁后的发酵罐中加入诱导剂,35~40℃,培养4~6h;
76.s105破碎离心:
77.诱导表达结束后,发酵罐中的菌液进行细胞破碎,破碎后的菌液4℃、12000rpm/min离心40min,上清液过滤后干燥,即得禽白血病p27蛋白。
78.进一步的,所述的重组大肠埃希杆菌bl21为重组大肠埃希杆菌bl21(de3)-pet-30a-p27。
79.进一步的,所述的发酵罐培养基的组成为:1%酵母粉、1%胰蛋白胨、1%甘油、0.4%kh2po4、0.2%k2hpo4、0.7%na2hpo4·
12h2o、0.1%mgso4、0.3%nh4cl、0.02%1000
×
微量元素混合液。
80.进一步的,所述的1000
×
微量元素混合液为1m cacl
2 2ml、1m mnso
4 1ml、1m zncl
2 1ml、0.2m cocl
2 1ml、0.1m cuso
4 2ml、0.2m niso
4 1ml、0.1m na2moo
4 2ml、0.1m na2seo
3 2ml、0.1m h3bo
3 2ml混合后121℃、20min高压灭菌后与过滤除菌后的0.1m fecl
3 50ml混合即得。
81.进一步的,所述的诱导剂为iptg,其在发酵液中的终浓度为0.8~1.2mmol/l。
82.进一步的,所述的步骤s103扩繁中,菌种培养至2h流加补料培养基一,流加速度为3ml/min,连续流加至培养结束;
83.所述的补料培养基一为10~30%的甘油。
84.进一步的,所述的步骤s103扩繁中,菌种培养至3.5~4h流加补料培养基二,流加速度为3ml/min,连续流加至培养结束;
85.所述的补料培养基二的组成为10~30%蛋白胨和10~30%酵母粉。
86.本发明还提供另外一种高效表达禽白血病p27蛋白的方法。
87.一种高效表达禽白血病p27蛋白的方法,所述的方法包括:
88.s201菌种培养:
89.重组大肠埃希杆菌bl21为重组大肠埃希杆菌bl21(de3)-pet-30a-p27菌种涂板于lb平板,35~40℃培养过夜;
90.挑取培养平板上的单菌落于lb液体培养基35~40℃摇床培养过夜;
91.摇床培养液按1%接种量(v:v)接种于lb液体培养基,35~40℃,200r/min培养4h,得种子液;
92.s202扩繁:
93.种子液按接种量(v:v)3~7%接种于lb液体培养基中,振荡培养至od
600nm
值为0.6-0.8;
94.s203诱导表达:
95.向扩繁液中加入终浓度为0.8~1.2mmol/l的iptg诱导剂,调节ph至6.8~7.2,35~40℃培养诱导表达4~6h;
96.s204破碎离心:
97.诱导表达结束后,菌液进行细胞破碎,破碎后的菌液4℃、12000rpm/min离心40min,上清液过滤后干燥,即得禽白血病p27蛋白。
98.进一步的,所述的lb平板、lb培养基和发酵罐培养基含有硫酸卡那霉素,硫酸卡那霉素在培养基/培养液中的终浓度为0.5g/l。
99.本发明还提供一种高效表达禽白血病p27蛋白方法的应用。
100.一种高效表达禽白血病p27蛋白的方法,用于高效表达禽白血病p27蛋白。
101.本发明还提供另一种高效表达禽白血病p27蛋白方法的应用。
102.一种高效表达禽白血病p27蛋白的方法,用于禽白血病检测试剂盒研发、生产和质
检。
103.实施例1
104.摇床培养诱导重组大肠埃希氏菌bl21(de3)-pet-30a-p27
105.菌种培养:取一支-80℃保存的bl21(de3)-pet-30a-p27甘油菌种,用接种环蘸取菌种在lb平板上四区划线,37℃培养过夜;
106.一级种子液制备:取培养过夜的单克隆于5ml的液体lb试管中,37.0℃、150r/min培养12h作为一级种子;
107.二级种子制备:将培养的一级种子5ml接入500ml液体lb培养基中,37.0℃、150r/min培养12h作为二级种子。
108.摇床诱导表达:
109.菌种的繁殖:取一级种子液10ml分别接种于两个1000ml lb液体培养基中,以220r/min振荡培养至od
600
nm值为0.6~0.8。
110.诱导:向菌液中加入iptg(异丙基-β-d-硫代半乳糖苷)诱导剂(诱导剂终浓度为1mmol/l),置37℃、220r/min培养诱导表达5小时。
111.菌体收获:收集诱导后菌液。
112.实施例2
113.发酵罐培养诱导重组大肠埃希氏菌bl21(de3)-pet-30a-p27
114.s101菌种培养:
115.菌种培养:取一支-80℃保存的bl21(de3)-pet-30a-p27甘油菌种,用接种环蘸取菌种在lb平板上四区划线,37℃培养过夜;
116.一级种子液制备:取培养过夜的单克隆于5ml的液体lb试管中,37.0℃、150r/min培养10h作为一级种子;
117.二级种子制备:将培养的一级种子5ml接入500ml液体lb培养基中,37.0℃、150r/min培养10h作为二级种子。
118.s102接种:
119.ph电极校准:将ph电极用纯化水清洗,滤纸擦干放入ph为6.86的缓冲液中进行标定,取出ph电极用纯化水清洗滤纸吸干水分然后放入到ph为4.01的缓冲液中进行零点标定。do电极校准:溶氧电极极化完后用纯化水洗净,擦拭干净然后加入到饱和的亚硫酸钠溶液中,待溶氧显示数值在1%时进行零点标定。biostat c生物反应器和发酵培养基的灭菌:加入发酵培养基后,打开安全阀,关闭空气加热套的冷凝水开关,调节泡沫高度电极位置。设定灭菌温度为121℃、灭菌时间20min以及发酵温度37℃。所述的发酵罐培养基的组成为:1%酵母粉、1%胰蛋白胨、1%甘油、0.4%kh2po4、0.2%k2hpo4、0.7%na2hpo4·
12h2o、0.1%mgso4、0.3%nh4cl、0.02%1000
×
微量元素混合液。所述的1000
×
微量元素混合液为1m cacl
2 2ml、1m mnso
4 1ml、1m zncl
2 1ml、0.2m cocl
2 1ml、0.1m cuso
4 2ml、0.2m niso
4 1ml、0.1m na2moo
4 2ml、0.1m na2seo
3 2ml、0.1m h3bo
3 2ml混合后121℃、20min高压灭菌后与过滤除菌后的0.1m fecl
3 50ml混合即得。二级种子按接种量(v:v)3%接种于发酵罐培养基中。
120.s103扩繁:
121.接种后的发酵罐调节温度35℃,转速300rpm,ph为7.0,溶氧量25%,培养6h;
122.菌种培养至2h流加补料培养基一,流加速度为3ml/min,连续流加至培养结束;补料培养基一为10%的甘油;
123.菌种培养至3.5h流加补料培养基二,流加速度为3ml/min,连续流加至培养结束;补料培养基二的组成为10%蛋白胨和30%酵母粉。
124.s104诱导表达:
125.向培养基中加入终浓度为1mmol/l的iptg,35℃,继续培养6h。
126.s105破碎离心:
127.诱导表达结束后,发酵罐中的菌液进行细胞破碎,破碎后的菌液4℃、12000rpm/min离心40min,上清液过滤后干燥,即得禽白血病p27蛋白。
128.实施例3
129.发酵罐培养诱导重组大肠埃希氏菌bl21(de3)-pet-30a-p27
130.s101菌种培养:
131.菌种培养:取一支-80℃保存的bl21(de3)-pet-30a-p27甘油菌种,用接种环蘸取菌种在lb平板上四区划线,37℃培养过夜;
132.一级种子液制备:取培养过夜的单克隆于5ml的液体lb试管中,37.0℃、150r/min培养12h作为一级种子;
133.二级种子制备:将培养的一级种子5ml接入500ml液体lb培养基中,37.0℃、150r/min培养12h作为二级种子。
134.s102接种:
135.ph电极校准:将ph电极用纯化水清洗,滤纸擦干放入ph为6.86的缓冲液中进行标定,取出ph电极用纯化水清洗滤纸吸干水分然后放入到ph为4.01的缓冲液中进行零点标定。do电极校准:溶氧电极极化完后用纯化水洗净,擦拭干净然后加入到饱和的亚硫酸钠溶液中,待溶氧显示数值在1%时进行零点标定。biostat c生物反应器和发酵培养基的灭菌:加入发酵培养基后,打开安全阀,关闭空气加热套的冷凝水开关,调节泡沫高度电极位置。设定灭菌温度为121℃、灭菌时间20min以及发酵温度37℃。所述的发酵罐培养基的组成为:1%酵母粉、1%胰蛋白胨、1%甘油、0.4%kh2po4、0.2%k2hpo4、0.7%na2hpo4·
12h2o、0.1%mgso4、0.3%nh4cl、0.02%1000
×
微量元素混合液。所述的1000
×
微量元素混合液为1m cacl
2 2ml、1m mnso
4 1ml、1m zncl
2 1ml、0.2m cocl
2 1ml、0.1m cuso
4 2ml、0.2m niso
4 1ml、0.1m na2moo
4 2ml、0.1m na2seo
3 2ml、0.1m h3bo
3 2ml混合后121℃、20min高压灭菌后与过滤除菌后的0.1m fecl
3 50ml混合即得。
136.二级种子按接种量(v:v)7%接种于发酵罐培养基中;
137.s103扩繁:
138.接种后的发酵罐调节温度40℃,转速600rpm,ph为7.0,溶氧量35%,培养4h;
139.菌种培养至2h流加补料培养基一,流加速度为3ml/min,连续流加至培养结束;补料培养基一为30%的甘油;
140.菌种培养至3.5h流加补料培养基二,流加速度为3ml/min,连续流加至培养结束;补料培养基二的组成为30%蛋白胨和10%酵母粉。
141.s104诱导表达:
142.向培养基中加入终浓度为1mmol/l的iptg,40℃,继续培养4h。
143.s105破碎离心:
144.诱导表达结束后,发酵罐中的菌液进行细胞破碎,破碎后的菌液4℃、12000rpm/min离心40min,上清液过滤后干燥,即得禽白血病p27蛋白。
145.实施例4
146.发酵罐培养诱导重组大肠埃希氏菌bl21(de3)-pet-30a-p27
147.s101菌种培养:
148.菌种培养:取一支-80℃保存的bl21(de3)-pet-30a-p27甘油菌种,用接种环蘸取菌种在lb平板上四区划线,37℃培养过夜;
149.一级种子液制备:取培养过夜的单克隆于5ml的液体lb试管中,37.0℃、150r/min培养11h作为一级种子;
150.二级种子制备:将培养的一级种子5ml接入500ml液体lb培养基中,37.0℃、150r/min培养11h作为二级种子。
151.s102接种:
152.ph电极校准:将ph电极用纯化水清洗,滤纸擦干放入ph为6.86的缓冲液中进行标定,取出ph电极用纯化水清洗滤纸吸干水分然后放入到ph为4.01的缓冲液中进行零点标定。do电极校准:溶氧电极极化完后用纯化水洗净,擦拭干净然后加入到饱和的亚硫酸钠溶液中,待溶氧显示数值在1%时进行零点标定。biostat c生物反应器和发酵培养基的灭菌:加入发酵培养基后,打开安全阀,关闭空气加热套的冷凝水开关,调节泡沫高度电极位置。设定灭菌温度为121℃、灭菌时间20min以及发酵温度37℃。所述的发酵罐培养基的组成为:1%酵母粉、1%胰蛋白胨、1%甘油、0.4%kh2po4、0.2%k2hpo4、0.7%na2hpo4·
12h2o、0.1%mgso4、0.3%nh4cl、0.02%1000
×
微量元素混合液。所述的1000
×
微量元素混合液为1m cacl
2 2ml、1m mnso
4 1ml、1m zncl
2 1ml、0.2m cocl
2 1ml、0.1m cuso
4 2ml、0.2m niso
4 1ml、0.1m na2moo
4 2ml、0.1m na2seo
3 2ml、0.1m h3bo
3 2ml混合后121℃、20min高压灭菌后与过滤除菌后的0.1m fecl
3 50ml混合即得。
153.二级种子按接种量(v:v)5%接种于发酵罐培养基中;
154.s103扩繁:
155.接种后的发酵罐调节温度37℃,转速450rpm,ph为7.0,溶氧量30%,培养5h;
156.菌种培养至2h流加补料培养基一,流加速度为3ml/min,连续流加至培养结束;补料培养基一为20%的甘油;
157.菌种培养至4h流加补料培养基二,流加速度为3ml/min,连续流加至培养结束;补料培养基二的组成为20%蛋白胨和20%酵母粉。
158.s104诱导表达:
159.向培养基中加入终浓度为1mmol/l的iptg,37℃,继续培养5h。
160.s105破碎离心:
161.诱导表达结束后,发酵罐中的菌液进行细胞破碎,破碎后的菌液4℃、12000rpm/min离心40min,上清液过滤后干燥,即得禽白血病p27蛋白。
162.实施例5
163.发酵罐发酵培养基对比试验
164.对lb培养基、tb培养基、2
×
yt培养基、sob培养基、本发明提供的发酵罐培养基进
行效果对比。所述各培养基组成如下:
165.lb培养基:0.5%酵母粉、1%蛋白胨、0.5%nacl。
166.tb培养基:1.2%蛋白胨,2.4%酵母提取物,0.4%甘油,0.231%磷酸二氢钾,1.254%磷酸氢二钾。
167.2yt培养基:1.6%蛋白胨,1%酵母提取物,0.5%氯化钠。
168.sob培养基:1%250mmol/l氯化钾,0.05%2mol/l氯化镁,2%胰蛋白胨,0.5%酵母提取物,0.05%氯化钠。
169.发酵罐培养基:1%酵母粉、1%胰蛋白胨、1%甘油、0.4%kh2po4、0.2%k2hpo4、0.7%na2hpo4·
12h2o、0.1%mgso4、0.3%nh4cl、0.02%1000
×
微量元素混合液。
170.1000
×
微量元素混合液为1m cacl
2 2ml、1m mnso
4 1ml、1m zncl
2 1ml、0.2m cocl
2 1ml、0.1m cuso
4 2ml、0.2m niso
4 1ml、0.1m na2moo
4 2ml、0.1m na2seo
3 2ml、0.1m h3bo
3 2ml混合后121℃、20min高压灭菌后与过滤除菌后的0.1m fecl
3 50ml混合即得。
171.称量7l培养基所需成分溶于双蒸水中,培养基溶解后流加到15l发酵罐,并加入7ml泡敌,按发酵罐的操作规程对罐体、管路和培养基进行灭菌操作,待灭菌结束后温度降至37℃使用火焰灭菌法在火焰圈下加入500ml种子液和7ml硫酸卡那霉素,通过调整发酵罐转速和通气量维持溶氧量为30%以上,最大转速不超过700r/min,全程自动流加3mol/l氨水调节ph7.0,自动流加消泡剂,培养温度为37℃,发酵至4h加入浓度为1mmol/l的iptg,诱导表达4h,结束发酵。测定菌体湿重和p27蛋白的表达量,平行重复3次试验。结果见表1。
172.表1重组p27蛋白大肠杆菌在不同培养基中的菌体湿重及p27蛋白表达量
[0173][0174][0175]
由表1可知,tb培养基、2yt培养基和本发明提供的发酵罐培养基均与lb培养基的菌体湿重和p27表达量呈显著性差异(p《0.05),结果表明使用本发明提供的发酵罐培养基发酵获得的p27蛋白产量最高。
[0176]
实施例6
[0177]
p27蛋白诱导表达结果
[0178]
对发酵罐诱导的三个实施例重组大肠埃希氏菌bl21(de3)-pet-30a-p27株诱导收获的菌液离心收集菌体(实施例2、实施例3、实施例4)用等体积pbs溶解后加入1/4体积上样buffer混合后煮沸10分钟,离心后进行sds-page凝胶电泳试验,结果表明三批次实验室试制均能诱导产生37kda的p27蛋白,结果详见图1~图3。目标蛋白表达量菌超过30%,收集的全部菌液离心后菌泥称重,分装菌体于-20℃保存,结果详见表2。
[0179]
表2重组大肠埃希氏菌pet-30a-p27-bl21(de3)株诱导收获的菌体(实施例2、实施
例3、实施例4)湿重
[0180]
批次实施例2实施例3实施例4菌体湿重(g)130012971255
[0181]
对摇床诱导(实施例1)的重组大肠埃希氏菌bl21(de3)-pet-30a-p27株诱导收获的菌液10倍浓缩后进行sds-page凝胶电泳试验,与发酵罐(实施例4)诱导重组大肠埃希氏菌bl21(de3)-pet-30a-p27株收获的菌液原倍相比,均能诱导产生37kda的p27蛋白,单位体积发酵罐诱导产生的p27蛋白明显高于摇瓶10倍以上,详见图4。
[0182]
实施例7
[0183]
禽白血病p27蛋白纯化
[0184]
1、液压破碎菌体
[0185]
分别取实施2~4发酵罐制备的和实施例1摇床诱导表达的p27菌液,5000g离心20min离心后菌体用平衡液重悬,调节液压破碎仪压力为0.8bar,开始破碎并收集破碎菌液。将破碎好的菌液4℃、12000rpm/min离心40min,上清用0.45μm滤器过滤,收集液体准备上样。
[0186]
2、ni focurose ff(imac)填料装填hk26/20型号空柱
[0187]
柱子使用前需先用20%乙醇润洗。
[0188]
用注射器装满20%乙醇,连接底部,注入乙醇,排出空气,让乙醇停留在滤网上,将底部与柱子连接。
[0189]
柱子用柱夹固定,向柱中加入20%乙醇或者纯水至几厘米高度。
[0190]
将装柱器连接在空柱上,确保柱子没有倾斜。
[0191]
装柱前设好报警压0.3mpa。
[0192]
将填料一次性贴壁加入装柱器中,用装柱液冲洗管壁,并补齐液面至装柱器顶部,盖上上方顶盖。
[0193]
点击pump wash a,排出设备及管路中空气。
[0194]
在柱底部放废液缸,拧开底部堵头。
[0195]
将顶部与管路连接;设流速为5ml/min,开始装柱;随着压力增加,填料不断被压实,稳定,稳定后标记液面位置,停止流速,将柱底用堵头堵住,将管路与装柱器断开;拆下装柱器;在柱头滴入适量装柱和缓冲液,补齐柱头液面;用注射器连接顶端适配器,推入20%乙醇,排除顶端适配器的空气让乙醇停留在柱网上;将适配器倾斜45
°
角,对准液面,向下盖紧,将溢出的液体吸走拧紧至胶面,此时液体会从柱头排出,将适配器拧到标记线下2~3cm处,将上端黑色螺纹拧至最紧。
[0196]
重新将上端管路连接至机器;打开底部堵头,继续运行流速,如果胶面改变,需重新调整;如暂时不用,填装20%乙醇,先下后上拆卸用堵头封闭,柱子装填完毕。
[0197]
3、akta层析系统纯化p27蛋白
[0198]
运行系统:启动akta pure仪器,进入unicorn7.0系统。
[0199]
洗泵:运行pumps wash程序清洗管道,排除管道气泡。
[0200]
设置系统参数:设置柱压为0.3mpa,设置流速为5ml/min。
[0201]
装柱:采用液滴对液滴的方式将ni focurose ff连接到层析系统上。
[0202]
平衡:用5-10cv缓冲液a以5.0ml/min平衡介质,直至基线平稳。
[0203]
上样:以5.0ml/min速度将hk26/20柱处理的样品上样。出液口收集流穿液。
[0204]
洗杂:以5.0ml/min流速设置2%浓度的缓冲液b洗脱杂蛋白,清洗直至基线为零。出液口收集洗杂液。
[0205]
洗脱:设置50%浓度的缓冲液b洗脱目的蛋白,根据uv吸收峰值收集洗脱蛋白样品,并收集紫外峰值的洗脱液。
[0206]
纯化结果验证:取各流穿液加入1/4体积的5
×
sds-page loading buffer,煮沸裂解10min,冰浴2min,12,000rpm离心10min,取上清进行sds-page蛋白质电泳鉴定。
[0207]
通过akta蛋白质层析纯化系统过ni focurose ff(imac)层析柱对发酵罐的三批(实施例2、实施例3、实施例4)禽白血病p27蛋白和和摇床制备(实施例1)的禽白血病p27蛋白进行纯化,纯化收集的目的蛋白进行sds-page电泳,结果表明,用50%缓冲液b收集吸收峰处的蛋白均为目的蛋白,约37kd,详见图5~7。
[0208]
经bca试剂盒测得实施例2禽白血病p27蛋白批次产量为11000mg;实施例3禽白血病p27蛋白产量为12000mg;实施例4禽白血病p27蛋白产量为10900mg;实施例1产量为80mg。使用发酵罐高效表达的禽白血病p27蛋白的批次产量是使用传统摇床批次产量的100倍以上。
[0209]
以上结果说明:用发酵罐高效表达禽白血病p27蛋白的稳定性和重复性较好,最终菌体密度达到109g/l以上,目的蛋白表达量30%以上,表达浓度达到1000mg/l,纯化蛋白产量达到10g/批次以上。发酵产量大幅提高。为后续生产工艺控制提供了理论与技术支持,并对禽白血病p27蛋白的大规模发酵生产和推广具有重要的技术指导意义。
[0210]
以上详细描述了本发明的优选实施方式,但是,本发明并不限于上述实施方式中的具体细节,在本发明的技术构思范围内,可以对本发明的技术方案进行多种变换,这些简单变型均属于本发明的保护范围。
[0211]
另外需要说明的是,在上述具体实施方式中所描述的各个具体技术特征和步骤,在不矛盾的情况下,可以通过任何合适的方式进行组合,为了避免不必要的重复,本发明对各种可能的组合方式不再另行说明。
[0212]
此外,本发明的各种不同的实施方式之间也可以进行任意组合,只要其不违背本发明的思想,其同样应当视为本发明所公开的内容。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1