一种多肽PROTAC分子及其制备方法和应用与流程
一种多肽protac分子及其制备方法和应用
技术领域
1.本发明属于生物技术领域,具体涉及一种多肽protac分子及其制备方法和应用。
背景技术:
2.大多数疾病的发生和发展皆和蛋白的异常表达或聚集相关,针对此类疾病的病理机制,传统的药物研发思路是研发小分子抑制剂或者蛋白类抑制剂,通过占据和阻断靶标蛋白的活性作用位点,抑制蛋白的功能活性。在传统的药物研发思路中,需要靶标蛋白具有活性口袋和结合位点,同时,这种通过占据驱动的模式需要在一段时间内保持较高的药物浓度才能发挥良好的治疗效果,但是较高的药物浓度易引起脱靶效应及不良反应。此外,小分子抑制剂易引起蛋白代偿性增加或基因突变,导致耐药性的产生。
3.靶向蛋白降解技术是一种利用真核细胞中固有的调控蛋白质稳态的蛋白降解机制干扰蛋白功能的新技术,所述靶向蛋白降解技术的兴起一定程度上解决了小分子抑制剂面临的困境。目前该领域发展最成熟的技术是基于泛素化-蛋白酶体系统的蛋白水解靶向嵌合体(proteolysis-targeting chimera,protac)技术。
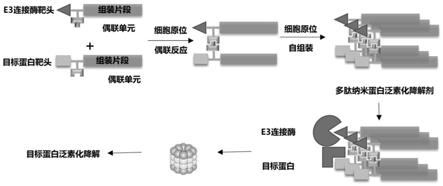
4.protac是一种异双功能的小分子或多肽化合物,利用连接子(linker)将靶蛋白结合配体(protein binding domain,pbd)与e3连接酶配体连接得到protac。通过拉近靶蛋白和e3泛素连接酶的距离,形成“靶蛋白-protac-e3连接酶”三元复合物,继而给靶蛋白加上泛素化的标签,最终利用泛素-蛋白酶体系统降解靶蛋白。
5.protac技术具有以下两个主要优势:(1)protac只需具备与靶蛋白结合活性,不需要直接抑制靶蛋白的功能活性,因此,可靶向传统“不可成药”的靶点;(2)protac通过“事件驱动”(event-driven)模式降解靶蛋白,只需亚化学剂量的protac分子与靶蛋白以非共价作用力瞬态结合即可实现靶蛋白的降解,因此,具有效率高、毒副作用弱和耐受性强的特点。
6.但是protac分子目前仍然面临着许多潜在的问题与挑战:(1)小分子protac存在钩子效应(hook effect),即在高浓度下倾向于结合单个e3连接酶或者目标蛋白,而非同时结合两个蛋白,从而不能发挥拉近目标蛋白与e3连接酶的功能。这种非剂量依赖的蛋白降解极大限制了protac分子的临床转化。(2)潜在脱靶效应引发的protac分子在非靶向的正常组织和器官的分布,从而带来的毒性,这限制了protac分子的临床转化。
7.因此开发一种可实现剂量依赖性、具有选择性的蛋白泛素化降解剂具有重要意义。
技术实现要素:
8.针对现有技术存在的不足,本发明的目的在于提供一种多肽protac分子及其制备方法和应用,本发明中所述多肽纳米蛋白泛素化降解剂是一种基于泛素化-蛋白酶体系统的蛋白水解靶向嵌合体(proteolysis-targeting chimera,protac)。本发明提供的多肽纳米蛋白泛素化降解剂可实现剂量依赖性,且是一种具有选择性的蛋白泛素化降解剂。所述
多肽纳米蛋白泛素化降解剂包括两个模块分子,两个模块分子在进入肿瘤细胞中后,通过肿瘤细胞内的酶或gsh激活偶联反应得到异双功能分子,所述异双功能分子具有结合e3连接酶和目标蛋白的能力,进而发挥蛋白泛素化的功能。所述异双功能分子的临界组装浓度降低,在细胞内原位形成组装结构,同时由于距离效应,使得e3连接酶和目标蛋白距离靠近从而满足泛素化的要求。在细胞内形成的长效滞留的组装体具有泛素化降解蛋白的潜力,更重要的是,原位形成的异双功能分子的自组装能力,有力地抵抗了小分子protacs在高浓度条件下导致的钩子效应。
9.为达到此发明目的,本发明采用以下技术方案:
10.第一方面,本发明提供一种多肽纳米蛋白泛素化降解剂,所述多肽纳米蛋白泛素化降解剂包括模块分子,所述模块分子包括模块分子a和模块分子b;
11.所述模块分子a包括偶联基团a、自组装基团和e3连接酶识别基团;
12.所述模块分子b包括偶联基团b、自组装基团和靶向结合基团;
13.所述偶联基团a和所述偶联基团b用于将模块分子a和模块分子b相连接。
14.本发明中,所述多肽纳米蛋白泛素化降解剂在肿瘤细胞高表达的酶或者gsh条件下激活偶联反应,发生偶联反应后的分子具有结合e3连接酶和目标蛋白的能力,从而发挥蛋白泛素化降解剂的功能,通过偶联基团a和偶联基团b将模块分子a和模块分子b相连接后,通过拉近目标蛋白和e3连接酶之间的空间距离,实现对于目标蛋白的降解。同时,发生反应后的分子由于拓扑结构的延伸,引发临界组装浓度降低,从而触发胞内原位组装,组装体可在胞内实现长效、浓度依赖的蛋白降解。
15.优选地,所述自组装基团包括自组装单元,所述自组装单元包括seq id no.1~22所示的氨基酸序列,优选为seq id no.22所示的氨基酸序列。
16.本发明中,所述自组装单元具有成核依赖以及蛋白介导的组装能力,所述自组装单元的氨基酸序列如下所示:
17.seq id no.1:klvffae;
18.seq id no.2:klvff;
19.seq id no.3:ff;
20.seq id no.4:yffgnnqqny;
21.seq id no.5:gsnkgaiiglm;
22.seq id no.6:gkvqiinkkldl;
23.seq id no.7:syssygqs;
24.seq id no.8:gnqqqny;
25.seq id no.9:gnqqqqy;
26.seq id no.10:gewtyd;
27.seq id no.11:wtvnys;
28.seq id no.12:fesnfn;
29.seq id no.13:hlfnlt;
30.seq id no.14:nqfiis;
31.seq id no.15:yqliwq;
32.seq id no.16:nqfnlm;
33.seq id no.17:nqnnfn;
34.seq id no.18:ynnynn;
35.seq id no.19:qnllwq;
36.seq id no.20:stwiye;
37.seq id no.21:yyqnyq;
38.seq id no.22:gnnnqny。
39.优选地,所述e3连接酶识别基团包括e3连接酶识别单元,所述e3连接酶识别单元的结构包括式(ⅰ)和/或式(ⅱ)所示的结构。
[0040][0041]
本发明中,所述e3连接酶识别基团识别的e3连接酶包括vhl和crbn,式(ⅰ)所示的结构靶向识别e3连接酶vhl ligand 1,式(ⅱ)所示的结构靶向e3连接酶crbn。
[0042]
优选地,所述靶向结合基团包括靶向结合单元,所述靶向结合单元包括小分子化学药物和/或小分子多肽。
[0043]
优选地,所述小分子化学药物包括吉非替尼衍生物、恩扎鲁铵衍生物、bms-1衍生物或er雌激素受体抑制剂衍生物中任意一种或至少两种的组合。
[0044]
优选地,所述小分子多肽的氨基酸序列包括seq id no.23所示的氨基酸序列。
[0045]
seq id no.23:larllt。
[0046]
优选地,所述靶向结合单元的结构包括式(ⅲ)、式(ⅳ)、式(
ⅴ
)或式(ⅵ)所示的结构中任意一种或至少两种的组合。
[0047][0048]
本发明中,所述靶向结合单元识别的靶向分子包括雄激素受体(ar)、雌激素受体(er)、上皮生长因子细胞增殖和信号传导的受体(egfr)或细胞程序性死亡-配体1(pd-l1)中任意一种或至少两种的组合。
[0049]
优选地,所述模块分子a中的偶联基团a包括催化单元和反应单元a。
[0050]
优选地,所述模块分子a中催化单元和反应单元a通过酰胺键连接。
[0051]
优选地,所述模块分子b中的偶联基团b包括催化单元和反应单元b;
[0052]
优选地,所述模块分子b中催化单元和反应单元b通过酰胺键连接。
[0053]
优选地,所述偶联基团a和偶联基团b中的催化单元均包括ghk(cu
2+
),所述ghk(cu
2+
)的结构包括式(ⅶ)所示的结构。
[0054][0055]
本发明中,ghk(cu
2+
)在肿瘤细胞内被gsh还原后,催化活性被激活,形成具有催化活性的cu
+
,其设计目的在于,仅在肿瘤细胞内实现特异性响应,解决了protacs分子在体内特异性差、有副作用的问题。
[0056]
优选地,所述模块分子a中的反应单元a包含叠氮基,所述反应单元a的结构包括式(
ⅷ
)所示的结构,其中n=1~10,n为整数,例如可以是1、2、4、6、8或10。
[0057][0058]
优选地,所述模块分子b中的反应单元b包含炔基,所述反应单元b的结构包括式(
ⅸ
)所示的结构,其中m=1~10,m为整数,例如可以是1、2、4、6、8或10。
[0059][0060]
本发明中,叠氮基和炔基被激活的催化剂cu
+
催化,发生click反应,从而实现多肽纳米蛋白泛素化降解剂中模块分子a和模块分子b的偶联,在肿瘤细胞内原位将模块分子a和模块分子b组装成多肽纳米蛋白泛素化降解剂。
[0061]
本发明中,所述偶联基团是一种在有/无催化剂条件下发生生物正交偶联反应的反应基团,所述反应包括:叠氮-炔烃的环化加成反应(spaac)和叠氮和炔基在cu
+
催化下发生环加成反应(cuaac);基于亚硝基(nitroso)的狄尔斯-阿尔德反应(diels-alder reaction);基于环张力的反式环辛烯亲双烯体与四嗪化合物(双烯体)的iedda生物正交反应;2-cyanobenzo thiazole(cbt)与巯基的环化加成反应。所述偶联基团采用叠氮和炔基在cu
+
催化下发生环加成反应进行偶联时,所述催化反应单元ghk(cu
2+
)中的cu
2+
被gsh还原成cu
+
,反应单元a中的叠氮基和反应单元b中的炔基发生环加成反应,从而将模块分子a和模块分子b相连接。
[0062]
优选地,所述模块分子a还包括连接单元a,所述连接单元a分别通过酰胺键将偶联基团a、自组装单元和e3连接酶识别单元相连接。
[0063]
优选地,所述模块分子b还包括连接单元b,所述连接单元b分别通过酰胺键将偶联基团b、自组装单元和靶向结合单元相连接。
[0064]
优选地,所述连接单元a和连接单元b均包括氨基酸衍生物。
[0065]
本发明中,所述连接单元a和连接单元b所选择的氨基酸衍生物的结构可以相同也可以不同。
[0066]
优选地,所述氨基酸衍生物的结构包括式(
ⅹ
)、式(
ⅺ
)、式(
ⅻ
)、或式(xiii)所示的结构中任意一种或至少两种的组合;
[0067][0068]
其中,式(
ⅹ
)中n=1~5,n为整数,例如可以是1、2、3、4或5,m=1~5,m为整数,例如可以是1、2、3、4或5;
[0069]
式(
ⅺ
)中n=1~5,n为整数,例如可以是1、2、3、4或5,m=1~5,m为整数,例如可以是1、2、3、4或5;
[0070]
式(
ⅻ
)中n=1~5,n为整数,例如可以是1、2、3、4或5;
[0071]
式(xiii)中n=1~5,n为整数,例如可以是1、2、3、4或5。
[0072]
优选地,所述氨基酸衍生物上可选地连接氨基酸重复单元,所述氨基酸重复单元包括甘氨酸重复单元gn、丝氨酸重复单元sn、甘氨酸和丝氨酸的重复单元(gs)n或gggs中任意一种或至少两种的组合。
[0073]
本发明中,所述氨基酸衍生物上所连接的氨基酸重复单元的种类可以相同也可以不同。
[0074]
优选地,所述甘氨酸重复单元gn中n=1~5,n为整数,例如可以是1、2、3、4或5。
[0075]
优选地,所述丝氨酸重复单元sn中n=1~5,n为整数,例如可以是1、2、3、4或5。
[0076]
优选地,所述甘氨酸和丝氨酸的重复单元(gs)n中n=1~5,n为整数,例如可以是1、2、3、4或5。
[0077]
优选地,所述连接单元为式(
ⅻ
)所示的氨基酸衍生物,n=4。
[0078]
优选地,所述模块分子a的连接顺序依次包括催化单元、反应单元、连接单元和组装单元,所述连接单元上还连接e3连接酶识别单元。
[0079]
优选地,所述模块分子b的连接顺序依次包括催化单元、反应单元、连接单元和组
装单元,所述连接单元上还连接靶向结合单元。
[0080]
优选地,所述模块分子a中e3连接酶识别单元的结构为式(ⅰ),所述模块分子a的结构如式(xiv)所示。
[0081][0082]
优选地,所述模块分子b中靶向结合单元的结构为式(ⅲ),所述模块分子b的结构如式(xv)所示。
[0083][0084]
优选地,所述模块分子b中靶向结合单元的结构为式(ⅳ),所述模块分子b的结构如式(xvi)所示。
[0085][0086]
在本发明中,所述多肽纳米蛋白泛素化降解剂中的模块分子的结构框架为ghk(cu
2+
)rxgnnqqny,其中,r代表含有叠氮基或炔基衍生物的反应基团;x代表靶向单元。
[0087]
其中,式(
ⅻ
)所示结构的分子为ghk(cu
2+
)k(n3)-e-(vhl-1)gnnqqny;
[0088]
式(ⅳ)所示结构的分子为ghk(cu
2+
)pra-k-(enza)gnnqqny;
[0089]
式(ⅳ)所示结构的分子为ghk(cu
2+
)pra-k-(gefi)gnnqqny。
[0090]
上述分子式中,ghk中,g(甘氨酸)、h(组氨酸)、k(赖氨酸);k(n3)表示含有叠氮基的赖氨酸衍生物,e(谷氨酸),vhl-1代表靶向e3连接酶vhl的靶向分子,gnnqqny中,g(甘氨酸)、n(天冬酰胺)、q(谷氨酰胺)、y(酪氨酸);pra表示炔基;enza代表恩扎鲁铵衍生物;gefi代表吉非替尼衍生物。在本发明中,enza(恩扎鲁铵衍生物)以及gefi(吉非替尼衍生物)的靶向结合单元可分别实现对雄激素受体(ar)或上皮生长因子细胞增殖和信号传导的受体(egfr)胞内域的结合;vhl-1可实现对e3连接酶vhl ligand 1的结合;因此,原位构筑的多肽纳米蛋白泛素化降解剂同时具有结合目标蛋白与e3连接酶的能力。
[0091]
在本发明中,所述多肽纳米蛋白泛素化降解剂在进入肿瘤细胞后,偶联基团a和偶联基团b中的催化单元ghk(cu
2+
)被肿瘤细胞中高表达的gsh催化,从而使模块分子a和模块分子b发生偶联反应,实现选择性在肿瘤细胞中构建多肽纳米蛋白泛素化降解的异双功能分子。在所述多肽纳米蛋白泛素化降解的异双功能分子中目标蛋白的靶头和e3连接酶靶头位于纳米蛋白泛素化降解剂单体同侧,可以拉近目标蛋白和e3连接酶之间的空间距离。
[0092]
在本发明中,所述异双功能分子在结合目标蛋白及e3连接酶之后会加速组装过程,在细胞中原位自组装形成纳米纤维结构的多肽纳米蛋白泛素化降解剂,能够发挥长效、剂量依赖性的蛋白降解功能,实现在细胞内的目标蛋白的长效降解。
[0093]
所述纳米纤维结构的多肽纳米蛋白泛素化降解剂具有同时结合目标蛋白和e3连接酶的能力,同时具有较大的比表面积,能提供较多的蛋白结合位点,目标蛋白和e3连接酶由于空间距离上的拉近,从而更好地实现e3连接酶对目标蛋白的泛素化过程,目标蛋白与e3连接酶的结合具有可调性和自适应性,因此,增加了形成的目标蛋白-降解剂-e3连接酶三元复合物的稳定性,提高了目标蛋白的降解效率。
[0094]
所述纳米纤维结构的多肽纳米蛋白泛素化降解剂具有浓度依赖性的目标蛋白降解效果。传统小分子protacs分子会随着浓度的升高形成二元复合物,而非形成可发挥降解功能的三元复合物,即hook钩子效应。但是,所述纳米纤维结构的多肽纳米蛋白泛素化降解剂由于形成纳米纤维的组装结构,在高浓度下不会倾向于形成二元复合物,因此可实现浓度依赖的蛋白降解。这种组装的策略能够抵抗protac分子高浓度下只结合单一蛋白产生的钩状(hook)效应。
[0095]
本发明所述的多肽纳米蛋白泛素化降解剂提供了一种通用的linker设计策略,通过在肿瘤细胞内组装形成纳米纤维状的多肽纳米蛋白泛素化降解剂,纳米组装体的表面效应提供了多个目标蛋白和e3连接酶的结合位点,目标蛋白与e3连接酶可适应性的结合到合适距离和空间位阻的位点,发挥泛素化的降解功能。本发明中所述多肽纳米蛋白泛素化降解剂的设计策略代表了一类通用的protac的设计策略,其设计策略中利用催化反应偶联组装的分子设计可作为通用的多肽纳米蛋白泛素化降解剂设计策略,还可以拓展e3连接酶靶头与目标蛋白靶头的种类,制备更多靶向其他靶标蛋白的多肽纳米蛋白泛素化降解剂。
[0096]
第二方面,本发明提供一种第一方面所述的多肽纳米蛋白泛素化降解剂的制备方法,所述制备方法包括如下步骤:
[0097]
通过多肽固相合成法合成所述偶联基团、自组装基团、e3连接酶识别基团和靶向结合基团,将偶联基团、自组装基团和e3连接酶识别基团相连接,将偶联基团、自组装基团和靶向结合基团相连接,得到所述多肽纳米蛋白泛素化降解剂。
[0098]
优选地,所述多肽纳米蛋白泛素化降解剂的制备方法包括如下具体步骤:
n,n,n',n'-四甲基脲六氟磷酸盐混合,得到混合液,分别将所述混合液用n-甲基吗啉和二甲基甲酰胺溶解,分别加入脱除保护基的赖氨酸和所述固定于树脂的多肽进行反应;采用裂解液进行裂解,所述裂解液包括三氟乙酸和三异丙基硅烷的水溶液,所述裂解液中三氟乙酸的体积分数为92.5~95%,三异丙基硅烷的体积分数为2~2.5%,再采用制备型反相高效液相色谱仪进行纯化,分别得到模块分子a或模块分子b。
[0117]
第三方面,本发明提供一种药物组合物,所述药物组合物包括第一方面所述的多肽纳米蛋白泛素化降解剂。
[0118]
优选地,所述药物组合物的给药方式包括静脉给药和/或灌注给药。
[0119]
优选地,所述药物组合物的给药浓度为100μm以下,例如可以是100μm、60μm、50μm、40μm、30μm、20μm或10μm等,优选为10~50μm。
[0120]
本发明中,所述药物组合物能够特异性地降解肿瘤细胞内的目标蛋白,抑制肿瘤的生长。
[0121]
第四方面,本发明提供一种第一方面所述的多肽纳米蛋白泛素化降解剂和/或第三方面所述的药物组合物在制备治疗肿瘤的药物中的应用。
[0122]
优选地,所述肿瘤包括前列腺肿瘤和/或肺部肿瘤。
[0123]
本发明所述的数值范围不仅包括上述例举的点值,还包括没有例举出的上述数值范围之间的任意的点值,限于篇幅及出于简明的考虑,本发明不再穷尽列举所述范围包括的具体点值。
[0124]
相对于现有技术,本发明具有以下有益效果:
[0125]
(1)本发明提供的多肽纳米蛋白泛素化降解剂为解决小分子protacs开发过程中的构效关系限制提供了新的思路。传统protacs依靠linker连接目标蛋白和e3连接酶靶头来构建三元复合物进而发挥距离靠近引发的蛋白降解。linker的长度、构象及修饰位点都会很大程度影响目标蛋白的降解效率。在新靶点的protacs的开发以及protacs降解效率的优化中,目前还没有普遍适用的linker设计策略。本发明提供的多肽纳米蛋白泛素化降解剂提供了一种通用的linker设计策略,通过在肿瘤细胞内组装形成纳米纤维状的多肽纳米蛋白泛素化降解剂,纳米组装体的表面效应提供了多个目标蛋白和e3连接酶的结合位点,目标蛋白与e3连接酶可适应性的结合到合适距离和空间位阻的位点,发挥泛素化的降解功能。
[0126]
(2)小分子protacs普遍面临着在高浓度下会优先形成protac与目标蛋白或者e3连接酶的二元复合物,而非三元复合物,影响了蛋白的降解效率;在本发明中,所述纳米纤维状的多肽纳米蛋白泛素化降解剂的结构打破了小分子protacs蛋白降解的非浓度依赖性;高浓度下,组装体的拓扑结构进一步延伸,提供了更大的表面积用来结合目标蛋白和e3连接酶,以实现高效、稳定的三元复合物的形成。
[0127]
(3)所述多肽纳米蛋白泛素化降解剂可特异性地在肿瘤区域触发,具有特异性和选择性,显著降低了脱靶毒性。该策略可实现在细胞水平和动物水平上高效地降解靶标蛋白,从而引起肿瘤细胞的凋亡,进而抑制肿瘤的生长。所述多肽纳米蛋白泛素化降解剂不会在体内产生明显副作用,具有良好的生物相容性。
附图说明
[0128]
图1是实施例1中纳米纤维状多肽纳米蛋白泛素化降解剂的形成过程示意图。
[0129]
图2是实施例1中模块分子a的结构图。
[0130]
图3是实施例1中模块分子b的结构图。
[0131]
图4是实施例2中模块分子b的结构图。
[0132]
图5是实施例3中模块分子a的结构图。
[0133]
图6是实施例4中模块分子a的结构图。
[0134]
图7是实施例4中模块分子b的结构图。
[0135]
图8是实施例5中模块分子a的结构图。
[0136]
图9是实施例5中模块分子b的结构图。
[0137]
图10是测试例1中western blot检测结果图。
[0138]
图11是测试例2中小鼠的成像结果图。
[0139]
图12是测试例3中小鼠肿瘤体积统计结果曲线图。
具体实施方式
[0140]
下面通过具体实施方式来进一步说明本发明的技术方案。本领域技术人员应该明了,所述实施例仅仅是帮助理解本发明,不应视为对本发明的具体限制。
[0141]
实施例中未注明具体技术或条件者,按照本领域内的文献所描述的技术或条件,或者按照产品说明书进行。所用试剂或仪器未注明生产厂商者,均为可通过正规渠道商购获得的常规产品。
[0142]
具体实施方式中的实验仪器与材料的来源如下表所示:
[0143]
试剂/仪器厂家货号/型号fmoc-tyr(tbu)-wang resin吉尔生化上海有限公司42001fmoc-谷氨酰胺(fmoc-gln(trt)-oh)吉尔生化上海有限公司36301fmoc-甘氨酸(fmoc-gly-oh)吉尔生化上海有限公司35301boc-甘氨酸(boc-gly-oh)吉尔生化上海有限公司30701fmoc-组氨酸(fmoc-his(trt)-oh)吉尔生化上海有限公司36701fmoc-赖氨酸(fmoc-lys(boc)-oh)吉尔生化上海有限公司36802fmoc-赖氨酸(fmoc-lys(dde)-oh)吉尔生化上海有限公司36884fmoc-天冬酰胺(fmoc-asn(trt)-oh)吉尔生化上海有限公司35102fmoc-酪氨酸(fmoc-tyr(trt)-oh)吉尔生化上海有限公司36901多肽固相合成管重庆欣维尔玻璃有限公司p120010c
[0144]
试验溶液的配制:
[0145]
脱保护液:将六氢吡啶与二甲基甲酰胺(dmf)的按照体积比1:4进行混合,所述脱保护液中六氢吡啶的体积份数为20%。
[0146]
反应液:将nmm与dmf的体积比1:24进行混合。
[0147]
裂解液:将tfa、tis和h2o混合,混合后各溶液的体积分数为:92.5%tfa、2.5%tis和2.5%h2o。
[0148]
茚三酮测试液:茚三酮、维生素c和苯酚各一滴。
[0149]
具体实施方式中使用的其他常用试剂包括:二甲基甲酰胺(dmf)、哌啶、二氯甲烷(dcm)、苯并三氮唑-n,n,n',n'-四甲基脲六氟磷酸盐(hbtu)、六氢吡啶、三异丙基硅烷(tis)、无水乙醚、三氟乙酸(tfa)、n-甲基吗啉(nmm)、甲醇、醋酸铜。
[0150]
实施例1
[0151]
本实施例提供一种多肽纳米蛋白泛素化降解剂,所述多肽纳米蛋白泛素化降解剂可在肿瘤细胞中的gsh还原下激活催化click反应过程,同时触发组装过程,进而在细胞内原位形成纳米纤维状多肽纳米蛋白泛素化降解剂,所述纳米纤维状多肽纳米蛋白泛素化降解剂的形成过程示意图如图1所示。
[0152]
所述多肽纳米蛋白泛素化降解剂的模块分子a靶向识别e3连接酶vhl ligand 1,模块分子b靶向识别ar;所述模块分子a为ghk(cu
2+
)k(n3)-e-(vhl-1)gnnqqny,所述模块分子a的结构如图2所示;所述模块分子b为ghk(cu
2+
)pra-k-(enza)gnnqqny,所述模块分子b的结构如图3所示。
[0153]
模块分子a和模块分子b中,ghk中,g(甘氨酸)、h(组氨酸)、k(赖氨酸);k(n3)表示含有叠氮基的赖氨酸,e(谷氨酸),vhl-1代表靶向e3连接酶vhl ligand 1的靶向分子,gnnqqny中,g(甘氨酸)、n(天冬酰胺)、q(谷氨酰胺)、y(酪氨酸);pra表示炔基;enza代表恩扎鲁铵衍生物。
[0154]
所述模块分子a的制备方法包括如下步骤:
[0155]
(1)将第一个氨基酸的c端固定于wang树脂(0.35mm修饰密度)上,n端利用fmoc进行保护。
[0156]
(2)在脱保护液中脱去第一个氨基酸的n端保护,用检测试剂进行脱保护检测,将预处理的氨基酸加入到脱去保护的树脂中进行反应,依次将氨基酸连接成固定于树脂的多肽。
[0157]
所述固定于树脂的多肽由如下步骤制备得到:
[0158]
fmoc(芴甲氧羰酰基)脱保护:称量0.1g wang树脂并投入到多肽固相合成管中,加入dmf溶胀30min。抽掉dmf,用脱保护液进行fmoc去保护反应,于摇床上放置10min。抽掉脱保护液,用dmf、dcm洗涤3次,从多肽固相合成管中取10mg wang树脂于试管中,用乙醇洗涤2次,茚三酮法检测呈深蓝色即为阳性结果后,准备接入第一个氨基酸(r),进入氨基酸缩合反应。
[0159]
氨基酸缩合:分别按照模块分子a的氨基酸序列顺序取10倍当量的氨基酸和hbtu,用7ml反应液溶解,投入到多肽固相合成管中,搅拌反应;1h后从多肽固相合成管中取10mg wang树脂于试管中,用乙醇洗涤2次,茚三酮法检测未变色后(即为阴性结果),证明缩合反应成功。抽掉多肽固相合成管中的液体,用dmf、dcm各洗涤2次,得到第一个氨基酸缩合后的肽树脂。
[0160]
对所得肽树脂重复进行以上“fmoc脱保护-氨基酸缩合”反应步骤,至最后一个氨基酸boc-甘氨酸反应完毕,得到固定于树脂的多肽。
[0161]
(3)将步骤(2)所述固定于树脂的多肽分别与e3连接酶识别单元通过酰胺缩合反应偶联,所述固定于树脂的多肽与e3连接酶识别单元或靶向结合单元的摩尔比例各自独立的为1:3,经裂解纯化分别得到模块分子a。
[0162]
所述酰胺缩合反应偶联和裂解纯化包括如下步骤:
[0163]
酰胺缩合反应:利用2%水合肼脱掉赖氨酸侧链的dde保护;分别将e3连接酶识别单元与hbtu混合,得到混合液,分别将所述混合液用nmm和dmf溶解,分别加入脱除保护基的赖氨酸和所述固定于树脂的多肽进行反应;
[0164]
裂解:反应完毕后,用dmf和dcm各洗涤树脂3次,甲醇洗2次,继续抽干20min。从多肽固相合成管中取出合成的肽树脂,裂解液先冰浴20min,在室温下于裂解液中裂解2h。将树脂过滤后,在旋蒸仪上蒸干,冰浴条件下用无水乙醚洗3次。再进行阴离子交换,将三氟乙酸根交换成醋酸根离子,之后在ph=8的条件下进行cu
2+
配位,得到粗肽。
[0165]
纯化:使用制备型反相hplc纯化所述粗肽,纯化后得到模块分子a,冻干后-20℃保存待用。hplc检测纯度(纯度》95%),使用质谱(ms,electrospray)对得到的纯肽进行鉴定,鉴定测量的分子量结果与目标分子量相同。
[0166]
所述模块分子b的制备方法参照模块分子a的制备方法。
[0167]
实施例2
[0168]
本实施例提供一种多肽纳米蛋白泛素化降解剂,所述多肽纳米蛋白泛素化降解剂的模块分子a与实施例1中的模块分子a一致,模块分子b靶向识别egfr;所述模块分子a为ghk(cu
2+
)k(n3)-e-(vhl-1)gnnqqny;所述模块分子b为ghk(cu
2+
)pra-k-(gefi)gnnqqny,所述模块分子b的结构如图4所示;模块分子b中,gefi代表吉非替尼衍生物。所述多肽纳米蛋白泛素化降解剂的制备方法参照实施例1的制备方法。
[0169]
实施例3
[0170]
本实施例提供一种多肽纳米蛋白泛素化降解剂,所述多肽纳米蛋白泛素化降解剂的模块分子a靶向识别e3连接酶crbn,模块分子b与实施例1中的模块分子b一致;所述模块分子a为ghk(cu
2+
)k(n3)-e-(crbn)gnnqqny,所述模块分子a的结构如图5所示。
[0171]
模块分子a中,crbn代表靶向e3连接酶crbn的靶向分子。所述多肽纳米蛋白泛素化降解剂的制备方法参照实施例1的制备方法。
[0172]
实施例4
[0173]
本实施例提供一种多肽纳米蛋白泛素化降解剂,所述多肽纳米蛋白泛素化降解剂的模块分子a靶向识别e3连接酶vhl ligand 1,模块分子b靶向识别目标蛋白egfr;所述模块分子a为ghk(cu
2+
)k(n3)-e-(vhl)gsgsgnnqqny,其连接单元a上还连接了氨基酸重复单元gsgs,所述模块分子a的结构如图6所示;所述模块分子b为ghk(cu
2+
)pra-k-(gefi)gsgsgnnqqny,其连接单元b上还连接了氨基酸重复单元gsgs,所述模块分子b的结构如图7所示。所述多肽纳米蛋白泛素化降解剂的制备方法参照实施例1的制备方法。
[0174]
实施例5
[0175]
本实施例提供一种多肽纳米蛋白泛素化降解剂,所述多肽纳米蛋白泛素化降解剂的模块分子a靶向识别e3连接酶vhl ligand 1,模块分子b靶向识别目标蛋白egfr;所述模块分子a为ghk(cu
2+
)k(n3)-e-(-(oeg)
3-vhl)gnnqqny,其连接单元a的结构如式(
ⅺ
)所示,其中m等于3,n等于4;所述模块分子a的结构如图8所示,所述模块分子b为ghk(cu
2+
)pra-k-(-(oeg)
3-enza)gnnqqny,其连接单元b的结构如式(
ⅹ
)所示,其中m等于3,n等于4,所述模块分子b的结构如图9所示。所述多肽纳米蛋白泛素化降解剂的制备方法参照实施例1的制备方法。
[0176]
测试例1
[0177]
本测试例对实施例2制备的多肽纳米蛋白泛素化降解剂进行细胞水平的蛋白降解效果验证实验。
[0178]
本测试例所选的细胞系为egfr高表达的肺癌a549细胞系。使用实施例2中的多肽纳米蛋白泛素化降解剂对a549细胞进行浓度依赖和时间依赖的孵育,并提取胞内蛋白;通过western blot对细胞内egfr表达水平进行验证。
[0179]
western blot检测结果图如图10所示,a549细胞在10μm、20μm、50μm浓度模块分子a和模块分子b共同作用下,egfr蛋白表达水平呈现浓度依赖的降低。结果表明,所述多肽纳米蛋白泛素化降解剂具有抵抗hook效应的浓度依赖的蛋白降解效果。
[0180]
测试例2
[0181]
本测试例对实施例2制备的多肽纳米蛋白泛素化降解剂进行动物水平的特异性识别及长效滞留实验。
[0182]
多肽-cy探针制备:将实施例2制备的多肽纳米蛋白泛素化降解剂与cy探针连接,cy探针是通过半胱氨酸的巯基与cy连接的,连接上cy探针以便于观察所述多肽纳米蛋白泛素化降解剂的滞留情况。
[0183]
小鼠皮下瘤模型的构建:用肺癌细胞进行小鼠皮下瘤的建立,取1
×
106个a549细胞注射到小鼠右腿皮下,2周后肿瘤成型,得到小鼠皮下瘤模型。
[0184]
利用多肽-cy探针进行动物水平的特异性识别及长效滞留实验,实验所选动物为小鼠。用多肽-cy探针进行鼠尾静脉注射,所用小鼠为3只,用小动物活体成像仪(ivis spectrum)进行成像,小鼠的成像结果图如图11所示,结果表明,所述多肽-cy探针在肿瘤组织处具有明显的信号聚集,并长效滞留可达48h。
[0185]
测试例3
[0186]
本测试例对实施例2制备的多肽纳米蛋白泛素化降解剂进行动物肿瘤生长抑制实验。
[0187]
小鼠皮下瘤模型的构建:用肺癌细胞进行小鼠皮下瘤的建立,取1
×
106个a549细胞注射到小鼠右腿皮下,2周后肿瘤成型,得到小鼠皮下瘤模型。
[0188]
用实施例2所述的多肽纳米蛋白泛素化降解剂进行鼠尾静脉注射(作为实验组),以生理盐水组为对照组,用小动物活体成像仪(ivis spectrum)进行成像,统计肿瘤的体积,小鼠肿瘤体积统计结果曲线图的结果如图12所示,对比实验组和同时给药与生理盐水组可发现,实验组注射多肽纳米蛋白泛素化降解剂后,肿瘤的生长速度显著降低,小鼠体内的肿瘤的体积显著低于生理盐水组,说明所述多肽纳米蛋白泛素化降解剂具有明显的肿瘤抑制效果。
[0189]
综上,本发明提供的多肽纳米蛋白泛素化降解剂在动物组织水平上实现了较好的蛋白降解效果,对小鼠实现了良好的肿瘤抑制效果。本发明所提供的多肽纳米蛋白泛素化降解剂可在肿瘤细胞中的gsh还原下激活催化click反应过程,同时触发组装过程,进而在细胞内原位形成纳米纤维状多肽纳米蛋白泛素化降解剂,所述纳米纤维状多肽纳米蛋白泛素化降解剂具有适应可调结合目标蛋白和e3连接酶的能力,进而介导距离拉近引起的泛素化蛋白酶体降解;随着浓度的增加、组装体尺寸增加和表面积增加,能提供更多位点来形成稳定的目标蛋白-组装体-e3连接酶三元复合物,从而使得体系实现不同于小分子的浓度依赖的蛋白降解。同时,由于所述纳米纤维状多肽纳米蛋白泛素化降解剂会在细胞中实现长
效滞留,因此可实现在细胞内长效降解靶标蛋白的作用。
[0190]
申请人声明,以上所述仅为本发明的具体实施方式,但本发明的保护范围并不局限于此,所属技术领域的技术人员应该明了,任何属于本技术领域的技术人员在本发明揭露的技术范围内,可轻易想到的变化或替换,均落在本发明的保护范围和公开范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1