吲哚哌啶嘧啶类衍生物及其制备方法和用途
1.本发明属于医药技术领域,具体涉及吲哚哌啶嘧啶类衍生物及其制备方法和用途。
背景技术:
2.艾滋病即获得性免疫缺陷综合症(acquired immune deficiency syndrome,aids)是由人类免疫缺陷病毒(human immunodeficiency virus,hiv)所导致传染性疾病。在hiv-1病毒复制周期中,逆转录酶(reverse transcriptase,rt)起着不可替代的作用,是抗hiv药物设计的重要靶点之一。在现有抗hiv药物研究中,非核苷类逆转录酶抑制剂(non-nucleoside reverse transcriptase inhibitor,nnrtis)因其高效低毒等优点成为各国药物化学家关注的热点之一。目前经过美国食品药品监督管理局(food and drug administration,fda)批准上市的nnrtis共有六种新化学实体:奈韦拉平(nevirapine)、地拉韦啶(delavirdine)、依非韦伦(efavirenz)、依曲韦林(etravirine,tmc125)、利匹韦林(rilpivirine,tmc278)和多拉韦林(doravirine)。其中,依曲韦林和利匹韦林均具有二芳基嘧啶结构,这类化合物通称为二芳基嘧啶类hiv-1抑制剂(dapys)。目前药物化学家发现了许多具有结构多样性的dapys(见古双喜等人撰写的《欧洲药物化学》综述文献gu s-x,lu h-h,liu g-y,et al.advances in diarylpyrimidines and related analogues as hiv-1 nonnucleoside reverse transcriptase inhibitors.eur.j.med.chem.,2018,158:371-392.)。基于dapys已有的生物活性和构效关系研究进展,我们认为吲哚哌啶嘧啶类衍生物会具有较好的抗hiv活性。
技术实现要素:
3.为解决现有技术的不足,本发明提供了吲哚哌啶嘧啶类衍生物及其制备方法和用途。
4.本发明所提供的技术方案如下:
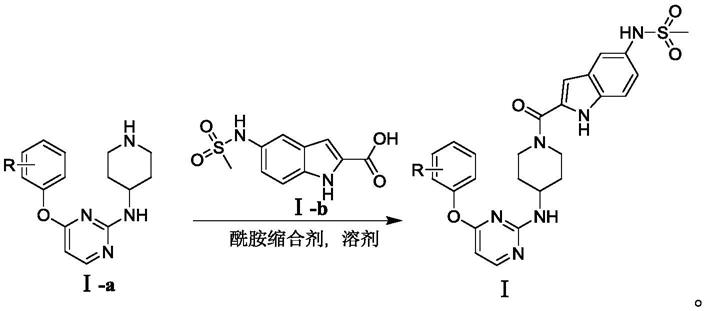
5.吲哚哌啶嘧啶类衍生物,其为式(ⅰ)化合物或其可药用盐:
[0006][0007]
其中,r为处于邻位、间位或对位的单取代、双取代或三取代取代基;所述取代基为氟原子、氯原子、溴原子、甲基、三氟甲基或氰基。
[0008]
上述技术方案所提供的新化合物具有较好的hiv-1细胞水平抑制活性,部分化合物对hiv-1iiib这一重要病毒株的抑制活性强于作为参考的上市药物齐多夫定、拉米夫定
和奈韦拉平,且化合物均具有低的细胞毒性和高的选择性指数,可用于进一步开发制备抗艾滋病药物。
[0009]
具体的,r为4-氯、4-溴、3-氰基、2-甲基、3-甲基、2-氟-4-溴、2,6-二甲基、2,4,6-三甲基或2,6-二甲基-4-氰基。
[0010]
优选的,r为2,6-二甲基、2,4,6-三甲基或2,6-二甲基-4-氰基。
[0011]
具体的,r为2-氯、3-氯、2-溴、3-溴、3-氟、3-三氟甲基、4-三氟甲基、4-氰基或3,5-二甲基-4-氯。
[0012]
本发明还提供了上述吲哚哌啶嘧啶类衍生物的制备方法,包括以下步骤:在惰性气体保护下,将5-(甲基磺酰氨基)-1h-吲哚-2-羧酸
ⅰ‑
b和酰胺缩合剂溶于溶剂中,搅拌后加入原料
ⅰ‑
a,室温搅拌至各原料消耗完全,分离纯化得到终产物ⅰ,其反应通式如下:
[0013][0014]
上述制备方法可在室温下进行,反应方式简单有效,并具有较高的收率,易于实施。
[0015]
具体的,所述的酰胺缩合剂为n,n-羰基二咪唑(cdi)、n,n-二异丙基碳二亚胺(dic)、n,n-二环己基碳二亚胺(dcc)、1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(edcl)、2-(7-偶氮苯并三氮唑)-n,n,n',n'-四甲基脲六氟磷酸酯(hatu)或苯并三氮唑-n,n,n',n'-四甲基脲六氟磷酸盐(hbtu)中的任意一种或几种的混合。
[0016]
具体的,溶剂为二氯甲烷、氯仿、四氯化碳、1,2-二氯乙烷、1,4-二氧六环、四氢呋喃、n,n-二甲基甲酰胺或二甲基亚砜中的任意一种或几种组成的混合溶剂。
[0017]
优选的,
ⅰ‑
a和
ⅰ‑
b等物质的量反应。
[0018]
本发明还提供了吲哚哌啶嘧啶类衍生物的应用,用于制备hiv-1抑制剂。
[0019]
本发明所提供的吲哚哌啶嘧啶类衍生物,具有较好的hiv-1细胞水平抑制活性,部分化合物对hiv-1iiib这一重要病毒株的抑制活性强于作为参考的上市药物齐多夫定、拉米夫定和奈韦拉平,且化合物均具有低的细胞毒性和高的选择性指数,可用于制备hiv-1抑制剂。
[0020]
具体的,用于制备预防用hiv-1抑制剂或治疗用hiv-1抑制剂。
具体实施方式
[0021]
以下对本发明的原理和特征进行描述,所举实施例只用于解释本发明,并非用于限定本发明的范围。
[0022]
实施例1:目标化合物(
ⅰ‑
1)的合成
[0023][0024]
称取
ⅰ‑
b(1mmol)和cdi(1mmol)溶于四氢呋喃(6ml)中,室温搅拌1h后,加入含有
ⅰ‑
a1(1mmol)的四氢呋喃(6ml)溶液,室温搅拌8h,薄层色谱监测反应,反应完全后,减压蒸馏反应液,得到油状物,柱层析分离纯化得
ⅰ‑
1,收率38.12%(以i-b计)。hrms(esi+)m/z:560.1914(m+h)
+
。1h nmr(400mhz,dmso-d6)δ(ppm):11.28(s,1h,indnh),9.10(s,1h,s-nh),7.85(s,1h,pyrh),7.31(s,2h,arh),7.12(s,1h,arh),7.01(d,j=8.2hz,1h,pyrh),6.75(s,1h,indch),6.73(s,1h,nh),6.35(s,1h,arh),5.89(s,1h,arh),3.92-3.98(m,2h,piph),3.67(s,1h,piph),3.04(s,3h,s-ch3),2.79(s,1h,piph),2.15(d,j=15.2hz,1h,piph),1.72(s,6h,ch3),1.53(m,1h,piph),1.33(m,1h,piph),0.99(m,2h,piph)。
13
c nmr(100mhz,dmso-d6)δ(ppm):168.36,162.20,162.01,160.61,153.78,134.15,133.14,132.86,131.50,130.97,127.42,120.09,119.08,115.00,112.97,108.63,104.03,49.02,48.58,38.85,31.87,29.07,16.27。
[0025]
实施例2:目标化合物(
ⅰ‑
2)的合成
[0026][0027]
称取
ⅰ‑
b(1mmol)和dic(1mmol)溶于二氯甲烷(6ml)中,室温搅拌1h后,加入含有
ⅰ‑
a2(1mmol)的二氯甲烷(6ml)溶液,室温搅拌8h,薄层色谱监测反应,反应完全后,减压蒸馏反应液,得到油状物,柱层析分离纯化得
ⅰ‑
2,收率32.13%(以i-b计)。hrms(esi+)m/z:532.1615(m+h)
+
。1h nmr(400mhz,dmso-d6)δ(ppm):11.64(s,1h,indnh),9.38(s,1h,s-nh),8.24(s,1h,pyrh),7.93(s,2h,arh),7.36-7.46(m,4h,arh),7.24(s,1h,nh),7.09(m,1h,pyrh),6.75(s,1h,indch),6.29(m,1h,arh),4.37(m,2h,piph),4.05-4.13(m,1h,piph),3.36(d,j=6.4hz,1h,piph),3.16(s,1h,piph),2.87(s,3h,s-ch3),1.88(m,2h,piph),1.39(m,2h,piph)。
13
c nmr(100mhz,dmso-d6)δ(ppm):169.01,162.18,161.86,160.82,156.59,134.54,134.15,131.54,130.91,127.46,123.43,120.01,118.97,114.92,112.99,108.28,104.05,49.07,48.39,38.87,31.95,31.33。
[0028]
实施例3:目标化合物(
ⅰ‑
3)的合成
[0029][0030]
称取
ⅰ‑
b(1mmol)和dcc(1mmol)溶于氯仿(6ml)中,室温搅拌1h后,加入含有
ⅰ‑
a3(1mmol)的氯仿(6ml)溶液,室温搅拌8h,薄层色谱监测反应,反应完全后,减压蒸馏反应液,得到油状物,柱层析分离纯化得
ⅰ‑
3,收率28.3%(以i-b计)。hrms(esi+)m/z:521.1808(m+h)
+
。1h nmr(400mhz,dmso-d6)δ(ppm):11.63(s,1h,indnh),9.44(s,1h,s-nh),8.17(s,1h,pyrh),7.31-7.48(m,3h,arh),6.97-7.12(m,5h,arh and nh),6.73(s,1h,pyrh),6.10(s,1h,indch),4.38(m,2h,piph),3.16(s,1h,piph),2.87(s,3h,s-ch3),2.32(s,3h,-ch3),1.88(m,2h,piph),1.43(m,2h,piph),1.06(m,2h,piph)。
13
c nmr(100mhz,dmso-d6)δ(ppm):169.95,162.19,162.08,160.18,152.83,134.09,131.51,131.15,129.82,127.43,126.37,122.60,120.06,119.79,119.14,114.86,112.94,104.00,56.46,48.32,38.85,32.04,21.29,19.01。
[0031]
实施例4:目标化合物(
ⅰ‑
4)的合成
[0032][0033]
称取
ⅰ‑
b(1mmol)和edcl(1mmol)溶于四氯化碳(6ml)中,室温搅拌1h后,加入含有
ⅰ‑
a4(1mmol)的四氯化碳(6ml)溶液,室温搅拌8h,薄层色谱监测反应,反应完全后,减压蒸馏反应液,得到油状物,柱层析分离纯化得
ⅰ‑
4,收率34.13%(以i-b计)。hrms(esi+)m/z:535.1976(m+h)
+
。1h nmr(400mhz,dmso-d6)δ(ppm):11.60(s,1h,indnh),9.35(s,1h,s-nh),8.16(s,1h,pyrh),7.47(s,1h,arh),7.37(d,j=8.7hz,1h,pyrh),7.05-7.13(m,5h,arh and nh),6.73(s,1h,indch),6.09(s,1h,arh),4.36(t,j=5.0hz,2h,piph),4.11(m,1h,piph),3.44(m,1h,piph),2.87(s,3h,s-ch3),2.05(s,6h,ch3),1.88(m,1h,piph),1.40(m,2h,piph),1.05(t,j=7.0hz 2h,piph)。
13
c nmr(100mhz,dmso-d6)δ(ppm):169.05,162.14,160.18,149.75,149.16,134.13,131.49,130.90,130.71,129.07,127.44,125.87,120.00,114.91,112.99,104.06,56.51,49.06,40.74,38.80,19.00,16.54。
[0034]
实施例5:目标化合物(
ⅰ‑
5)的合成
[0035][0036]
称取
ⅰ‑
b(1mmol)和hatu(1mmol)溶于1,2-二氯乙烷(6ml)中,室温搅拌1h后,加入含有
ⅰ‑
a5(1mmol)的1,2-二氯乙烷(6ml)溶液,室温搅拌8h,薄层色谱监测反应,反应完全后,减压蒸馏反应液,得到油状物,柱层析分离纯化得
ⅰ‑
5,收率24.3%(以i-b计)。hrms(esi+)m/z:549.2127(m+h)
+
。1h nmr(400mhz,dmso-d6)δ(ppm):11.62(s,1h,indnh),9.36(s,1h,s-nh),8.15(s,1h,pyrh),7.47(s,1h,arh),7.37(d,j=8.7hz,1h,arh),7.09(d,j=8.6hz,1h,pyrh),7.02(s,1h,nh),6.92(s,2h,arh),6.73(s,1h,indch),6.07(m,1h,arh),4.37(s,2h,piph),3.44(m,1h,piph),2.87(s,3h,s-ch3),2.23(s,3h,ch3),2.00(s,6h,ch3),1.88(m,2h,piph),1.40(m,2h,piph),1.05(t,j=7.0hz,2h,piph)。
[0037]
实施例6:目标化合物(
ⅰ‑
6)的合成
[0038][0039]
称取
ⅰ‑
b(1mmol)和hbtu(1mmol)溶于1,4-二氧六环(6ml)中,室温搅拌1h后,加入含有
ⅰ‑
a6(1mmol)的1,4-二氧六环(6ml)溶液,室温搅拌8h,薄层色谱监测反应,反应完全后,减压蒸馏反应液,得到油状物,柱层析分离纯化得
ⅰ‑
6,收率33.13%(以i-b计)。hrms(esi+)m/z:532.1615(m+h)
+
。1h nmr(400mhz,dmso-d6)δ(ppm):11.58(s,1h,indnh),9.32(s,1h,s-nh),8.22(s,1h,pyrh),7.81(s,1h,arh),7.73(d,j=7.0hz,1h,arh),7.65(t,j=7.7hz,1h,arh),7.58(d,j=7.4hz,1h,pyrh),7.47(s,1h,arh),7.38(d,j=hz,1h,arh),7.16(s,1h,nh),7.10(d,j=8.6hz,1h,indch),6.73(s,1h,arh),6.25(s,1h,arh),4.37(d,2h,piph),4.02(m,1h,piph),2.87(s,3h,s-ch3),1.88-1.99(m,3h,piph),1.36(m,2h,piph),1.15-1.23(m,1h,piph)。
13
c nmr(100mhz,dmso-d6)δ(ppm):168.74,161.69,161.32,160.10,152.47,133.66,131.02,130.43,129.19,127.36,126.97,125.78,119.54,118.07,114.44,112.51,103.58,96.51,59.74,47.95,38.39,31.47,20.73,14.07。
[0040]
实施例7:目标化合物(
ⅰ‑
7)的合成
[0041][0042]
称取
ⅰ‑
b(1mmol)和cdi(1mmol)溶于n,n-二甲基甲酰胺(6ml)中,室温搅拌1h后,加入含有
ⅰ‑
a7(1mmol)的n,n-二甲基甲酰胺(6ml)溶液,室温搅拌8h,薄层色谱监测反应,反应完全后,减压蒸馏反应液,得到油状物,柱层析分离纯化得
ⅰ‑
7,收率43.13%(以i-b计)。hrms(esi+)m/z:521.1823(m+h)
+
。1h nmr(400mhz,dmso-d6)δ(ppm):11.61(s,1h,indnh),9.36(s,1h,s-nh),8.16(s,1h,pyrh),7.47(s,1h,arh),7.08-7.38(m,6h,arh),6.73(s,1h,pyrh),6.11(m,1h,indch),5.76(s,1h,nh),4.36(s,2h,piph),4.04(s,1h,piph),3.51(m,1h,piph),3.04(m,1h,piph),2.87(s,3h,s-ch3),2.10(s,3h,ch3),1.87(s,2h,piph),1.39(s,2h,piph)。
[0043]
实施例8:目标化合物(
ⅰ‑
8)的合成
[0044][0045]
称取
ⅰ‑
b(1mmol)和hatu(1mmol)溶于二甲基亚砜(6ml)中,室温搅拌1h后,加入含有
ⅰ‑
a8(1mmol)的二甲基亚砜(6ml)溶液,室温搅拌8h,薄层色谱监测反应,反应完全后,减压蒸馏反应液,得到油状物,柱层析分离纯化得
ⅰ‑
8,收率33.33%(以i-b计)。hrms(esi+)m/z:541.4151(m+h)
+
。1h nmr(400mhz,dmso-d6)δ(ppm):11.62(s,1h,indnh),9.37(s,1h,s-nh),8.21(s,1h,pyrh),7.59(s,1h,arh),7.30-7.48(m,6h,arh and nh),7.11(d,1h,pyrh),6.67(m,1h,indch),6.24(s,1h,arh),4.38(m,2h,piph),4.01(s,1h,piph),2.87(s,3h,s-ch3),1.78-1.98(m,3h,piph),1.40(m,2h,piph),1.16(t,1h,piph)。
13
c nmr(100mhz,dmso-d6)δ(ppm):170.41,168.69,161.74,161.50,148.28,133.72,131.07,130.50,130.26,128.54,127.12,127.03,126.38,124.58,119.60,114.51,112.59,103.67,59.83,38.41,31.61,20.81,14.13。
[0046]
实施例9:目标化合物(
ⅰ‑
9)的合成
[0047][0048]
称取
ⅰ‑
b(1mmol)和hatu(1mmol)溶于四氢呋喃(6ml)中,室温搅拌1h后,加入含有
ⅰ‑
a9(1mmol)的四氢呋喃(6ml)溶液,室温搅拌8h,薄层色谱监测反应,反应完全后,减压蒸馏反应液,得到油状物,柱层析分离纯化得
ⅰ‑
9,收率38.23%(以i-b计)。hrms(esi+)m/z:541.4152(m+h)
+
。1h nmr(400mhz,dmso-d6)δ(ppm):11.63(s,1h,indnh),9.37(s,1h,s-nh),8.21(s,1h,pyrh),7.09-7.48(m,8h,arh and nh),6.74(s,1h,pyrh),6.21(s,1h,indch),4.38(s,2h,piph),4.02(t,1h,piph),2.87(s,3h,s-ch3),1.98(s,1h,piph),1.89(s,2h,piph),1.42(s,2h,piph),1.16(t,1h,piph)。
13
c nmr(100mhz,dmso-d6)δ(ppm):170.37,169.00,161.72,161.45,153.14,133.70,133.45,131.06,130.97,130.49,127.01,125.38,122.32,120.81,119.56,114.45,112.56,103.63,59.79,38.38,31.51,20.78,14.11。
[0049]
实施例10:目标化合物(
ⅰ‑
10)的合成
[0050][0051]
称取
ⅰ‑
b(1mmol)和hatu(1mmol)溶于四氢呋喃(6ml)中,室温搅拌1h后,加入含有
ⅰ‑
a10(1mmol)的n,n-二甲基甲酰胺(6ml)溶液,室温搅拌8h,薄层色谱监测反应,反应完全后,减压蒸馏反应液,得到油状物,柱层析分离纯化得
ⅰ‑
10,收率32.12%(以i-b计)。hrms(esi+)m/z:541.4166(m+h)
+
。1h nmr(400mhz,dmso-d6)δ(ppm):11.62(s,1h,indnh),9.36(s,1h,s-nh),8.20(s,1h,pyrh),7.08-7.49(m,8h,arh and nh),6.74(m,1h,pyrh),6.20(s,1h,indch),4.37(s,2h,piph),4.04(m,1h,piph),2.87(s,3h,s-ch3),1.98(s,1h,piph),1.88(m,2h,piph),1.40(m,2h,piph),1.17-1.22(m,1h,piph)。
13
c nmr(100mhz,dmso-d6)δ(ppm):169.17,161.75,161.45,159.93,151.19,133.71,131.08,130.49,129.54,129.37,127.02,123.87,119.59,114.50,112.58,103.66,59.82,38.40,31.58,20.81,14.13。
[0052]
实施例11:目标化合物(
ⅰ‑
11)的合成
[0053][0054]
称取
ⅰ‑
b(1mmol)和cdi(1mmol)溶于四氢呋喃(6ml)中,室温搅拌1h后,加入含有
ⅰ‑
a11(1mmol)的二甲基亚砜(6ml)溶液,室温搅拌8h,薄层色谱监测反应,反应完全后,减压蒸馏反应液,得到油状物,柱层析分离纯化得
ⅰ‑
11,收率26.13%(以i-b计)。hrms(esi+)m/z:585.0756(m+h)
+
。1h nmr(400mhz,dmso-d6)δ(ppm):11.62(s,1h,indnh),9.37(s,1h,s-nh),8.20(s,1h,pyrh),7.72(s,1h,arh),7.09-7.48(m,7h,arh and nh),6.73(d,1h,pyrh),6.22(m,1h,indch),4.38(m,2h,piph),4.02(m,1h,piph),2.88(s,3h,s-ch3),1.80-1.98(m,3h,piph),1.41(m,2h,piph),1.16(t,1h,piph)。
13
c nmr(100mhz,dmso-d6)δ(ppm):169.10,162.17,161.91,160.65,149.94,134.14,133.68,131.52,130.91,129.53,127.81,127.45,125.00,120.03,116.52,114.94,113.00,104.07,60.23,38.82,31.87,21.22,14.54。
[0055]
实施例12:目标化合物(
ⅰ‑
12)的合成
[0056][0057]
称取
ⅰ‑
b(1mmol)和cdi(1mmol)溶于四氢呋喃(6ml)中,室温搅拌1h后,加入含有
ⅰ‑
a12(1mmol)的四氢呋喃(6ml)溶液,室温搅拌8h,薄层色谱监测反应,反应完全后,减压蒸馏反应液,得到油状物,柱层析分离纯化得
ⅰ‑
12,收率29.6%(以i-b计)。hrms(esi+)m/z:585.0754(m+h)
+
。1h nmr(400mhz,dmso-d6)δ(ppm):11.62(s,1h,indnh),9.36(s,1h,s-nh),8.22(s,1h,pyrh),7.09-7.47(m,8h,arh and nh),6.74(s,1h,pyrh),6.21(s,1h,indch),4.38(s,2h,piph),4.02(m,1h,piph),2.87(s,3h,s-ch3),1.99(s,1h,piph),1.88(s,2h,piph),1.42(s,2h,piph),1.17(m,1h,piph)。
13
c nmr(100mhz,dmso-d6)δ(ppm):169.01,161.73,161.45,160.52,153.18,133.70,131.31,131.09,130.48,128.26,127.02,125.11,121.17,119.58,114.48,112.56,103.63,59.79,48.07,38.40,31.57,20.79,14.12。
[0058]
实施例13:目标化合物(
ⅰ‑
13)的合成
[0059][0060]
称取
ⅰ‑
b(1mmol)和cdi(1mmol)溶于四氢呋喃(6ml)中,室温搅拌1h后,加入含有
ⅰ‑
a13(1mmol)的四氢呋喃(6ml)溶液,室温搅拌8h,薄层色谱监测反应,反应完全后,减压蒸馏反应液,得到油状物,柱层析分离纯化得
ⅰ‑
13,收率24.13%(以i-b计)。hrms(esi+)m/z:585.0746(m+h)
+
。1h nmr(400mhz,dmso-d6)δ(ppm):11.62(s,1h,indnh),9.36(s,1h,s-nh),8.19(s,1h,pyrh),7.08-7.62(m,8h,arh and nh),6.74(m,1h,pyrh),6.20(s,1h,indch),4.37(s,2h,piph),4.03(m,1h,piph),2.87(s,3h,s-ch3),1.98(s,1h,piph),1.88(m,2h,piph),1.41(m,2h,piph),1.17(m,1h,piph)。
[0061]
实施例14:目标化合物(
ⅰ‑
14)的合成
[0062][0063]
称取
ⅰ‑
b(1mmol)和cdi(1mmol)溶于四氢呋喃(6ml)中,室温搅拌1h后,加入含有
ⅰ‑
a14(1mmol)的四氢呋喃(6ml)溶液,室温搅拌8h,薄层色谱监测反应,反应完全后,减压蒸馏反应液,得到油状物,柱层析分离纯化得
ⅰ‑
14,收率43.5%(以i-b计)。hrms(esi+)m/z:525.1573(m+h)
+
。1h nmr(400mhz,dmso-d6)δ(ppm):11.58(s,1h,indnh),9.33(s,1h,s-nh),8.20(s,1h,pyrh),7.04-7.48(m,8h,arh and nh),6.74(s,1h,pyrh),6.18(s,1h,indch),4.37(d,2h,piph),4.02(m,1h,piph),2.88(s,3h,s-ch3),1.88-1.98(m,3h,piph),1.43(m,2h,piph),1.15-1.22(m,1h,piph)。
[0064]
实施例15:目标化合物(
ⅰ‑
15)的合成
[0065]
[0066]
称取
ⅰ‑
b(1mmol)和cdi(1mmol)溶于四氢呋喃(6ml)中,室温搅拌1h后,加入含有
ⅰ‑
a15(1mmol)的四氢呋喃(6ml)溶液,室温搅拌8h,薄层色谱监测反应,反应完全后,减压蒸馏反应液,得到油状物,柱层析分离纯化得
ⅰ‑
15,收率35.15%(以i-b计)。hrms(esi+)m/z:575.1525(m+h)
+
。1h nmr(400mhz,dmso-d6)δ(ppm):11.59(s,1h,indnh),9.34(s,1h,s-nh),8.22(s,1h,pyrh),7.37-7.68(m,6h,arh),7.17(s,1h,nh),7.10(d,1h,arh),6.72(s,1h,pyrh),6.25(s,1h,indch),4.35(d,2h,piph),4.03(m,1h,piph),2.87(s,3h,s-ch3),1.84-1.98(m,3h,piph),1.15-1.40(m,3h,piph)。
13
c nmr(100mhz,dmso-d6)δ(ppm):169.40,162.16,161.85,160.59,153.12,134.14,131.49,131.35,130.91,127.43,126.74,125.55,122.43,120.02,119.34,114.92,112.99,104.04,60.22,48.42,38.85,31.91,21.20,14.53。
[0067]
实施例16:目标化合物(
ⅰ‑
16)的合成
[0068][0069]
称取
ⅰ‑
b(1mmol)和cdi+hatu(0.5mmol+0.5mmol)溶于四氢呋喃(6ml)中,室温搅拌1h后,加入含有
ⅰ‑
a16(1mmol)的四氢呋喃(6ml)溶液,室温搅拌8h,薄层色谱监测反应,反应完全后,减压蒸馏反应液,得到油状物,柱层析分离纯化得
ⅰ‑
16,收率33.56%(以i-b计)。hrms(esi+)m/z:575.1524(m+h)
+
。1h nmr(400mhz,dmso-d6)δ(ppm):11.60(s,1h,indnh),9.35(s,1h,s-nh),8.24(s,1h,pyrh),7.82(s,2h,arh),7.36-7.47(m,4h,arh),7.18(s,1h,nh),7.10(d,1h,arh),6.73(m,1h,pyrh),6.27(s,1h,indch),4.02-4.37(m,3h,piph),2.87(s,3h,s-ch3),1.87-1.98(m,3h,piph),1.15-1.40(m,3h,piph)。
13
c nmr(100mhz,dmso-d6)δ(ppm):169.27,162.17,161.89,160.68,155.98,134.14,131.52,130.93,127.44,126.33,125.96,123.15,119.99,114.89,112.98,104.01,60.20,38.86,31.92,21.20,18.99,14.53。
[0070]
实施例17:目标化合物(
ⅰ‑
17)的合成
[0071][0072]
称取
ⅰ‑
b(1mmol)和cdi+hbtu(0.5mmol+0.5mmol)溶于四氢呋喃(6ml)中,室温搅拌
1h后,加入含有
ⅰ‑
a17(1mmol)的四氢呋喃(6ml)溶液,室温搅拌8h,薄层色谱监测反应,反应完全后,减压蒸馏反应液,得到油状物,柱层析分离纯化得
ⅰ‑
17,收率38.23%(以i-b计)。hrms(esi+)m/z:569.1569(m+h)
+
。1h nmr(400mhz,dmso-d6)δ(ppm):11.62(s,1h,indnh),9.36(s,1h,s-nh),8.17(s,1h,pyrh),7.41(s,2h,arh),7.38(d,1h,arh),7.06-7.16(m,4h,arh and nh),6.74(s,1h,indch),6.11-6.17(m,1h,pyrh),4.37(s,2h,piph),4.02(m,1h,piph),2.87(s,3h,s-ch3),2.33(s,6h,ch3),1.88-1.98(m,3h,piph),1.41(m,2h,piph),1.17(m,1h,piph)。
[0073]
实施例18:目标化合物(
ⅰ‑
18)的合成
[0074][0075]
称取
ⅰ‑
b(1mmol)和cdi+dcc(0.5mmol+0.5mmol)溶于四氢呋喃(6ml)中,室温搅拌1h后,加入含有
ⅰ‑
a18(1mmol)的四氢呋喃(6ml)溶液,室温搅拌8h,薄层色谱监测反应,反应完全后,减压蒸馏反应液,得到油状物,柱层析分离纯化得
ⅰ‑
18,收率36.89%(以i-b计)。hrms(esi+)m/z:603.0840(m+h)
+
。1h nmr(400mhz,dmso-d6)δ(ppm):11.62(s,1h,indnh),9.36(s,1h,s-nh),8.22(s,1h,pyrh),7.08-7.75(m,7h,arh and nh),6.74(s,1h,pyrh),6.31(s,1h,indch),4.36(s,2h,piph),4.02(m,1h,piph),2.87(s,3h,s-ch3),1.99(s,1h,piph),1.78-1.91(m,2h,piph),1.15-1.40(m,3h,piph)。
13
c nmr(100mhz,dmso-d6)δ(ppm):168.69,162.17,161.76,160.58,139.36,134.14,131.51,130.92,128.66,127.45,126.59,120.62,120.00,118.14,114.91,112.98,104.05,60.21,48.49,38.87,31.84,21.21,14.54。
[0076]
实施例19:
[0077]
采用如下常规方法对18个吲哚哌啶嘧啶类化合物进行抗hiv生物活性测试:
[0078]
体外细胞水平的抗hiv病毒活性测定,主要包括对hiv感染的mt-4细胞的抑制活性及细胞毒性两方面。方法描述如下:使化合物在hiv感染的mt-4细胞中感染hiv不同时间,用mtt法测定药物对hiv诱变的细胞病变的保护作用,计算使50%的细胞免于hiv诱导的细胞病变所需的浓度半数有效浓度ec
50
,毒性测定与抗hiv活性实验平行进行,也是在mt-4细胞培养中,用mtt法测定使50%的未感染细胞发生细胞病变的浓度(cc
50
)。
[0079]
材料与方法:各化合物的抗hiv活性由药物对hiv在细胞中引起的细胞病变的抑制作用效率来监控。采用mt-4细胞进行细胞培养。采用的病毒株为hiv-1病毒株iiib。
[0080]
具体操作如下:将化合物用二甲基亚砜(dmso)或水溶解后用磷酸盐缓冲食盐水溶液稀释,将3
×
105mt-4细胞用100μl各化合物不同浓度此溶液在37℃预培养l h,然后向该化合物中加入100μl适当的病毒稀释液,将细胞于37℃培养l h。洗涤三次后,将细胞再次分别悬浮于含有或不含有化合物的培养介质中。接着将细胞在5%二氧化碳氛围中,于37℃下
再培养7天,并于感染后第三天用含有或不含有化合物的培养介质替换补充培养液。每种培养液条件都重复操作两次。对病毒的细胞病变作用每天都用反向光学显微镜监控。典型来讲,本实验中所用的病毒稀释液常常会在病毒感染后第五天导致细胞病变。药物抑制浓度以药物对病毒细胞病变作用产生50%抑制作用而同时对细胞无直接毒性的浓度(cc
50
)。需要强调的是,当化合物水溶性较差,需要用dmso才能溶解时,dmso比浓度相对于水来讲,一般低于10%,(dmso在mt-4细胞培养介质中最终浓度小于2%)。因为dmso能影响测试化合物的抗病毒活性,对含有相同浓度dmso溶液抗病毒活性对比空白实验也应该平行进行。另外,dmso最终浓度(1/1000)远远低于影响hiv-1在t细胞中复制所需的浓度。
[0081]
表1中列出了18个吲哚哌啶嘧啶类化合物(结构式i)对hiv-1野生株的抑制活性ec
50
以及cc
50
和选择性指数(si)。上市药物齐多夫定、拉米夫定、奈韦拉平、依曲韦林和依法韦伦也被作为参考药物同时测试。
[0082][0083]
表1吲哚哌啶嘧啶类化合物的活性与细胞毒性结果
[0084]
[0085][0086]
由表1可知,所测试的18个吲哚哌啶嘧啶类化合物均具有hiv-1野生株抑制活性,化合物1、4、5对hiv-1野生株这一重要病毒株的抑制活性强于作为参考的上市药物拉米夫定和奈韦拉平。且部分化合物的选择性极高(》2000),细胞毒性低,可用于进一步开发制备抗艾滋病药物。
[0087]
以上所述仅为本发明的较佳实施例,并不用以限制本发明,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1