干扰SQR基因的shRNA及其应用的制作方法
3
′
;(见seq id no.6);
12.反义链:5
′‑
aattcaaaaacctcactgttaactacaagaactcgagttcttgtagttaacagtgagg-3
′
;(见seq id no.7)。
13.根据sqr基因的靶点序列:5
′‑
gagacatttctaccagccaat-3
′
设计干扰sqr基因的shrna的正义链和反义链,其核苷酸序列如下所示:
14.正义链:5
′‑
ccgggagacatttctaccagccaatctcgagattggctggtagaaatgtctctttttg-3
′
;(见seq id no.8);
15.反义链:5
′‑
aattcaaaaagagacatttctaccagccaatctcgagattggctggtagaaatgtctc-3
′
;(见seq id no.9)。
16.本发明还保护含有干扰sqr基因的shrna的重组慢病毒表达载体。
17.进一步的,所述慢病毒表达载体为gv112,所述载体包括age i酶切位点和ecor i酶切位点,将gv112载体用age i酶和ecor i酶双酶切,得到线性化的gv112载体,将干扰sqr基因的shrna的正义链和反义链dna,进行退火,形成包含干扰靶点序列的dna双链;通过t4 dna连接酶将线性化的gv112载体和纯化好的dna双链连接,得到重组病毒表达载体。
18.一种重组慢病毒,由重组慢病毒表达载体经转染细胞后包装得到。
19.本发明还提供了所述的干扰sqr基因的shrna或所述的含有干扰sqr基因的shrna的重组慢病毒表达载体或所述的重组慢病毒在制备抗食管癌药物中的应用。
20.进一步的,所述抗食管癌药物是降低食管癌细胞活力的药物。
21.进一步的,所述抗食管癌药物是降低食管癌细胞克隆形成能力的药物。
22.进一步的,所述抗食管癌药物是抑制食管癌细胞侵袭的药物。
23.用于降低sqr基因在食管癌细胞中的表达的试剂盒也在本技术的保护范围内。
24.相比于现有技术,本发明的有益效果为:本发明针对sqr基因设计了一种慢病毒干扰rna,通过在细胞中转染该慢病毒干扰rna,能调控和干扰sqr基因表达,降低细胞克隆形成能力,抑制细胞迁移和侵袭;因此抑制sqr基因表达的慢病毒干扰rna,降低sqr的表达,有效抑制食管癌细胞增殖、迁移和侵袭。本发明为食管癌治疗提供了一个新的基因靶点和药物,具备很高的临床实际应用价值。
附图说明
25.图1是免疫组织化学染色检测sqr基因在食管癌患者组织及癌旁组织中的表达图;
26.图2是shrna干扰sqr效率鉴定的蛋白免疫印迹实验结果图;图中,kyse150为人食管鳞癌细胞;gd表示gapdh,作为内参;nc为阴性对照组;#1、#2、#3分别为感染慢病毒干扰shrna-1、shrna-2、shrna-3的实验组;
27.图3为shrna干扰sqr表达的细胞活力实验结果图;
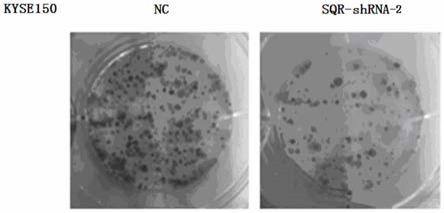
28.图4为shrna干扰sqr表达的细胞克隆形成实验结果图;
29.图5为shrna干扰sqr表达的细胞transwell实验结果图。
具体实施方式
30.下面结合具体实施例对本发明进一步进行描述。以下实施例中未作具体说明的分子生物学实验方法,均可参照《分子克隆实验指南》(第三版)j.萨姆布鲁克一书中所列的方
法或本领域的常规方法进行,或者按照试剂盒和产品说明书进行。
31.实施例1
32.一、免疫组织化学染色检测sqr基因在食管癌患者组织及癌旁组织中的表达
33.多聚甲醛固定后的组织,进行石蜡包埋,连续切片,压在载玻片上;将免疫组化片,放在80℃烘箱内,烘片30min;在二甲苯i和二甲苯ii中各浸泡15min;然后依次放入无水乙醇、95%乙醇、80%乙醇、70%乙醇各2min;最后将片子放入超纯水中浸泡清洗;将片子放在edta抗原修复液中,高压锅煮至冒气后,继续加热3min,离开热源,打开高压锅盖并冷却;pbst冲洗3次后,使用免疫组化笔圈出组织,再用h2o2室温孵育20min;用抗体稀释液稀释一抗,4℃孵育过夜;第二天,室温复温30min;pbst冲洗3次后,孵育二抗20min;pbst小心冲洗后,用dab显色,观察颜色变化,当显示棕色时,用自来水终止反应;苏木精染色30s,自来水冲洗,显微镜下观察,若染色不深,可重复苏木精染色;然后依次放入梯度乙醇浸泡4min,再放入二甲苯i和二甲苯ii各浸泡10min。中性树脂封片,通风橱晾干后,显微镜下观察。
34.图1是免疫组织化学染色检测sqr基因在食管癌患者组织及癌旁组织中的表达图;结果表明,sqr基因在食管癌患者组织中的表达明显高于癌旁组织。
35.二、sqr慢病毒干扰片段的设计并构建慢病毒载体和阴性对照质粒
36.从genbank调取sqr(nm_021199)基因信息;利用上海吉凯基因化学技术有限公司的设计软件genechem设计针对sqr基因的有效的sirna靶点,表1列出了其中3条针对sqr基因的有效的sirna靶点序列。针对sirna靶点序列合成相应的shrna的链dna oligo,其序列及结构如表2所示。
37.表1靶向于人sqr基因的sirna靶点序列
38.no.靶序列gc%1gcgcctttccatgtatctcat42.11%2cctcactgttaactacaagaa31.58%3gagacatttctaccagccaat42.11%
39.表2包含sqr基因的sirna靶点序列的双链dna oligo
40.[0041][0042]
合成后成对的引物干粉溶解于退火缓冲液中,90℃水浴15分钟,然后自然冷却至室温。以age i和ecor i限制性内切酶作用于gv112载体使其线性化,酶切反应体系为:ddh2o 41μl,10
×
cutsmart buffer 5μl,纯化的质粒dna(1μg/μl)2μl,age i(10u/μl)1μl,ecor i 1μl,总酶切体系为50μl。用移液器轻轻吹打混匀,短暂离心,置于37℃反应3h或过夜。对载体酶切产物进行琼脂糖凝胶电泳,回收目的条带。
[0043]
通过t4 dna连接酶将双酶切线性化的gv112载体和退火双链dna连接,16℃连接过夜,回收连接产物。连接反应体系为:线性化载体(100ng/μl)1μl,双链dna(100ng/μl)1μl,10
×
t4 dna ligase缓冲液2μl,t4 dna ligase 1μl,dd h2o补足至20μl。
[0044]
将连接产物转化氯化钙制备的新鲜的感受态大肠杆菌细胞。在连接转化产物长出菌表面沾一下,溶于10μl lb培养基,混匀取1μl作为模板,在以慢病毒载体中rnai序列的上下游,设计通用pcr引物(上游引物序列:5
′‑
ccatgattccttcatatttgc-3
′
;下游引物序列:5
′‑
gtaatacggttatccacgcg-3
′
),进行菌落pcr扩增实验,pcr扩增产物以琼脂糖凝胶电泳鉴定,鉴定为阳性的克隆进行测序和比对分析,将测序正确的菌液进行扩大培养,采用质粒提取试剂盒提取细菌中含有sqr干扰片段的重组载体。
[0045]
sirna阴性对照靶点序列为5
′‑
ttctccgaacgtgtcacgt-3
′
,构建sirna对照质粒时,针对sirna阴性对照靶点序列合成双链dna oligo序列(上游引物序列:5
′‑
ccggttctccgaacgtgtcacgtttcaagagaacgtgacacgttcggagaatttttg-3
′
;下游引物序列:5
′‑
aattcaaaaattctccgaacgtgtcacgttctcttgaaacgtgacacgttcggagaa-3
′
),其余构建方法、鉴定方法及条件均同上,构建成功的阴性对照命名为shrna-nc。
[0046]
三、sqr慢病毒干扰片段的筛选
[0047]
细胞培养条件及培养基:kyse150细胞株用含10%胎牛血清的rpmi 1640(hyclone sh30809.01)培养在5%co2,37℃的培养箱中。
[0048]
细胞转染:将构建的shrna-1、shrna-2和shrna-3重组质粒用qiagen公司的质粒中量抽提试剂盒提取并稀释至终浓度为20μm溶液待用;将细胞消化后,铺在6孔板中,当细胞密度汇合到30-50%时进行转染;准备三个无菌1.5ml的ep管,分别在4个ep管中加入opti-mem 200μl和对应的shrna-1、shrna-2、shrna-3及阴性对照shrna溶5μl(无靶向的shrna空载序列,命名为shrna-nc),快速涡旋10s使其完全混匀;再分别向4个ep管中加入6μl shrna-mate转染试剂,室温静置10min,使shrna和转染试剂形成转染复合物,再加入6孔板对应的孔中,轻晃摇匀;2天后,免疫印迹法验证敲低效率以及进行细胞功能实验。如图2所示。
[0049]
蛋白表达量的结果如图2所示,可以看出,与对照组比较,感染慢病毒干扰rna1(shrna-1)、慢病毒干扰rna2(shrna-2)和慢病毒干扰rna3(shrna-3)的实验组的sqr蛋白的
表达量都降低,从蛋白的相对表达量能清楚得看出,感染慢病毒干扰shrna-2的实验组对sqr蛋白表达的干扰最大,效果最好。因此可以将干扰sqr基因表达的shrna-2应用在干扰sqr基因表达中,用于后续实施例。
[0050]
四、sqr慢病毒干扰片段抑制食管癌细胞活力
[0051]
cck8法检测细胞增殖情况。将转染shsqr或nc的kyse150细胞以3
×
103个/孔的密度接种于96孔板中,分别培养24h、48h和72h。在不同时间点,每孔加入10ul cck8试剂(dojindo laboratories),37℃孵育2h。为研究顺铂的敏感性,将转染shsqr或nc的kyse150细胞以1
×
104的密度接种于96孔板中过夜培养。然后分别用4和1μg/ml顺铂处理0h、24h、48h、72h。使用微型平板阅读器(thermo science)测试450nm处的吸光度。
[0052]
如图3所示,sqr慢病毒干扰rna干扰的实验组与nc组相比,细胞活力显著降低,表明sqr能够促进kyse150细胞活力,即通过慢病干扰shrna-2转染kyse150干扰sqr基因,能抑制细胞活力。
[0053]
五、sqr慢病毒干扰片段抑制食管癌转移和侵袭的检测
[0054]
1、克隆形成实验证明shrna-2干扰sqr导致细胞水平的抗肿瘤效应
[0055]
将500个细胞/孔的细胞悬液放入6cm的培养皿中。在37℃孵箱中用3ml培养液培养细胞。培养细胞培养2周后,用pbs温和洗涤,福尔马林固定,0.1%结晶紫染色,测定克隆形成率。如图4所示,慢病毒干扰sqr转染的食管癌细胞kyse150增殖能力明显减弱,慢病毒干扰sqr转染的食管癌细胞kyse150数量明显下降。
[0056]
结果表明,sqr慢病毒干扰rna干扰的实验组与nc组相比,细胞克隆数显著降低,表明sqr能够促进大鼠kyse150细胞克隆形成,即通过慢病干扰shrna-2转染kyse150干扰sqr基因,能抑制细胞的克隆形成。
[0057]
2、transwell分析实验证明sqr慢病毒干扰片段细胞水平的抗肿瘤效应
[0058]
先准备24孔板,将小室移至24孔板内;细胞侵袭实验,基质胶需要提前一天从-20℃放入4℃冰箱,24孔板、枪头、小室都需要提前预冷,所有操作都需在冰上进行;将转染后的细胞从6孔板中消化下来,离心后,弃去上清,留细胞沉淀;加入1ml pbs重悬,离心;再加入1ml pbs重悬,离心,弃上清;加入少些基培重悬,然后取200μl体积内含5
×
105个细胞,置于孔径为8um的transwell室中,进行或不进行matrigel处理,并在下部隔室中装入1640含10%fbs的培养基500μl。温育24小时后,移去上腔室细胞悬液,用4%多聚甲醛将下腔室膜上的细胞固定30min,然后用结晶紫染色5min。用显微镜随机选择5个视野来计数侵袭细胞。如图5所示,为侵袭实验的细胞状态,慢病毒干扰sqr转染的食管癌细胞kyse150侵袭能力明显减弱,慢病毒干扰sqr转染的食管癌细胞kyse150数量明显下降。
[0059]
本领域普通技术人员可知,本发明的技术方案在下述范围内变化时,仍然能够得到与上述实施例相同或相近的技术效果,仍然属于本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1