一种氮杂大环席夫碱及其金属配合物、微纳米材料和应用
1.本发明涉及氮杂大环席夫碱技术领域,尤其涉及一种氮杂大环席夫碱及其金属配合物、微纳米材料和应用。
背景技术:
2.氮杂冠醚是一类具有柔性骨架结构的富电子大环化合物,是超分子化学研究的第一代大环主体分子。随环的大小不同,氮杂冠醚对于过渡离子、镧系金属离子及一些缺电子中性分子都能够进行选择性识别。
3.氮杂冠醚作为相转移催化剂已广泛应用于有机合成反应中,其在超分子催化方面的研究也有较多报道。
4.近年来,金属配合物催化剂在选择性催化领域的研究令人瞩目。目前金属配合物催化剂大致有卟啉类配合物,salen类配合物以及其他类型的配合物,它们可在相对温和的条件下催化烯烃氧化,得到较高的转化率和选择性。li等合成的邻菲啰啉-cucl2配合物能在温和条件下高效催化氧化环己烷,其转化率达到24.4%,环己酮的选择性几乎100%。esmelindro等合成的双核fe(iii)配合物在催化以h2o2为氧源的环己烷氧化反应中,其转化率达到19.2%,醇酮的收率分别为12.6%和6.6%。
5.微纳米技术以及微纳米粒子独特的物理和化学特性引起了广泛的重视,微纳米催化剂由于其更大的外表面,更多暴露的晶胞、更多易接近和均匀分布的活性位等,也能够承载更多的组分。等人研究ag纳米负载于α-al2o3载体上催化分子氧,氧化苯乙烯环氧化反应,苯乙烯转化率达到94.6%,环氧苯乙烷选择性为55.6%,催化剂在反应30天后才出现极少量的钝化。
6.随着材料维度的降低和特征尺度的减小,纳米结构的量子效应、尺寸效应、表界面效应等一系列物理效应变得显著,它们是提高有机-无机杂化材料催化性能的关键所在。
7.鉴于金属配合物与纳米粒子的以上特殊性质,现有技术中已有研究将其两者结合,即将金属配合物制备成纳米级颗粒,显示出了其惊人的特性。本发明旨在提出一种新的氮杂大环席夫碱,并将其应用于研究金属配合物参与催化反应的作用机理,设计和探索新型的氮杂大环配合物催化剂。
技术实现要素:
8.基于背景技术存在的技术问题,本发明提出了一种氮杂大环席夫碱及其金属配合物、微纳米材料和应用。
9.本发明提出的一种氮杂大环席夫碱,其分子式为c
16h34cl2
n4o8,结构式如式(ⅰ)所示:
[0010][0011]
优选地,所述氮杂大环席夫碱的晶体为斜方晶系,fbca;晶胞参数:体为斜方晶系,fbca;晶胞参数:β=90
°
;γ=90
°
。
[0012]
本发明还提出了上述氮杂大环席夫碱的制备方法,步骤如下:将乙二胺分散到丙酮中,搅拌下向其中滴加高氯酸水溶液进行反应,过滤,静置,有无色方片状晶体析出,过滤,洗涤,即得。
[0013]
上述反应过程中,丙酮既是溶剂也是反应物,产物大环上的甲基来源自丙酮。滴加高氯酸水溶液,边滴加边反应。
[0014]
优选地,于30min内滴加高氯酸水溶液完毕;乙二胺和高氯酸的摩尔比为1:1。
[0015]
本发明还提出了一种氮杂大环席夫碱的金属配合物,是以上述氮杂大环席夫碱为配体,与mn
2+
进行配位,得到氮杂大环席夫碱的锰(ⅱ)配合物。
[0016]
本发明还提出了上述氮杂大环席夫碱的金属配合物的制备方法,步骤如下:将氮杂大环席夫碱溶于甲醇中,然后加入乙酸锰水溶液,转移至反应釜中于80℃下反应72h,自然冷却至室温,得到黄色固体,即得;其中,氮杂大环席夫碱和乙酸锰的摩尔比为1:1。
[0017]
本发明还提出了一种氮杂大环席夫碱的金属配合物微纳米材料,是将上述氮杂氮杂大环席夫碱的金属配合物经研磨后,超声分散于甲醇中,取上清液离心,干燥,即得其微纳米材料。
[0018]
本发明还提出了上述氮杂大环席夫碱的金属配合物微纳米材料在催化苯酚羟基化中的应用。
[0019]
有益效果:本发明提供了一种氮杂大环席夫碱,并将其作为配体制备金属配合物,其合成方法简单、操作方便;将该金属配合物制备成纳米颗粒,并将其应用于催化苯酚羟基化反应,具有较好的催化活性,其对于设计和探索新型的氮杂大环配合物催化剂有重要意义。
附图说明
[0020]
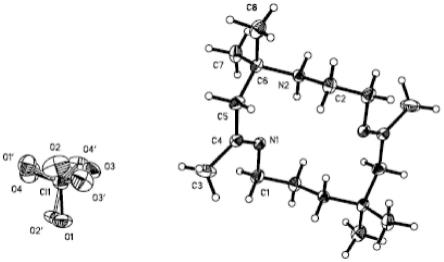
图1为本发明制备的氮杂大环席夫碱的晶体结构图;
[0021]
图2为本发明制备的氮杂大环席夫碱的分子晶胞堆积排列图;
[0022]
图3为本发明制备的氮杂大环席夫碱的锰(ⅱ)配合物微纳米材料的sem图。
具体实施方式
[0023]
下面,通过具体实施例对本发明的技术方案进行详细说明。
[0024]
实施例1
[0025]
氮杂大环席夫碱的合成方法:在250ml丙酮中,加入165mmol乙二胺,在搅拌下,30分钟内,用滴液漏斗滴加70%的高氯酸170mmol,过滤,液体放置24h,有无色方片状晶体析出。过滤,以丙酮洗涤,产率40%。
[0026]
对上述制备得到的氮杂大环席夫碱进行表征:
[0027]
红外分析ir(kbr cm-1
):ν(n-h)3190cm-1
(s),ν(c=n)1666cm-1
(s),ν(c1o
4-),1076cm-1
,629cm-1
(vs)。
[0028]
元素分析:按c
16h32
n4·
2hclo4计算,理论值(%):c 39.92,h 7.07,n 11.64;实测值(%):c 40.10,h 7.02,n 11.57。
[0029]
结构表征:氮杂大环席夫碱的晶体数据,以及典型键长、键角数据分别见表1-3,对其结构进行解析,其分子结构图及分子晶胞堆积排列图分别如图1和图2所示。
[0030]
表1氮杂大环席夫碱的晶体数据
[0031]
[0032][0033]
表2氮杂大环席夫碱的典型键长数据
[0034]
[0035]
[0036][0037]
表3氮杂大环席夫碱的键角数据
[0038]
[0039]
[0040]
[0041][0042]
实施例2
[0043]
氮杂大环席夫碱的金属配合物的制备:将1mmol的实施例1制备的氮杂大环席夫碱溶于10ml甲醇溶液中,然后加入lmmol的(ch3coo)3mn
·
2h2o的10ml水溶液,将混合液置于聚四氟乙烯衬里的反应釜中,放入烘箱中,反应温度为80℃,反应72h后,自然冷却到室温,得到黄色固体a,即得。
[0044]
对上述制备得到的氮杂大环席夫碱的金属配合物进行表征:
[0045]
红外分析:主要ir(kbr)数据ν(n-h)3440cm-1
(s),ν(c=n)1641cm-1
(s),ν(c1o
4-)1099cm-1
、633cm-1
(vs)。
[0046]
元素分析:按c
16h32
n4o8cl2mn(534.29)计算,理论值(%):c 35.97,h 6.04,n10.49;实测值(%):c 35.89,h 6.98,n10.43。
[0047]
氮杂大环席夫碱的金属配合物微纳米材料的制备:将上述制备的黄色固体a研磨1h,加入20ml甲醇,超声10分钟,取上清液离心,空气中干燥得黄色粉末b,对其进行sem表征,结果如图3所示。
[0048]
上述氮杂大环席夫碱的金属配合物微纳米材料对苯酚羟基化的催化研究。
[0049]
苯酚氧化的反应过程如下所示:
[0050][0051]
具体操作如下:称取10mg的黄色粉末b,加入到圆底烧瓶中,加入0.1g苯酚,再加入
15ml体积比为1:1的乙醇和水的混合溶剂,加热到50℃后,搅拌下滴加3mmol 30%的h2o2溶液,在50℃条件下搅拌回流5小时,冷却。用液相色谱仪检测苯二酚的产率,紫外检测器(λ=277nm),转化率:46.1%。
[0052]
以上所述,仅为本发明较佳的具体实施方式,但本发明的保护范围并不局限于此,任何熟悉本技术领域的技术人员在本发明揭露的技术范围内,根据本发明的技术方案及其发明构思加以等同替换或改变,都应涵盖在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1