一种5-硝基亚氨基-4H-1,2,4-三唑类化合物及其制备方法和应用
一种5-硝基亚氨基-4h-1,2,4-三唑类化合物及其制备方法和应用
技术领域
1.本发明涉及农药开发技术领域,尤其涉及一种5-硝基亚氨基-4h-1,2,4-三唑类化合物及其制备方法和应用。
背景技术:
2.三唑是含三个氮原子的五元杂环,作为药效团三唑类化合物不仅展示了丰富的生物活性和更低的毒性,而且由于其具有较强的络合金属离子和形成氢键能力,成药性更好。因此,在农药创制领域,三唑类农药一直是近年来的研究热点,特别是1h-1,2,4-三唑类农药。已商品化且被广泛大量使用的代表性产品包括:杀虫剂三唑磷,如式a所示;杀螨剂三唑锡,如式b所示;杀菌剂戊唑醇,如式c所示;除草剂唑草胺,如式d所示;植物生长调节剂多效唑,如式e所示。
[0003][0004]
尽管1,2,4-三唑类化合物被大量报道,但其药效团结构单一,鲜见有新的1,2,4-三唑药效团应用于农药分子设计。2011年,苏旺苍通过硝基缩氨基胍类衍生物在醋酸介质中的分子内脱氢关环反应,获得了如式f所示的一类5-硝基亚氨基-1h-1,2,4-三唑化合物(苏旺苍.新型硝基缩氨基胍类杀虫剂的开发与相关研究[d].北京:中国农业大学,2011:54-86.),并且当r2为2-氯-5氯甲基吡啶时展示出良好的杀虫活性。2014年,该课题组成员袁小勇以5-硝基亚氨基-1,2,4-三唑杂环为新的药效团,根据活性亚结构拼接原理,将r2用中间体(e)-2-(2-溴甲基)苯基-2-甲氧亚胺基乙酸甲酯代替,设计了一类如式g所示的化合物。然而,由于甲氧基丙烯酸酯结构在醋酸介质中十分容易发生副反应,导致式g类化合物产率过低,最终仅成功分离得到2种产物。其中当r1为正丁基时如式g所示的化合物不仅具有良好的杀虫活性,还具有较好的杀菌活性(袁小勇.含硝基缩氨基胍活性结构的甲氧基丙烯酸酯类化合物的合成、生物活性与构效关系研究[d].北京:中国农业大学,2013:94-97.)。
[0005][0006]
目前,三唑类农药创制产品主要局限为1h-1,2,4-三唑类化合物,限制了5-硝基亚氨基-1,2,4-三唑作为药效团生物活性多样性的发挥。
技术实现要素:
[0007]
本发明的目的在于提供一种5-硝基亚氨基-4h-1,2,4-三唑类化合物及其制备方法和应用,所述5-硝基亚氨基-4h-1,2,4-三唑类化合物克服了三唑类农药创制产品主要局限为1h-1,2,4-三唑类化合物的不足,为开发4h-1,2,4-三唑类杀虫剂、杀菌剂、杀螨剂、除草剂提供指导。
[0008]
为了实现上述发明目的,本发明提供以下技术方案:
[0009]
本发明提供了一种5-硝基亚氨基-4h-1,2,4-三唑类化合物,具有式i所示结构:
[0010][0011]
式i中,r1包括氢、c1~c10饱和脂肪烃基、c1~c10不饱和脂肪烃基、芳烃基、取代的芳烃基、芳杂基、取代的芳杂基、饱和杂环基或取代的饱和杂环基;所述取代所用取代基独立地包括卤素、羟基、氨基、氰基、硝基、c1~c5烷基、c1~c5烷氧基、c1~c5氟代烷基、c1~c5氟代烷氧基、芳基或芳氧基;
[0012]
r2包括c2~c10饱和脂肪烃基、c2~c10不饱和脂肪烃基、烷氧基甲基、取代的烷氧基甲基、苄基、取代的苄基、芳杂基甲基、取代的芳杂基甲基、甲酰基、取代的甲酰基、苯甲酰基、取代的苯甲酰基、乙酰基、取代的乙酰基、苯乙酰基、取代的苯乙酰基、丙酰基、取代的丙酰基、丁酰基、取代的丁酰基、戊酰基、取代的戊酰基、己酰基、取代的己酰基、庚酰基、取代的庚酰基、芳杂基甲酰基、取代的芳杂基甲酰基、n,n-二甲基甲酰基、n,n-二乙基甲酰基、n-取代苯磺酰基甲酰基或苯磺酰基甲酰基;所述取代所用取代基独立地包括卤素、羟基、氨
基、硝基、c1~c5烷基、c1~c5烷氧基、c1~c5氟代烷基、c1~c5氟代烷氧基、芳基或芳氧基。
[0013]
优选的,所述r1中,所述c1~c10饱和脂肪烃基包括正丙基、正丁基、正戊基或正己基;所述芳烃基包括苯基、萘基或蒽基;所述芳杂基包括吡啶基、噻唑基、噁唑基或呋喃基;所述取代的芳烃基和取代的芳杂基中取代基独立为卤素、氰基、甲基、叔丁基、苯氧基、甲氧基或三氟甲基;所述饱和杂环基包括四氢呋喃基、四氢噻吩基或四氢吡咯基;所述取代的饱和杂环基中取代基为甲基或卤代苯基;所述r2为n-甲酰基吗啉、甲氧基乙酰基、苯乙酰基、对甲基苯磺酰基、3-三氟甲基-4-氯苯磺酰基、2-甲基-4-三氟甲基-1,3-噻唑-5-甲酰基、4-甲基-1,2,3-噻二唑-5-甲酰基、2-三氟甲基苯甲酰基、1-甲基环己基甲酰基、5-氯-1,3-二甲基吡唑-4-甲酰基、1-甲基-3-三氟甲基吡唑-4-甲酰基、3,5-二氯对甲基苯甲酰基、2-甲基呋喃-3-甲酰基、2-甲基-1,4-氧硫环己烯-3-甲酰基、6-氯-3-吡啶甲基、3-氯-2-吡啶基、2-氯-1,3-噻唑-5-基甲基、2,6-二氯三氟对甲苯基、2-乙氧基甲基、2-丙炔基、叔丁基、异丙基、n,n-二甲基甲酰基、n,n-二乙基甲酰基、乙酰基、n-苯磺酰基甲酰基、
[0014][0015]
优选的,所述5-硝基亚氨基-4h-1,2,4-三唑类化合物包括:
[0016]
[0017][0018]
本发明提供了上述技术方案所述5-硝基亚氨基-4h-1,2,4-三唑类化合物的制备方法,包括以下步骤:
[0019]
将式1所示结构的酯类化合物、水合肼和醇溶剂混合,进行肼解反应,得到式2所示结构的酰肼类化合物;
[0020]
将式2所示结构的酰肼类化合物、硝基胍、第一碱和水混合,进行亲核加成-消除反应,得到式3所示结构的3-取代-5-硝基亚氨基-1,2,4-三唑类化合物;
[0021]
将所述式3所示结构的3-取代-5-硝基亚氨基-1,2,4-三唑类化合物、r2x、第二碱、催化剂和有机溶剂混合,进行亲核反应,得到式i所示结构的5-硝基亚氨基-4h-1,2,4-三唑类化合物;其中,x为cl或br;
[0022][0023]
其中,r1包括氢、c1~c10饱和脂肪烃基、c1~c10不饱和脂肪烃基、芳烃基、取代的芳烃基、芳杂基、取代的芳杂基、饱和杂环基或取代的饱和杂环基;所述取代所用取代基独立地包括卤素、羟基、氨基、氰基、硝基、c1~c5烷基、c1~c5烷氧基、c1~c5氟代烷基、c1~c5氟代烷氧基、芳基或芳氧基;
[0024]
r2包括c2~c10饱和脂肪烃基、c2~c10不饱和脂肪烃基、烷氧基甲基、取代的烷氧基甲基、苄基、取代的苄基、芳杂基甲基、取代的芳杂基甲基、甲酰基、取代的甲酰基、苯甲酰基、取代的苯甲酰基、乙酰基、取代的乙酰基、苯乙酰基、取代的苯乙酰基、丙酰基、取代的丙酰基、丁酰基、取代的丁酰基、戊酰基、取代的戊酰基、己酰基、取代的己酰基、庚酰基、取代的庚酰基、芳杂基甲酰基、取代的芳杂基甲酰基、n,n-二甲基甲酰基、n,n-二乙基甲酰基、n-取代苯磺酰基甲酰基或苯磺酰基甲酰基;所述取代所用取代基独立地包括卤素、羟基、氨基、硝基、c1~c5烷基、c1~c5烷氧基、c1~c5氟代烷基、c1~c5氟代烷氧基、芳基或芳氧基。
[0025]
优选的,所述式1所示结构的酯类化合物和水合肼的摩尔比为1:(5~10)。
[0026]
优选的,所述肼解反应的温度为60~80℃,时间为2~12h。
[0027]
优选的,所述式2所示结构的酰肼类化合物、硝基胍和第一碱的摩尔比为1:(1~1.5):(1~1.5);所述亲核加成-消除反应的温度为75~85℃,时间为2~10h。
[0028]
优选的,所述式3所示结构的3-取代-5-硝基亚氨基-1,2,4-三唑类化合物、r2x、第二碱和催化剂的摩尔比为1:1:(0.5~1.5):(0.01~0.1)。
[0029]
优选的,所述第二碱包括碳酸钾、碳酸钠、碳酸铯、氢化钠或三乙胺;所述催化剂包括碘化钾;当所述r2x为卤代烃时,所述亲核反应的温度为75~85℃,时间为2~15h;当所述r2x为酰卤或磺酰卤时,所述亲核反应的温度≤5℃,时间为0.5~5h。
[0030]
本发明提供了上述技术方案所述5-硝基亚氨基-4h-1,2,4-三唑类化合物或上述技术方案所述制备方法制备得到的5-硝基亚氨基-4h-1,2,4-三唑类化合物在制备杀虫剂、杀菌剂或除草剂中的应用。
[0031]
本发明提供了一种5-硝基亚氨基-4h-1,2,4-三唑类化合物,该类化合物克服了三唑类农药创制产品主要局限为1h-1,2,4-三唑类化合物的不足,拓展了三唑类化合物的种类,与其它三唑类杀虫剂、杀菌剂、除草剂中的三唑环结构相比,既具有相似性又具有新颖性,为发现新型高杀虫、杀菌、除草活性的先导化合物奠定了基础。
[0032]
本发明还提供了所述5-硝基亚氨基-4h-1,2,4-三唑类化合物的制备方法,通过设计合成路线,将3-取代-5-硝基亚氨基-1,2,4-三唑类化合物与与r2x反应,该亲核反应选择性发生在4位,而非1位,对于开发4h-1,2,4-三唑类化合物、更加系统全面评价5-硝基亚氨基-1,2,4-三唑药效团的价值作用具有重要意义。
附图说明
[0033]
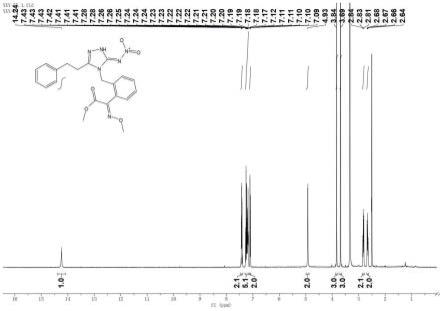
图1为本发明实施例1所得产品的核磁共振氢谱图;
[0034]
图2为本发明实施例1所得产品的核磁共振碳谱图;
[0035]
图3为本发明实施例1所得产品的x-ray单晶衍射图;
[0036]
图4为本发明部分目标化合物对番茄灰霉病的杀菌效果图;
[0037]
图5为本发明部分目标化合物对棉花立枯病的杀菌效果图。
[0038]
图6为本发明部分目标化合物对稗草的除草效果图。
具体实施方式
[0039]
本发明提供了一种5-硝基亚氨基-4h-1,2,4-三唑类化合物,具有式i所示结构:
[0040][0041]
式i中,r1包括氢、c1~c10饱和脂肪烃基、c1~c10不饱和脂肪烃基、芳烃基、取代的芳烃基、芳杂基、取代的芳杂基、饱和杂环基或取代的饱和杂环基;所述取代所用取代基独立地包括卤素、羟基、氨基、氰基、硝基、c1~c5烷基、c1~c5烷氧基、c1~c5氟代烷基、c1~c5氟代烷氧基、芳基或芳氧基;
[0042]
r2包括c2~c10饱和脂肪烃基、c2~c10不饱和脂肪烃基、烷氧基甲基、取代的烷氧基甲基、苄基、取代的苄基、芳杂基甲基、取代的芳杂基甲基、甲酰基、取代的甲酰基、苯甲酰基、取代的苯甲酰基、乙酰基、取代的乙酰基、苯乙酰基、取代的苯乙酰基、丙酰基、取代的丙酰基、丁酰基、取代的丁酰基、戊酰基、取代的戊酰基、己酰基、取代的己酰基、庚酰基、取代的庚酰基、芳杂基甲酰基、取代的芳杂基甲酰基、n,n-二甲基甲酰基、n,n-二乙基甲酰基、n-取代苯磺酰基甲酰基或苯磺酰基甲酰基;所述取代所用取代基独立地包括卤素、羟基、氨基、硝基、c1~c5烷基、c1~c5烷氧基、c1~c5氟代烷基、c1~c5氟代烷氧基、芳基或芳氧基。
[0043]
在本发明中,所述r1中,所述c1~c10饱和脂肪烃基优选包括正丙基、正丁基、正戊基或正己基;所述芳烃基优选包括苯基、萘基或蒽基;所述芳杂基优选包括吡啶基、噻唑基、噁唑基或呋喃基;所述取代的芳烃基或取代的芳杂基中取代基独立优选为卤素、氰基、甲基、叔丁基、苯氧基、甲氧基或三氟甲基;所述饱和杂环基优选包括四氢呋喃基、四氢噻吩基或四氢吡咯基;所述取代的饱和杂环基中取代基优选为甲基或卤代苯基;
[0044]
所述r2优选为n-甲酰基吗啉、甲氧基乙酰基、苯乙酰基、对甲基苯磺酰基、3-三氟甲基-4-氯苯磺酰基、2-甲基-4-三氟甲基-1,3-噻唑-5-甲酰基、4-甲基-1,2,3-噻二唑-5-甲酰基、2-三氟甲基苯甲酰基、1-甲基环己基甲酰基、5-氯-1,3-二甲基吡唑-4-甲酰基、1-甲基-3-三氟甲基吡唑-4-甲酰基、3,5-二氯对甲基苯甲酰基、2-甲基呋喃-3-甲酰基、2-甲基-1,4-氧硫环己烯-3-甲酰基、6-氯-3-吡啶甲基、3-氯-2-吡啶基、2-氯-1,3-噻唑-5-基甲基、2,6-二氯三氟对甲苯基、2-乙氧基甲基、2-丙炔基、叔丁基、异丙基、n,n-二甲基甲酰基、n,n-二乙基甲酰基、乙酰基、n-苯磺酰基甲酰基、
[0045][0046]
在本发明中,所述5-硝基亚氨基-4h-1,2,4-三唑类化合物优选包括:
[0047]
[0048][0049]
本发明提供了上述技术方案所述5-硝基亚氨基-4h-1,2,4-三唑类化合物的制备方法,包括以下步骤:
[0050]
将式1所示结构的酯类化合物、水合肼和醇溶剂混合,进行肼解反应,得到式2所示结构的酰肼类化合物;
[0051]
将式2所示结构的酰肼类化合物、硝基胍、第一碱和水混合,进行亲核加成-消除反应,得到式3所示结构的3-取代-5-硝基亚氨基-1,2,4-三唑类化合物;
[0052]
将所述式3所示结构的3-取代-5-硝基亚氨基-1,2,4-三唑类化合物、r2x、第二碱、催化剂和有机溶剂混合,进行亲核反应,得到式i所示结构的5-硝基亚氨基-4h-1,2,4-三唑类化合物;其中,x为cl或br;
[0053][0054]
其中,r1包括氢、c1~c10饱和脂肪烃基、c1~c10不饱和脂肪烃基、芳烃基、取代的芳烃基、芳杂基、取代的芳杂基、饱和杂环基或取代的饱和杂环基;所述取代所用取代基独立地包括卤素、羟基、氨基、氰基、硝基、c1~c5烷基、c1~c5烷氧基、c1~c5氟代烷基、c1~c5氟代烷氧基、芳基或芳氧基;
[0055]
r2包括c2~c10饱和脂肪烃基、c2~c10不饱和脂肪烃基、烷氧基甲基、取代的烷氧基甲基、苄基、取代的苄基、芳杂基甲基、取代的芳杂基甲基、甲酰基、取代的甲酰基、苯甲酰基、取代的苯甲酰基、乙酰基、取代的乙酰基、苯乙酰基、取代的苯乙酰基、丙酰基、取代的丙酰基、丁酰基、取代的丁酰基、戊酰基、取代的戊酰基、己酰基、取代的己酰基、庚酰基、取代的庚酰基、芳杂基甲酰基、取代的芳杂基甲酰基、n,n-二甲基甲酰基、n,n-二乙基甲酰基、n-取代苯磺酰基甲酰基或苯磺酰基甲酰基;所述取代所用取代基独立地包括卤素、羟基、氨基、硝基、c1~c5烷基、c1~c5烷氧基、c1~c5氟代烷基、c1~c5氟代烷氧基、芳基或芳氧基。
[0056]
在本发明中,若无特殊说明,所需制备原料均为本领域技术人员熟知的市售商品。
[0057]
本发明将式1所示结构的酯类化合物、水合肼和醇溶剂混合,进行肼解反应,得到式2所示结构的酰肼类化合物。
[0058]
在本发明中,所述式1所示结构的酯类化合物优选为市售商品或采用本领域熟知的方法制备,所述式1所示结构的酯类化合物的制备方法优选包括:将r1cooh和氯化亚砜(溶剂和氯化试剂)混合,回流反应0.5~12h后,蒸除氯化亚砜,加入无水甲醇室温反应0.5~12h,反应完毕后,将所得产物分离纯化,得到式1所示结构的酯类化合物。
[0059]
在本发明的实施例中,所述式1所示结构的酯类化合物优选包括3-苯丙酸甲酯、丙酸甲酯、丁酸甲酯、异丁酸甲酯、2-甲基丁酸甲酯、戊酸甲酯、异戊酸甲酯、已酸甲酯、庚酸甲酯、3-甲氧基丙酸甲酯或3-氟苯乙酸甲酯。
[0060]
在本发明中,所述醇溶剂优选为甲醇;所述水合肼的质量含量优选为80%。
[0061]
在本发明中,所述式1所示结构的酯类化合物和水合肼的摩尔比优选为1:(5~10),更优选为1:(6~8);本发明对所述醇溶剂的用量没有特殊的限定,能够保证反应顺利进行即可。
[0062]
在本发明中,所述式1所示结构的酯类化合物、水合肼和醇溶剂混合的过程优选为将式1所示结构的酯类化合物溶解于醇溶剂,待溶解后加入水合肼。
[0063]
在本发明中,所述肼解反应的温度优选为60~80℃,更优选为65℃;时间优选为2~12h。本发明优选采用tlc监测反应进度。
[0064]
完成所述肼解反应后,本发明优选将所得物料进行蒸发,除去多余溶剂,冷却至室温后过滤,将所得产物采用质量分数50%的冰乙醇清洗2~3次,得到式2所示结构的酰肼类
化合物。本发明对所述蒸发、冷却和过滤的过程没有特殊的限定,按照本领域熟知的过程进行即可。
[0065]
得到式2所示结构的酰肼类化合物后,本发明将式2所示结构的酰肼类化合物、硝基胍、第一碱和水混合,进行亲核加成-消除反应,得到式3所示结构的3-取代-5-硝基亚氨基-1,2,4-三唑类化合物。
[0066]
在本发明中,所述水优选为超纯水;所述第一碱优选为氢氧化钾或氢氧化钠。在本发明中,所述式2所示结构的酰肼类化合物、硝基胍和碱的摩尔比优选为1:(1~1.5):(1~1.5),更优选为1:(1~1.3):(1~1.3)。本发明对所述水的用量没有特殊的限定,能够保证反应顺利进行即可。
[0067]
在本发明中,所述式2所示结构的酰肼类化合物、硝基胍、碱和水混合的过程优选为在部分水中加入式2所示结构的酰肼类化合物和硝基胍,边搅拌边加热至反应温度,将碱溶于剩余水后滴加至所得混合物中。本发明对所述搅拌和滴加的速率没有特殊的限定,按照本领域熟知的过程将物料混合均匀即可。
[0068]
在本发明中,所述亲核加成-消除反应的温度优选为75~85℃,更优选为80℃,时间优选为2~10h,更优选为8h。
[0069]
完成所述亲核加成-消除反应后,本发明优选将所得产物在冰水浴条件下酸化至ph值为1,将所得产物依次进行过滤、水洗和重结晶,得到3-取代-5-硝基亚氨基-1,2,4-三唑类化合物。在本发明中,所述酸化所用酸液优选为稀盐酸,所述稀盐酸的浓度优选为0.1~1mol/l;所述重结晶所用试剂优选为乙醇;本发明对所述过滤和水洗的过程没有特殊的限定,按照本领域熟知的过程进行即可。
[0070]
得到式3所示结构的3-取代-5-硝基亚氨基-1,2,4-三唑类化合物后,本发明将所述式3所示结构的3-取代-5-硝基亚氨基-1,2,4-三唑类化合物、r2x、第二碱、催化剂和有机溶剂混合,进行亲核反应,得到式i所示结构的5-硝基亚氨基-4h-1,2,4-三唑类化合物。
[0071]
在本发明中,所述r2x优选为市售商品或按照已公开方法制备。
[0072]
在本发明的实施例中,所述r2x具体为(e)-2-(2-溴甲基)苯基-2-甲氧亚胺基乙酸甲酯或(e)-2-(2-溴甲基)苯基-3-甲氧基丙烯酸甲酯。
[0073]
在本发明中,所述第二碱优选包括碳酸铯、碳酸钾、碳酸钠、氢化钠或三乙胺;所述催化剂优选包括碘化钾;本发明利用第二碱与4位n上的h反应,使n更容易与r2x发生反应。
[0074]
在本发明中,所述式3所示结构的3-取代-5-硝基亚氨基-1,2,4-三唑类化合物、r2x、第二碱和催化剂的摩尔比优选为1:1:(0.5~1.5):(0.01~0.1),当所述第二碱为碳酸铯、碳酸钾或碳酸钠时,所述式3所示结构的3-取代-5-硝基亚氨基-1,2,4-三唑类化合物、r2x、第二碱和催化剂的摩尔比更优选为1:1:0.6:0.05;当所述第二碱为氢化钠或三乙胺时,所述式3所示结构的3-取代-5-硝基亚氨基-1,2,4-三唑类化合物、r2x、第二碱和催化剂的摩尔比更优选为1:1:1.2:0.05。
[0075]
在本发明中,所述有机溶剂优选为乙腈、n,n-二甲基甲酰胺、四氢呋喃或甲苯;本发明对所述有机溶剂的用量没有特殊的限定,能够保证反应顺利进行即可。
[0076]
在本发明中,所述式3所示结构的3-取代-5-硝基亚氨基-1,2,4-三唑类化合物、r2x、催化剂和有机溶剂混合的过程优选为向部分有机溶剂中加入式3所示结构的3-取代-5-硝基亚氨基-1,2,4-三唑类化合物和催化剂,加热至回流后,将溶于剩余有机溶剂的r2x
用恒压漏斗滴加至所得混合物中。
[0077]
在本发明中,当所述r2x为卤代烃时,所述亲核反应的温度优选为75~85℃,时间优选为2~15h;所述有机溶剂为n,n-二甲基甲酰胺或乙腈;当所述有机溶剂为n,n-二甲基甲酰胺时,所述第二碱优选为氢化钠或碳酸铯;当所述有机溶剂为乙腈时,所述第二碱优选为碳酸铯、碳酸钾或碳酸钠。
[0078]
在本发明中,当所述r2x为酰卤或磺酰卤时,所述亲核反应的温度优选≤5℃,时间优选为0.5~5h;所述有机溶剂优选为无水四氢呋喃或甲苯;所述第二碱优选为三乙胺。
[0079]
本发明优选采用tlc监测反应进度。
[0080]
完成所述亲核反应后,本发明优选将所得产物冷却至室温,过滤(除去不溶物),蒸发除去溶剂,将所得物料柱层析后,得到式i所示结构的5-硝基亚氨基-4h-1,2,4-三唑类化合物。本发明对所述冷却、过滤和蒸发的过程没有特殊的限定,按照本领域熟知的过程进行即可。在本发明中,所述柱层析所用试剂优选为乙酸乙酯和石油醚混合物,所述乙酸乙酯和石油醚的体积比优选为1:3。
[0081]
在本发明中,所述5-硝基亚氨基-4h-1,2,4-三唑类化合物的制备反应式为
[0082][0083]
本发明提供了上述技术方案所述5-硝基亚氨基-4h-1,2,4-三唑类化合物或上述技术方案所述制备方法制备得到的5-硝基亚氨基-4h-1,2,4-三唑类化合物在制备杀虫剂、杀菌剂或除草剂中的应用。本发明对所述应用的方法没有特殊的限定,按照本领域熟知的方法应用即可。
[0084]
下面将结合本发明中的实施例,对本发明中的技术方案进行清楚、完整地描述。显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
[0085]
以下实施例1~20制备的5-硝基亚氨基-4h-1,2,4-三唑类化合物中,r1和r2的具体结构和产物的理化性质见表1。
[0086]
表1实施例1~20制备的5-硝基亚氨基-4h-1,2,4-三唑类化合物及理化性质
[0087][0088][0089]
实施例1
[0090]
在250ml圆底烧瓶中加入3-苯丙酸甲酯(0.1168mol)和100ml甲醇,待溶解后加入80%水合肼(0.5840mol)并加热至回流过夜,温度为65℃,tlc监测反应进度,待反应结束后蒸除多余溶剂,冷却至室温后过滤,并用50%冰乙醇清洗3次,得到化合物1,产率99.6%;
[0091]
在350ml超纯水中加入0.1187mol化合物1和0.1543mol硝基胍,边搅拌边加热至80℃,然后将0.1543mol氢氧化钾溶于水后滴加到反应体系,保温反应8小时后停止反应,冰水浴条件下将溶液使用1mol/l的稀盐酸酸化至ph≈1,过滤,水洗,用乙醇重结晶得到化合物2,产率57.5%;
[0092]
在50ml乙腈溶剂中,加入0.0039mol化合物2和0.00234mol碳酸铯及0.000195mol碘化钾,加热至回流后,温度为80℃,将溶于乙腈的0.0039mol中间体((e)-2-(2-溴甲基)苯基-2-甲氧亚胺基乙酸甲酯,江苏耕耘化学有限公司)用恒压漏斗滴入,tlc监测反应进度,反应时间为5h,待反应结束后,冷却至室温,过滤不溶物,蒸除滤液中的溶剂,用乙酸乙酯:石油醚=1:3柱层析,得到目标化合物h-(1),产率25%。
[0093]
表征
[0094]
对实施例1所得目标化合物的结构进行表征,核磁共振氢谱图、核磁共振碳谱图和x-射线单晶衍射图分别如图1、图2和图3所示,结构表征数据如下所示:
[0095]1hnmr(400mhz,dmso)δ14.24(s,1h,n-h),7.46
–
7.38(m,2h,arh),7.34
–
7.15(m,5h,arh),7.13-7.07(m,2h,arh),4.93(s,2h,n-ch
2-),3.84(s,3h,-o-ch3),3.69(s,3h,-o-ch3),2.87-2.78(m,2h,-ch
2-),2.73-2.59(m,2h,-ch
2-).
[0096]
13
cnmr(101mhz,dmso-d6)δ162.70,151.63,150.97,148.46,140.17,132.65,130.23,130.07,129.37,128.87,128.78,128.61,128.19,126.79,63.84,53.15,44.66,31.15,26.35.
[0097]
esi-hrms(m/z):c
21h22
n6o5(m+h)
+
的计算值:439.1724,实验值:439.1723。
[0098]
根据以上数据和谱图,特别是x-射线单晶衍射图,可以确定目标化合物属于5-硝基亚氨基-4h-1,2,4-三唑类化合物,所得产物符合式h-(1)所示的结构:
[0099][0100]
实施例2
[0101]
将实施例1中(e)-2-(2-溴甲基)苯基-2-甲氧亚胺基乙酸甲酯替换为(e)-2-(2-溴甲基)苯基-3-甲氧基丙烯酸甲酯,江苏耕耘化学有限公司;
[0102]
目标化合物h-(2)的合成方法与实施例1相同,产率为23.7%。
[0103]
目标化合物h-(2)的结构表征数据如下所示:
[0104]1hnmr(400mhz,dmso)δ14.22(s,1h,n-h),7.57(s,1h,=ch-o),7.34-7.23(m,4h,arh),7.20-7.16(m,1h,arh),7.13-7.05(m,4h,arh),4.91(s,2h,n-ch
2-),3.77(s,3h,-o-ch3),3.51(s,3h,-o-ch3),2.79(t,j=7.6hz,2h,-ch
2-),2.61(s,2h,-ch
2-).
[0105]
13
cnmr(101mhz,dmso-d6)δ166.91,161.74,151.72,150.92,140.30,133.88,132.47,132.14,128.83,128.65,128.49,128.39,127.63,126.72,108.15,62.37,51.70,44.72,31.25,26.30.
[0106]
esi-hrms(m/z):c
22h23
n5o5(m+h)
+
的计算值:438.1772,实验值:438.1772。
[0107]
根据以上数据,结合实施例1的x-射线单晶衍射图,可以确定目标化合物属于5-硝基亚氨基-4h-1,2,4-三唑类化合物,所得产物符合式h-(2)所示的结构:
[0108][0109]
实施例3
[0110]
将实施例1中3-苯丙酸甲酯替换为丙酸甲酯;目标化合物h-(3)的合成方法与实施例1相同,产率为16.5%。
[0111]
目标化合物h-(3)的结构表征数据如下所示:
[0112]1hnmr(400mhz,dmso)δ14.15(s,1h,n-h),7.42(s,2h,arh),7.20(s,2h,arh),4.93(s,2h,n-ch
2-),3.89(d,j=4.3hz,3h,-o-ch3),3.73(d,j=4.3hz,3h,-o-ch3),2.34(s,2h,ch
3-ch
2-),1.03(dd,j=7.0,3.9hz,3h,ch
3-ch
2-).
[0113]
13
cnmr(101mhz,dmso-d6)δ162.70,152.54,151.69,148.53,132.71,130.19,130.14,129.31,128.73,128.28,63.89,53.19,44.71,18.42,9.77.
[0114]
esi-hrms(m/z):c
15h18
n6o5(m+h)
+
的计算值:363.1411,实验值:363.1405。
[0115]
根据以上数据,结合实施例1的x-射线单晶衍射图,可以确定目标化合物属于5-硝基亚氨基-4h-1,2,4-三唑类化合物,所得产物符合式h-(3)所示的结构:
[0116][0117]
实施例4
[0118]
将实施例1中3-苯丙酸甲酯替换为丙酸甲酯;将(e)-2-(2-溴甲基)苯基-2-甲氧亚胺基乙酸甲酯替换为(e)-2-(2-溴甲基)苯基-3-甲氧基丙烯酸甲酯;
[0119]
目标化合物h-(4)的合成方法与实施例1相同,产率为19.8%。
[0120]
目标化合物h-(4)的结构表征数据如下所示:
[0121]1hnmr(400mhz,dmso)δ14.14(s,1h,n-h),7.56(s,1h,=ch-o),7.39
–
7.23(m,2h,arh),7.17-7.01(m,2h,arh),4.92(s,2h,n-ch
2-),3.85(s,3h,-o-ch3),3.55(s,3h,-o-ch3),2.29(s,2h,ch
3-ch
2-),1.00(t,j=7.4hz,3h,ch3–
ch2–
).
[0122]
13
cnmr(101mhz,dmso-d6)δ166.92,161.66,152.48,151.74,133.93,132.56,132.11,128.46,128.39,127.77,108.23,62.44,51.74,44.84,18.39,9.87.
[0123]
esi-hrms(m/z):c
16h19
n5o5(m+h)
+
的计算值:362.1459,实验值:362.1455。
[0124]
根据以上数据,结合实施例1的x-射线单晶衍射图,可以确定目标化合物属于5-硝基亚氨基-4h-1,2,4-三唑类化合物,所得产物符合式h-(4)所示的结构:
[0125][0126]
实施例5
[0127]
将实施例1中3-苯丙酸甲酯替换为丁酸甲酯;目标化合物h-(5)的合成方法与实施例1相同,产率为23.4%。
[0128]
目标化合物h-(5)的结构表征数据如下所示:
[0129]1hnmr(400mhz,dmso)δ14.17(s,1h,n-h),7.42(s,2h,arh),7.32
–
7.11(m,2h,arh),4.92(s,2h,n
–
ch2–
),3.91(d,j=3.3hz,3h,-o-ch3),3.74(d,j=3.3hz,3h,
–o–
ch3),2.31(d,j=4.5hz,2h,
–
ch2–
),1.47(d,j=7.1hz,2h,-ch
2-),0.80(dd,j=9.0,5.7hz,3h,
–
ch).
[0130]
13
cnmr(101mhz,dmso-d6)δ162.75,151.64,151.38,148.50,132.82,130.18,130.05,129.32,128.69,128.03,63.92,53.19,44.65,26.44,18.71,13.74.
[0131]
esi-hrms(m/z):c
16h20
n6o5(m+h)
+
的计算值:377.1568,实验值:377.1562。
[0132]
根据以上数据,结合实施例1的x-射线单晶衍射图,可以确定目标化合物属于5-硝基亚氨基-4h-1,2,4-三唑类化合物,所得产物符合式h-(5)所示的结构:
[0133][0134]
实施例6
[0135]
将实施例1中3-苯丙酸甲酯替换为丁酸甲酯;
[0136]
将(e)-2-(2-溴甲基)苯基-2-甲氧亚胺基乙酸甲酯替换为(e)-2-(2-溴甲基)苯基-3-甲氧基丙烯酸甲酯;
[0137]
目标化合物h-(6)的合成方法与实施例1相同,产率为20.5%。
[0138]
目标化合物h-(6)的结构表征数据如下所示:
[0139]1hnmr(400mhz,dmso)δ14.16(s,1h,n
–
h),7.59(s,1h,=ch
–
o),7.35
–
7.25(m,2h,arh),7.14
–
7.02(m,2h,arh),4.92(s,2h,arh),3.86(s,3h,
–o–
ch3),3.57(s,3h,
–o–
ch3),2.26(t,j=7.3hz,2h,
–
ch2–
),1.44(dd,j=14.9,7.4hz,2h,
–
ch2–
),0.78(t,j=7.4hz,3h,
–
ch3).
[0140]
13
cnmr(101mhz,dmso-d6)δ166.94,161.74,151.70,151.33,133.99,132.45,132.09,128.43,128.34,127.52,108.20,62.47,51.76,44.76,26.44,18.78,13.77.
[0141]
esi-hrms(m/z):c
17h21
n5o5(m+h)
+
的计算值:376.1615,实验值:376.1612。
[0142]
根据以上数据,结合实施例1的x-射线单晶衍射图,可以确定目标化合物属于5-硝
基亚氨基-4h-1,2,4-三唑类化合物,所得产物符合式h-(6)所示的结构:
[0143][0144]
实施例7
[0145]
将实施例1中3-苯丙酸甲酯替换为异丁酸甲酯;
[0146]
目标化合物h-(7)的合成方法与实施例1相同,产率为25%。
[0147]
目标化合物h-(7)的结构表征数据如下所示:
[0148]1hnmr(400mhz,dmso)δ14.23(s,1h,n
–
h),7.46
–
7.37(m,2h,arh),7.24
–
7.20(m,1h,arh),7.17
–
7.13(m,1h,arh),4.96(s,2h,n
–
ch2–
),3.91(s,3h,
–o–
ch3),3.75(s,3h,
–o–
ch3),2.73
–
2.62(m,1h,
–
ch
–
),1.01(d,j=6.7hz,6h,
–
ch3).
[0149]
13
cnmr(101mhz,dmso-d6)δ162.80,155.92,151.57,148.52,133.02,130.22,130.07,129.32,128.68,127.83,63.92,53.23,44.61,24.94,20.53.
[0150]
esi-hrms(m/z):c
16h20
n6o5(m+h)
+
的计算值:377.1568,实验值:377.1562。
[0151]
根据以上数据,结合实施例1的x-射线单晶衍射图,可以确定目标化合物属于5-硝基亚氨基-4h-1,2,4-三唑类化合物,所得产物符合式h-(7)所示的结构:
[0152][0153]
实施例8
[0154]
将实施例1中3-苯丙酸甲酯替换为异丁酸甲酯;
[0155]
将(e)-2-(2-溴甲基)苯基-2-甲氧亚胺基乙酸甲酯替换为(e)-2-(2-溴甲基)苯基-3-甲氧基丙烯酸甲酯;
[0156]
目标化合物h-(8)的合成方法与实施例1相同,产率为23.5%。
[0157]
目标化合物h-(8)的结构表征数据如下所示:
[0158]1hnmr(400mhz,dmso)δ14.21(s,1h,n-h),7.60(s,1h,=ch-o),7.34
–
7.26(m,2h,arh),7.13-7.08(m,1h,arh),7.07-7.01(m,1h,arh),4.95(s,2h,n-ch
2-),3.86(s,3h,-o-ch3),3.57(s,3h,-o-ch3),2.68-2.57(m,1h,-ch-),0.98(s,6h,-ch3).
[0159]
13
cnmr(101mhz,dmso-d6)δ167.01,161.75,155.98,151.56,134.17,132.45,132.14,128.48,128.42,127.46,108.16,62.46,51.80,44.82,24.97,20.50.
[0160]
esi-hrms(m/z):c
17h21
n5o5(m+h)
+
的计算值:376.1615,实验值:376.1610。
[0161]
根据以上数据,结合实施例1的x-射线单晶衍射图,可以确定目标化合物属于5-硝基亚氨基-4h-1,2,4-三唑类化合物,所得产物符合式h-(8)所示的结构:
[0162][0163]
实施例9
[0164]
将实施例1中3-苯丙酸甲酯替换为2-甲基丁酸甲酯;
[0165]
目标化合物h-(9)的合成方法与实施例1相同,产率为22.8%。
[0166]
目标化合物h-(9)的结构表征数据如下所示:
[0167]1hnmr(400mhz,cdcl3)δ11.94(s,1h,n-h),7.48-7.38(m,2h,arh),7.24-7.17(m,1h,arh),7.09
–
7.02(m,1h,arh),4.98(s,2h,n-ch
2-),4.08(s,3h,
–o–
ch3),3.93(s,3h,
–o–
ch3),2.50(h,j=6.9hz,1h,
–
ch
–
ch3),1.71
–
1.47(m,2h,
–
ch2–
ch3),1.09(d,j=6.8hz,3h,
–
ch2–
ch3),0.76(t,j=7.3hz,3h,
–
ch
–
ch3).
[0168]
13
cnmr(101mhz,cdcl3)δ163.06,155.59,152.65,148.26,132.28,130.11,129.30,129.00,128.53,126.85,64.14,53.34,44.42,31.69,27.64,18.19,11.16,
[0169]
esi-hrms(m/z):c
17h22
n6o5(m+h)
+
的计算值:391.1724,实验值:391.1725。
[0170]
根据以上数据,结合实施例1的x-射线单晶衍射图,可以确定目标化合物属于5-硝基亚氨基-4h-1,2,4-三唑类化合物,所得产物符合式h-(9)所示的结构:
[0171][0172]
实施例10
[0173]
将实施例1中3-苯丙酸甲酯替换为2-甲基丁酸甲酯;
[0174]
将(e)-2-(2-溴甲基)苯基-2-甲氧亚胺基乙酸甲酯替换为(e)-2-(2-溴甲基)苯基-3-甲氧基丙烯酸甲酯;
[0175]
目标化合物h-(10)的合成方法与实施例1相同,产率为28.3%。
[0176]
目标化合物h-(10)的结构表征数据如下所示:
[0177]1hnmr(400mhz,cdcl3)δ11.85(s,1h,n
–
h),7.61(s,1h,=ch
–
o),7.39
–
7.30(m,2h,arh),7.20(dd,j=7.4,1.5hz,1h,arh),7.07(d,j=7.0hz,1h,arh),5.10(s,2h,n
–
ch2–
),3.94(s,3h,
–o–
ch3),3.70(s,3h,
–o–
ch3),2.47(dd,j=13.7,6.8hz,1h,
–
ch
–
ch3),1.54
–
1.36(m,2h,
–
ch2–
ch3),1.05(d,j=6.6hz,3h,
–
ch2–
ch3),0.75(t,j=7.4hz,3h,
–
ch
–
ch3).
[0178]
13
cnmr(101mhz,dmso-d6)δ166.98,161.90,155.14,151.53,134.28,132.34,132.08,128.41,128.29,127.31,108.12,62.49,51.81,44.60,31.33,27.39,18.11,11.37.
[0179]
esi-hrms(m/z):c
18h23
n5o5(m+h)
+
的计算值:390.1772,实验值:390.1774。
[0180]
根据以上数据,结合实施例1的x-射线单晶衍射图,可以确定目标化合物属于5-硝
基亚氨基-4h-1,2,4-三唑类化合物,所得产物符合式h-(10)所示的结构:
[0181][0182]
实施例11
[0183]
将实施例1中3-苯丙酸甲酯替换为戊酸甲酯;目标化合物h-(11)的合成方法与实施例1相同,产率为20.9%。
[0184]
目标化合物h-(11)的结构表征数据如下所示:
[0185]1hnmr(400mhz,dmso)δ14.18(s,1h,n
–
h),7.47
–
7.36(m,2h,arh),7.26
–
7.13(m,2h,arh),4.93(s,2h,n
–
ch2–
),3.90(s,3h,
–o–
ch3),3.74(s,3h,
–o–
ch3),2.33(t,j=7.5hz,2h,
–
ch2–
),1.47
–
1.35(m,2h,
–
ch2–
),1.25
–
1.15(m,2h,
–
ch2–
),0.75(t,j=7.3hz,3h,
–
ch3).
[0186]
13
cnmr(101mhz,dmso-d6)δ162.74,151.71,151.46,148.51,132.91,130.16,130.06,129.34,128.59,127.95,63.91,53.16,44.62,27.16,24.20,21.83,13.80.
[0187]
esi-hrms(m/z):c
17h22
n6o5(m+h)
+
的计算值:391.1724,实验值:391.1719。
[0188]
根据以上数据,结合实施例1的x-射线单晶衍射图,可以确定目标化合物属于5-硝基亚氨基-4h-1,2,4-三唑类化合物,所得产物符合式h-(11)所示的结构:
[0189][0190]
实施例12
[0191]
将实施例1中3-苯丙酸甲酯替换为戊酸甲酯;
[0192]
将(e)-2-(2-溴甲基)苯基-2-甲氧亚胺基乙酸甲酯替换为(e)-2-(2-溴甲基)苯基-3-甲氧基丙烯酸甲酯;
[0193]
目标化合物h-(12)的合成方法与实施例1相同,产率为25.9%。
[0194]
目标化合物h-(12)的结构表征数据如下所示:
[0195]1hnmr(400mhz,dmso)δ14.17(s,1h,n
–
h),7.58(s,1h,=ch
–
o),7.39
–
7.22(m,2h,arh),7.13
–
7.08(m,1h,arh),7.08
–
7.04(m,1h,arh),4.92(s,2h,n
–
ch2–
),3.85(s,3h,
–o–
ch3),3.56(s,3h,
–o–
ch3),2.27(s,2h,
–
ch2–
),1.46
–
1.33(m,2h,
–
ch2–
),1.18(dq,j=14.6,7.4hz,2h,
–
ch2–
),0.74(t,j=7.3hz,3h,
–
ch3).
[0196]
13
cnmr(101mhz,dmso-d6)δ166.93,161.73,151.67,151.49,134.00,132.48,132.12,128.39,128.32,127.63,108.16,62.43,51.73,44.82,27.20,24.23,21.85,13.78.
[0197]
esi-hrms(m/z):c
18h23
n5o5(m+h)
+
计算值:390.1772,实验值:390.1767。
[0198]
根据以上数据,结合实施例1的x-射线单晶衍射图,可以确定目标化合物属于5-硝基亚氨基-4h-1,2,4-三唑类化合物,所得产物符合式h-(12)所示的结构:
[0199][0200]
实施例13
[0201]
将实施例1中3-苯丙酸甲酯替换为异戊酸甲酯;
[0202]
目标化合物h-(13)的合成方法与实施例1相同,产率为21.5%。
[0203]
目标化合物h-(13)的结构表征数据如下所示:
[0204]1hnmr(400mhz,dmso)δ14.22(s,1h,n
–
h),7.46
–
7.37(m,2h,arh),7.25
–
7.20(m,1h,arh),7.17
–
7.11(m,1h,arh),4.92(s,2h,n
–
ch2–
),3.93(s,3h,
–o–
ch3),3.75(s,3h,
–o–
ch3),2.23(d,j=7.1hz,2h,
–
ch2
–
),1.79(dt,j=13.5,6.8hz,1h,
–
ch
–
),0.80(d,j=6.6hz,6h,
–
ch3).
[0205]
13
cnmr(101mhz,dmso-d6)δ162.78,151.70,150.58,148.47,132.96,130.16,129.91,129.37,128.59,127.76,63.99,53.19,44.62,33.16,25.62,22.42.
[0206]
esi-hrms(m/z):c
17h22
n6o5(m+h)
+
的计算值:391.1724,实验值:391.1720。
[0207]
根据以上数据,结合实施例1的x-射线单晶衍射图,可以确定目标化合物属于5-硝基亚氨基-4h-1,2,4-三唑类化合物,所得产物符合式h-(13)所示的结构:
[0208][0209]
实施例14
[0210]
将实施例1中3-苯丙酸甲酯替换为异戊酸甲酯;
[0211]
将(e)-2-(2-溴甲基)苯基-2-甲氧亚胺基乙酸甲酯替换为(e)-2-(2-溴甲基)苯基-3-甲氧基丙烯酸甲酯;
[0212]
目标化合物h-(14)的合成方法与实施例1相同,产率为27.1%。
[0213]
目标化合物h-(14)的结构表征数据如下所示:
[0214]1hnmr(400mhz,dmso)δ14.21(s,1h,n
–
h),7.61(s,1h,=ch
–
o),7.30(pd,j=7.5,3.8hz,2h,arh),7.11(dd,j=6.9,2.0hz,1h,arh),7.06
–
6.98(m,1h,arh),4.90(s,2h,n
–
ch2–
),3.86(s,3h,
–o–
ch3),3.58(s,3h,
–o–
ch3),2.18(d,j=7.1hz,2h,
–
ch2–
),1.76(dt,j=13.5,6.8hz,1h,
–
ch
–
),0.77(d,j=6.6hz,6h,
–
ch3).
[0215]
13
cnmr(101mhz,dmso-d6)δ166.94,161.83,151.67,150.61,133.99,132.31,132.11,128.39,128.31,127.38,108.11,62.51,51.80,44.77,33.17,25.64,22.41
[0216]
esi-hrms(m/z):c
18h23
n5o5(m+h)
+
的计算值:390.1772,实验值:390.1768。
[0217]
根据以上数据,结合实施例1的x-射线单晶衍射图,可以确定目标化合物属于5-硝基亚氨基-4h-1,2,4-三唑类化合物,所得产物符合式h-(14)所示的结构:
[0218][0219]
实施例15
[0220]
将实施例1中3-苯丙酸甲酯替换为已酸甲酯;目标化合物h-(15)的合成方法与实施例1相同,产率为31.4%。
[0221]
目标化合物h-(15)的结构表征数据如下所示:
[0222]1hnmr(400mhz,dmso)δ14.15(s,1h,n
–
h),7.51
–
7.31(m,2h,arh),7.25
–
7.19(m,1h,arh),7.20
–
7.13(m,1h,arh),4.92(s,2h,n
–
ch2–
),3.91(s,3h,
–o–
ch3),3.75(s,3h,
–o–
ch3),2.33(t,j=7.6hz,2h,
–
ch2–
),1.50
–
1.34(m,2h,
–
ch2–
),1.16(dt,j=7.3,3.7hz,4h,
–
ch2–
),0.78(t,j=7.1hz,3h,
–
ch3).
[0223]
13
cnmr(101mhz,dmso-d6)δ162.74,151.71,151.45,148.51,132.95,130.16,130.03,129.34,128.55,127.89,63.91,53.16,44.58,30.85,24.80,24.45,22.03,14.14.
[0224]
esi-hrms(m/z):c
18h24
n6o5(m+h)
+
的计算值:405.1881,实验值:405.1877。
[0225]
根据以上数据,结合实施例1的x-射线单晶衍射图,可以确定目标化合物属于5-硝基亚氨基-4h-1,2,4-三唑类化合物,所得产物符合式h-(15)所示的结构:
[0226][0227]
实施例16
[0228]
将实施例1中3-苯丙酸甲酯替换为已酸甲酯;
[0229]
将(e)-2-(2-溴甲基)苯基-2-甲氧亚胺基乙酸甲酯替换为(e)-2-(2-溴甲基)苯基-3-甲氧基丙烯酸甲酯;
[0230]
目标化合物h-(16)的合成方法与实施例1相同,产率为22.8%。
[0231]
目标化合物h-(16)的结构表征数据如下所示:
[0232]1hnmr(400mhz,dmso)δ14.14(s,1h,n
–
h),7.59(s,1h,=ch
–
o),7.35
–
7.26(m,2h,arh),7.13
–
7.09(m,1h,arh),7.08
–
7.03(m,1h,arh),4.91(s,2h,n
–
ch2–
),3.85(s,3h,
–o–
ch3),3.56(s,3h,
–o–
ch3),2.27(t,j=7.2hz,2h,
–
ch2–
),1.46
–
1.34(m,2h,
–
ch2–
),1.20
–
1.07(m,4h,
–
ch2–
),0.77(t,j=6.8hz,3h,
–
ch3).
[0233]
13
cnmr(101mhz,dmso-d6)δ167.07,161.67,151.72,151.51,133.85,132.44,
132.15,128.50,128.43,127.82,108.12,62.44,51.79,44.94,30.78,24.81,24.49,21.92,14.08.
[0234]
esi-hrms(m/z):c
19h25
n5o5(m+h)
+
的计算值:404.1928,实验值:404.1924。
[0235]
根据以上数据,结合实施例1的x-射线单晶衍射图,可以确定目标化合物属于5-硝基亚氨基-4h-1,2,4-三唑类化合物,所得产物符合式h-(16)所示的结构:
[0236][0237]
实施例17
[0238]
将实施例1中3-苯丙酸甲酯替换为庚酸甲酯;目标化合物h-(17)的合成方法与实施例1相同,产率为27.6%。
[0239]
目标化合物h-(17)的结构表征数据如下所示:
[0240]1hnmr(400mhz,dmso)δ14.17(s,1h,n
–
h),7.46
–
7.37(m,2h,arh),7.25
–
7.20(m,1h,arh),7.19
–
7.14(m,1h,arh),4.92(s,2h,n
–
ch2–
),3.91(s,3h,
–o–
ch3),3.74(s,3h,
–o–
ch3),2.32(t,j=7.5hz,2h,
–
ch2–
),1.41(dd,j=14.7,7.3hz,2h,
–
ch2
–
),1.23
–
1.08(m,6h,
–
ch2–
),0.80(t,j=7.0hz,3h,
–
ch3).
[0241]
13
cnmr(101mhz,dmso-d6)δ162.74,151.64,151.54,148.48,132.85,130.15,130.04,129.34,128.65,128.05,63.90,53.17,44.66,31.07,28.29,25.05,24.49,22.27,14.27.
[0242]
esi-hrms(m/z):c
19h26
n6o5(m+h)
+
的计算值:419.2037,实验值:419.2033。
[0243]
根据以上数据,结合实施例1的x-射线单晶衍射图,可以确定目标化合物属于5-硝基亚氨基-4h-1,2,4-三唑类化合物,所得产物符合式h-(17)所示的结构:
[0244][0245]
实施例18
[0246]
将实施例1中3-苯丙酸甲酯替换为3-甲氧基丙酸甲酯;
[0247]
目标化合物h-(18)的合成方法与实施例1相同,产率为25.4%。
[0248]
目标化合物h-(18)的结构表征数据如下所示:
[0249]1hnmr(400mhz,dmso)δ14.24(s,1h,n
–
h),7.47
–
7.37(m,2h,arh),7.26
–
7.19(m,1h,arh),7.18
–
7.12(m,1h,arh),4.96(s,2h,n
–
ch2–
),3.91(s,3h,
–o–
ch3),3.75(s,3h,
–o–
ch3),3.43(t,j=6.6hz,2h,
–
ch2–
),3.13(s,3h,
–
ch2–
och3),2.62(t,j=6.6hz,2h,
–
ch2–
).
[0250]
13
cnmr(101mhz,dmso-d6)δ162.73,151.70,149.48,148.53,132.76,130.22,
130.08,129.31,128.67,127.97,68.01,63.92,58.33,53.18,44.66,25.43.
[0251]
esi-hrms(m/z):c
16h20
n6o6(m+h)
+
的计算值:393.1517,实验值:393.1512。
[0252]
根据以上数据,结合实施例1的x-射线单晶衍射图,可以确定目标化合物属于5-硝基亚氨基-4h-1,2,4-三唑类化合物,所得产物符合式h-(18)所示的结构:
[0253][0254]
实施例19
[0255]
将实施例1中3-苯丙酸甲酯替换为3-氟苯乙酸甲酯;目标化合物h-(19)的合成方法与实施例1相同,产率为36.6%。
[0256]
目标化合物h-(19)的结构表征数据如下所示:
[0257]1hnmr(400mhz,dmso)δ14.25(s,1h,n
–
h),7.42
–
7.21(m,4h,arh),7.05(td,j=7.8,3.9hz,2h,arh),6.97
–
6.85(m,2h,arh),4.96(s,2h,n
–
ch2–
),3.89(s,3h,
–o–
ch3),3.81(s,2h,
–
ch2–
),3.74(s,3h,
–o–
ch3).
[0258]
13
cnmr(101mhz,dmso-d6)δ163.70,162.82,161.28,151.94,150.18,148.58,136.98,136.90,132.63,130.79,130.71,130.11,129.96,129.33,128.57,127.88,125.68,125.66,116.48,116.26,114.49,114.29,63.91,53.18,44.87,30.33.
[0259]
esi-hrms(m/z):c
20h19
fn6o5(m+h)
+
的计算值:443.1474,实验值:443.1470。
[0260]
根据以上数据,结合实施例1的x-射线单晶衍射图,可以确定目标化合物属于5-硝基亚氨基-4h-1,2,4-三唑类化合物,所得产物符合式h-(19)所示的结构:
[0261][0262]
实施例20
[0263]
将实施例1中3-苯丙酸甲酯替换为3-氟苯乙酸甲酯;
[0264]
将(e)-2-(2-溴甲基)苯基-2-甲氧亚胺基乙酸甲酯替换为(e)-2-(2-溴甲基)苯基-3-甲氧基丙烯酸甲酯;
[0265]
目标化合物h-(20)的合成方法与实施例1相同,产率为31.5%。
[0266]
目标化合物h-(20)的结构表征数据如下所示:
[0267]1hnmr(400mhz,dmso)δ14.26(s,1h,n
–
h),7.59(s,1h,=ch
–
o),7.27(dqd,j=16.6,7.6,1.3hz,3h,arh),7.12(dd,j=7.5,1.3hz,1h,arh),7.05(td,j=8.5,2.2hz,1h,arh),6.96(d,j=7.1hz,1h,arh),6.92
–
6.82(m,2h,arh),4.94(s,2h,n
–
ch2–
),3.83(s,3h,
–o–
ch3),3.73(s,2h,
–
ch2–
),3.55(s,3h,
–o–
ch3).
[0268]
13
cnmr(101mhz,dmso-d6)δ167.04,163.67,161.75,161.25,151.85,150.22,136.94,136.86,133.60,132.39,132.17,130.81,130.73,128.48,128.44,127.69,125.60,125.57,116.37,116.15,114.48,114.28,108.20,62.45,51.77,45.12,30.38.
[0269]
esi-hrms(m/z):c
21h20
fn5o5(m+h)
+
的计算值:442.1521,实验值:442.1516。
[0270]
根据以上数据,结合实施例1的x-射线单晶衍射图,可以确定目标化合物属于5-硝基亚氨基-4h-1,2,4-三唑类化合物,所得产物符合式h-(20)所示的结构:
[0271][0272]
测试例1
[0273]
实施例制备的目标化合物的离体杀菌活性测定:
[0274]
1.供试药剂
[0275]
分别将目标化合物h-(1)、h-(2)、h-(15)、h-(16)、h-(17)用二甲基亚砜溶解后定容配成10000μg/ml母液备用。
[0276]
2.供试菌株
[0277]
番茄灰霉病原菌和棉花立枯病原菌均由中国农业大学理学院提供。
[0278]
3.实验方法
[0279]
参照《农药室内生物测定试验准则杀菌剂》,采用菌丝生长速率法测定药剂对植物病原菌的毒力,设二甲基亚砜为对照。
[0280]
(1)含药平板的制备
[0281]
用移液枪分别从上述供试药剂中移取400μl加入到80ml液态pda培养基中,摇匀后将其均匀倒入3个灭菌培养皿,待其凝固后,即制成含药浓度为50μg/ml的平板。以二甲基亚砜作为对照。
[0282]
(2)接菌培养
[0283]
用直径5mm灭菌后的打孔器沿菌落边缘打取菌饼,然后将菌饼反转置于含药平板中央,置于25℃条件下培养至空白对照菌丝生长直径为7.5厘米。
[0284]
(3)结果检查
[0285]
以十字交叉法测量菌落直径,计算净生长量和菌丝生长抑制率:
[0286]
净生长量(mm)=测量菌落直径-5
[0287][0288]
所得结果见表2。
[0289]
表2 50μg/ml供试药剂对两种植物病原菌的杀菌活性测定结果
[0290][0291]
由表2可知,本发明的目标化合物对两种植物病原菌均具有一定的杀菌活性(菌丝生长情况见图4和5),且随3位侧链的长度增加,杀菌活性会明显提高。因此,以5-硝基亚氨基-4h-1,2,4-三唑杂环为药效团,对3位的侧链r1和4位r2进一步修饰和改造,有望开发新型5-硝基亚氨基-4h-1,2,4-三唑类杀菌剂。
[0292]
测试例2
[0293]
实施例制备的部分目标化合物的杀虫活性测定:
[0294]
1.供试药剂
[0295]
将目标化合物h-(11)、h-(12)、h-(15)、h-(16)、h-(19)、h-(20)分别用n,n-二甲基甲酰胺溶解后定容配成10000μg/ml母液备用。
[0296]
2.供试虫源
[0297]
白菜蚜虫,采自田间种群。
[0298]
3.实验方法
[0299]
将10000μg/ml目标化合物h-(11)、h-(12)、h-(15)、h-(16)、h-(19)、h-(20)分别用0.05%吐温80水溶液稀释至浓度为200μg/ml。采用药液浸渍法,将带有20头白菜蚜的叶片在药液中浸渍5s后取出,用吸水纸吸去多余药液,放入培养皿内,皿内放有湿润吸水纸保湿,加保鲜膜加盖置25
±
1℃下恢复。用不含药水溶液作空白对照。24h后在台式放大镜下检查结果。以毛笔尖轻触虫体,无反应和不能正常爬行者为死亡。
[0300]
所得结果见表3:
[0301]
表3 200μg/ml供试药剂对白菜蚜虫的杀虫活性(24h)
[0302][0303][0304]
由表3可知,本发明的目标化合物对白菜蚜虫具有一定的杀虫活性,如将4位取代基r2采用的是一些具有杀虫活性的基团如6-氯-3-吡啶甲基、2-氯-1,3-噻唑-5-基甲基等,
可显著提高目标化合物活性,有望开发出新型5-硝基亚氨基-4h-1,2,4-三唑类杀虫剂。
[0305]
测试例3
[0306]
实施例制备的部分目标化合物的除草活性测定:
[0307]
1.供试药剂
[0308]
将目标化合物h-(1)、h-(3)、h-(6)、h-(8)、h-(9)、h-(11)、h-(13)、h-(14)、h-(18)、h-(19)、h-(20)分别用n,n-二甲基甲酰胺溶解后定容配成10000μg/ml母液备用。
[0309]
2.供试杂草
[0310]
供试杂草为稗草,采用盆栽法培养:分别在每盆播种20粒稗草种子,然后用0.5cm的土壤覆盖,并在25-35℃的温室温度下生长;待杂草长至3-4叶期,待用。
[0311]
3.实验方法
[0312]
将10000μg/ml目标化合物h-(1)、h-(3)、h-(6)、h-(8)、h-(9)、h-(11)、h-(13)、h-(14)、h-(18)、h-(19)、h-(20)分别用0.05%吐温80水溶液稀释至浓度为400μg/ml。采用苗后喷雾处理法,每盆喷液量10毫升,以等量n,n-二甲基甲酰胺加入等量0.05%吐温80水溶液作为对照,6天后观察生长状况。
[0313]
4.实验结果
[0314]
供试药剂处理稗草6天后主要症状描述如表4所示,症状图如图6所示。
[0315]
表4 400μg/ml供试药剂对稗草的除草活性
[0316][0317][0318]
从图6可见,供试药剂h-(1)、h-(3)、h-(6)、h-(8)、h-(9)、h-(11)、h-(13)、h-(14)、h-(18)、h-(19)、h-(20)均能使稗草表现一定的中毒症状,尤其是h-(13)、h-(14)和h-(19)可显著抑制稗草生长,中毒症状明显。
[0319]
鉴于5-硝基亚氨基-4h-1,2,4-三唑杂环与三唑啉酮类除草剂药效团结构十分相似。因此,在开发新型5-硝基亚氨基-4h-1,2,4-三唑类除草剂方面也具有较大潜力。
[0320]
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人
员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1