威尼斯镰刀菌内源U6启动子及其基于CRISPR/Cas9的基因编辑方法
威尼斯镰刀菌内源u6启动子及其基于crispr/cas9的基因编辑方法
技术领域
1.本发明涉及威尼斯镰刀菌基因工程领域,具体涉及威尼斯镰刀菌内源u6启动子及其基于crispr/cas9的基因编辑方法。
背景技术:
2.威尼斯镰刀菌是从3000多株真菌中筛选到的可用于发酵生产菌丝蛋白的工业菌株。该菌株发酵产生的菌丝蛋白与单细胞蛋白相比更加味美,具有类似肉质的组织结构,并且能够提供很好的营养平衡,包括脂肪含量低,氨基酸种类齐全,富含微量元素、维生素及利于人胃肠蠕动的可食性粗纤维。此外,威尼斯镰刀菌菌丝蛋白还具有很好的安全性,已在全球的18个国家获得食品原料上市许可。因此,具有部分或全部替代动物性和植物性蛋白质食品的潜力。
3.过去几年,crispr/cas9基因编辑体系已在丝状真菌中得到广泛的应用,使研究人员对丝状真菌的改造能力大幅度提升。在crispr/cas9基因编辑体系的建立过程中,调控sgrna表达的高效ⅲ型启动子起着关键作用,其中又以u6启动子研究最为普遍。当前在威尼斯镰刀菌中还未有关于内源高效u6启动子的报告。因此,挖掘高效的威尼斯镰刀菌tb01内源u6启动子,并以此建立crispr/cas9基因编辑系统,有望大幅提高同源重组效率,减少对筛选标记的依赖,以及实现多基因同时编辑,最终推进该菌株的基础研究和开发利用。
技术实现要素:
4.针对现有技术的需求,本发明以威尼斯镰刀菌tb01 gfp荧光菌株为编辑对象,以能够在丝状真菌中自主复制且包含了黑曲霉密码子优化的cas9蛋白表达载体为cas9蛋白供体,通过比较不同内源u6启动子调控sgrna
gfp
时对gfp基因的编辑效率,筛选到u6启动子u6
374
和u6
94
,并以此为基础建立了能够实现威尼斯镰刀菌tb01菌株基因组精准、高效编辑的crispr/cas9基因编辑体系。
5.因而,本发明的目的在于提供威尼斯镰刀菌的高效内源u6启动子和适合于威尼斯镰刀菌的基于crispr/cas9基因编辑的方法。
6.本发明提供一种来源于威尼斯镰刀菌的内源u6启动子,其特征在于,在威尼斯镰刀菌中可诱导sgrna的表达,以使cas9在正确位置对靶标序列进行切割,所述内源u6启动子的核苷酸序列如seq id no:1或seq id no:2。更具体地,所述启动子是从丝状真菌是威尼斯镰刀菌tb01克隆到的,该菌株的保藏编号为cgmcc no.20740,分类命名为镰刀菌fusarium venenatum,于2020年10月12日保藏于中国微生物菌种保藏管理委员会普通微生物中心(保藏地址为北京市朝阳区北辰西路1号院3号)。
7.本发明提供一种来源于威尼斯镰刀菌的内源u6启动子,其特征在于,在威尼斯镰刀菌中可诱导sgrna的表达,以使cas9在正确位置对靶标序列进行切割,所述内源u6启动子的核苷酸序列如seq id no:1或seq id no:2所示。
8.进一步本发明提供含有所述的威尼斯镰刀菌的内源u6启动子的表达盒。优选地,表达盒包括所述内源u6启动子,和与其可操作连接的sgrna中参与识别目标基因靶点的序列以及grna scaffold。更优选地,所述的grna scaffold的核苷酸序列如seq id no:3所示。
9.本发明还提供含有所述的来源于威尼斯镰刀菌的内源u6启动子或所述的表达盒的重组载体。
10.本发明进一步提供一种威尼斯镰刀菌的基因编辑的方法,其包括如下步骤:将含有所述的来源于威尼斯镰刀菌的内源u6启动子介导的编辑目标基因的sgrna片段和cas9表达载体共转化威尼斯镰刀菌原生质体中,进一步筛选编辑成功的转化子。
11.在优选实施方式中,所述cas9表达载体中的调控元件包括如seq id no:5所示的pgpda启动子;cas9蛋白;sv40 nls为病毒sv40的核定位信号;构巢曲霉trpc的启动子ptrpc和终止子ttrpc;潮霉素抗性基因hyg;丝状真菌自主复制子ama1;其中,所述内源u6启动子介导的编辑目标基因的sgrna片段包括所述内源u6启动子、sgrna中参与识别目标基因靶点的序列以及grna scaffold,进一步优选地所述的grna scaffold的核苷酸序列如seq id no:3所示。
12.在一个具体实施方式中,所述威尼斯镰刀菌原生质体采用如下方法制备:收集威尼斯镰刀菌孢子,并用无菌0.7 m氯化钠洗涤后,酶解2小时,所述酶解采用的酶裂解液为:20mg崩溃酶+40mg蜗牛酶溶于10ml 0.7 m氯化钠,并过滤除菌。
13.进一步优选地,所述威尼斯镰刀菌为威尼斯镰刀菌tb01。
14.另外,优选地,上述方法进一步包括通过pcr或测序验证目的基因编辑成功的转化子。
15.本发明有益效果在于,在威尼斯镰刀菌中成功建立了以内源u6启动子为基础的crispr/cas9基因编辑体系,并实现对靶标基因的定点编辑,因而在低同源重组率威尼斯镰刀菌中实现方便、快速、高效的基因编辑,具有较高应用价值。
16.本发明的其它优点、目标和特征将部分通过下面的说明体现,部分还将通过对本发明的研究和实践而为本领域的技术人员所理解。
附图说明
17.图1 威尼斯镰刀菌内源u6启动子调控sgrna
gfp
表达的融合片段构建。其中a为各内源u6启动子片段及sgrna
gfp
片段扩增后的电泳结果。b为各内源u6启动子片段与sgrna
gfp
片段融合后的电泳结果。c为各内源u6启动子片段与sgrna
gfp
片段融合后的测序比对结果。
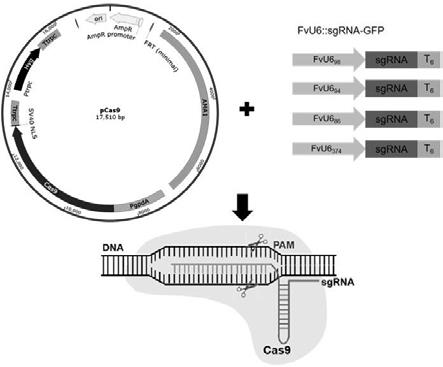
18.图2 cas9表达载体构建。其中a为pcas9表达载体示意图。pgpda为威尼斯镰刀菌tb01内源启动子;cas9为进行黑曲霉密码子优化的cas9蛋白;sv40 nls为病毒sv40的核定位信号;ptrpc和ttrpc为构巢曲霉trpc的启动子和终止子;hyg为潮霉素抗性基因;ama1为丝状真菌自主复制子。b为pcas9表达载体转化子的pcr扩增电泳结果。1-10为pcas9转化子,h20为阴性对照。c为pcas9表达载体转化子的测序结果表明的已包含启动子和cas9蛋白扩增片段的结构图。
19.图3 威尼斯镰刀菌crispr/cas9基因编辑系统示意图。
20.图4 crispr/cas9编辑gfp荧光菌株的gfp基因编辑转化子的荧光代表性照片。
21.图5荧光菌株gfp编辑转化子的pcr扩增后电泳结果。m为dna marker;wt为野生型威尼斯镰刀菌(阴性对照);1-4为编辑后的无荧光转化子;5为未编辑的gfp荧光菌株。
具体实施方式
22.下面通过具体实施例对本发明作进一步的阐述,以便更好的理解本发明,但并不构成对本发明的限制。
23.实施例1:威尼斯镰刀菌tb01不同内源u6启动子调控sgrna
gfp
表达的融合片段构建本发明通过和其它物种通过序列比较和检索,在威尼斯镰刀菌tb01中挖掘并克隆到内源u6启动子u6
94
和u6
374
(序列分别如seq id no:1和seq id no:2),属于ii类启动子,因而特别适合专门用于基因编辑中诱导sgrna表达。
24.1. 引物u6
98-1ctcacgtgccagtgccaaatu6
98-2tgatatagacgttgtggctgcatattcggtcagtatcgtgatatcaggu6
94-1ccaggcggaattaatcagtcagu6
94-2tgatatagacgttgtggctgcgtagtgatggtcttgtgttaacu6
86-1gctggagtgtgatagaatagu6
86-2tgatatagacgttgtggctgcccatagaccgctggaccaaacu6
374-1atgcgggcggatgttttgcgagtctu6
374-2tgatatagacgttgtggctgcgaagggttggtcttattttaacsgrna-1gcagccacaacgtctatatcagttttagagctagaaatagcsgrna-2aaaaaaagcaccgactcggtgcc2.片段扩增程序3.实验方法分别以引物对u6
98-1/2,u6
94-1/2,u6
86-1/2,u6
374-1/2从威尼斯镰刀菌tb01的dna基因组中扩出相应内源u6启动子序列u6
86
、u6
94
、u6
98
、u6
374
,以引物对sgrna-1/2在人工合成的grna scaffold片段(seq id no:3)的基础上扩出sgrna
gfp
序列(seq id no:4)。随后通过融合pcr进行两轮扩增,将u6片段与sgrna
gfp
片段进行融合,并对融合片段进行测序确认。
25.实验结果如图1所示,其中a为各内源u6启动子片段及sgrna
gfp
片段扩增后的电泳结果。b为各内源u6启动子片段与sgrna
gfp
片段融合后的电泳结果。c为各内源u6启动子片段与sgrna
gfp
片段融合后的测序比对结果。电泳结果和序列测序比对结果显示,各内源u6启动子与sgrna
gfp
片段融合成功,随后将融合片段置于-20℃保存。
26.实施例2:cas9蛋白表达载体构建1.引物pgpda1tatgaccatgattacgaattcggtgttgatcgtcaaccaagtccpgpda2tatacttcttgtccataagctttttgttaaggaggttctgtttgaggpcas9-t1atggacaagaagtatagcatcggpcas9-t2catcttctgtcgacactagtgcctctaaacaagtgtacctgpgc1tgtgtgttcgtgggatgatgpgc2gtcagaccaagtgacaacgc2.片段扩增程序
pgpda片段98℃10s,55℃15s,72℃50s;35个循环 primestar,takaracas9-t片段98℃10s,55℃15s,72℃3min;35个循环primestar,takara转化子验证98℃10s,55℃15s,72℃50s;35个循环primestar,takara同源重组50℃30min
ꢀꢀꢀꢀꢀ
minervasuperfusioncloningkit,useverbright
3.实验方法以引物对pgpda1/2从威尼斯镰刀菌tb01的dna基因组中扩出内源性的强启动子pgpda的序列(seq id no:5),以引物对pcas9-t1/2从包含优化黑曲霉密码子后的cas9骨架载体中扩出cas9-ttrpc序列。随后通过同源重组酶将其连接到包含丝状真菌中自主复子ama1和hyg抗性的骨架载体上获得pcas9表达载体。将其进行大肠杆菌dh5α转化后挑选单菌落进行pcr验证(以横跨gpda和cas9的片段为检测对象,引物对为pgc1/2),获得阳性转化子。
27.图2中a显示为pcas9表达载体示意图。实验结果如图2中b和c所示。电泳图(图2中b)和测序结果表明的结构(图2中c)显示,pgpda片段和cas9-t片段已成功连接到骨架载体上,随后将阳性转化子菌株置于-80℃保存,用于后续cas9表达质粒的提取。
28.实施例3:不同内源u6启动子调控sgrna
gfp
融合片段与cas9表达载体的威尼斯镰刀菌gfp荧光菌株的原生质体共转化本实施例描述了威尼斯镰刀菌crispr/cas9基因编辑具体实验过程。图3示了本发明的威尼斯镰刀菌crispr/cas9基因编辑系统示意图。
29.1.培养基yepd: 酵母粉3g,蛋白胨10g,葡萄糖20g,定容到1l溶解酶的缓冲液:0.7 m氯化钠stc:0.8 m山梨醇;50 mm cacl2,50 mm tris-hcl(ph 8.0)sptc:含40% peg6000的stc再生培养基:酵母提取物1g,胰蛋白胨1g,蔗糖274g,琼脂糖10g,定容1l筛选培养基:葡萄糖30g,酵母粉6g,琼脂粉15g,定容到1l。
30.2.实验方法1)吐温80制备威尼斯镰刀菌孢悬液,涂于gy固体培养基上,28℃,培养7-10 d产孢;2)制备孢悬液接于yepd液体培养基中(加玻璃珠),28℃,200rmp培养至萌发菌丝长度为孢子的3-4倍(16h);
3)4℃,13000rpm,15min收集孢子,并用无菌0.7 m氯化钠洗涤1次;4)酶裂解液制备原生质体(20mg崩溃酶+40mg蜗牛酶溶于10ml 0.7 m氯化钠,并过滤除菌),30℃ 100 rpm裂解2h;5)三层擦镜纸过滤后4℃,7000rpm,10min;6)stc洗涤2次,按上述离心后用stc重选原生质体(浓度106),放于冰上备用;7)取80μl上述原生质体悬浮液,加入20μl sptc,轻轻混匀,再分别加入10μg融合u6::sgrna片段和cas9表达载体,轻轻混匀后放置冰上30min;8)加入1ml sptc轻轻混匀,室温放置20min;9)混合液加到40℃左右的再生培养基中,摇匀倒板,28℃培养过夜(12h左右);10)倒上筛选培养基,28℃培养长出转化子(3-4d),以进一步筛选gfp基因编辑转化子。
31.实施例4:gfp基因编辑转化子的荧光观察利用手持荧光激发器luyor-3415gr照射实施例2中获得的gfp基因编辑转化子,并通过滤片进行拍照。实验结果如下表和图4所示。
32.基于不同内源u6启动子的crispr/cas9编辑系统对gfp基因编辑效率比较启动子名称转化子数目无荧光转化子数目编辑效率(%)u6
98
1100u6
94
9222u6
86
900u6
374
6467结果显示,在荧光激发器照射下,只有以u6
374
启动子和u6
94
启动子为基础的crispr/cas9基因编辑系统转化荧光菌株后才出现无荧光的转化子(gfp被编辑),且u6
374
启动子中所呈现的无荧光转化子比例(67%)明显高于u6
94
启动子(22%),表明基于威尼斯镰刀菌内源u6
374
启动子和u6
94
启动子建立的crispr/cas9基因编辑系统能够在威尼斯镰刀菌中工作,且启动子u6
374
的诱导活性最强。
33.实施例5:荧光菌株gfp编辑转化子的pcr扩增及测序1.试剂菌丝裂解液:取1.2 gnaoh用去离子水溶解后定容至100 ml。
34.菌丝中和液:10 ml 1m tris-hcl(ph8.0),40 ml 0.3 m hcl,用去离子水定容至800 ml。
35.2.引物编辑验证-1atggtgagcaagggcgaggagctgtt编辑验证-2cgcctggacgactaaaccaaaataggc3.片段扩增程序
编辑验证片段98℃10s,55℃15s,72℃45s;35个循环 primestar,takara
4.实验方法针对实施例3中的无荧光转化子,利用菌丝裂解液和中和液对其制备简易模板(取少量菌丝体于8μl菌丝裂解液中,98℃处理2min,随后加入170μl菌丝中和液即为简易模板),并通过引物对编辑验证-1/2扩增包含gfp基因的片段,随后对片段进行测序比对。
36.实验结果如图5所示荧光菌株gfp编辑转化子的pcr扩增后电泳结果。经无荧光转化子的pcr扩增及测序比对结果表明,导入cas9和sgrna
gfp
后gfp基因在特定sgrna结合位置发生碱基缺失,导致整个基因发生移码突变。该结果进一步证实内源u6启动子及相应crispr/cas9基因编辑系统能够在威尼斯镰刀菌中能够有效应用。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1