一种产气荚膜梭菌β毒素纳米抗体及其应用
一种产气荚膜梭菌
β
毒素纳米抗体及其应用
技术领域
1.本发明属于生物工程技术领域,尤其涉及一种产气荚膜梭菌β毒素纳米抗体及其应用。
背景技术:
2.骆驼科动物(羊驼、骆驼)和软骨鱼体内的一种天然缺失重链但仍然具有生物活性的特异性抗体称单域抗体,单域抗体的抗原结合位点(vhh)具有独立的抗原识别能力,独立表达的vhh又被称为纳米抗体。与传统的四联体抗体相比,单域抗体的主要特点有:分子量小,结构简单,理化性质稳定等。纳米抗体得优良特性使其在多种方面具有优势:在抗体进入机体方面纳米抗体能够穿过动物机体内的一些保护性的屏障进入发病部位发挥作用,如血脑屏障、血睾屏障等;在抗原抗体结合方面能够结合一些隐蔽的抗原表位,特别适用于比较难得到抗体的靶点,如gpcr、离子通道和酶活中心等;在降低生产成本方面纳米抗体结构简单易于体外表达,同时体外表达不易产生包涵体,生产工艺简单;同时纳米抗体的分子量小,结构简单,更有利于进行基因改造,纳米抗体人源化修饰等特性。
3.产气荚膜梭菌(clostridium perfringens),又称魏氏梭菌(clostridium welchii),也称产气荚膜芽孢杆菌。目前,已发现产气荚膜梭菌产生的毒素和酶多达20种,其中α毒素(cpa),β毒素(cpb),ε毒素(etx),ι毒素(itx)是其产生的最主要的毒素,也是诱导疾病发生的主要毒素。β毒素可以由b型和c型产气荚膜梭菌产生,是人类和动物坏死性小肠结肠炎和肠毒素血症的主要毒素。制备产气荚膜梭菌β毒素纳米抗体,一方面可以成为快速检测产气荚膜梭菌β毒素的工具,另一方面可以作为治疗产气荚膜梭菌β毒素引起的疾病提供方法,目前尚未有产气荚膜梭菌β毒素纳米抗体的有关研究。
技术实现要素:
4.有鉴于此,本发明的目的在于提供一种对产气荚膜梭菌β毒素蛋白具有较好的灵敏度的产气荚膜梭菌β毒素纳米抗体,可用于产气荚膜梭菌β毒素的检测。
5.为了实现上述发明目的,本发明提供了以下技术方案:
6.本发明提供了一种产气荚膜梭菌β毒素纳米抗体,所述产气荚膜梭菌β毒素纳米抗体的氨基酸序列如seq id no.1所示。
7.本发明还提供了一种编码上述产气荚膜梭菌β毒素纳米抗体的核苷酸序列,如seq id no.2所示。
8.本发明还提供了一种含有上述核苷酸序列的表达载体。
9.本发明还提供了一种宿主细胞,所述细胞表达上述产气荚膜梭菌β毒素纳米抗体或含有上述表达载体。
10.本发明还提供了一种上述产气荚膜梭菌β毒素纳米抗体或上述核苷酸序列在制备检测产气荚膜梭菌β毒素产品中的应用。
11.本发明还提供了一种上述产气荚膜梭菌β毒素纳米抗体或上述核苷酸序列在制备
检测与产气荚膜梭菌β毒素有关疾病产品中的应用。
12.优选的,所述疾病包括坏死性小肠结肠炎和肠毒素血症。
13.优选的,所述产品包括试剂、试剂盒、试纸和探针。
14.本发明还提供了一种非诊断目的的检测粪便中产气荚膜梭菌β毒素的方法,包括以下步骤:以畜禽粪便作为抗原包被酶标板,以上述纳米抗体为一抗进行elisa检测。
15.优选的,所述elisa方法中的二抗为his-hrp抗体。
16.本发明的有益效果:
17.本发明提供的产气荚膜梭菌β毒素纳米抗体,不仅能够特异性结合产气荚膜梭菌β毒素蛋白,而且对该蛋白的灵敏度较好,最低可达到0.3125μg/ml。以elisa的方法检测羊和羊驼粪便中的产气荚膜梭菌β毒素时,灵敏度可达到1μg/ml。
附图说明
18.图1为第一轮pcr-vhh凝胶电泳图;
19.图2为第二轮pcr-vhh电泳图;
20.图3为平板检测β毒素-vhh纳米文库库容结果;
21.图4为平板检测β毒素-vhh纳米文库丰度结果;
22.图5为pcr检测β毒素-vhh纳米文库插入率结果;
23.图6为软件分析50个样品序列对应的氨基酸序列结果;
24.图7为sds-page检测纯化的产气荚膜梭菌β毒素纳米抗体;
25.图8为western blot法检测产气荚膜梭菌β毒素纳米抗体。
具体实施方式
26.本发明提供了一种产气荚膜梭菌β毒素纳米抗体,所述产气荚膜梭菌β毒素纳米抗体的氨基酸序列如seq id no.1所示。
27.在本发明中,所述纳米抗体的氨基酸序列如下:
28.esggglvqtggslrlscvaslsggrvsvntiewhrqvpgkqrelvagitrsgtpnysefakgrftisrenakntvylqmnnlkpddtavylcnvradtligstgaiehqywgqgtevivss。
29.本发明还提供了一种上述产气荚膜梭菌β毒素纳米抗体的筛选方法,包括以下步骤:
30.1)将产气荚膜梭菌β毒素纳米抗体文库进行第一轮淘洗,得到β毒素-vhh1;所述第一轮淘洗的产气荚膜梭菌β毒素蛋白的包被浓度优选为18~22μg/ml;
31.2)将所述步骤1)得到的β毒素-vhh1依次进行第二轮、第三轮和第四轮淘洗,得到噬菌体溶液;所述第二轮淘洗的产气荚膜梭菌β毒素蛋白的包被浓度优选为8~12μg/ml;所述第三轮淘洗的产气荚膜梭菌β毒素蛋白的包被浓度优选为3~8μg/ml;所述第四轮淘洗的产气荚膜梭菌β毒素蛋白的包被浓度优选为3~8μg/ml;
32.3)将所述步骤2)得到的噬菌体液与tg1菌液混合、感染后进行培养,得到菌株;
33.4)将所述步骤3)得到的菌株与km13辅助噬菌体混合、感染,将得到的感染物进行第一振荡培养后进行第一离心,将得到的第一沉淀经液体培养基重悬后进行第二振荡培养后,进行第二离心,将得到的第二上清液与封闭液混合、孵育后进行间接elisa检测,检测第
二上清液同产气荚膜梭菌β毒素蛋白的反应性,以确定所述菌株与产气荚膜梭菌β毒素蛋白具有反应性;
34.所述第一振荡的温度优选为35~42℃,所述第二振荡的温度优选为28~32℃;
35.所述第一离心的离心力优选为7500~8500g,所述第二离心的离心力优选为2000~2100g;
36.5)将所述步骤4)与产气荚膜梭菌β毒素蛋白具有反应性的菌株进行质粒提取,以所述质粒为模版,用质粒引物对进行pcr扩增,得到纳米抗体vhh片段,将所述纳米抗体vhh片段与表达载体连接,得到重组质粒;
37.所述质粒引物包括质粒上游引物和质粒下游引物,所述质粒上游引物具有seq id no.3所示的核苷酸序列,具体序列如下:
38.cgggatcc gagtctggaggaggcttggt,其中,ggatcc为bamhⅰ酶切位点。
39.所述质粒下游引物具有seq id no.4所示的核苷酸序列;
40.gcgtcgac tgaggagacgatgacctcgg,其中,gtcgac为salⅰ酶切位点。
41.6)将所述步骤5)得到的重组质粒、pet28a转入大肠杆菌,得到纳米抗体表达菌株,对所述纳米抗体表达菌株进行iptg诱导后,提取得到诱导后的纳米抗体表达菌株的蛋白,根据蛋白分子量及his-tag标签对所述蛋白进行western blotting鉴定,蛋白分子量为13kda的蛋白为产气荚膜梭菌β毒素纳米抗体。
42.本发明对所述产气荚膜梭菌β毒素纳米抗体文库没有特殊限定,采用常规使用的产气荚膜梭菌β毒素纳米抗体文库即可,在本发明实施例中,所述产气荚膜梭菌β毒素纳米抗体文库的构建方法优选包括以下步骤:
43.a.将产气荚膜梭菌β毒素基因中的cds区的基因与载体连接,得到表达载体;
44.b.将所述步骤a得到的表达载体进行诱导表达并纯化得到β毒素抗原蛋白;
45.c.将所述步骤b得到的蛋白免疫动物后,提取动物血液中淋巴细胞总rna,将所述淋巴细胞总rna反转录为cdna;
46.d.以所述步骤c得到的cdna为模版,用call001-f和call002-r引物对进行第一pcr扩增,得到700bp扩增产物;
47.所述call001-f引物具有seq id no.5所示的核苷酸序列,具体序列如下:
48.gtcctggctgctcttctacaagg;
49.所述call002-r引物具有seq id no.6所示的核苷酸序列,具体序列如下:
50.ggtacgtgctgttgaactgttcc。
51.e.以所述步骤d得到的700bp扩增产物为模版,用vhh2-f和vhh2-r引物对进行第二pcr扩增,得到vhh片段;
52.所述vhh2-f引物具有seq id no.7所示的核苷酸序列,具体序列如下:
53.tttctattactaggcccagccggccgagtctggaggrrgcttggtgca;
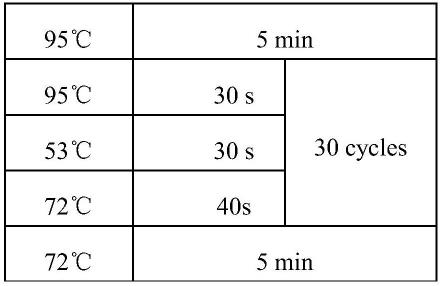
54.所述vhh2-r引物具有seq id no.8所示的核苷酸序列,具体序列如下:
55.aaaccgttggccataatggcctgaggagacgrtgacstsggtc。
56.f.将所述步骤e得到的vhh片段和pcantab5e分别经两次sfii酶切后连接,得到连接产物;
57.g.将所述步骤f得到的连接产物与tg1电转化感受态细胞混合后进行电转化,得到
产气荚膜梭菌β毒素纳米抗体文库。
58.在本发明中,所述载体优选为pet28a,本发明对所述连接的方法没有特殊限定,采用常规即可。本发明优选将表达载体进行原核表达纯化得到的蛋白。在本发明中,所述诱导表达时间优选为6-20h,更优选为12h。所述诱导表达中使用的iptg浓度为0.2-1.0mmol/l,更优选0.8mmol/l。
59.本发明优选将所述蛋白免疫动物后,提取动物血液中淋巴细胞总rna,将所述淋巴细胞总rna反转录为cdna。在本发明中,所述动物优选为羊驼。本发明对所述免疫的方法没有特殊限定,采用常规免疫原免疫动物的方法即可。
60.本发明对所述提取动物血液中淋巴细胞总rna的方法没有特殊限定,采用常规rna提取的方法即可。
61.在本发明中,所述反转录优选包括:将5μg总rna、1μl random6 primer、1μl oligo(dt)18primer、1μl dntpmix和7μl ddh2o混合后在65℃下处理5min,将得到的处理物在冰上静置5min,将所述静置物与4μl 5
×
primescript iibuffer、0.5μl rnase inhibiter、1μl primer scrip ii rtase和4.5μl ddh2o混合后,依次40℃处理40min和70℃处理15min,得到cdna。
62.本发明以cdna为模版,用call001-f和call002-r引物对进行第一pcr扩增,得到700bp扩增产物;在本发明中,所述call001-f引物对应羊驼抗体的leader区,所述call002-r引物对应于羊驼抗体的第二恒定区(ch2),可分别对常规抗体(900bp)及重链抗体(700bp)的leader区及ch2区域进行扩增。本发明将扩增得到的700bp扩增产物进行第二扩增。
63.在本发明中,所述第一pcr扩增的体系优选每50μl包括:2μl cdna、浓度为10umol/μl的call001-f 1μl、浓度为10umol/μl的call001-r 1μl、25μl taq greenpcrmix和21μl ddh2o。
64.在本发明中,所述第一pcr扩增的程序优选包括:95℃5min;95℃30s,53℃30s,72℃40s,30个循环;72℃5min。
65.在本发明中,根据第一轮pcr产物的测序结果,在羊驼单域抗体(vhh结构域)的两端恒定区fr1、fr4区域分别设计第二轮扩增引物vhh2-f和vhh2-r,以扩增vhh序列。
66.本发明将得到的vhh片段和pcantab5e分别经两次sfii酶切后连接,得到连接产物。
67.本发明对所述vhh片段和pcantab5e的酶切没有特殊限定,采用常规酶切的方法即可。在本发明中,经两次酶切后能够消除空载率。
68.在本发明中,所述连接使用的酶优选为t4连接酶。在本发明中,所述连接的体系优选每200μl包括:vhh片段1μg、pcantab5e载体3μg、t4dnaligase 10μl、10
×
buffer20μl,ddh2o补充至200μl。本发明对所述连接的条件没有特殊限定,采用常规连接条件即可。
69.本发明将所述连接产物与tg1电转化感受态细胞混合后进行电转化,得到产气荚膜梭菌β毒素纳米抗体文库。
70.在本发明中,所述电转化优选包括:所述电转化的电压优选为1.5~2.0kv,更优选为1.8kv;所述电转化的电阻优选为180~220ω,更优选为200ω;所述电转化的电容优选为20~30μf,更优选为25μf;所述电转化的时间优选为4~6ms,更优选为5ms。
71.本发明电转化后还包括:将得到的电转化物在37℃下孵育1h,将得到的孵育物在
5000g下离心5min,将得到的沉淀加入soc液体培养基后,得到产气荚膜梭菌β毒素纳米抗体文库。
72.在本发明中,所述第一轮淘洗的产气荚膜梭菌β毒素蛋白的包被浓度为18~22μg/ml,优选为10μg/ml。本发明对所述第一轮淘洗的方法没有特殊限定,采用本领域常规淘洗的方法即可。
73.本发明将得到的β毒素-vhh1依次进行第二轮、第三轮和第四轮淘洗,得到噬菌体溶液;所述第二轮淘洗的产气荚膜梭菌β毒素蛋白的包被浓度为8~12μg/ml,优选为10μg/ml;所述第三轮淘洗的产气荚膜梭菌β毒素蛋白的包被浓度为3~8μg/ml,优选为5μg/ml;所述第四轮淘洗的产气荚膜梭菌β毒素蛋白的包被浓度为3~8μg/ml,优选为5μg/ml。本发明对所述第二轮淘洗、第三轮淘洗和第四轮淘洗的方法没有特殊限定,采用本领域常规淘洗的方法即可。
74.本发明将得到的噬菌体液与tg1菌液混合、感染后进行培养,得到菌株。
75.在本发明中,所述噬菌体液与tg1菌液的体积比优选为1:4。在本发明中,所述tg1菌液的od600值优选为0.4。在本发明中,所述培养的温度优选为25~35℃,更优选为30℃。
76.在本发明中,所述菌株与km13辅助噬菌体混合后优选以静置的方式进行感染,所述感染的时间优选为25~35min,优选为30min。
77.在本发明中,所述第一振荡的温度优选为35~42℃,更优选为37℃;所述第二振荡的温度优选为28~32℃,更优选为30℃;所述第一离心的离心力优选为1700~1900g,更优选为所述第二离心的离心力为1800g;所述第二离心的离心力优选为2000~2100g,更优选为2020g。
78.本发明将与产气荚膜梭菌β毒素蛋白具有反应性的菌株进行质粒提取,以所述质粒为模版,用质粒引物对进行pcr扩增,得到纳米抗体vhh片段,将所述纳米抗体vhh片段与表达载体连接,得到重组质粒;所述质粒引物包括质粒上游引物和质粒下游引物,所述质粒上游引物具有seq id no.3所示的核苷酸序列;所述质粒下游引物具有seq id no.4所示的核苷酸序列。
79.本发明对质粒的提取没有特殊限定,采用常规提取质粒的方法即可。本发明对所述pcr扩增使用的体系和程序没有特殊限定,采用常规使用的体系和程序即可。在本发明中,所述所述质粒引物包括质粒上游引物和质粒下游引物,所述质粒上游引物优选具有seq id no.3所示的核苷酸序列,具体如下:
80.cgggatcc gagtctggaggaggcttggt;
81.所述质粒下游引物具有seq id no.4所示的核苷酸序列,具体序列如下:
82.gcgtcgac tgaggagacgatgacctcgg。
83.本发明对所述纳米抗体vhh片段与表达载体连接的方法没有特殊限定,采用本领域常规连接方法即可。
84.本发明将得到的重组质粒、pet28a转入大肠杆菌,得到纳米抗体表达菌株,对所述纳米抗体表达菌株进行iptg诱导后,提取得到诱导后的纳米抗体表达菌株的蛋白,根据蛋白分子量(13kda左右)及his-tag标签对所述蛋白进行western blotting鉴定,蛋白分子量为13kda的蛋白为产气荚膜梭菌β毒素纳米抗体。
85.本发明对所述重组质粒、pet28a转入大肠杆菌的转入方法没有特殊限定,采用常
规方法即可。本发明对所述纳米抗体表达菌株进行iptg诱导的诱导方法没有特殊限定,采用常规诱导方法即可。本发明对提取得到诱导后的纳米抗体表达菌株的蛋白的提取方法没有特殊限定,采用常规提取微生物中的蛋白的方法即可。本发明对所述sds-page鉴定的方法没有特殊限定,采用常规即可。
86.本发明还提供了一种编码上述产气荚膜梭菌β毒素纳米抗体的核苷酸序列,如seq id no.2所示,具体如下:
87.gagtctggaggaggcttggtgcaaactggggggtctctaagactctcctgcgtagcctcgctaagcggaggcagagtgagcgtcaataccattgagtggcaccgccaggttccagggaagcagcgcgaattagtcgccggtattacgaggagtgggacgccaaactactcagaattcgcgaagggtcgattcaccatctcccgagagaacgccaagaacacagtatatctgcaaatgaacaacctgaaacctgatgacacggccgtctatttgtgcaatgtgagggcggacacgctcattgggagtaccggagccattgaacatcagtactggggtcaggggaccgaggtcatcgtctcctca。
88.本发明还提供了一种含有上述核苷酸序列的表达载体。
89.本发明对于所述载体的具体类型没有特殊限定,采用本领域常规载体种类即可。
90.本发明还提供了一种宿主细胞,所述细胞表达上述产气荚膜梭菌β毒素纳米抗体或含有上述表达载体。
91.本发明对于宿主细胞的具体类型没有特殊限定,采用本领域常规宿主细胞均可。
92.本发明还提供了一种上述产气荚膜梭菌β毒素纳米抗体或上述核苷酸序列在制备检测产气荚膜梭菌β毒素产品中的应用。
93.本发明还提供了一种上述产气荚膜梭菌β毒素纳米抗体或上述核苷酸序列在制备检测与产气荚膜梭菌β毒素有关疾病产品中的应用。
94.在本发明中,所述疾病优选的包括坏死性小肠结肠炎和肠毒素血症,所述产品优选的包括试剂、试剂盒、试纸和探针。
95.本发明还提供了一种非诊断目的的检测粪便中产气荚膜梭菌β毒素的方法,包括以下步骤:以畜禽粪便作为抗原包被酶标板,以上述纳米抗体为一抗进行elisa检测。
96.在本发明中,所述粪便优选为羊或羊驼粪便。所述elisa方法中的二抗优选为his-hrp抗体。
97.下面结合实施例对本发明提供的技术方案进行详细的说明,但是不能把它们理解为对本发明保护范围的限定。
98.实施例1
99.抗原制备:通过pcr技术将产气荚膜梭菌β毒素基因的cds区与pet28a原核表达载体相连,构建产气荚膜梭菌β毒素原核表达载体,转化bl21(de3)菌株。37℃振荡培养10h后转接到500ml kan抗性的lb培养基中,37℃振荡培养至od600为0.6时加入iptg(终浓度0.8mm)诱导表达,15℃振荡培养过夜。次日16000g离心10min,用pbs洗涤菌体3次后超生破碎30min,离心取上清。经纯化仪纯化后,用bca检测蛋白浓度。待作抗原。
100.免疫程序及鉴定:免疫之前采集10ml实验羊驼的促凝血液,分离血清,保存备用。将上一步骤制备的蛋白分装成4管,每管200μg,挑选体况良好的成年雄性羊驼,采取肩胛部皮下注射的方式进行免疫,免疫间隔为2周,共免疫4次,每次免疫的蛋白量为200μg,其中初次免疫使用完全弗氏佐剂(sigma),第二到第四次免疫使用不完全弗氏佐剂(sigma),第三次免疫后采集羊驼促凝血,分离血清elisa检测免疫效果,elisa按说明书进行,在此过程
中,使用的二抗来源于llama。
101.淋巴细胞总rna的提取和vhh模板cdna的合成
102.按rna提取试剂盒说明书提取rna后,并按长链cdna反转录试剂盒说明书合成vhh第一条链,反应体系如表1:
103.表1反应体系
104.总rna5μgrandom6/oligo(dt)
18
primer1/1μldntp mix1μlrnase waterup to 10μl65℃5min冰上5min5x primescript ii buffer4μlrnase inhibiter0.5μlprimer scrip ii rtase1μlrnase waterup to 20μl
105.反应体系瞬时涡旋,pcr仪按40℃、40min;70℃、15min;12℃保存的反应体系进行反转录。
106.第一轮pcr扩增vhh片段:纳米抗体免疫文库构建采用巢式pcr法,第一轮pcr扩增的引物call001-f和call002-r,其中call001-f对应羊驼抗体的leader区,call002-r对应于羊驼抗体的第二恒定区(ch2),可分别对常规抗体(900bp)及重链抗体(700bp)的leader区及ch2区域进行扩增,具体方法如下:
107.第一轮pcr引物见表2:
108.表2引物序列
109.call001-f:seq id no.5gtcctggctgctcttctacaaggcall002-r:seq id no.6ggtacgtgctgttgaactgttcc
110.以合成的第一链cdna为模板进行pcr扩增,反转录产物分成30个反应,每个pcr反应体系为50μl,反应所用试剂为康为世纪的2
×
tap酶,反应体系见表3:
111.表3反应体系
112.cdna2μlcall001-f(10umol/μl)1μlcall002-r10umol/μl)1μltaq green pcr mix25μlwater21μl总体积50μl
113.pcr扩增反应程序见表4:
114.表4扩增程序
[0115][0116]
琼脂糖凝胶电泳分析第一轮pcr反应产物主要包含大小为900bp和700bp的两种扩增产物,紫外灯下切胶回收700bp的核酸,胶回收试剂盒(康为世纪)回收纯化700bp的核酸片段,1μl胶回收产物与pmd19-t simple载体相连,反应体系见表5:
[0117]
表5反应体系
[0118]
pmd19-t simple1μl胶回收产物1μlsolution i5μlwaterup to 10μl总体积10μl
[0119]
瞬时涡旋反应体系,4℃反应过夜,热激连接产物与dh5α感受态细胞混匀,冰上孵育25min,42℃精确热激90s,冰上孵育4min,加入400μl的lb培养基37℃、200rpm孵育40min,50μl转化后的菌液均匀的涂布到含有氨苄青霉素(amp)的lb固体培养基表面,培养板倒置,37℃过夜培养。次日挑取20个单克隆菌落接种到5ml含有amp抗性的lb液体培养基过夜培养后测定其碱基序列。vectornti软件分析测序结果,设计建库用的第二轮pcr引物vhh2-f和vhh2-r。
[0120]
第二轮pcr扩增vhh:以第一轮pcr产生的700bp的回收片段为模板,以测序设计的引物vhh2-f和vhh2-r进行vhh片段扩增。50μl的反应体系,共做24个pcr反应,具体反应体系见表6:
[0121]
表6反应体系
[0122]
胶回收产物80μg/μl6μlvhh2-f(10umol/μl)2μlvhh2-r(10umol/μl)2μltaq green pcr mix25μlwater15μl总体积50μl
[0123]
pcr扩增反应条件见表7:
[0124]
表7扩增程序
[0125]
[0126][0127]
取2μl二轮pcr反应产物进行琼脂糖凝胶电泳检测,扩增产物为单一条带。二轮vhh-pcr产物可直接使用核酸纯化试剂盒说明书进行纯化。
[0128]
vhh片段及载体酶切纯化:摇菌质粒小提含有pcantab5e质粒的大肠杆菌。抽取10μl的质粒进行质粒测序,检测所用质粒质量,有无突变碱基等。vhh片段及质粒pcantab5e进行二轮酶切,反应所用酶为sfii(thermo),酶切体系见表8:
[0129]
表8酶切体系
[0130][0131]
vhh片段及pcantab5e载体进行2轮酶切以消除空载率,第一轮vhh和载体都做20个反应的酶切,反应条件:50℃水浴酶切1h。pcr产物纯化试剂盒纯化vhh体系;载体酶切体系先进行琼脂糖纯化,然后采用胶回收试剂盒纯化。一轮酶切后的纯化产物按照上面的酶切体系再度50℃水浴、酶切1h,两种产物再度纯化。
[0132]
酶切产物连接及纯化:两轮酶切纯化后的vhh片段和载体pcantab5e进行连接,连接采用t4连接酶(thermo),反应体系见表9:
[0133]
表9连接体系
[0134][0135][0136]
反应体系瞬时涡旋,4℃反应过夜。次日按说明书进行连接产物的纯化。
[0137]
产气荚膜梭菌β毒素纳米抗体文库的构建及特性鉴定:将纯化后的pcantab5e-vhh连接产物(总体积100μl)加入刚制备的新鲜tg1电转化感受态细胞,吹打混匀,冰浴10min;
在电压1.8kv,电阻200ω,电容25μf,时间5ms的条件下,在电转仪中进行转化后,将电转杯中点击后的tg1细胞转移至50ml无菌离心管中,37℃振荡孵育1h;孵育过的菌液5000g离心5min,弃净上清,重新加入8ml新鲜的soc培养基重悬沉淀;取100μl菌液梯度稀释后涂布到16个2
×
ytag的固体培养板(90mm)测定库容,每个梯度两个平板,共做8个梯度平板,剩余菌液涂布到30个2
×
ytag固体培养板(150mm平板),25℃静置培养箱培养过夜;次日待培养板菌落长好后,39个150mm的平板中每个平板加入5ml的2
×
yt液体培养基清洗菌落收集清洗液;5000g、4℃、离心12min,加入含15%甘油的2
×
yt液体培养基90ml重悬沉淀,分管密封后即为制备的初级文库菌,命名为β毒素-vhh,即为产气荚膜梭菌β毒素纳米抗体文库,取100μl初级文库菌用于测定文库丰度,其余分装冻存于-70℃。
[0138]
文库库容的测定:100μl电转后的菌液梯度稀释,稀释度从10-1
~10-8
;每个稀释度各取100μl涂布2个2
×
ytag固体培养板,25℃培养过夜;次日对梯度板的菌落进行统计,计算库容。
[0139]
文库丰度的测定:取100μl初级文库菌液进行梯度稀释,稀释度从10-4
~10-10
;每个稀释度各取100μl菌液涂布2个2
×
ytag固体培养板,25℃培养过夜;次日对梯度板的菌落进行统计,计算文库丰度。
[0140]
文库vhh片段插入率及插入多样性的测定:待文库库容大小测定后,从测定库容的固体培养板中随机挑取50个单克隆菌落接种于1ml 2
×
ytag培养基,37℃振荡培养过夜;次日,对50个克隆进行菌液pcr鉴定,并将剩余的菌液送测序公司进行测序;分析pcr鉴定结果及测序结果,计算vhh片段的插入率及插入的多样性。
[0141]
实验结果:
[0142]
1.elisa法检测免疫效果
[0143]
空白孔和阴性孔中都添加10-1
稀释的血清,根据elisa数据结果发现:未免血清中已经含有产气荚膜梭菌β毒素的抗体,而免疫后的全血清中的阳性反应更加强烈,说明免疫效果很好,可以用于后续文库构建。实验结果如下表10。表10中所记载的数值为经elisa检测后在450nm波长下测定的吸光值,若该值大于pbs阴性对照的三倍,即判定为阳性。
[0144]
表10 elisa法检测免疫效果
[0145][0146]
2.淋巴细胞分离及vhh片段扩增
[0147]
细胞计数仪检测分离得到的羊驼免疫后淋巴细胞为3.6
×
107个,将淋巴细胞分成10管,每管添加1ml的trizol,按步骤提取细胞总rna,两步法反转录合成长片段cdna,call001和calloo2引物扩增vhh的leader区到fr2区域片段,凝胶电泳检测条带,由图1所示,一轮pcr引物可以扩增传统抗体(900bp)和重链抗体(700bp)的vhh片段。
[0148]
一轮pcr产物连接pmd19t载体后,挑选20个单克隆菌斑进行测序分析,vector nti软件(vector nti 11.5.1)对测序结果进行分析比对,设计二轮pcr引物vhh2-f和vhh2-r二次体外扩增β毒素-vhh片段。二轮pcr扩增体系同上一轮pcr扩增体系,琼脂糖凝胶电泳检测二轮pcr产物电泳图如图2所示:二轮pcr产物大小为400bp左右,条带单一,大小与预期相符。
[0149]
3.产气荚膜梭菌β毒素纳米抗体文库构建
[0150]
梯度稀释法检测产气荚膜梭菌β毒素纳米抗体文库纳米抗体文库库容:10-5
稀释平板上有11个单克隆菌落,11
÷
(100
×
10-5
)
×
30
×
103=3.3
×
108个(图3),文库的丰度为25
÷
(100
×
10-7
)
×
215
×
103=5.375
×
10
11
个/ml(图4)。52个菌液pcr样品中仅有2个样品片段长度与vhh片段不符(图5),52个测序样品只有2个克隆测序结果不合格,并非vhh片段,软件分析50个样品序列的相似性发现有4个插入片段相同,测序合格的样品序列。
[0151]
ncbi分析发现其都是vhh序列,因此可计算文库vhh片段的插入率为96%,序列的多样性为92%。软件分析50个样品序列对应的氨基酸序列,分析其结构,可见产气荚膜梭菌β毒素纳米抗体文库分为分区明显的恒定区及可变区域,分析结果如图6所示。
[0152]
以上均说明产气荚膜梭菌β毒素纳米抗体文库是一个特性很好的免疫文库,适合用于特异性纳米抗体的筛选。
[0153]
实施例2
[0154]
将实施例1制备的产气荚膜梭菌β毒素纳米抗体文库进行第一轮淘洗,得到β毒素-vhh1,分装冻存于-70℃。
[0155]
淘洗时用50mm碳酸钠/碳酸氢钠缓冲液作为包被缓冲液,包被浓度20μg/ml,包被体积2ml,以产气荚膜梭菌β毒素蛋白包被免疫管。
[0156]
淘洗方法如下:
[0157]
(1)将500μl实施例1制备的产气荚膜梭菌β毒素纳米抗体文库接种于100ml 2
×
ytag培养基,37℃200rmp振荡培养1小时至od600为0.4;
[0158]
2)加入km13辅助噬菌体,100ml菌液加100μlkm13辅助噬菌体,37℃静置感染30分钟,而后振荡培养30分钟;
[0159]
3)4000
×
g离心10分钟,去除培养基上清,用100ml 2
×
ytak培养基重悬菌体沉淀,30℃200rmp振荡培养过夜;
[0160]
4)次日上午11000
×
g,4℃离心过夜培养菌液10分钟,将上清转至新的离心瓶并加入20ml peg/nacl溶液,混匀冰浴70分钟;
[0161]
5)11000
×
g,4℃离心30分钟,弃上清,而后再次离心2分钟,彻底吸尽上清;
[0162]
6)使用2.6ml pbs缓冲液重悬沉淀,而后将其分装于2个1.5ml离心管中,11600
×
g离心10分钟;
[0163]
7)回收上清,命名为zj-β毒素-vhh1,取100μl待用于滴度测定,剩余同1.6ml mpbs溶液混合,室温共孵育1h,得到混合液(mpbs溶液处理过的β毒素-vhh1),待用。
[0164]
包被蛋白处理:
[0165]
(1)包被蛋白次日,将免疫管内的液体倒出,使用pbs缓冲液洗管3次。
[0166]
(2)在每管中加满mpbs,室温封闭2h后使用pbs缓冲液洗管3次。
[0167]
(3)在免疫管中加入2ml上述步骤(7)得到的混合液,室温孵育2h后使用pbst溶液洗管10次,而后用pbs缓冲液洗管10次。
[0168]
(4)在每管中加入2ml 100mm tea溶液,室温轻摇15min洗脱结合的噬菌体,而后加入2ml tris-hcl溶液中和。
[0169]
(5)将洗脱的噬菌体(命名为xt-β毒素-vhh1)转至50ml离心管,并加入16ml od600为0.4的tg1菌液,37℃水浴30分钟,使洗脱的噬菌体感染tg1菌液。(并在免疫管内加入4ml的od600为0.4的tg1菌液进行感染,最后合并,总共24ml的体积)
[0170]
(6)取100μl菌液待用于滴度测定,剩余菌液于4000g离心10min。
[0171]
(7)使用1ml 2
×
yt培养基重悬菌体沉淀,将重悬后的菌液涂布于5个2
×
ytag固体培养板(150mm平板),置于30℃孵箱培养过夜。
[0172]
(8)次日用2
×
yt培养基收集平板上长出的菌落,加入60%的甘油至终浓度为15%,其即为一级文库菌,命名为β毒素-vhh1,分装冻存于-70℃。
[0173]
测定拯救噬菌体滴度:zj-β毒素-vhh1进行梯度稀释,稀释度从10-7
~10-13
;每个稀释度取10μl噬菌体感染190μl od600为0.4的tg1菌液;每个稀释度取100μl菌液涂布2
×
ytag固体培养板,置于30℃培养箱培养过夜;对测定板上的菌落计数,计算zj-β毒素-vhh1滴度。
[0174]
测定洗脱噬菌体滴度:将xt-β毒素-vhh1进行梯度稀释,稀释度从10-1
~10-5
;每个
稀释度取100μl菌液涂布2
×
ytag固体培养板,置于30℃培养箱培养过夜;对测定板上的菌落计数,计算xt-β毒素-vhh1滴度;进而计算第一轮淘洗的输入输出比i/o。
[0175]
在一轮淘洗的基础上,依次进行二至四轮淘洗:产气荚膜梭菌β毒素蛋白包被浓度分别为10μg/ml、5μg/ml、5μg/ml;拯救噬菌体滴度测定稀释度分别为10-7
~10-12
、10-8
~10-11
、10-8
~10-11
;洗脱噬菌体滴度测定稀释度分别为10-1
~10-6
、10-1
~10-6
、10-1
~10-6
;洗脱的噬菌体用tris-hcl溶液(1m,ph值为7.4)中和后,取200μl噬菌体感染800μl od600为0.4的tg1菌液(取100μl进行梯度稀释,剩余的进行保菌),而后做10-3
~10-6
共4个稀释度,每个稀释度涂布3个2
×
ytag固体培养板(150mm平板),每板100μl菌液,置于30℃培养过夜;对培养板菌落计数,计算滴度,并将培养板标记为平板,置于4℃冰箱待用。
[0176]
特异性纳米抗体的筛选:
[0177]
单克隆噬菌体上清的制备:从平板各挑取192个单克隆菌株共接种2块96孔深孔培养板,每孔中均含200μl 2
×
ytag培养基,培养板分别标记为e-1、e-2,于30℃振荡培养。8h后,从每孔中吸取20μl菌液接种于180μl 2
×
ytag培养基,于37℃振荡培养,原平板的剩余菌液中则加入60μl 60%的甘油至终浓度为15%,冻存于-80℃。转接平板振荡培养1h后,在每孔中加入20μl km13(60μl km13+12ml 2
×
ytag)辅助噬菌体,37℃静置感染30min,而后37℃振荡培养40min。1800
×
g离心深孔板10min,弃上清并在每孔中加入400μl 2
×
ytak培养基重悬沉淀,30℃振荡培养过夜。次日,最大转速2020xg离心20分钟,从各孔中吸250μl噬菌体上清转移至新的深孔板中,并在每孔中加入250μl封闭液(含3%bsa的pbs缓冲溶液)常温共孵育1小时,待用于间接elisa检测。
[0178]
特异性单克隆噬菌体的鉴定:通过间接elisa试验检测噬菌体上清同产气荚膜梭菌β毒素蛋白的反应性,具体方法如下:使用产气荚膜梭菌β毒素蛋白,包被96孔酶标板,包被浓度为2μg/ml,每孔100μl,置于4℃过夜。次日弃孔内包被液体,在每孔中加入100μl封闭液于37℃封闭1h。弃孔内封闭液,在每孔分别中加入100μl封闭液处理过的四轮筛选得到的噬菌体上清作为一抗,37℃孵育1h。用pbst洗液洗板12次。在每孔中加入100μl二抗(hrp-m13 antibody,稀释度1:10000),37℃孵育1h。用pbst洗液洗板12次。在每孔中加入100μl显色底物,避光反应5-15min,而后在每孔中加入50μl终止液终止反应。将96孔酶标板置于读板机上读取od450吸收值。对elisa结果进行分析并确定阳性孔号。
[0179]
通过间接elisa方法检测192个单克隆对应的噬菌体上清同产气荚膜梭菌β毒素蛋白的反应性,根据间接elisa试验的结果挑选出了20个单克隆,这些单克隆均同产气荚膜梭菌β毒素蛋白有较好的反应性且同bsa蛋白的反应值较弱。将20个单克隆的培养菌液送测序公司测序。
[0180]
产气荚膜梭菌β毒素纳米抗体活性和亲和性
[0181]
原核表达重组质粒的构建:将上述测序结果正确的克隆株的甘油菌接种5ml 2
×
ytag培养基培养,并利用质粒小量提取试剂盒提取质粒作为原核表达的模板质粒。之后设计用于原核表达的引物,并在引物的5’端和3'端分别引入bamhⅰ和sali酶切位点。利用设计的引物扩增纳米抗体vhh序列,并通过上述酶切位点将其连接入pet28a原核表达载体,构建纳米抗体原核表达重组质粒以进行纳米抗体的产气荚膜梭菌β毒素特异性鉴定。
[0182]
原核表达的引物:
[0183]
(seq id no.3)f:cgggatcc gagtctggaggaggcttggt;
[0184]
(seq id no.4)r:gcgtcgac tgaggagacgatgacctcgg。
[0185]
筛选步骤如下
[0186]
将重组质粒和pet28a空载转化入bl21(de3)菌株并获得相应的纳米抗体表达菌株。而后对纳米抗体进行诱导表达,具体方法为:
[0187]
将转化后涂板后的菌液进行过夜培养,次日挑取培养板上的单克隆菌落过夜培养。将次日培养的菌液进行保菌。
[0188]
(吸取10μl甘油菌接种于5ml kan抗性的lb培养基,37℃振荡培养过夜;)
[0189]
第二天吸取50μl菌液接种5ml kan抗性的lb培养基,各接种2管,37℃振荡培养至od600为0.6;
[0190]
在其中1管菌液中加入iptg诱导(终浓度0.8mm),另1管不加iptg做为未诱导对照,15℃振荡培养过夜;
[0191]
同时做bl21(de3)空菌株对照,空菌株对照培养使用无抗性的lb培养基。
[0192]
1.2.3.5纳米抗体的sds-page鉴定
[0193]
将对纳米抗体的表达进行sds-page鉴定,具体方法为:
[0194]
吸取1ml菌液于1.5ml离心管,13000rpm离心2min;
[0195]
弃上清,使用pbs缓冲液洗涤菌体沉淀2次;
[0196]
用20μl pbs缓冲液重悬菌体沉淀,而后加入5μl 5
×
蛋白上样缓冲液,并于沸水中煮样5分钟。用10%的聚丙烯酰胺凝胶对样品进行电泳。待电泳结束后,用考马斯亮蓝染液染胶1h,而后用脱色液进行脱色。
[0197]
具有抗产气荚膜梭菌β毒素中和活性的纳米抗体的筛选:分别将筛选出的nb.1、nb.2、nb.3、nb4、nb.5的纳米抗体对应甘油菌株接种于5ml kan抗性的lb培养基,37℃振荡培养10h后转接到500ml kan抗性的lb培养基中,37℃振荡培养至od600为0.6时加入iptg(终浓度0.8mm)诱导表达,15℃振荡培养过夜。次日,对上述3株纳米抗体进行纯化,结果如图7所示。
[0198]
产气荚膜梭菌β毒素纳米抗体的亲和性:用5μg/ml得产气荚膜梭菌β毒素包被elisa板;经bsa封闭后将纯化稀释后的产气荚膜梭菌β毒素纳米抗体作为一抗,分别梯度稀释到5μg/ml、2.5μg/ml、1.25μg/ml、0.625μg/ml、0.3125μg/ml,进行elisa鉴定。
[0199]
纯化产物的鉴定:经elisa鉴定,筛选出亲和性最好的产气荚膜梭菌β毒素纳米抗体,并对该抗体用western blotting法进行his标签鉴定:经sds-page电泳后,转到nc膜,直接用his二抗进行标记,经显影术显示抗体,如图8所示。
[0200]
纳米抗体的应用:以畜禽粪便作为抗原包被酶标板,以上述纯化得到的纳米抗体为一抗,his-hrp作为二抗进行标记显色,进行elisa检测,显示不同粪便中产气荚膜梭菌β毒素。
[0201]
结果:
[0202]
elisa筛选结果
[0203]
通过间接elisa方法检测192个单克隆对应的噬菌体上清同产气荚膜梭菌β毒素蛋白的反应性,根据间接elisa试验的结果挑选出了20个单克隆,这些单克隆均同产气荚膜梭菌β毒素蛋白有较好的反应性且同bsa蛋白的反应值较弱(表11)。表11中的数值为elisa后在450nm波长下测定的吸光值,若该值大于阴性对照的三倍,即判定为阳性。将20个单克隆
的培养菌液送测序公司测序。
[0204]
表11产气荚膜梭菌β毒素单克隆elisa筛选结果
[0205][0206][0207]
经elisa筛选后,选择阳性最强的三个克隆进行测序,经测序并预测的氨基酸序列为:
[0208]
nb.1(β毒素-vhh1)氨基酸序列:
[0209]
esggglvqtggslrlscvaslsggrvsvntiewhrqvpgkqrelvagitrsgtpnysefakgrftisre
nakntvylqmnnlkpddtavylcnvradtligstgaiehqywgqgtevivss
[0210]
nb.2(β毒素-vhh2)氨基酸序列:
[0211]
esggslvqtggslrlscvaslsggrvsvntiewhrqvpgkqrelvagitrsgtpnysefakgrftisrenakntvylqmnnlkpddtavylcnvradtligstgaiehqywgqgtdvtvss;
[0212]
nb.3(β毒素-vhh3)氨基酸序列:
[0213]
esggslvqpggslrlscvmhgippdvyavtwlrqapgqerediacisskdensrtnyadsakgrftvsrdntkatvfldmvdlksedtalyqratgpgltaacrgpasyfgpgtdvtvss
[0214]
nb.4(β毒素-vhh4)氨基酸序列:
[0215]
esggglvqpgaslrlscvgsghifglnamgwhrqapgkerelvaaissggstyyrdsvkgrftisrdnakntlslqmnslkpedaamyycaaglnsdypqywgqgtevtvss
[0216]
nb.5(β毒素-vhh5)氨基酸序列:
[0217]
esggglvqpgeslrlscaasgltlerftmawfrqisgkereivscvsnsedktyytdfvkgrftisrdnanhaaylqmndlapddsavyycaalpgrgfnfdsgfwcgassdydfwgqgthvivss
[0218]
产气荚膜梭菌β毒素纳米抗体亲和性检测:
[0219]
将上述三个克隆进行表达后,亲和性检测结果为:产气荚膜梭菌β毒素纳米抗体nb.1对产气荚膜梭菌β毒素蛋白的灵敏度为0.3125μg/ml;产气荚膜梭菌β毒素纳米抗体nb.2和nb.3对产气荚膜梭菌β毒素蛋白的灵敏度为0.625μg/ml;产气荚膜梭菌β毒素纳米抗体nb.4和nb.5对产气荚膜梭菌β毒素蛋白的灵敏度较弱,只有5μg/ml。本发明最终选择灵敏度最高的纳米抗体用于检测产气荚膜梭菌β毒素,能够提高与产气荚膜梭菌β毒素有关疾病的检出率。his标签检测:用westernblotting法对纯化的抗体进行his标签检测,结果出现his阳性印迹条带,且分子量大小约为13kda,符合纳米抗体大小。
[0220]
elisa检测羊和羊驼粪便结果:
[0221]
通过elisa检测,发现在30只待检测羊粪便中,有21只呈阳性;在待检测的7只羊驼粪便中,有2只呈阳性;以上结果说明,纯化得到的产气荚膜梭菌β毒素纳米抗体可用于粪便检测,检测灵敏度为1μg/ml(见表12)。表12中的数值为elisa后在450nm波长下测定的吸光值,若该值大于pbs阴性对照的三倍,即判定为阳性。阳性对照主要用于评价该项试验结果是否有效和试验结果的稳定性与可比性。在本试验中阳性对照有4个重复即可表明该试验结果有效,所以表12中阳性对照列表格只显示了四组数据。
[0222]
表12羊和羊驼粪便中产气荚膜梭菌β毒素检测结果
[0223]
[0224][0225]
由以上实施例可知,本发明提供的产气荚膜梭菌β毒素纳米抗体能够特异性结合产气荚膜梭菌β毒素蛋白,对该蛋白的灵敏度为0.3125μg/ml;能以elisa的方法检测羊和羊驼粪便中的灵敏度为1μg/ml。
[0226]
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1