一类桥连双苯并咪唑类盐及其制备方法和应用
1.本发明属于桥连双苯并咪唑盐制备领域,具体为一类桥连双苯并咪唑类盐及其制备方法和应用。
背景技术:
2.在电子工业发展的初期,半导体材料大多是无机材料,如硅(si)、锗(ge)、砷化镓(ga as)等,有机材料则常被用于绝缘、钝化、牺牲层及图案化材料。
3.传统观点认为,有机材料是以碳原子为基础的绝缘体,通常不具备光、电和磁等导体或半导体的性质。经过数年的发展,有机半导体材料已经在电致发光、光伏电池等领域得到了广泛和深入的应用。桥连双苯并咪唑类盐具有氧化还原性能,可以通过有机化学、光化学以及电化学等方法实现两步可逆的氧化还原反应,同时伴随着颜色的变化。涉及到电子转移的有机多级氧化还原系统,在有机材料用于功能染料、电子器件、光伏电池、数据存储和有机场效应晶体管等方面发挥了重要作用。
4.一般来说,这种氧化还原分子的结构特征是由两个端基x和一个π-体系键组成,通过电子的吸收和损失形成三种氧化还原态。虽然已有的分子显示了良好的氧化还原特性,但碳源性氧化还原分子在实际应用中的广泛用途仍有待开发。
技术实现要素:
5.针对现有技术中存在的问题,本发明提供了一类桥连双苯并咪唑类盐及其制备方法和应用,可在光催化领域和电致变色器件领域中应用,拓展了新型有机半导体材料在电致变色领域的应用。
6.本发明是通过以下技术方案来实现:
7.一类桥连双苯并咪唑类盐,所述双苯并咪唑类盐的结构式如下:
[0008][0009]
其中,ar
–
linker为如下基团中的一个:
[0010][0011]
一种所述的桥连双苯并咪唑类盐的制备方法,包括如下步骤:
[0012]
步骤1,将n1,n2–
二取代基苯
–
1,2
–
二胺和结构不同的二甲醛按(2.5~3):1的摩尔
比在冰醋酸的催化下进行反应,所述的二甲醛为对苯二甲醛、联苯二甲醛、三联苯
–
4,4
”–
二甲醛、噻诺[3,2
–
b]噻吩
–
2,5-二甲醛、9,10
–
蒽二甲醛或1,4
–
萘二甲醛,得到中间产物a;
[0013]
步骤2,将中间产物a和2
–
溴苯乙酮在有机溶剂中反应16~24h,中间产物a和2
–
溴苯乙酮的摩尔比为2.5:1,之后分离产物,得到中间产物b;
[0014]
步骤3,将中间产物b和三氟甲基磺酸甲酯在有机溶剂中于室温下进行反应,中间产物b和三氟甲基磺酸甲酯的摩尔比为2.5:1,之后分离产物,得到所述的桥连双苯并咪唑类盐。
[0015]
优选的,步骤1中冰醋酸和所述的二甲醛摩尔比为0.2。
[0016]
优选的,步骤1中n1,n2–
二取代基苯
–
1,2
–
二胺和结构不同的二甲醛在20~50℃下反应16~24h。
[0017]
优选的,步骤1先将n1,n2–
二取代基苯
–
1,2
–
二胺、结构不同的二甲醛和冰醋酸溶解在二氯甲烷中,之后再进行反应,分离反应液中的产物,得到中间产物a。
[0018]
优选的,步骤2和步骤3中所述的有机溶剂分别为四氢呋喃和二氯甲烷。
[0019]
优选的,步骤2的中间产物a和2
–
溴苯乙酮在20~50℃下进行反应,所得的反应物经柱状层析进行分离,得到中间产物b。
[0020]
优选的,步骤3的中间产物b和三氟甲基磺酸甲酯在室温下反应12~24h,所得的反应物经减压真空的方式进行分离,得到所述的桥连双苯并咪唑类盐。
[0021]
桥连双苯并咪唑类盐作为光催化剂的应用,所述的桥连双苯并咪唑类盐以摩尔比计,加入5%~20%的当量,在可见光诱导下,促进如下的交叉脱氢偶联反应构建碳
–
磷键:
[0022][0023]
桥连双苯并咪唑类盐在电致变色器件中的应用,将所述的桥连双苯并咪唑类盐溶解在n,n-二甲基甲酰胺中,之后填充在两块含有氧化铟锡涂层的玻璃中,得到所述的电致变色器件。
[0024]
与现有技术相比,本发明具有以下有益的技术效果:
[0025]
本发明的桥连双苯并咪唑类盐与普通咪唑盐相比,具有更刚性平面的桥连骨架、额外的氧化还原中心和更窄的homo-lumo能隙。良好的氧化还原性质使桥连双咪唑盐在溶液型电致变色器件中有更好的应用,将其溶解在n,n-二甲基甲酰胺中,之后填充在两块含有氧化铟锡涂层的玻璃中,施加不超过2v的外加电压,均有明显颜色变化,通过原位光谱电化学的手段监测器件在不同电压下的多种颜色转换过程,这一结果为开发柔性低压驱动的电致变色器件奠定了良好的基础。本发明基于对n-杂环卡宾配体的设计和对功能化的探索,以二氨基碳烯为端基的π-连接基团,得到了桥连双苯并咪唑盐ar(ipr)a
1-6
·
2otf-以及ar(me)a1·
2otf-,可成功地应用于电致变色和光催化领域。桥连双苯并咪唑类盐的颜色变化是源于分子间的电荷转移。对中性态桥连双苯并咪唑类盐施加一定的电压时,中性态桥连双苯并咪唑类盐会表现出一价阳离子态和二价阳离子态。
[0026]
本发明一类桥连双苯并咪唑类盐的制备方法,先由n1,n2–
二取代基苯
–
1,2
–
二胺与结构不同的二甲醛在冰醋酸的催化下进行反应,生成桥连双苯并咪唑,之后和溴苯乙酮反
应,可得到相应的溴阴离子桥连双苯并咪唑类盐,最后通过三氟甲基磺酸甲酯,将阴离子换成otf
–
得到目标产物。制备条件温和,操作简单。
[0027]
本发明的桥连双苯并咪唑类盐可作为光催化剂,在可见光诱导下,可促进n
–
苯基四氢异喹啉和二苯基氧化膦之间进行交叉脱氢偶联反应,形成碳磷(c-p)键。具体可在空气中,白光存在下,产率可达80~90%。
[0028]
本发明的桥连双苯并咪唑类盐溶解在dmf后的溶液可注入两片氧化铟锡(ito)涂层的玻璃中间,施加不超过2v的电压,可以观察到随着电压的增加,出现三种颜色变化,红色(-0.95v)、蓝紫色(-0.90v)和深蓝色(-0.85v),更重要的是撤去电压后又可逆地变为无色状态。由此可见,本发明的桥连双苯并咪唑类盐在电致变色领域有很大的应用潜力。
附图说明
[0029]
图1a是本发明实施例1得到的桥连双苯并咪唑类盐化合物的核磁共振氢谱图。
[0030]
图1b是本发明实施例2得到的桥连双苯并咪唑类盐化合物的核磁共振氢谱图。
[0031]
图1c是本发明实施例3得到的桥连双苯并咪唑类盐化合物的核磁共振氢谱图。
[0032]
图1d是本发明实施例4得到的桥连双苯并咪唑类盐化合物的核磁共振氢谱图。
[0033]
图1e是本发明实施例5得到的桥连双苯并咪唑类盐化合物的核磁共振氢谱图。
[0034]
图1f是本发明实施例6得到的桥连双苯并咪唑类盐化合物的核磁共振氢谱图。
[0035]
图1g是本发明实施例7得到的桥连双苯并咪唑类盐化合物的核磁共振氢谱图。
[0036]
图2a是本发明实施例1得到的桥连双苯并咪唑类盐化合物的循环伏安图。
[0037]
图2b是本发明实施例2得到的桥连双苯并咪唑类盐化合物的循环伏安图。
[0038]
图2c是本发明实施例3得到的桥连双苯并咪唑类盐化合物的循环伏安图。
[0039]
图2d是本发明实施例4得到的桥连双苯并咪唑类盐化合物的循环伏安图。
[0040]
图2e是本发明实施例5得到的桥连双苯并咪唑类盐化合物的循环伏安图。
[0041]
图2f是本发明实施例6得到的桥连双苯并咪唑类盐化合物的循环伏安图。
[0042]
图2g是本发明实施例7得到的桥连双苯并咪唑类盐化合物的循环伏安图。
[0043]
图3是本发明实施例1~实施例6得到的桥连双苯并咪唑类盐化合物1
–
6的紫外/可见吸收光谱图。
[0044]
图4a是本发明实施例1得到的桥连双苯并咪唑类盐化合物1制得的溶液型电致变色器件图。
[0045]
图4b是本发明实施例1得到的桥连双苯并咪唑类盐化合物1在dmf中的紫外可见光谱图。
[0046]
图5a是本发明实施例4得到的桥连双苯并咪唑类盐化合物4制得的溶液型电致变色器件图。
[0047]
图5b是本发明实施例4得到的桥连双苯并咪唑类盐化合物4在dmf中的紫外可见光谱图。
[0048]
图6a是本发明实施例6得到的桥连双苯并咪唑类盐化合物5制得的溶液型电致变色器件图。
[0049]
图6b是本发明实施例6得到的桥连双苯并咪唑类盐化合物5在dmf中的紫外可见光谱图。
[0050]
图7a是本发明实施例5得到的桥连双苯并咪唑类盐化合物6制得的溶液型电致变色器件图。
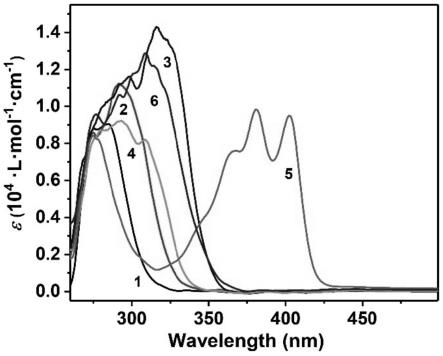
[0051]
图7b是本发明实施例5得到的桥连双苯并咪唑类盐化合物6在dmf中的紫外可见光谱图。
具体实施方式:
[0052]
为了使本技术领域的人员更好地理解本发明的技术方案,下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分的实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都应当属于本发明保护的范围。
[0053]
本发明的思路如下:
[0054]
先由n1,n2–
二取代基苯
–
1,2
–
二胺与结构不同的二甲醛(对苯二甲醛,联苯二甲醛,三联苯
–
4,4
”–
二甲醛,噻诺[3,2
–
b]噻吩
–
2,5-二甲醛,9,10
–
蒽二甲醛,1,4
–
萘二甲醛)反应,再加入溴代苯乙酮,得到阴离子是溴的桥连双苯并咪唑类盐(ara
·
2br-1-6),最后通过三氟甲基磺酸甲酯,将阴离子换成(三氟甲磺酸根)otf
–
(ara
1-6
·
2otf-1-6),得到目标产物。具体过程如下:
[0055][0056]
本发明以9,10
–
蒽二甲醛制备产物为代表,得到的桥连双苯并咪唑类盐的化学名称为2,2'
–
(蒽
–
9,10
–
二基)双(1,3
–
二异丙基
–
1h
–
苯并咪唑
–3–
鎓)三氟甲磺酸鎓盐。
[0057]
本发明制备桥连双苯并咪唑类盐的具体步骤如下:
[0058]
步骤1,先制备9,10
–
蒽二甲醛;
[0059]
n1,n2–
二取代基苯
–
1,2
–
二胺与结构不同的二甲醛的投料摩尔比是胺:醛=(2.5~3):1;
[0060]
步骤2,在二氯甲烷中搅拌,对应二甲醛的浓度为0.19m,使n1,n2–
二取代基苯
–
1,2
–
二胺与9,10
–
蒽二甲醛完全溶解,之后滴加0.2eq.作为催化剂的冰醋酸(即与对应二甲醛的摩尔比为0.2),继续搅拌,在20~50℃下反应16~24小时后,除去溶剂二氯甲烷;
[0061]
将得到的中间产物a溶于四氢呋喃中,使其浓度为0.19m,之后加入2
–
溴苯乙酮继续搅拌,溴代苯乙酮与中间产物a的投料摩尔比是溴代苯乙酮:中间产物a=2.5:1,反应时间为16~24小时,反应温度为室温~50℃,经柱状层析分离,得到中间产物b;
[0062]
将所得中间产物b溶于二氯甲烷(0.1m)中,滴加三氟甲基磺酸甲酯,二者投料摩尔比为1:2.5,常温搅拌12~24小时后除去溶剂二氯甲烷,得到目标产物。
[0063]
结构如下:
[0064][0065]
其中,ar
–
linker具有π
–
π共轭结构,有优异的光物理性质和电化学性质的应用。此类化合物可用作光催化剂,在下述反应中构建碳
–
磷键。加入双苯并咪唑类盐5mol%~20mol%当量,作为光催化剂,在可见光诱导下,促进交叉脱氢偶联反应构建碳
–
磷键;
[0066][0067]
桥连双苯并咪唑类盐具有优异的电化学性质,可用于电致变色,通过原位光谱电化学的手段监测器件在不同电压下出现多种颜色,通过改变电压使其颜色可逆转换。
[0068]
ar
–
linker作为桥连结构的π
–
π共轭结构,为苯基,联苯基,三联苯基,萘基,蒽基和噻吩并噻吩,结构如下:
[0069][0070]
上述合成方法中没有用到任何金属催化剂。
[0071]
一、桥连双苯并咪唑类盐合成的具体实施方法:
[0072]
实施例1
[0073]
向n1,n2–
二异丙基苯
–
1,2
–
二胺(768mg,4.00mmol)的二氯甲烷(3ml)溶液中加入对苯二甲醛(1mmol,134mg)。然后加入0.35ml冰醋酸,将所得的混合溶液在50℃下以100rpm的速率搅拌,反应16小时,减压真空除去溶剂,得到1,4
–
双(1,3
–
二异丙基
–
2,3
–
二氢
–
1h
–
苯并咪唑)
–2–
基)苯的粗产物。
[0074]
向1,4
–
双(1,3
–
二异丙基
–
2,3
–
二氢
–
1h
–
苯并咪唑
–2–
基)苯粗产物的四氢呋喃溶液中(6ml)加入2
–
溴苯乙酮(2.1mmol,418mg),在室温搅拌20小时。除去滤液,并将残余物通过硅胶色谱法纯化(甲醇/二氯甲烷的体积比=1:10),得到ar(ipr)a1·
2br-,(0.7mmol,334mg)。
[0075]
室温下将ar(ipr)a1·
2br-和三氟甲基磺酸甲酯(0.95mmol,156mg)混合在干燥的二氯甲烷(3ml)中,并将反应混合物在室温搅拌12小时,减压真空除去溶剂,得到呈白色固
体的ar(ipr)a1·
2otf-,结构式如下:
[0076][0077]
按常规方法对目标产物进行了核磁共振氢谱(图1a)、质谱分析,其结果如下:
[0078]
氢谱:1h nmr(400mhz,dmso-d6):δ8.41-8.39(m,4h,ch-ar),8.29(s,4h,ch-ar),7.78-7.75(m,4h,ch-ar),4.60-4.53(m,4h,ch-ipr),1.68(d,j=6.8hz,24h,ch3-ipr).
[0079]
质谱:hrms(esi
+
):m/zcalcd for c
32h40n42+
[m/2]
+
240.1621,found 240.1613.
[0080]
因此,本实施例得到了目标产物。
[0081]
实施例2
[0082]
向n1,n2–
二异丙基苯
–
1,2
–
二胺(768mg,4.00mmol)的二氯甲烷(3ml)溶液中加入联苯二甲醛(1mmol,210.2mg)。然后加入0.35ml冰醋酸,将所得的混合溶液在50℃下以100rpm的速率搅拌,反应16小时,减压真空除去溶剂,得到4,4'-双(1,3-二异丙基-2,3-二氢-1h-苯并咪唑-2-基)-1,1'-联苯的粗产物。
[0083]
向4,4'-双(1,3-二异丙基-2,3-二氢-1h-苯并咪唑-2-基)-1,1'-联苯粗产物的四氢呋喃溶液中(6ml)加入2
–
溴苯乙酮(2.1mmol,418mg),在室温搅拌20小时。除去滤液,并将残余物通过硅胶色谱法纯化(甲醇/二氯甲烷的体积比=1:10),得到ar(ipr)a2·
2br-(0.7mmol,502.3mg)。
[0084]
室温下将ar(ipr)a2·
2br-和三氟甲基磺酸甲酯(0.95mmol,156mg)混合在干燥的二氯甲烷(3ml)中,并将反应混合物在室温搅拌12小时,减压真空除去溶剂,得到呈白色固体的ar(ipr)a2·
2otf-,结构式如下:
[0085][0086]
按常规方法对目标产物进行了核磁共振氢谱(图1b)、质谱分析,其结果如下:
[0087]
氢谱:1h nmr(400mhz,dmso).δ8.28(dd,j=6.4,3.2hz,4h),8.17(d,j=8.0hz,4h),7.99(d,j=8.0hz,4h),7.66(dd,j=6.0,3.2hz,4h),4.42(dt,j=14.0,7.2hz,4h),1.57(d,j=6.9hz,24h).
[0088]
质谱:hrms(esi
+
):m/z calcd for c
38h44n42+
[m/2]
+
278.1778,found 278.1779.
[0089]
因此,本实施例得到了目标产物。
[0090]
实施例3
[0091]
向n1,n2–
二异丙基苯
–
1,2
–
二胺(768mg,4.00mmol)的二氯甲烷(3ml)溶液中加入三联苯
–
4,4
”–
二甲醛(1mmol,286.3mg)。然后加入0.35ml冰醋酸,将所得的混合溶液在50℃下以100rpm的速率搅拌,反应16小时,减压真空除去溶剂,得到4,4
”–
双(1,3
–
二异丙基
–
2,3
–
二氢
–
1h
–
苯并咪唑
–2–
基)
–
1,1':4',1
”–
三联苯的粗产物。
[0092]
向4,4
”–
双(1,3
–
二异丙基
–
2,3
–
二氢
–
1h
–
苯并咪唑
–2–
基)
–
1,1':4',1
”–
三联苯粗产物的四氢呋喃溶液中(6ml)加入2
–
溴苯乙酮(2.1mmol,418mg),在室温搅拌20小时。除去滤液,并将残余物通过硅胶色谱法纯化(甲醇/二氯甲烷的体积比=1:10),得到ar(ipr)a3·
2br-(0.7mmol,554.9mg)。
[0093]
室温下将ar(ipr)a3·
2br-和三氟甲基磺酸甲酯(0.95mmol,156mg)混合在干燥的二氯甲烷(3ml)中,并将反应混合物在室温搅拌12小时,减压真空除去溶剂,得到呈白色固体的ar(ipr)a3·
2otf-,结构式如下:
[0094][0095]
按常规方法对目标产物进行了核磁共振氢谱(图1c)、质谱分析,其结果如下:
[0096]
氢谱:1h nmr(400mhz,dmso-d6).δ8.37-8.35(m,4h,ch-ar),8.21-8.19(d,4h,ch-ar),8.05-8.01(m,8h,ch-ar)7.74-7.72(m,4h,ch-ar),4.55-4.48(m,4h,ch-ipr),1.66(d,j=7.2hz,24h,ch3-ipr).
[0097]
质谱:hrms(esi
+
):m/zcalcd for c
44h48n42+
[m/2]
+
316.1934,found 316.1921.
[0098]
因此,本实施例得到了目标产物。
[0099]
实施例4
[0100]
向n1,n2–
二异丙基苯
–
1,2
–
二胺(768mg,4.00mmol)的二氯甲烷(3ml)溶液中加入1,4
–
萘二甲醛(1mmol,184.2mg)。然后加入0.35ml冰醋酸,将所得的混合溶液在50℃下以100rpm的速率搅拌,反应16小时,减压真空除去溶剂,得到1,4
–
双(1,3
–
二异丙基
–
2,3
–
二氢
–
1h
–
苯并咪唑
–2–
基)萘的粗产物。
[0101]
向的1,4
–
双(1,3
–
二异丙基
–
2,3
–
二氢
–
1h
–
苯并咪唑
–2–
基)萘粗产物的四氢呋喃溶液中(6ml)加入2
–
溴苯乙酮(2.1mmol,418mg),在室温搅拌20小时。除去滤液,并将残余物通过硅胶色谱法纯化(甲醇/二氯甲烷的体积比=1:10),得到ar(ipr)a4·
2br-,为白色固体(0.7mmol,483.4mg)。
[0102]
室温下将ar(ipr)a4·
2br-和三氟甲基磺酸甲酯(0.95mmol,156mg)混合在干燥的二氯甲烷(3ml)中,并将反应混合物在室温搅拌12小时,减压真空除去溶剂,得到ar(ipr)a4·
2otf-,结构式如下:
[0103][0104]
按常规方法对目标产物进行了核磁共振氢谱(图1d)、质谱分析,其结果如下:
[0105]
氢谱:1h nmr(400mhz,dmso-d6).δ8.37-8.34(m,6h,ch-ar),7.76-7.72(m,4h,ch-ar),4.77-4.70(m,4h,ch-ipr),1.71(d,j=6.8hz,24h,ch3-ipr).
[0106]
质谱:hrms(esi+):m/z calcd for c
36h42n42+
[m/2]
+
265.1699,found 265.1690.
[0107]
因此,本实施例得到了目标产物。
[0108]
实施例5
[0109]
向n1,n2–
二异丙基苯
–
1,2
–
二胺(768mg,4.00mmol)的二氯甲烷(3ml)溶液中加入9,10
–
蒽二甲醛(1mmol,234.3mg)。然后加入0.35ml冰醋酸,将所得的混合溶液在50℃下以100rpm的速率搅拌,反应16小时,减压真空除去溶剂,得到9,10
–
双(1,3
–
二异丙基
–
2,3
–
二氢
–
1h
–
苯并咪唑
–2–
基)蒽的粗产物。
[0110]
向的9,10
–
双(1,3
–
二异丙基
–
2,3
–
二氢
–
1h
–
苯并咪唑
–2–
基)蒽粗产物的四氢呋喃溶液中(6ml)加入2
–
溴苯乙酮(2.1mmol,418mg),在室温搅拌20小时。除去滤液,并将残余物通过硅胶色谱法纯化(甲醇/二氯甲烷的体积比=1:10),得到ar(ipr)a5·
2br-(0.7mmol,518.4mg)。
[0111]
室温下将ar(ipr)a5·
2br-和三氟甲基磺酸甲酯(0.95mmol,156mg)混合在干燥的二氯甲烷(3ml)中,并将反应混合物在室温搅拌12小时,减压真空除去溶剂,得到呈淡黄色固体的ar(ipr)a5·
2otf-,结构式如下:
[0112][0113]
按常规方法对目标产物进行了核磁共振氢谱(图1e)、质谱分析,其结果如下:
[0114]
氢谱:1h nmr(400mhz,dmso).δ8.49-8.47(m,4h,ch-ar),7.91-7.89(m,4h,ch-ar),7.82-7.79(m,8h,ch-ar)7.73-7.70(m,4h,ch-ar),4.30-4.23(m,4h,ch-ipr),1.50(d,j=6.8hz,24h,ch3-ipr).
[0115]
质谱:hrms(esi
+
):m/zcalcd for c
40h44n42+
[m/2]
+
290.1778,found 290.1768.
[0116]
因此,本实施例得到了目标产物。
[0117]
实施例6
[0118]
向n1,n2–
二异丙基苯
–
1,2
–
二胺(768mg,4.00mmol)的二氯甲烷(3ml)溶液中加入噻诺[3,2
–
b]噻吩
–
2,5
–
二甲醛(1mmol,196.2mg)。然后加入0.35ml冰醋酸,将所得的混合溶液在50℃下以100rpm的速率搅拌,反应16小时,减压真空除去溶剂,得到2,5
–
双(1,3
–
二异丙基
–
2,3
–
二氢
–
1h
–
苯并咪唑
–2–
基)噻吩并[3,2
–
b]噻吩的粗产品。
[0119]
向的2,5
–
双(1,3
–
二异丙基
–
2,3
–
二氢
–
1h
–
苯并咪唑
–2–
基)噻吩并[3,2
–
b]噻吩粗产品的四氢呋喃溶液中(6ml)加入2
–
溴苯乙酮(2.1mmol,418mg),在室温搅拌20小时。除去滤液,并将残余物通过硅胶色谱法纯化(甲醇/二氯甲烷的体积比=1:10),得到ar(ipr)a6·
2br-(0.7mmol,491.8mg)。
[0120]
室温下将ar(ipr)a6·
2br-和三氟甲基磺酸甲酯(0.95mmol,156mg)混合在干燥的二氯甲烷(3ml)中,并将反应混合物在室温搅拌12小时,减压真空除去溶剂,得到ar(ipr)a6·
2otf-,结构式如下:
[0121][0122]
按常规方法对目标产物进行了核磁共振氢谱(图1f)、质谱分析,其结果如下:
[0123]
氢谱:1h nmr(400mhz,dmso-d6).δ8.37-8.34(m,6h,ch-ar),7.76-7.72(m,4h,ch-ar),4.77-4.70(m,4h,ch-ipr),1.71(d,j=6.8hz,24h,ch3-ipr).
[0124]
质谱:hrms(esi
+
):m/z calcd for c
32h38
n4s
22+
[m/2]
+
271.1263,found 271.1254.
[0125]
因此,本实施例得到了目标产物。
[0126]
实施例7
[0127]
向n1,n2–
二甲基基苯
–
1,2
–
二胺(544mg,4.00mmol)的二氯甲烷(3ml)溶液中加入对苯二甲醛(1mmol,134mg)。然后加入0.35ml冰醋酸,将所得的混合溶液在50℃下以100rpm的速率搅拌,反应16小时,减压真空除去溶剂,得到1,4
–
双(1,3
–
二甲基
–
2,3
–
二氢
–
1h
–
苯并咪唑)
–2–
基)苯的粗产物。
[0128]
向1,4
–
双(1,3
–
二甲基
–
2,3
–
二氢
–
1h
–
苯并咪唑)
–2–
基)苯的粗产物的四氢呋喃溶液中(6ml)加入2
–
溴苯乙酮(2.1mmol,418mg),在室温搅拌20小时。除去滤液,并将残余物通过硅胶色谱法纯化(甲醇/二氯甲烷的体积比=1:10),得到ar(me)a1·
2br-(0.7mmol,369.8mg)。
[0129]
室温下将ar(me)a1·
2br-和三氟甲基磺酸甲酯(0.95mmol,156mg)混合在干燥的二氯甲烷(3ml)中,并将反应混合物在室温搅拌12小时,减压真空除去溶剂,得到ar(me)a1·
2otf-,结构式如下:
[0130][0131]
按常规方法对目标产物进行了核磁共振氢谱(图1g)、质谱分析,其结果如下:
[0132]
氢谱:1h nmr(400mhz,dmso-d6)δ8.28(s,4h,ch-ar),8.20(d,j=8.2hz 4h,ch-ar),7.82(d,j=8.1hz,4h,ch-ar),4.01(s,12h,ch3).
[0133]
质谱:hrms(esi
+
):m/z calcd for c
24h24n42+
[m/2]
+
184.0995,found 184.0989.
[0134]
因此,本实施例得到了目标产物。
[0135]
二、本发明所述桥连双苯并咪唑类盐的应用,包括以下内容:
[0136]
1、基于上述桥连双苯并咪唑类盐在可见光催化中的应用,具体如下:
[0137]
实施例5得到的桥连双苯并咪唑类盐作为催化剂,以5mol%的当量加入n-苯基四氢异喹啉和二苯基氧化膦之间形成碳磷(c-p)键的交叉脱氢偶联的反应中,反应时长12h,在可见光(白光)引发下,促进交叉脱氢偶联反应的进行,形成碳磷(c
–
p)键,得到产率为93%的偶联产物。
[0138]
2、基于上述桥连双苯并咪唑类盐在电致变色器件方面的应用,具体如下:
[0139]
上述实施例1-6得到的桥连双苯并咪唑类盐溶于溶剂dmf(0.01m)中,将溶液注入两块含有氧化铟锡(ito)涂层的玻璃中间,其中一块含有氧化铟锡(ito)涂层的玻璃中开始有凹槽,施加0~2v的电压,优选为0.7v、0.9v观察颜色的变化及对应的电势。
[0140]
下面做进一步详细描述:
[0141]
将桥连双苯并咪唑类盐化合物1-6制备可见光致变色器件:用双面胶将两片ito玻璃贴合成约0.5mm厚空腔的器件基底,将6种桥连双苯并咪唑类盐化合物分别溶解在dmf中,加入制备好的器件空腔中,密封制得可见光致变色器件。
[0142]
实施例2和实施例3的可见光致变色器件在外部高电压(1.2v)下会从原来的无色状态变为黑色,并且一旦去除电位就不能恢复,这是由于桥连双苯并咪唑类盐化合物2,3不稳定易分解导致的。
[0143]
本发明对上述实施例制得的7种桥连双苯并咪唑类盐化合物进行相关测试,其测试结果参见图2~图7:
[0144]
图2a、图2b、图2c、图2d、图2e、图2f和图2g所展示的分别是桥连双苯并咪唑类盐化合物1~7的循环伏安图,表明这些化合物都具有两组可逆的氧化还原中心,其中化合物5表现出优异的氧化还原性质。
[0145]
图3所展示的是桥连双苯并咪唑类盐化合物1~6的紫外/可见吸收光谱,该光谱谱图表明由于共轭体系的扩大导致本发明所述桥连双苯并咪唑类盐化合物的最大吸收波长红移。
[0146]
参见图4a,桥连双苯并咪唑类盐化合物1制得的溶液型电致变色器件,在施加0.95v电压时变为粉色,图4b中吸收光谱显示500-600间的吸收逐渐增强。
[0147]
参见图5a,桥连双苯并咪唑类盐化合物4制得的溶液型电致变色器件,在施加0.85v电压时变为紫色,图5b中吸收光谱显示500-600间的吸收逐渐增强。
[0148]
参见图6a和图6b中,桥连双苯并咪唑类盐化合物5制得的溶液型电致变色器件,在施加0.7v电压时变为蓝色,吸收光谱显示500-600间的吸收逐渐增强,当施加0.9v电压时,颜色变为红色,600-700间的吸收逐渐增强,可见桥连双苯并咪唑类盐化合物5为首个具有两种电致变色过程的咪唑盐。
[0149]
参见图7a,桥连双苯并咪唑类盐化合物6制得的溶液型电致变色器件,在施加0.85v电压时变为深蓝色,图7b中吸收光谱显示500-700间的吸收逐渐增强。
[0150]
以上内容仅为说明本发明的技术思想,不能以此限定本发明的保护范围,凡是按照本发明提出的技术思想,在技术方案基础上所做的任何改动,均落入本发明权利要求书的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1