一种整合表达生产红景天苷的重组大肠杆菌及其应用
1.本发明涉及一种整合表达生产红景天苷的重组大肠杆菌及其应用,属于生物技术领域。
背景技术:
2.红景天苷(salidroside)是红景天中的主要药用成分。临床研究结果表明,红景天苷不但有抗缺氧、抗寒冷、抗疲劳、抗微波辐射、抗病毒、抗肿瘤等明显功能,而且还具有增强注意力、提高工作效率、延缓机体衰老、防止老年疾病等功效,尤其在军事医学、航天医学、运动医学和保健医学等方面具有十分重要的应用价值,是一种极具开发前景的环境适应药物,近年来备受关注。红景天苷无毒无害,可直接作为天然保健食品或药品,也可添加到焙烤制品、肉制品、面制品、乳制品、果冻、饮料等几乎大部分食品中。红景天苷在化妆品、饲料添加剂方面也有很好的市场前景。因此,红景天苷市场潜力不断扩大,具有很好的市场前景。
3.目前红景天苷的生产方法是从红景天植物中提取获得。红景天属于高寒多年生草本植物,天然资源有限,并且尚未实现大面积的人工栽培。红景天中红景天苷含量很低,随着开采力度不断加大,导致红景天属植物逐渐枯竭,同时提取法工艺复杂、成本高,并且产物中含有有毒物质百脉根苷。化学合成的方法有文献报道,但未实现工业化。化学合成方法大都存在需要进行选择性保护、活化或使用昂贵的金属催化剂等缺点,往往残留少量或痕量的其它有毒化学品,具有不安全性,生产成本仍然较高。
4.目前,已有以大肠杆菌为宿主实现以葡萄糖为原料利用微生物高效发酵合成红景天苷,并且已初步建立了提取工艺。与化学合成法相比,微生物合成红景天苷具有反应条件温和、目标产物可以发酵大量生产的特点,红景天苷主要存在于发酵液中,提取工艺简单;与传统生产方法相比,降低了生产成本和环境污染,实现可持续发展,具有很好的应用前景。但是,现有技术当中红景天苷的产量还有很大的提升空间,而且抗生素和诱导剂的滥用造成了环境和安全问题。
5.虽然,公开号为cn 113897325 a的中国发明专利申请文本中公开了一种生产红景天苷的重组大肠杆菌,但是,该重组基因工程菌在发酵制备红景天苷时,需要添加抗生素,使其得到的产物不能直接利用,并且由于质粒传代过程中容易丢失,从而导致基因工程菌的产率不稳定,因此,开发价格低廉、环境友好、安全高效的生物法合成高产红景天苷成为必然的趋势。
技术实现要素:
6.本发明提供了一种价格低廉、环境友好、安全高效的生物法合成高产红景天苷的方法。
7.本发明在现有技术的基础上,提供了一种生物合成红景天苷的方法。利用现代生物基因工程的技术,在已有酪醇高产菌株的基础上构建了一株高产红景天苷的方法,且发
酵不需要诱导剂和抗生素。
8.为了解决上述问题,本发明提供了一种重组大肠杆菌,所述重组大肠杆菌以大肠杆菌cctcc no:m2019390为宿主细胞,在该菌株基因组上的整合表达了来源于拟南芥的糖基转移酶基因ugt85a1(genbank登录号:at1g22400),所述糖基转移酶基因ugt85a1在该基因组上的整合位点为ptsg、usha、poxb、yjip-yjir、nupg-spec、thrw-ykfn、ykgh-beta、iley-ygaq中的一个或多个。
9.在本发明的一种实施方式中,所述整合位点ptsg在ncbi上的genebank登录号为eck1087。
10.在本发明的一种实施方式中,所述整合位点usha在ncbi上的genebank登录号为eck0474。
11.在本发明的一种实施方式中,所述整合位点poxb在ncbi上的genebank登录号为eck0862。
12.在本发明的一种实施方式中,其余五个位点均为两个基因之间的间隔区域:所述整合位点yjip-yjir的两个基因在ncbi上的genebank登录号分别为ecs_5301和eck4331;所述整合位点nupg-spec的两个基因在ncbi上的genebank登录号分别为eck2959和eck2960;所述整合位点thrw-ykfn的两个基因在ncbi上的genebank登录号分别为eck0245和eck4458;所述整合位点ykgh-beta的两个基因在ncbi上的genebank登录号为eck0308和eck0309;所述整合位点iley-ygaq在ncbi上的genebank登录号为eck2648和eck2649。
13.在本发明的一种实施方式中,所述重组大肠杆菌以大肠杆菌cctcc no:m2019390为宿主细胞,在该菌株基因组的八个位点ptsg、usha、poxb、yjip-yjir、nupg-spec、thrw-ykfn、ykgh-beta、iley-ygaq分别整合表达一个来源于拟南芥的糖基转移酶基因ugt85a1。
14.在本发明的一种实施方式中,所述大肠杆菌cctcc no:m2019390记载于公开号为cn110452865a的中国专利申请文本中,在本发明中将其命名为e.coli ymgr5a。
15.在本发明的一种实施方式中,所述糖基转移酶基因ugt85a1的氨基酸序列如seq id no 1所示。
16.在本发明的一种实施方式中,所述糖基转移酶基因ugt85a1的核苷酸序列如seq id no 2所示。
17.本发明还提供了一种构建上述重组大肠杆菌的方法,所述方法包括以下步骤:
18.(1)重组质粒pkk223-3-ugt85a1的构建:将糖基转移酶基因ugt85a1,通过酶切连接插入到质粒pkk223-3中,获得重组质粒pkk223-3-ugt85a1;
19.(2)线性整合表达盒的构建:设计引物,采用pcr扩增得到片段up、down、tac-ugt85a1-rrnb terminater,并将上述片段采用融合pcr进行连接,获得线性整合表达盒;
20.(3)采用crispr-cas9的方法,先将pcas质粒采用电转化的方法转化进入大肠杆菌cctcc no:m2019390感受态细胞中,然后将带有sgrna的质粒sg-ptarget及线性整合表达盒电转化进入大肠杆菌cctcc no:m2019390感受态细胞中;挑取转化子进行菌落pcr验证,将验证正确的菌株,利用iptg进行诱导,消除sg-ptarget质粒及42℃消除pcas质粒,构建得到重组大肠杆菌。
21.(4)按照(1)~(3)构建方法依次在大肠杆菌cctcc no:m2019390菌株基因组的ptsg、usha、poxb、yjip-yjir、nupg-spec、thrw-ykfn、ykgh-beta、iley-ygaq八个位点分别
整合表达一个来源于拟南芥的糖基转移酶基因ugt85a1,该对大肠杆菌命名为e.coli 5a8s。
22.在本发明的一种实施方式中,步骤(1)中,ugt85a1基因经金唯智公司合成获得,并插入到质粒pkk223-3的ecor i与hind iii位点,获得重组质粒pkk223-3-ugt85a1。
23.在本发明的一种实施方式中,步骤(2)中,ptsg∷ugt85a1、usha∷ugt85a1、poxb∷ugt85a1、yjip-yjir∷ugt85a1、nupg-spec∷ugt85a1、thrw-ykfn∷ugt85a1、ykgh-beta∷ugt85a1、iley-ygaq∷ugt85a1线性整合表达盒的构建:根据不同位点设计相应的引物,采用pcr扩增得到相应位点的线性整合片段up、down、tac-ugt85a1-rrnb terminater,并上述片段采用融合pcr进行连接,获得不同位点的线性整合表达盒。
24.本发明还提供了一种提高重组大肠杆菌发酵制备红景天苷的方法,所述方法为,在大肠杆菌cctcc no:m2019390基因组上整合表达了来源于拟南芥的糖基转移酶基因ugt85a1,所述糖基转移酶基因ugt85a1在该基因组上的整合位点为ptsg、usha、poxb、yjip-yjir、nupg-spec、thrw-ykfn、ykgh-beta、iley-ygaq中的一个或多个。
25.在本发明的一种实施方式中,所述糖基转移酶基因ugt85a1的氨基酸序列如seq id no 1所示。
26.在本发明的一种实施方式中,所述糖基转移酶基因ugt85a1的核苷酸序列如seq id no 2所示。
27.本发明还提供了一种生产红景天苷的方法,所述方法为采用上述重组大肠杆菌生产红景天苷。
28.在本发明的一种实施方式中,所述方法为,将所述重组大肠杆菌接种至种子培养基中培养,制备得到种子液;将种子液接种至发酵培养基中,发酵制备红景天苷。
29.在本发明的一种实施方式中,将所述重组大肠杆菌接种至lb固体培养基上培养,得到单菌落,挑取单菌落接种于lb液体培养基中,于37℃、200r/min条件下培养12h,制备得到种子液。
30.在本发明的一种实施方式中,将述重组大肠杆菌接种至lb固体培养基上划线培养,挑取单菌落接种于装有20ml lb液体培养基的100ml锥形瓶中,于37℃、200r/min进行活化培养12h,制备得到种子液。
31.在本发明的一种实施方式中,将制备得到的种子液接种至lb液体培养基中,在37℃、200r/min条件下培养10h后收集菌体;将收集得到的菌体接种至m9y液体培养基中进行发酵培养,制备得到红景天苷。
32.在本发明的一种实施方式中,所述种子液的接种为单菌落。
33.在本发明的一种实施方式中,摇瓶发酵条件:按1%(v/v)接种量接入到装有50ml lb液体培养基的250ml锥形瓶中,于37℃、200r/min培养10h后收集菌体,并用生理盐水清洗菌体一次。转入装有50ml m9y液体培养基的250ml锥形瓶中,于30℃、200r/min培养48h。
34.本发明还提供了上述重组大肠杆菌在制备红景天苷及含有红景天苷的产品中的应用。
35.有益效果
36.(1)采用本发明提供的重组大肠杆菌是在大肠杆菌e.coli ymgr5a基因组八个位点ptsg、usha、poxb、yjip-yjir、nupg-spec、thrw-ykfn、ykgh-beta、iley-ygaq各整合表达
一个来源于拟南芥的糖基转移酶基因ugt85a1得到一株多拷贝ugt85a1基因的菌株,能够实现将葡萄糖转化为红景天苷,并且在发酵过程中无需添加任何的诱导剂及抗生素;因此本发明的原材料廉价易得,无危害人体健康的添加剂、重金属和抗生素,为后期的产物提纯奠定良好的基础,更能够达到商业应用的要求。
37.(2)采用本发明提供的重组大肠杆菌e.coli 5a8s是通过糖基转移酶基因ugt85a1整合表达到基因组上获得的,相较于质粒表达的菌株,它具有良好的遗传稳定性和生长状况。
38.(3)采用本发明提供的重组大肠杆菌e.coli 5a8s在以葡萄糖为底物的发酵培养基中摇瓶发酵生产红景天苷的产量为2.42g/l,摇瓶发酵水平的产量高于目前绝大多数研究团队的结果。
附图说明
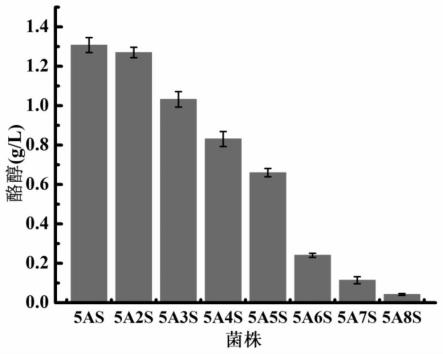
39.图1:本发明所构建的八株重组大肠杆菌(e.coli 5as、5a2s、5a3s、5a4s、5a5s、5a6s、5a7s、5a8s)发酵的酪醇产量结果。
40.图2:本发明所构建的八株重组大肠杆菌(e.coli 5as、5a2s、5a3s、5a4s、5a5s、5a6s、5a7s、5a8s)发酵的红景天苷产量结果。
41.图3:本发明所构建的重组大肠杆菌e.coli 5a8s发酵罐发酵od
600
、残糖和红景天苷产量结果。
42.图4:本发明所构建的重组大肠杆菌e.coli 5a8s多次传代的菌株(3次)摇瓶发酵后不同时间点的生物量(od
600
)。
43.图5:本发明所构建的重组大肠杆菌e.coli 5a8s多次传代的菌株(3次)摇瓶发酵后不同时间点的红景天苷产量结果。
44.图6:本发明所构建的重组大肠杆菌e.coli 5ab摇瓶发酵后不同时间点的生物量(od
600
)。
45.图7:本发明所构建的重组大肠杆菌e.coli 5ab摇瓶发酵后不同时间点的红景天苷和酪醇产量结果。
46.图8:本发明所构建的八株重组大肠杆菌(e.coli 5as、5a2s、5a3s、5a4s、5a5s、5a6s、5a7s、5a8s)主要代谢途径改造。
具体实施方式
47.下述实施例中所涉及的培养基如下:
48.lb培养基配方(g/l):酵母粉5,蛋白胨10,nacl 10,固体培养基另加1.5%-2.0%琼脂粉。
49.m9y培养基配方(g/l):na2hpo4·
12h2o 17.1,kh2po
4 3,nacl 0.5,nh4cl 1,葡萄糖20,酵母粉0.25,补加终浓度mgso
4 5mmol
·
l-1
。
50.下述实施例中所涉及的检测方法如下:
51.酪醇及红景天苷检测方法,采用高效液相色谱(hplc)检测。色谱检测条件具体如下:agela innoval c18色谱柱(4.6
×
250mm,孔径为5μm);流动相为80%的0.1%甲酸水溶液,20%的甲醇;流速0.7ml/min;进样量10μl;紫外检测器,检测波长280nm;柱温为25℃。
52.下述实施例中所涉及的引物如表1所示
53.表1引物序列
54.55.[0056][0057]
实施例1:重组大肠杆菌e.coli 5as的构建
[0058]
具体步骤如下:
[0059]
1、pkk223-3-ugt85a1质粒的构建
[0060]
(1)糖基转移酶ugt85a1基因(核苷酸序列如seq id no 2所示)经金唯智公司合成获得;
[0061]
(2)将ecor i与hind iii酶切位点设计在引物ugt85a1-l和ugt85a1-r中,将目的基因片段糖基转移酶ugt85a1基因与pkk223-3质粒进行两位点的酶切纯化后,用solution i连接酶进行连接,经过化学转化法转入e.coli jm109中,涂布于含有浓度为50μg/l的氨苄青霉素抗性的lb固体培养基平板上,于37℃培养箱培养12h左右,将长出的单菌落提质粒进
行酶切验证,将正确的菌株进行培养后重组质粒pkk223-3-ugt85a1的提取。
[0062]
2、ptsg∷ugt85a1线性整合表达盒的构建
[0063]
根据ptsg以及重组质粒pkk223-ugt85a1的基因序列设计引物ptsg-up-l、ptsg-up-r,ptsg-ugt85a1-l、ptsg-ugt85a1-r,ptsg-down-l、ptsg-down-r以大肠杆菌e.coli mg1655基因组以及质粒pkk223-ugt85a1为模板分别扩增,得到片段ptsg-up、ptsg-down、tac-ugt85a1-rrnb terminater;以ptsg-up-l,ptsg-down-r为引物,采用融合pcr的方法将三个片段进行连接,获得ptsg∷ugt85a1线性整合表达盒。
[0064]
3、重组大肠杆菌e.coli 5as的构建
[0065]
(1)利用crispr-cas9的方法,将e.coli ymgr5a(大肠杆菌cctcc no:m2019390)制备成电转感受态,将携带转运蛋白基因cas9的质粒pcas电转化进入感受态细胞中,涂布于含有浓度为50μg/l的卡那霉素抗性的lb固体培养基平板上,长出的单菌落即为ymgr5a/pcas。
[0066]
(2)设计ptsg位点sgrna引物sg-ptsg、ptarget-r,以ptargetf质粒为模板进行pcr,将获得的基因片段进行dpn i酶切纯化,采用solution i酶将片段连接后采用化学转化法转入e.coli jm109感受态细胞中,涂布于含有浓度为50μg/l的壮观霉素的lb固体培养基平板上,将长出的单菌落采用引物testsg-ptsg、ptarget-r进行菌落pcr验证,验证正确的菌株即为sg-ptarget质粒。
[0067]
(3)将sg-ptarget质粒及上述的ptsg∷ugt85a1的整合表达盒共同电转化进入ymgr5a/pcas感受态细胞中,涂布于含有浓度均为50μg/l的卡那霉素和壮观霉素双抗性的lb固体培养基平板上,于30℃培养24h,将长出的转化子用引物ptsg-jl、ptsg-jr进行菌落pcr验证,菌株ymgr5a/pcas作为对照。
[0068]
(4)挑取菌落pcr验证正确的菌株利用iptg进行诱导后,涂布于含有浓度为50μg/l的卡那霉素单抗性的lb固体培养基平板上,于30℃培养。挑取生长的单菌落进行点板验证,仅在卡那霉素单抗性的平板上生长而在步骤(3)的双抗性平板上不生长的菌落视为消除sg-ptarget质粒的菌株。将该菌株于无抗性的lb固体培养基的平板上划线,于42℃下培养至长出单菌落,同样进行点板验证,仅在无抗性的平板上生长而在上述卡那霉素抗性平板上不生长的菌落视为消除pcas质粒的菌株,即为无抗性的稳定菌株e.coli 5as。
[0069]
实施例2:重组大肠杆菌e.coli 5a2s~e.coli 5a8s的构建
[0070]
本发明所构建的八株重组大肠杆菌(e.coli 5as、5a2s、5a3s、5a4s、5a5s、5a6s、5a7s、5a8s)主要代谢途径改造如图8所示,构建的具体步骤如下:
[0071]
(1)具体实施方式同实施例1,区别在于,将整合位点调整为usha,引物如表1所示,构建得到usha∷ugt85a1整合表达盒,调整实施例1的步骤3中的感受态为菌株e.coli 5as感受态细胞,按照实施例1的方法及表1所示的引物,制备得到大肠杆菌e.coli 5a2s。
[0072]
(2)具体实施方式同实施例1,区别在于,将整合位点调整为poxb,引物如表1所示,构建得到poxb∷ugt85a1整合表达盒,调整实施例1的步骤3中的感受态为菌株e.coli 5a2s感受态细胞,按照实施例1的方法及表1所示的引物,制备得到重组大肠杆菌e.coli 5a3s。
[0073]
(3)具体实施方式同实施例1,区别在于,将整合位点调整为yjip-yjir,引物如表1所示,构建得到yjip-yjir∷ugt85a1整合表达盒,调整实施例1的步骤3中的感受态为菌株e.coli 5a3s感受态细胞,按照实施例1的方法及表1所示的引物,制备获得重组大肠杆菌
e.coli 5a4s。
[0074]
(4)具体实施方式同实施例1,区别在于,将整合位点调整为nupg-spec,引物如表1所示,构建得到nupg-spec∷ugt85a1整合表达盒,调整实施例1的步骤3中的感受态为菌株e.coli 5a4s感受态细胞,按照实施例1的方法及表1所示的引物,制备得到重组大肠杆菌e.coli 5a5s。
[0075]
(5)具体实施方式同实施例1,区别在于,将整合位点调整为thrw-ykfn,引物如表1所示,构建得到thrw-ykfn∷ugt85a1整合表达盒,调整实施例1的步骤3中的感受态为菌株e.coli 5a5s感受态细胞,按照实施例1的方法及表1所示的引物,制备得到重组大肠杆菌e.coli 5a6s。
[0076]
(6)具体实施方式同实施例1,区别在于,将整合位点调整为ykgh-beta,引物如表1所示,构建得到ykgh-beta∷ugt85a1整合表达盒,调整实施例1的步骤3中的感受态为菌株e.coli 5a6s感受态细胞,按照实施例1的方法及表1所示的引物,制备得到重组大肠杆菌e.coli 5a7s。
[0077]
(7)具体实施方式同实施例1,区别在于,将整合位点调整为iley-ygaq,引物如表1所示,构建得到iley-ygaq∷ugt85a1整合表达盒,调整实施例1的步骤3中的感受态为菌株e.coli 5a7s感受态细胞,按照实施例1的方法及表1所示的引物,制备得到重组大肠杆菌e.coli 5a8s。
[0078]
实施例3:摇瓶发酵生产红景天苷
[0079]
具体步骤如下:
[0080]
(1)分别将实施例1和2制备得到的重组大肠杆菌菌株在lb固体培养基上划线培养,得到单菌落,挑取单菌落接种于装有20ml lb液体培养基的100ml锥形瓶中,于37℃、200r/min培养12h;分别制备得到种子液。
[0081]
(2)分别将步骤(1)制备得到的种子液按1%(v/v)的接种量接入到装有50ml lb液体培养基的250ml锥形瓶中,于37℃、200r/min培养10h后,分别收集菌体;
[0082]
(3)分别将步骤(2)得到的菌体采用生理盐水清洗菌体一次后,转入装有50ml m9y液体培养基的250ml锥形瓶中,于30℃、200r/min培养60h。
[0083]
每隔12h取样检测产物含量,结果如表2~3和图1~2所示。其中,酪醇60h产量结果如图1、表2所示,红景天苷60h产量结果如图2、表3所示。
[0084]
表2:反应60h时酪醇的产量
[0085][0086]
表3:反应60h时红景天苷的产量
[0087][0088]
结果显示,大肠杆菌菌株e.coli 5as~5a8s随糖基转移酶基因ugt85a1拷贝数的逐步增加,中间产物酪醇的产量逐渐降低,而红景天苷产量不断升高。最终菌株e.coli 5a8s摇瓶发酵的红景天苷产量达到2.4260g/l。
[0089]
实施例4:菌株e.coli 5a8s在5l发酵罐条件下发酵生产红景天苷
[0090]
具体步骤如下:
[0091]
(1)将菌株e.coli 5a8s在lb固体培养基上划线培养,得到单菌落,挑取单菌落接种于装有20ml lb液体培养基的100ml锥形瓶中,于37℃、200r/min培养12h,制备得到种子液;
[0092]
(2)将步骤(1)制备得到的种子液按1%(v/v)的接种量接入到装有50ml lb液体培养基的250ml锥形瓶中,于37℃、200r/min培养4~5h,得到发酵液;
[0093]
(3)将步骤(2)制备得到的发酵液按照10%(v/v)的接种量转入装有2.25l m9y液体培养基的5l发酵罐中,通气量1vvm,控制溶氧在40%左右,于30℃培养至120h;
[0094]
发酵过程中根据菌体生长情况和耗糖情况适量补加葡萄糖和酵母粉。每隔4h左右取样检测od
600
、残糖和红景天苷产量,结果如图3和表4所示。
[0095]
表4:不同的反应时间od
600
、残糖和红景天苷产量
[0096]
时间(h)红景天苷(g/l)od
600
残糖(g/l)40.00401.092280.00843.3620120.09407.9216160.220713.1610200.404322.285.2240.645624.221.5281.0686128.41.7321.1639301.2361.689033.522.5402.255135.522.8442.629736.163.3483.004935.242.2523.530336.082563.784837.283604.153237.843644.412536.162.6684.668536.081.4724.750436.81764.853436.83.1805.290437.63845.501738.41.8885.831035.523.5926.113534.213.4966.412835.522.61006.883134.242.91047.213536.042.5
1087.628733.461.41128.023133.641.21168.646733.760.81209.347935.720.8
[0097]
结果显示:最终菌株e.coli 5a8s在5l发酵罐放大生产的红景天苷产量达到9.3479g/l。
[0098]
实施例5:重组大肠杆菌e.coli 5a8s传代稳定性
[0099]
具体步骤如下:
[0100]
(1)将大肠杆菌菌株5a8s在无抗生素的lb固体培养基上划线培养,得到单菌落。挑取平板上的单菌落在新的lb固体培养基上划线培养,再次得到单菌落。以此方式,得到该菌株三代单菌落,分别命名为e.coli 5a8s-1、e.coli 5a8s-2、e.coli 5a8s-3。
[0101]
(2)将三代单菌落分别接种于装有20ml lb液体培养基的100ml锥形瓶中,于37℃、200r/min培养12h,制备得到种子液;
[0102]
(3)将步骤(2)制备得到的种子液按1%(v/v)的接种量分别接入到瓶装有50ml lb液体培养基的250ml锥形瓶中,于37℃、200r/min培养10h后收集菌体;
[0103]
(4)将步骤(3)得到的菌体采用生理盐水清洗菌体一次后,转入装有50ml m9y液体培养基的250ml锥形瓶中,于30℃、200r/min培养60h。
[0104]
每隔12h取样检测产物含量,结果如表5~6和图4~5所示。其中,生物量od
600
结果如图4、表5所示,红景天苷60h产量结果如图5、表6所示。
[0105]
表5:不同反应时间的生物量
[0106][0107]
表6:不同菌株发酵制备得到的红景天苷的产量
[0108]
菌株5a8s-15a8s-25a8s-3红景天苷(g/l)2.352.422.47
[0109]
结果显示:重组大肠杆菌菌株e.coli 5a8s传代三次后,在生长状况和产物红景天苷的产量两方面均表现出良好的稳定性,表明了整合表达的菌株相较于质粒表达菌株具有良好的遗传稳定性。
[0110]
对比例1:不同整合位点对重组大肠杆菌发酵制备红景天苷的影响
[0111]
具体步骤如下:
[0112]
(1)具体实施方式同实施例1,区别在于,将整合位点调整为ydib,引物如表1所示,构建得到ydib∷ugt85a1整合表达盒,感受态为菌株e.coli ymgr5a感受态细胞,按照实施例1的方法及表1所示的引物,制备得到大肠杆菌e.coli 5ab。
[0113]
(2)将步骤1制备得到的重组大肠杆菌菌株在lb固体培养基上划线培养,得到单菌落,挑取单菌落接种于装有20ml lb液体培养基的100ml锥形瓶中,于37℃、200r/min培养12h,制备得到种子液。
[0114]
(3)将步骤(2)制备得到的种子液按1%(v/v)的接种量接入到装有50ml lb液体培养基的250ml锥形瓶中,于37℃、200r/min培养10h后收集菌体;
[0115]
(4)将步骤(3)得到的菌体采用生理盐水清洗菌体一次后,转入装有50ml m9y液体培养基的250ml锥形瓶中,于30℃、200r/min培养60h。
[0116]
每隔12h取样检测产物含量和生物量od
600
,结果如表7~8和图6~7所示。其中,生物量od
600
结果如图6~7所示(图中5a代表e.coli ymgr5a,5ab代表e.coli 5ab),红景天苷和酪醇产量结果如图6~7所示。
[0117]
表7:不同反应时间的菌株的生物量
[0118][0119]
表8:不同反应时间菌株e.coli 5ab发酵的红景天苷产量和酪醇产量
[0120][0121]
结果显示:在e.coli ymgr5a的ydib位点整合一个糖基转移酶基因ugt85a1,得到重组菌株e.coli 5ab。
[0122]
虽然重组菌株的生长和原始菌株基本无差异,但是发酵液并没有检测到红景天苷,表明不同的整合位点对于基因的表达是有差异的。
[0123]
虽然本发明已以较佳实施例公开如上,但其并非用以限定本发明,任何熟悉此技术的人,在不脱离本发明的精神和范围内,都可做各种的改动与修饰,因此本发明的保护范围应该以权利要求书所界定的为准。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1