一种用于检测PRRSV抗原的纳米抗体对、试剂盒及其应用
一种用于检测prrsv抗原的纳米抗体对、试剂盒及其应用
技术领域
1.本发明属于生物技术检测技术领域,具体涉及一种用于检测prrsv抗原的纳米抗体对、试剂盒及其应用。
背景技术:
2.猪繁殖与呼吸综合征(porcine reproductive and respiratory syndrome,prrs)是由prrs病毒(porcine reproductive and respiratory syndrome virus,prrsv)引起的病毒性传染病,该病在临床上主要引起母猪流产以及各年龄段猪的呼吸系统疾病,给养猪业造成不可挽回的经济损失。
3.目前,prrsv主要通过q-pcr检测猪血液病毒感染情况及通过elisa试剂盒检测抗体水平来判断猪是否感染病毒。q-pcr方法需要离心机及荧光定量pcr仪提取病毒rna并进行扩增,需要专业人员进行操作;该方法还存在因引物、反应体系或敏感性问题,导致漏检或假阳性结果。但是,关于纳米抗体在prrsv病毒抗原诊断方法中的应用未见相关研究报道,也未有商品化产品。因此,筛选与病毒保守的n蛋白反应的纳米抗体,并应用纳米抗体和hrp偶联纳米抗体建立双抗体夹心elisa检测方法,无需抗体标记和使用二抗,简化了生产工艺并降低了生产成本,广谱性、高灵敏度高、特异性检测血液及组织液病毒,具有非常广阔的应用前景。
技术实现要素:
4.本发明的目的是为了提供一种特异性检测prrs病毒的纳米抗体对。
5.本发明提供了一种用于检测prrsv抗原的纳米抗体对所述抗体对为nb12纳米抗体和 n35纳米抗体,所述nb12纳米抗体的可变区的cdr-1的氨基酸序列如seq id no.7所示,所述nb12纳米抗体的可变区的cdr-2的氨基酸序列如seq id no.8所示,所述nb12纳米抗体的可变区的cdr-3的氨基酸序列如seq id no.9所示;
6.所述n35纳米抗体的可变区的cd-1的氨基酸序列如seq id no.10所示,所述n35纳米抗体的可变区的cdr-2的氨基酸序列如seq id no.11所示,所述n35纳米抗体的可变区的cdr-3的氨基酸序列如seq id no.12所示。
7.进一步地限定,所述nb12纳米抗体的氨基酸序列如seq id no.15所示。
8.进一步地限定,所述n35纳米抗体的氨基酸序列如seq id no.16所示。
9.进一步地限定,所述nb12纳米抗体的核苷酸序列如seq id no.13所示。
10.进一步地限定,所述n35纳米抗体的核苷酸如seq id no.14所示。
11.进一步地限定,nb12纳米抗体与辣根过氧化物酶组成融合蛋白。
12.本发明提供了上述的纳米抗体对在制备用于检测prrsv抗原的试剂盒的应用。
13.进一步地限定,所述试剂盒的检测方法包括酶联免疫法、化学发光检测法、蛋白质印迹检测法或者免疫组化法。
14.有益效果:本发明提供了一种纳米抗体对:nb12纳米抗体和n35纳米抗体,能特异
性识别prrsv抗原,最低检测1.0
×
103tcid
50
/100μl病毒,nb12纳米抗体与hrp融合蛋白表达的制备方法,用于检测prrsv抗原,不需要标记和使用hrp标记的二抗,可以简化生产工艺,降低生产成本,具有很好的市场转化前景。
附图说明
15.图1为纳米抗体氨基酸序列比对结果;
16.图2为elisa方法检测表达纳米抗体与prrsvn蛋白elisa反应,其中,横坐标是组别,纵坐标是od
450nm
。
17.图3为验证prrsv-n-nb12-hrp融合蛋白的表达分泌以及亲和力和特异性结果图。
18.图4为纳米抗体对敏感性检测结果,其中,横坐标是组别,纵坐标是od
450nm
。
19.图5为纳米抗体对广谱性检测结果,其中,横坐标是组别,纵坐标是od
450nm
。
20.图6为纳米抗体对特异性检测结果,其中,横坐标是组别,纵坐标是od
450nm
。
21.图7为载体连接示意图。
具体实施方式
22.prrsvhun4株记载来源于陶冶,王刚,刘永刚,等.高致病性prrsvhun4株不同代次病毒对仔猪胸腺损伤的研究[j].中国预防兽医学报,2014,36(5):4.
[0023]
prrsv-1株、prrsv-2的lineage1、3、5、8分支毒(l1、l3、l5和l8)为本实验室分离培养,经测序鉴定后分类,记载在下述的文章中:
[0024]
1.twonovelrecombinantporcinereproductiveandrespiratorysyndromevirusesbelongtosublineage3.5originatingfromsublineage3.2..wen-lizhang,hong-liangzhang,huxu,yan-dongtang,chao-liangleng,jin-meipeng,qianwang,tong-qingan,xue-huicai,jing-huifan,zhi-juntian,transboundemergdis.2019,66(6):2592-2600.
[0025]
2.molecularepidemiologyofprrsv:aphylogeneticperspective.mangshia,tommytsan-yuklama,chung-chauhona,raymondkin-heihuia,kays.faabergb,trevorwennblomc,michaelp.murtaughd,tomaszstadejeke,frederickchi-chingleunga,virusresearch,20101547
–
17.
[0026]
实施例1.纳米抗体的制备与筛选的方法
[0027]
1.prrsvhun4株的增殖与纯化
[0028]
(1)当marc-145细胞长至单层且铺满培养瓶底部时,将104tcid
50
prrsvhun4株病毒液(-80℃冻存)接种到15ml含2%fbsdmem培养液的t175细胞瓶中,37℃,5%co2培养箱中孵育2h。
[0029]
(2)孵育完成后,补加2%fbsdmem至50ml,轻轻混匀后继续培养,待细胞出现明显的cpe时收取病毒上清液。
[0030]
(3)收取的病毒上清液进行粗离,4000rpm,4℃,离心30min,去除病毒上清液中细胞碎片。
[0031]
(4)用0.45μm滤膜对病毒液进行过滤,过滤后进行超速离心,40000rpm,4℃,离心4h。离心后沉淀物用6mlpbs重悬,4℃保存备用。
[0032]
(5)层析柱用灭菌水洗涤干净,将凝胶层析柱填料sepharose6ff缓慢注入,注意防止气泡产生。
[0033]
(6)用2个柱体积的pbs洗涤,流速1ml/min。
[0034]
(7)当填料sepharose6ff平衡完成后,将浓缩后的病毒样品缓慢注射到上样阀中。
[0035]
(8)用1ml/min的流速洗脱蛋白,连续监测洗脱过程中od
280nm
值。
[0036]
(9)当od
280nm
值上升时开始收取样品,下降到10mau以下且不再发生变化时,终止收取样品。
[0037]
(10)利用凝胶层析方法纯化上述获得的样品得到纯化后prrsv。
[0038]
2.纯化后prrsv的鉴定
[0039]
(1)取步骤1纯化后prrsv加入loadingbuffe后在沸水中煮样10min。
[0040]
(2)各取30μl上样于凝胶孔中,电泳完成后,用考马斯亮蓝染液染色,检测蛋白条带。
[0041]
(3)或当电泳完成后,将蛋白转移至pvdf膜上。
[0042]
(4)用5%脱脂乳室温封闭2h。
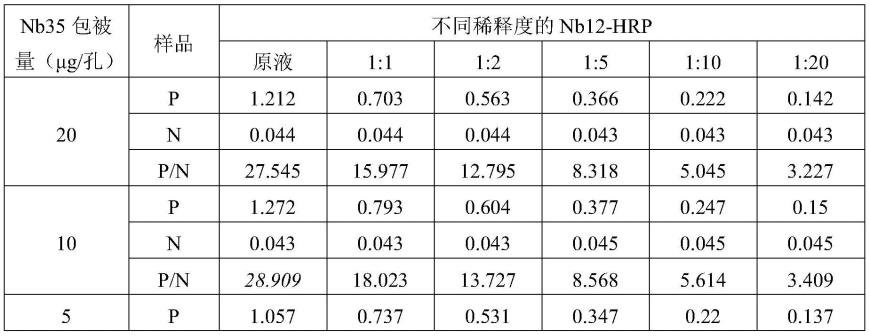
[0043]
(5)tbst洗3次,n蛋白的单克隆抗体(anti-prrsv-nprotein抗体上海钰博生物科技有限公司,货号yb
‑‑
23941r)的细胞培养上清室温孵育1h。
[0044]
(6)tbst洗3次,加入dylight800标记的山羊抗鼠igg(1:10000稀释),室温作用1h。
[0045]
(7)tbst洗涤后,通过扫膜成像系统观察,收集样品为prrsv病毒颗粒。
[0046]
3.羊驼免疫
[0047]
将凝胶层析方法纯化的prrsv免疫羊驼,每两周1次,共免疫6次,第一次使用弗氏完全佐剂,其余,佐剂与病毒1:1混合乳化5次全部使用弗式不全佐剂。
[0048]
4.噬菌体文库的构建
[0049]
(1)第6次免疫后4天,采血,分离羊驼外周血淋巴细胞并提取总rna,利用的试剂盒为plusminikit;
[0050]
(2)将rna反转录成cdna,以此为模板进行巢式pcr扩增,引物序列表2所示,并通过psti、noti酶切位点连入pcantab5e噬菌体展示载体获得连接产物。
[0051]
表2vhh片段扩增及检测引物
[0052]
名称引物序列(5
’‑3’
)call001gtggtcctggctgctctwctacaa(seq id no.1)call002ggtacgtgctgttgaactgttcc(seq id no.2)alpaca for pst icaggtgcagctgcagatggccgaggtgcagctggtgsag(seq id no.3)vhh for pst icaggtgcagctgcagatggagtcdgggggagrct(seq id no.4)vhh revctagtgcggccgctgaggagacggtgaccygggt(seq id no.5)p5e-foraatacgcaaaccgcctctcc(seq id no.6)
[0053]
注:s代表g或c;r代表a或g。w代表a/t,d代表a或g或t,y代表c或t
[0054]
(3)将连接产物电转至tg1感受态细胞中,活化后涂于lb-amp琼脂平板,37℃过夜培养,收集菌苔,制成甘油菌在-80℃保存。
[0055]
(4)利用引物p5e-for,vhh rev,通过菌落pcr检测所建文库的阳性率,并测定库容大小及多样性,检测结果阳性率为96%,库容量为1.7
×
108克隆。
[0056]
5.抗prrsv n蛋白的特异性纳米抗体的筛选
[0057]
m13ko7辅助噬菌体感染纳米抗体文库,拯救得到羊驼纳米抗体基因噬菌体文库。利用噬菌体展示技术淘选的prrsv特异性纳米抗体。
[0058]
5.1重组噬菌体文库的拯救
[0059]
(1)取100μl制备的重组噬菌体文库,加入100ml 2
×
yt/amp-glu培养基,培养至od
600nm
值为0.6~0.8。
[0060]
(2)加入100μl m13k07(滴度:1.5
×
10
13
pfu/ml),约20个moi的感染复数,37℃静置感染30min。
[0061]
(3)3800g室温离心10min,沉淀加入到200ml 2
×
yt/amp-kan培养基,37℃200rpm 过夜培养。
[0062]
(4)3800g,4℃离心30min,将上清分装到5个50ml的离心管中,40ml/管,再加入冰上提前预冷的peg/nacl溶液,10ml/管,混匀后冰上静置沉淀2h。
[0063]
(5)3800g,4℃离心30min,各用2ml pbs重悬沉淀。
[0064]
(6)12000g,4℃离心20min,上清分装到10个1.5ml的ep管中,1ml/管,各加入250μl预冷的peg/nacl溶液,混匀后冰上静置2h。
[0065]
(7)12000g,4℃离心10min,所得沉淀用1ml pbs重悬,4℃保存备用
[0066]
5.2抗原包被:将纯化的prrsv每孔4μg包于96孔酶标板,同时选取一个孔直接加入 pbs作为无抗原对照孔,4℃包被过夜;用2.5%脱脂奶粉封闭
[0067]
5.3淘选富集
[0068]
elisa板中加入噬菌体37℃孵育1h;用pbst洗涤5次,洗去不结合的噬菌体,加入新鲜配制的0.1m三乙胺100μl每孔,洗脱与prrsv特异性结合的噬菌体,即p0代洗脱产物。将洗脱产物感染处于对数期生长的大肠杆菌tg1,生产并纯化噬菌体用于下一轮的筛选。经过3轮筛选,富集阳性克隆。
[0069]
6.抗prrsv n蛋白的特异性纳米抗体的鉴定
[0070]
随机挑取96个单菌落进行测序,比对纳米抗体cdr3高变区,发现共筛选出13株抗 prrsv的特异性纳米抗体,结果如图1所示。对13株纳米抗体诱导表达的粗提物进行间接 elisa鉴定其与prrsv反应性,具体步骤如下:
[0071]
挑取阳性单菌落,37℃,200rpm过夜培养;分别取上述菌液10μl转接到24孔板的 tb培养基(1ml/孔),培养至对数期。;每孔加入终浓度为1mm iptg,37℃200rpm诱导10h;3800g,4℃离心10min,菌体置于-20℃冷冻30min;待恢复室温后,加入pbs重悬菌体,500μl/孔,250rpm,4℃振荡30min;3800g,4℃离心10min,上清即为重组纳米抗体粗提物。
[0072]
将重组纳米抗体粗提物加入prrsv包被的elisa板(400ng/孔)及pbs包被的elisa 板中,100μl/孔,37℃孵育1h。加入兔抗e-tag多抗(1:2000稀释),100μl/孔,37℃孵育1h。加入hrp标记的山羊抗兔igg(1:10000稀释),100μl/孔,37℃孵育1h。加入tmb显色液,100μl/孔,37℃反应15min。
[0073]
显色完成后加入1m盐酸终止反应,100μl/孔,测定od
450nm
值。
[0074]
根据重组纳米粗提物的间接elisa检测结果,结果如图2所示,将13株纳米抗体进
行原核表达和后续研究。
[0075]
其中用于检测prrsv双抗体夹心lisa抗体对的两株纳米抗体,命名为prrsv-n-nb12,prrsv-n-nb35。nb12纳米抗体的可变区的cdr-1的氨基酸序列如seqidno.7所示(gftfsqhhms),所述nb12纳米抗体的可变区的cdr-2的氨基酸序列如seqidno8所示(gigtfgqinyadsakg),所述nb12纳米抗体的可变区的cdr-3的氨基酸序列如seqidno.9所示(ytsgrry);
[0076]
n35纳米抗体的可变区的cd-1的氨基酸序列如seqidno.10所示(gfssntyvtr),所述n35纳米抗体的可变区的cdr-2的氨基酸序列如seqidno.11所示(tlpgagtaryadsvrg),所述n35纳米抗体的可变区的cdr-3的氨基酸序列如seqidno.12所示(egygrni)。
[0077]
nb12纳米抗体的核苷酸序列如seqidno.13所示,prrsv-n-nb12:
[0078]
atggccgaggtgcagctggtgcagtctgggggaggcttggtgcaccctggggggtctctgaggctctcctgtgcagcctctggattcaccttcagtcagcatcacatgagctggtaccggcaggctccaggaaagcagcgcgagttggtcgcaggtattggtactttcggtcaaataaattatgcggactccgcgaagggccgattcaccatttccagagacaacgccaagaacacggtgtctctgcaaatgaacagcctgagtcctgaggacacggccgtctatcagtgttctgcatacacatcgggccggcgttattggggccaggggacccaggtcaccgtctcctca
[0079]
n35纳米抗体的核苷酸如seqidno.14所示,prrsv-n-nb35:
[0080]
atggccgaggtgcagctggtgcagtctgggggaggcttggtgcagcctggggggtctctgaggctctcctgtgcagcctctggattcaccttcagtcagcatcacatgagctggtaccggcaggctccaggaaagcagcgcgagttggtcgcaggtattggtactttcggtcaaataaattatgcggactccgcgaagggccgattcaccatttccagagacaacgccaagaacacggtgtctctgcaaatgaacagcctgagtcctgaggacacggccgtctatcagtgttctgcatacacatcgggccggcgttattggggccaggggacccaggtcaccgtctcctca
[0081]
nb12纳米抗体的氨基酸序列如seqidno.15所示,prrsv-n-nb12:maqvqlqmaevqlvqsggglvqpggslrlscaasgftfsqhhmswyrqapgkqrelvagigtfgqinyadsakgrftisrdnakntvslqmnslspedtavyqcsaytsgrrywgqgtqvtvssaaagapvpypdplepraa
[0082]
n35纳米抗体的氨基酸序列如seqidno.16所示,prrsv-n35:
[0083]
maevqlvqsggglvhpggslrlscaasgftfsqhhmswyrqapgkqrelvagigtfgqinyadsakgrftisrdnakntvslqmnslspedtavyqcsaytsgrrywgqgtqvtvssaaagapvpypdplepraa
[0084]
实施例2.纳米抗体与辣根过氧化物酶融合蛋白的制备
[0085]
1.改造载体:将prrsv-n-nb12基因序列与hrp序列连接到pegfp-n2(载体,按照图7展示的连接顺序进行连接,在nb12两端保留酶切位点psti(ctgcag)和noti(gcggccgc),测序鉴定后,获得阳性质粒pegfp-nb12-hrp。hrp序列(如seqidno.17所示)。
[0086]
2.表达蛋白
[0087]
待6孔板中hek293t细胞密度达到80%时换液,加入2ml2%fbsdmem。取100μl无血清dmem对4μg质粒(pegfp-nb12-hrp)稀释,加入9μl转染试剂pei,混匀后室温静置15min。将上述转染体系缓慢加入六孔板,轻轻晃匀后37℃培养6~8h换液。37℃继续培养48~60h。收集细胞分泌表达上清液,经离心浓缩后,即获得prrsv-n-nb12-hrp融合蛋白。
[0088]
3.通过elisa验证prrsv-n-nb12-hrp融合蛋白的表达分泌以及亲和力和特异性,结果如图3所示,其中图a是特异性,图b是亲和力。prrsv-n-nb12-hrp融合蛋白成功在
hek293t细胞中的表达,细胞上清中的融合蛋白可特异性的与prrsv n蛋白结合, nb12-hrp融合蛋白1:80稀释仍可与prrsv结合。
[0089]
实施例3.基于纳米抗体的夹心elisa方法的建立
[0090]
1.nb35最佳包被量与nb12-hrp最佳稀释度的确定
[0091]
捕获抗体nb35的包被浓度分别为20μg/孔、10μg/孔、5μg/孔、2μg/孔、1μg/孔和0.5μg/ 孔,检测抗体nb12-hrp分别加入原液、1:1、1:2、1:5、1:10和1:20稀释。.通过棋盘法确定nb35包被浓度为10μg/孔,nb12-hrp加入原液时,p/n值最高,为28.909(表1所示)。
[0092]
表1
[0093][0094][0095]
2.获得的试剂盒的成分是:样品稀释液:含3%bsa,0.5%triton x-100的pbs溶液(ph 7.5),nb12-hrp抗体,阳性对照:prrsv培养液,阴性对照:阴性猪血清。
[0096]
3.试剂盒的使用方法:
[0097]
(1)将待检测的抗原稀释后加入到包被elisa板中,孵育1小时,pbst洗板3次,
[0098]
(2)将nb12-hrp抗体加入到elisa板,孵育1小时,pbst洗板3次,;
[0099]
(3)在elisa板中加入显色液避光显色15min,加入3m浓h2so4终止反应;
[0100]
(4)观察elisa板的颜色变化,读取od450数值,计算s/p值,s/p大于0.13判为阳性,s/p≤0.13判为阴性:
[0101]
4产品质量研究
[0102]
4.1.敏感性检测
[0103]
分别将prrsv hun4病毒上清液稀释至1.0
×
105tcid
50
/100μl,5.0
×
104tcid50/100μl, 2.5
×
104tcid
50/
100μl,5.0
×
103tcid
50
/100μl,2.5
×
103tcid
50
/100μl和1.0
×
103tcid
50
/100 μl进行检测,根据结果评价elisa方法的敏感性,结果如图4所示,可以检测到1.0
×
10
3 tcid
50
/100μl病毒。
[0104]
4.2.广谱性检测
[0105]
分别对prrsv的多种毒株进行检测,选择4株prrsv病毒,包括prrsv-1、 prrsv-2-l1、prsv-2-l3、prrsv-2-l5和prrsv-2-l8,结果如图5所示,该elisa方法可以检测不同分支的prrsv病毒。
[0106]
4.3夹心elisa方法与荧光定量pcr方法的符合率比较
[0107]
通过检测临床样品,包括40份组织样品和50份血清样品,对建立的夹心elisa方法和荧光定量pcr方法进行比较,结果如表2所示,两者的总符合率为86.6%。
[0108]
表2夹心elisa与荧光定量pcr方法检测prrsv临床样品的一致性比较
[0109][0110]
4.4.特异性检测
[0111]
为了评价建立的夹心elisa方法的特异性,分别对猪的其他常见病毒进行检测,包括 csfv(猪瘟病毒)、pcv(猪圆环病毒)、pedv(猪流行性腹泻病毒)、ppv(猪细小病毒)和prv(伪狂犬病病毒),结果如图6所示,该方法与其他猪病毒均无反应,特异性好。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1