一种调控花朵衰老的RhBEE3基因及其应用
一种调控花朵衰老的rhbee3基因及其应用
技术领域
1.本发明涉及植物基因工程技术领域,具体涉及一种从切花月季中分离、克隆的一个基本螺旋-环-螺旋(bhlh)类转录因子rhbee3,以及rhbee3基因在调控花朵衰老中的应用。
背景技术:
2.花朵的开放和衰老是被子植物生长发育中的一个重要阶段。花朵依靠其独特的外观、色彩和香味吸引动物协助授粉,授粉完成后,花朵逐渐走向衰老,具体表现为花朵的萎蔫、脱落和花色的变化。花朵衰老是一个高度程序化的事件,包含了一系列生理生化过程,如细胞内结构的解体、大分子和膜系统的降解以及物质的循环利用等(price et al.,2008;xu et al.,2000)。据报道,植物激素作为一个关键因素在花的衰老过程中起重要作用,其中乙烯被广泛认为是发育的中心调节因子,参与调控花朵衰老的生理过程。
3.乙烯已被证明能促进许多观赏植物的开花,如剑兰(gladiolus gandavensis)、康乃馨(dianthus caryophyllus)、月季(r.hybrida)、腊梅(chimonanthus praecox)等。如梅花花朵经外源乙烯处理可迅速达到盛开阶段,而乙烯抑制剂1-甲基环丙烯(1-mcp)处理可显著延迟花朵开放(suietal.,2015)。乙烯生物合成基因的转录上调被认为是乙烯促进花朵衰老的主要原因。例如,通过外源应用乙烯的生物合成前体acc可以加速扶桑(hibiscus rosa-sinensisl.)花朵的衰老(trivellini etal.,2011)。在石竹(d.chinensis)花衰老过程中,乙烯合成基因acs和aco的表达也显著增加(tanase et al.,2015)。而除此之外,转录因子参与的乙烯响应也是影响花衰老的重要因素。
4.转录因子(tfs)通过以序列特异性的方式直接与靶基因的启动子结合来控制多种生理过程。tfs功能丰富,参与多种植物激素的信号响应,并被报道广泛参与了植物激素介导的花朵衰老,例如,在拟南芥中,过表达forever young flower(fyf)通过下调ethylene response dna-binding factor 1/2(edf1/2)从而抑制乙烯反应来延缓花的衰老(chen e tal.,2011)。这种抑制作用被证明是由erf基因fuf1介导的(chen et al.,2015)。近年来有报道称,乙烯诱导矮牵牛花花冠中pherf6的表达逐渐增加。pherf6蛋白与eobi(emission of benzenoidsi)发生互作,从而阻止eobi激活odo1(odorant1)基因,导致挥发性物质的产生减少(liu et al.,2017)。这表明乙烯响应的转录因子基因可能参与了乙烯诱导的衰老和次生代谢的调节。
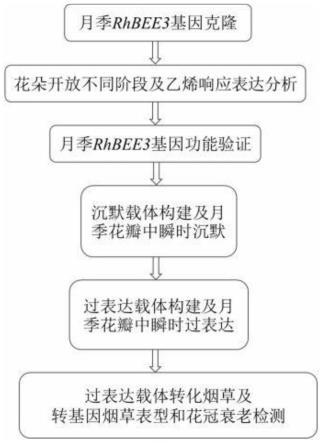
5.基本螺旋-环-螺旋(bhlhs)转录因子广泛分布于所有真核生物中,构成了最大的转录因子家族之一(ledent et al.,2001;riechmann et al.,2000)。bhlhs参与控制许多生物过程的转录调控,如损伤和干旱胁迫(kiribuchi et al.,2004)、光信号传递(leivar et al.,2008;roig-villanova et al.,2007)、根和气孔发育(menand et al.,2007;pillitteri et al.,2007)以及果实发育(liljegren et al.,2004)等。有研究表明,bhlh转录因子通过参与激素信号传导途径调控植物生长发育。例如,bhlh转录因子广泛参与到ja的信号传导途径(jonas et al.,2017;wanget al.,2014)。在ja信号中,bhlh转录因子还
与myb转录因子相互作用,形成转录复合物调控花朵发育(qi et al.,2015)。在br信号中,一对bzr1下游的hlh/bhlh转录因子通过拮抗br调控植物发育(zhang et al.,2009)。此外,还发现了一个矮牵牛中的bhlh转录因子phfbh4与acs1的启动子结合,从而影响到乙烯的合成并调控花朵的衰老(yin et al.,2015)。这些研究均表明bhlh转录因子的一些成员可能通过参与激素信号传导途径调控花朵衰老的过程。目前在月季中还没有bhlh转录因子调控花朵衰老的研究报道。在月季分子育种方面,前人通过将三色堇(viola spp.)中的类黄酮3’,5
’‑
羟化酶(flavonoid 3’,5
’‑
hydoxylase,f3
’5’
h)基因转入月季,培育出转基因蓝色月季品种(katsumoto etal.,2007)。未来有望利用基因工程在月季中进行rhbee3基因的干涉或敲除,这将在延缓月季花朵衰老,延长花期方面有很大的潜力。
技术实现要素:
6.为解决以上技术问题,本发明提供了一种花朵基因rhbee3,所述基因rhbee3为月季(rosa hybrida
‘
samantha’)基本螺旋-环-螺旋(bhlh)类转录因子,其序列如seq id no.1所示,所述花朵基因rhbee3编码的蛋白质的核苷酸序列如seq id no.2所示,所述花朵基因rhbee3的3’端非翻译区(3
’‑
utr)序列为seq id no.3所示。
7.为解决以上技术问题,本发明还提供了一种花朵基因rhbee3在调控花朵衰老中的应用,其特征在于,包括如下步骤:
8.(1)rhbee3基因的克隆;
9.(2)rhbee3在花朵开放不同时期的表达模式与乙烯诱导表达分析;
10.(3)沉默载体构建以及在月季花瓣中的瞬时沉默;
11.(4)过表达载体构建以及在月季花瓣中的瞬时过表达;
12.(5)过表达载体转化烟草及转基因烟草表型和花冠衰老检测。
13.与现有技术相比,本发明的有益效果是:本发明利用转基因技术为延缓花朵衰老提供重要的基因工程方法,突破了传统育种手段的障碍;此外本发明的基因在烟草中性状稳定,为花朵衰老分子机制研究提供理论依据。
附图说明
14.图1为本发明的技术流程图;
15.图2为本发明的rhbee3基因的系统进化分析图;
16.图3为本发明的rhbee3在月季开放不同阶段的表达分析;
17.图4为本发明的rhbee3在乙烯处理后月季花朵中的表达分析;
18.图5为本发明的rhbee3沉默载体的构建图谱;
19.图6为本发明的rhbee3沉默处理后的月季花瓣检测结果图,其中a为rhbee3在月季花瓣中瞬时沉默处理后花瓣衰老表型变化;b为rhbee3在月季花瓣中瞬时沉默与对照组13天后的定量分析;c为rhbee3在月季花瓣中瞬时沉默与对照组13天后花瓣电导率的测定结果;
20.图7为本发明的rhbee3超量表达载体的构建图谱;
21.图8为本发明的rhbee3超表达处理后的月季花瓣检测结果图,其中a为rhbee3在月季花瓣中瞬时过表达处理后花瓣衰老表型变化;b为rhbee3在月季花瓣中瞬时过表达处理
与对照组6天后的定量分析;c为rhbee3在月季花瓣中瞬时过表达处理与对照组6天后花瓣电导率的测定结果;
22.图9为本发明的烟草花朵开放不同级数,其中s1时期为花苞期,花冠筒已充分膨大,还未打开;s2时期为初开期,花冠筒顶端稍微打开;s3时期为盛开期,花冠筒完全打开,花朵直径达到最大;s4时期为衰老初期,花冠筒基部开始变为浅褐色;s5时期为衰老中期,花冠筒超过一半的部分转为褐色;s6时期为衰老后期,花冠筒逐渐萎蔫,大部分转为褐色;
23.图10为本发明的rhbee3烟草转基因超表达株系t2代花冠衰老检测结果图,其中a为rhbee3超表株系t2代#2-4与#6-9与对照组#1-6的花朵衰老表型变化;b为转基因株系t2代#2-4与#6-9与对照组#1-6花朵rhbee3基因的定量分析,c为转基因株系t2代#2-4与#6-9与对照组#1-6花朵mda含量的测定结果图。
具体实施方式
24.为使本发明的目的、技术方案和优点更加清楚明白,下面结合实施条例和附图,对本发明作进一步的详细说明,本发明的示意性实施方式及其说明仅用于解释本发明,并不作为对本发明的限定。
25.实施例1分离rhbee3基因
26.(1)rhbee3基因全长的克隆
27.以月季
‘
samantha’为试验材料,使用热硼法(ma et al.,2006)提取花瓣rna,使用全式金反转录试剂盒(货号:ae311-03)合成cdna,方法参考试剂盒说明书。
28.参考前人研究(peietal.,2013),筛选了月季花朵中显著响应乙烯的bhlh类转录因子基因rhbee3,使用primer premier5软件设计一对全长引物:
29.rhbee3 orf up:5
’‑
atggctcagttcacagaagatttg-3’30.rhbee3 orf low:5
’‑
tcaaagagaccaataattagttgagg-3’31.通过pcr扩增从月季
‘
samantha’花瓣cdna中克隆得到rhbee3的全长。
32.pcr反应体系见表1。
33.表1 pcr反应体系
[0034][0035]
pcr扩增条件见表2。
[0036]
表2 pcr扩增条件
[0037][0038]
将扩增得到的pcr产物,通过琼脂糖凝胶电泳分离目标条带,使用全式金胶回收试剂盒(货号:eg101-01)回收目标条带,方法参考试剂盒说明书。将扩增获得的pcr产物连入pclonez载体(货号:c5852-50),筛选阳性克隆并测序,获得rhbee3基因全长序列,其核苷酸序列为seq id no.1所示,长度855bp,其编码的氨基酸序列如序列seq id no.2所示,编码284个氨基酸。将rhbee3的蛋白序列提交到ncbi(https://www.ncbi.nlm.nih.gov/guide/)中进行blast分析,查找到63个同源蛋白的序列。使用clustalx 1.83和mega6软件对rhbee3和63个同源蛋白进行系统进化分析,表明rhbee3和月季花中bee3-like(accessionnumber:xp_024174009.1)同源性最高(图2)。
[0039]
(2)rhbee3基因3
’‑
utr的克隆
[0040]
在rhbee3的编码区设计两条上游引物:
[0041]
rhbee3 up1:5
’‑
tgctctaagactatgggaatggc-3’[0042]
rhbee3 up2:5
’‑
agaagatgctatggaaacaatgc-3’[0043]
使用3
’‑
race的方法,从月季
‘
samantha’花瓣cdna中克隆得到257bp的rhbee3的3
’‑
utr序列,其核苷酸序列为seq id no.3所示。
[0044]
pcr反应体系见表3。
[0045]
表3 3
’‑
racepcr反应体系
[0046][0047]
pcr扩增条件见表4。
[0048]
表4pcr扩增条件
[0049][0050]
实施例2rhbee3在花朵开放不同时期的表达模式与乙烯诱导表达分析
[0051]
基于pcr扩增获得的rhbee3校正后序列,用primerpremier5软件设计一对用于进
行实时荧光定量pcr的特异引物:
[0052]
rhbee3 qrt up:5
’‑
aacagcagcagcgacaacaac-3’[0053]
rhbee3 qrt low:5
’‑
tcgaaactgagggattggagac-3’[0054]
参考前人对月季中基因表达模式的研究,使用rhactin5基因作为内参基因,引物序列为:
[0055]
rhactin5 qrt up:5'-aaggtggttgccccaccaga-3'
[0056]
rhactin5 qrt low:5'-accagagaacaagaatgcaagcagc-3'
[0057]
参考前人论文中对月季花朵开放不同时期的定义(maetal.,2018)和乙烯处理方法(luoetal.,2021)进行月季花朵的处理和取样,每个处理3个生物学重复。使用热硼法提取花瓣rna,反转录获得cdna。使用艾德莱的2
×
sybr green qpcr mix试剂(货号:pc3302)检测rhbee3基因的表达,实时荧光定量pcr反应在罗氏96pcr仪中进行。
[0058]
荧光定量pcr扩增条件见表5。
[0059]
表5荧光定量pcr扩增条件
[0060][0061]
使用2-δδct
法(livak and schmittgen,2001)进行数据的处理。
[0062]
利用实时定量pcr对rhbee3在月季花朵开放的不同时期的表达量进行检测,发现rhbee3在花朵开放后期(stage 5)和衰老期(stage 6)表达量急剧上升,具体见图3。乙烯处理后,rhbee3在处理后6小时即显著地受到乙烯强烈诱导,具体见图4。
[0063]
实施例3rhbee3在月季花瓣中的瞬时沉默
[0064]
(1)rhbee3沉默载体的构建
[0065]
通过对rhbee3序列进行比对,选取rhbee3非保守的3’utr设计引物,分析酶切位点,选择ecori和kpni两个酶切位点用于载体的构建。
[0066]
首先设计带酶切位点的rhbee3的3’utr引物:
[0067]
rhbee3 vigsup(+ecori):
[0068]
5'-ccggaattccgtctcaaagagtctgactacaattttg-3'
[0069]
rhbee3 vigs low(+kpni):
[0070]
5'-cggggtaccttaggaaaaaaatttgactgtagtc-3'
[0071]
用带酶切位点的引物扩增带酶切位点的rhbee3的3’utr。
[0072]
通过琼脂糖凝胶电泳分离目标条带,使用胶回收试剂盒回收目标条带。
[0073]
用限制性内切酶ecori和kpni对rhbee3的3’utr回收产物和病毒载体ptrv2进行酶切过夜,分离和回收目标条带,酶切体系见表6。
[0074]
表6酶切体系
[0075][0076]
使用thermo的t4dna连接酶(货号:el0014)对rhbee3的3’utr和ptrv2载体酶切产物进行连接,连接体系见表7。
[0077]
表7连接体系
[0078][0079]
16℃连接过夜后,将连接产物转化大肠杆菌感受态,涂布于lb+卡那霉素(kanamycin,kan)平板,在37℃培养箱中倒置培养15-16个小时。
[0080]
从菌板上挑取阳性菌摇菌,经过pcr阳性检测和测序验证,获得构建成功的trv2-rhbee3沉默载体质粒(图5)。
[0081]
(2)trv2-rhbee3转化月季花瓣
[0082]
使用冻融法将trv1、trv2、trv2-rhbee3三种质粒分别转化农杆菌gv3101感受态,涂布在lb+kan的平板上,28℃培养箱中倒置培养48h;
[0083]
挑单菌落摇一次菌,经过pcr检测阳性后,在500ml三角瓶中加100mllb培养基,其中含2-吗啉乙磺酸(mes,终浓度10mmol/l)、乙酰丁香酮(as,终浓度20μmol/l)和kan(终浓度50mg/l),并加入100ul一次菌,在28℃摇床上以200r/min转速二次摇菌过夜;
[0084]
5000r/min离心10min集菌;
[0085]
配制侵染液,其中含mes(终浓度10mmol/l)、mgcl2(终浓度10mmol/l)、as(终浓度150μmol/l),调ph至5.6;
[0086]
用侵染液将菌块打散,用分光光度计测量菌液浓度,调节od
600nm
=0.8,使trv1、trv2、trv2-rhbee3三种菌液od值相近,随后分别按1:1比例混合trv1与trv2以及trv1与trv2-rhbee3的菌液得到两种混合菌液,暗处静置2小时;
[0087]
从附近的花卉市场购买新鲜的月季
‘
samantha’切花,取中层花瓣5-6片,用直径12mm的打孔器从花瓣的两侧打孔,将花瓣圆片泡在去离子水中,每个处理准备300个花瓣圆片;
[0088]
将花瓣圆片分别浸泡在trv1+trv2及trv1+trv2-rhbee3混合菌液中,用真空泵抽吸侵染,用真空泵对花瓣进行抽吸侵染,由1个大气压抽到0.5个大气压,抽气需要3~5分钟,放气20~25分钟,侵染处理完毕后,用去离子水将花瓣圆片表明附着的农杆菌冲洗干净后,将花瓣圆片摆在直径15cm、垫有两层湿润滤纸的的培养皿中;
[0089]
将培养皿放在8℃条件下暗培养3天,然后转到23℃正常光照条件下培养,此时记为0天,跟踪观察花瓣圆片的表型变化,5天后取样测定第一次生理指标并提取样本rna,随后每隔4天进行取样测定和提取rna。
[0090]
如图6a所示,侵染5天开始,rhbee3沉默组与对照组花瓣相比表现明显的衰老延
迟,到第13天为止均没有表现出明显的衰老表型。利用实时定量pcr对侵染13天后的沉默与对照组rhbee3表达量进行检测,发现沉默处理的样本rhbee3基因表达水平显著低于对照组(图6b)。参照luo et al.(2021)论文中的方法对两组侵染13天花瓣的离子渗透率检测结果表明rhbee沉默组的离子渗透率显著低于对照组(图6c)。因此,降低rhbee3基因的表达水平可以延缓花朵衰老。
[0091]
实施例4 rhbee3在月季花瓣中的瞬时过表达
[0092]
(1)rhbee3超量表达载体的构建
[0093]
通过对rhbee3全长序列进行酶切位点,结合super1300载体多克隆位点(multiple cloning site,mcs)区域可用的酶切位点,选择swai和kpni两个酶切位点用于载体的构建。
[0094]
首先设计带酶切位点的rhbee3全长引物:
[0095]
rhbee3 orf up(+swai):
[0096]
5'-gcgatttaaatatggctcagttcacagaagatttg-3'
[0097]
rhbee3 orf low(+kpni):
[0098]
5'-gtcggtaccgagagaccaataattagttgaggaatac-3'
[0099]
用带酶切位点的引物从含有校正后rhbee3全长序列的pclonez质粒上扩增带酶切位点的rhbee3全长;
[0100]
通过琼脂糖凝胶电泳分离目标条带,使用胶回收试剂盒回收目标条带;
[0101]
用限制性内切酶swai和kpni对rhbee3回收产物和super1300空载进行酶切过夜,分离和回收目标条带,酶切体系见表8。
[0102]
表8酶切体系
[0103][0104]
使用thermo的t4 dna连接酶(货号:el0014)对rhbee3和super1300载体酶切产物进行连接,连接体系见表9;
[0105]
表9连接体系
[0106][0107][0108]
16℃连接过夜后,将连接产物转化大肠杆菌感受态,涂布于lb+卡那霉素(kanamycin,kan)平板,在37℃培养箱中倒置培养15-16个小时;
[0109]
从菌板上挑取阳性菌摇菌,经过pcr阳性检测和测序验证,获得构建成功的super1300-rhbee3载体(图7)。
[0110]
(2)super1300-rhbee3转化月季花瓣
[0111]
使用冻融法将super1300、super1300-rhbee3质粒转化农杆菌gv3101感受态,涂布
在lb+kan的平板上,28℃培养箱中倒置培养48h;
[0112]
挑单菌落摇一次菌并进行阳检,随后参照实施例3中转化月季花瓣的方法进行二次摇菌与集菌;
[0113]
配制与实施例3中相同的侵染液打散菌块,用分光光度计测量菌液浓度,调节od
600nm
=0.8,暗处静置2小时;
[0114]
从附近的花卉市场购买新鲜的月季
‘
samantha’切花,取中层花瓣5-6片,用直径12mm的打孔器从花瓣的两侧打孔,将花瓣圆片泡在去离子水中,每个处理准备300个花瓣圆片;
[0115]
将花瓣圆片浸泡在菌液中,用真空泵对花瓣进行抽吸侵染,浸染过程与实施例3瞬时沉默花瓣浸染过程相同;
[0116]
将培养皿放在8℃条件下暗培养3天,然后转到23℃、正常光照条件下培养,此时记为0天,跟踪观察花瓣圆片的表型变化,每隔3天取样测定生理指标,提取样本rna。
[0117]
如图8a所示,侵染6天后,rhbee3过表达处理组与对照组花瓣相比表现明显褪色。利用实时定量pcr对侵染6天后的过表达与对照组rhbee3表达量进行检测,发现rhbee3过表达处理样本中rhbee3基因的表达水平显著高于对照组(图8b)。测定两组花瓣侵染6天后的离子渗透率,发现过表达组的离子渗透率显著高于对照组(图8c)。综上,过表达rhbee3可以促进花朵衰老。结合实施例3可得,rhbee3基因具有调控花朵衰老的功能。
[0118]
实施例5rhbee3在烟草中的过表达
[0119]
(1)转基因烟草的获得
[0120]
活化携带super1300或super1300-rhbee3质粒的农杆菌gv3101,挑取单菌落进行一次摇菌,通过pcr进行阳性检测后在500ml三角瓶中进行二次摇菌;
[0121]
5000r/min离心10min收集沉淀集菌,并用ms液体培养基将离心收集到的菌块沉淀重悬,调节od
600nm
到0.6~0.8,静置1~2h后倒入三角瓶准备侵染;
[0122]
从长势良好的野生型烟草(n.tabacuml.)无菌苗上剪取若干枚叶片,用75%的酒精消毒30s,再用0.1%的升汞消毒8min,无菌水冲洗6~7遍,备用;
[0123]
参考zengetal.(2016)论文中的方法,通过农杆菌介导的叶盘法侵染烟草叶片,并获得转基因烟草。
[0124]
(2)转基因烟草的表型鉴定
[0125]
将生长良好的转基因烟草阳性苗移栽到营养土中,在温室内进一步培养,环境温度控制在15~25℃,空气湿度60~70%;
[0126]
转基因烟草花朵逐渐开放后,根据烟草花朵开放级数的划分(图9),选择同处于s1时期(花苞期)的rhbee3两个转基因株系t2-2-4和t2-6-9以及对照supert2-1-6进行跟踪拍照,花苞期记为第一天,第四天对照花朵supert2-1-6花朵进入盛开期,此时进行取样,测定同一时间对照和转基因株系花朵mda含量和基因表达水平;
[0127]
mda含量测定参考《植物生理生化实验原理和技术》教材中的方法(李合生等,2000),rhbee3基因表达水平的检测使用荧光定量pcr的方法。
[0128]
表型观察发现,rhbee3两个转基因株系t2-2-4和t2-6-9花朵开放和衰老的速度明显比对照supert2-1-6快,花朵衰老表型变化如图10a,转基因株系中rhbee3表达水平显著高于对照组(图10b),并且转基因株系mda含量也显著高于空载对照(图10c)。结果均表明
rhbee3的过表达促进烟草花朵的衰老。
[0129]
通过本发明的上述实施例,本发明基于3
’‑
utr和全长序列分别构建了沉默和过表达载体,在月季花瓣中进行rhbee3的瞬时沉默和过表达,通过观察表型变化、测定基因表达水平和电导率等发现rhbee3可正向调控花朵衰老;通过叶盘法转化烟草(nicotiana tabacum l.),获得rhbee3超表达的转基因植株,通过观察表型变化、测定基因表达水平和丙二醛(mda)等发现rhbee3超表达促进转基因株系花朵衰老;突破了传统育种手段的障碍,为植物花朵衰老调控提供了重要的基因工程的方法。
[0130]
如上即为本发明的实施例。上述实施例以及实施例中的具体参数仅是为了清楚表述发明验证过程,并非用以限制本发明的专利保护范围,本发明的专利保护范围仍然以其权利要求书为准,凡是运用本发明的说明书及附图内容所作的等同结构变化,同理均应包含在本发明的保护范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1