一种虫草属菌株的培养方法
1.本发明属于真菌菌种种性保持领域,具体涉及一种提高蛹虫草菌种活性、延缓菌种退化的方法,更具体涉及一种有效延缓菌种退化、提高菌种活性的蛹虫草液体深层发酵培养方法。
背景技术:
2.蛹虫草作为一种重要的药用食用菌,其菌种退化问题一直是研究者关注的热点。蛹虫草受到医药界、精细化工业高度关注,其主要活性成分如虫草素、腺苷、多糖、虫草酸、麦角甾醇等功效逐渐被认知并广泛应用,具有抗肿瘤、免疫调节、抗氧化、降血脂等功效。在蛹虫草菌种研究中发现,菌种的退化导致活性氧、丙二醛有害物质累积,其代谢产物合成能力下降等。因而,退化严重影响了蛹虫草的经济性状,给大规模生产及菌种保藏工作带来重大损失。
3.导致蛹虫草退化的原因有很多,可以是自身基因突变,也可能是不良环境因素导致的变异,或者微生物污染导致,或者保藏方式不当,或连续转代等都会使得退化现象不断扩大。
4.蛹虫草菌种主要采取复壮的方式,使退化菌株恢复优良的性状。例如:组织分离:将退化的蛹虫草栽培出菇,挑选外观健壮的子实体,在无菌条件下重新进行组织分离。菌丝纯化与尖端菌丝分离:挑取健壮的菌丝尖端部分,进行培养,以期获得复壮的菌株。有性孢子分离筛选:选择长势好的子实体,采用孢子收集器将有性孢子收集后进行多孢或单孢分离培养。将所得单核菌丝还要与可亲和的单核菌丝杂交后形成双核菌丝,再进行出菇实验,确定丰产的菌株。添加抗生素,对菌株进行复壮。
5.以上方法都是在菌株退化后,再利用不同方法,重新选择。前三种方法都费时耗力,而且不能保证得到复壮的菌株,最后一种方法,虽然简单,但要添加各种不同抗生素,目前抗生素使用已受到严格控制,因此很难得到很好推广和应用。
技术实现要素:
6.本发明所要解决的技术问题是提供一种有效防止蛹虫草菌种退化的方法,该方法突破了传统的菌株复壮的方法,采用简单、经济、无害的褪黑素,且效果显著。
7.本发明的一种有效延缓蛹虫草菌种退化的方法,具体地,该方法至少包括在蛹虫草菌株培养中使用褪黑素。在本发明提供的实施方式中,使用含有褪黑素的培养基培养蛹虫草菌株。
8.具体地,褪黑素在培养基中的浓度为10~200mol/l,优选地,褪黑素在培养基中的浓度为20~150mol/l,更加优选为50~100mol/l,特别优选为60mol/l。
9.可选的培养基包括pda或pdb加富培养基培养蛹虫草菌。
10.所述pda加富培养基的组成为:基于每1000ml的培养基,含有:马铃薯200g、葡萄糖20g、琼脂20g、蛋白胨3g、硫酸镁1.5g、磷酸二氢钾3g、维生素b1 0.01g、蒸馏水补足至
1000ml。
11.所述pdb加富培养基的组成为:基于每1000ml的培养基,含有:马铃薯200g、葡萄糖20g、蛋白胨3g、硫酸镁1.5g、磷酸二氢钾3g、维生素b1 0.01g、蒸馏水补足至1000ml。
12.更具体地,本发明给出了褪黑素培养蛹虫草的方法,包括以下步骤:
13.将初期退化蛹虫草菌株,接种于培养基中。对于蛹虫草的接种量没有特别的要求。通常基于基于100重量份的培养基,接种0.1~5重量份的初期退化蛹虫草菌株。在优选的实施方式中,初期退化蛹虫草菌株的接种量为0.3~1%。在实际操作中,也可基于10ml的培养基,接种约为0.05~0.1cm2的蛹虫草菌。
14.初期退化蛹虫草菌株包括经连续传代产生退化的菌株,也包括因环境原因导致退化的菌株。所述初期退化蛹虫草菌株包括节律环不规则,出现角变现象,菌丝尖端不整齐,菌丝尖端扭曲,生长速度缓慢的菌株。
15.本发明实施例中,为了便于实验对比,使用连续传代第3代菌种作为初期退化蛹虫草菌株,但并不意味着本发明的使用褪黑素复壮的方案仅适用于本发明实施例中的初期退化的蛹虫草菌株。
16.在本发明的实施例中,将初期退化蛹虫草菌株,接种于培养基中。其中培养基优选地为添加了60mol/l褪黑素的pda加富培养基。
17.本发明中,为了便于褪黑素的添加,本发明使用褪黑素溶液加入培养基中。
18.为了防止杂菌的引入,所述褪黑素优选地除菌后加入,特别是通过75%的酒精溶解的褪黑素。
19.为了去除杂菌,优选地,褪黑素溶液进一步过滤。
20.本发明实施例中,使用的褪黑素溶液可通过下述方法制备得到:基于褪黑素0.58g,加入75%酒精溶解后定容至2500ml。
21.在本发明的一种实施方式中,以1000ml pda或pdb培养基为例,添加6ml褪黑素溶液。
22.本发明中,将初期退化蛹虫草菌株接种于培养基中,于22℃~25℃培养10天,进行传代,保藏,即可得到复壮的蛹虫草菌株。
23.本发明使用褪黑素不限于对蛹虫草菌株的培养,亦可用于虫草属菌株的培养。
24.本发明的方法适用于由于反复传代或环境因素所导致的菌丝角变频率增加、菌丝气生现象明显、色素明显减少等现象,同时适用于菌种常规实验和保藏,可以明显减少菌种的退化频率。
附图说明
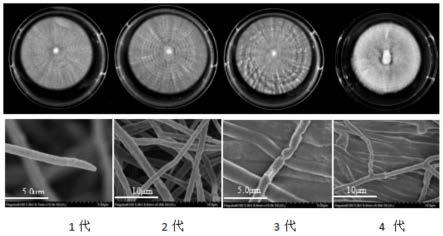
25.图1:未使用褪黑素连续传代4代菌落退化对比图。
26.图2:使用褪黑素与未使用褪黑素在连续传代四代菌落形态对比图。
27.图3:使用褪黑素与未使用褪黑素在连续传代四代菌落过氧化氢对比图。
28.图4:使用褪黑素与未使用褪黑素在连续传代四代菌落丙二醛对比图。
29.图5:使用褪黑素与未使用褪黑素在连续传代四代菌落菌丝干重对比图。
30.图6:使用褪黑素与未使用褪黑素在连续传代四代菌落虫草素含量对比图。
31.图7:使用褪黑素与未使用褪黑素在培养环境变化引起菌落退化对比图。
32.图8:使用褪黑素与未使用褪黑素活性氧积累对比图。
33.图9:不同浓度褪黑素培养菌落过氧化氢对比图。
34.图10:不同浓度褪黑素培养菌落丙二醛对比图。
35.图11:不同浓度褪黑素培养菌落虫草素含量对比图。
36.图12:不同浓度褪黑素培养菌落腺苷含量对比图。
37.其中,图3-图6中a为空白实验组数据,b为使用褪黑素组数据。
具体实施方式
38.本发明中,使用pda加富培养基,其组成为:马铃薯200g、葡萄糖20g、琼脂20g、蛋白胨3g、硫酸镁1.5g、磷酸二氢钾3g、维生素b1 0.01g、蒸馏水1000ml。所述pdb液体加富培养基的组成为:马铃薯200g、葡萄糖20g、蛋白胨3g、硫酸镁1.5g、磷酸二氢钾3g、维生素b1 0.01g、蒸馏水1000ml。
39.本发明中,所述pdb加富培养基的组成为:基于每1000ml的培养基,含有:马铃薯200g、葡萄糖20g、蛋白胨3g、硫酸镁1.5g、磷酸二氢钾3g、维生素b1 0.01g、蒸馏水补足至1000ml。
40.实施例1:褪黑素对连续转代多次后菌种退化的影响
41.1.1空白对照组:连续转代多次后退化菌种
42.在pda加富培养基中进行,在22℃-25℃,光周期为6h/d,湿度75%
±
5%条件下培养。菌种接种量为每10ml培养基接种0.1cm3。经过连续传代,从图1所示的菌落形态可看出,1代和2代呈橘黄色绒毡状,节律环明显,菌丝圆润笔直,3代节律环不规则,出现角变现象,菌丝尖端扭曲,4代出现明显气生菌丝,且菌丝生长速度较慢,菌丝扭曲、细胞壁扭曲缢裂。
43.1.2褪黑素组:
44.1.2褪黑素组与1.1空白对照组采用相同菌株开始实验,在与1.1空白对照组相同培养条件下,在继代第3代菌种培养基中添加褪黑素,加入褪黑素后,褪黑素在培养基中的含量为100mol/l。加入褪黑素后,菌种退化逆转,恢复活性,参见图2所示。使用褪黑素组的菌落形态如图2右侧图中所示,较未使用褪黑素组的空白组(参见图2左侧图)使用褪黑素后其色泽呈橘黄色绒毡状,气生菌丝显著减少,角变减少,菌丝干重显著增加(参见图5)、菌丝中活性氧及丙二醛含量显著下降(参见图3、图4)、虫草素含量显著增加(参见图6)。实验证明褪黑素能有效逆转菌种退化不影响其产量和其它经济性状。
45.实施例2:褪黑素对环境因素变化引起菌种退化的影响
46.2.1空白对照组
47.在pdb培养基中,培养温度18℃~20℃、黑暗条件下培养4天。
48.2.2褪黑素组
49.2.2褪黑素组与2.1空白对照组采用相同的菌株、相同的培养条件,在pdb培养基加入褪黑素,加入褪黑素后培养基中的褪黑素含量为100mol/l。黑暗条件下培养,培养时间4天。
50.如图7所示,左侧是未加入褪黑素的空白组,右侧是加入褪黑素的处理组。通过对比可以看出,添加褪黑素处理菌丝量明显增加、菌丝中活性氧含量下降。
51.实施例3:不同褪黑素添加量对连续转代多次后菌种活性的影响
52.3.1空白对照组
53.将正常蛹虫草菌连续转接3次所得w5-3菌株,即初期退化菌株,接种于pda加富培养基上连续传代,培养条件同实施例1中1.1空白对照组。
54.3.2褪黑素组
55.将正常蛹虫草菌连续转接3次所得w5-3菌株(初期退化菌株)接种于褪黑素浓度梯度为10mol/l(m3)、20mol/l(m4)、60mol/l(m5)、100mol/l(m6)、150mol/l(m7)、250mol/l(m8)的pda加富培养基上,培养条件同实施例1.2,每组3次重复,经过培养,菌株角变频率下降、气生菌丝量下降。
56.通过实验进一步发现,随着培养基中褪黑素的浓度的增加,过氧化氢含量、丙二醛含量存在先减小后增大的变化趋势,且二者均于60mol/l褪黑素含量的培养基样本中获得极小值;与褪黑素浓度的增加同步变化的是虫草素的含量以及腺苷含量存在先增大后减小的变化趋势,且二者也均于60mol/l褪黑素含量的培养基培养样本中获得极大值。这表明褪黑素对蛹虫草的促进生长和复壮的效果存在随着褪黑素浓度增加而先增加后降低的趋势。
57.实施例4:不同褪黑素添加量对连续转代多次后菌种活性的影响
58.将w5-3菌株接种于接种于褪黑素浓度梯度为10mol/l(m3)、20mol/l(m4)、60mol/l(m5)、100mol/l(m6)、150(m7)、250(m8)mol/l的pdb培养基中,接种量为每10ml培养基中接种0.4cm3的蛹虫草菌株,培养条件同实施例2,培养温度18-20℃、黑暗条件下培养4天,重复3次。表1~4为各样本菌株三次培养菌株过氧化氢、丙二醛、虫草素、腺苷含量。
59.表1:菌株过氧化氢含量,单位:umol/g
60.编号123均值ck0.94601.12801.11801.0640m30.70800.67200.72000.7000m40.56400.54800.54000.5507m50.35000.37400.33800.3540m60.49000.42000.53000.4800m70.55600.68200.66400.6340m80.78600.84800.85200.8287
61.注:ck为空白组。
62.从表1可以看出随着培养基中褪黑素的浓度的增加,过氧化氢含量存在先减小后增大的变化趋势,于60mol/l(m5)褪黑素含量的培养基样本中过氧化氢含量极小值。
63.表2:菌株丙二醛含量,单位:mmol/g
64.编号123均值ck0.18770.22330.17940.1968m30.12790.14220.14840.1395m40.09370.08150.08840.0879m50.04680.05190.04600.0482m60.07080.08910.07200.0773m70.11010.10000.11190.1073m80.17150.15920.15180.1608
65.注:ck为空白组。
66.从表2可以看出随着培养基中褪黑素的浓度的增加,丙二醛含量存在先减小后增大的变化趋势,于60mol/l(m5)褪黑素含量的培养基样本中丙二醛含量极小值。
67.表3:菌株虫草素含量,单位:mg/g
68.编号123均值ck2.48132.42522.44012.4489m32.72312.60522.61232.6469m42.84332.86682.89742.8692m53.84943.55253.31593.5726m62.70292.66602.73822.7024m72.60232.64732.62082.6234m82.49472.58172.66542.5806
69.注:ck为空白组。
70.从表3可以看出随着培养基中褪黑素的浓度的增加,虫草素含量存在先增大后减少的变化趋势,于60mol/l(m5)褪黑素含量的培养基样本中虫草素含量极大值。
71.表4:菌株腺苷含量,单位:mg/g
72.编号123均值ck15.396315.314515.218215.3097m316.793717.233817.029317.0189m418.643618.659019.364718.8891m521.789221.669522.505121.9879m616.885417.583217.514617.3277m716.459716.236016.720516.4721m814.616114.787315.203414.8689
73.注:ck为空白组。
74.从表4可以看出随着培养基中褪黑素的浓度的增加,腺苷含量存在先增大后减少的变化趋势,于60mol/l(m5)褪黑素含量的培养基样本中腺苷含量极大值。
75.本发明突破了常规的丝状真菌复壮的方法,能有效的复壮,且有效防止菌种退化发生。此方法操作简单、经济实惠,安全无害,且效果显著。经此方法培养已经退化的蛹虫草菌株,菌株角变频率明显下降,气生菌丝明显减少,菌丝中活性氧、丙二醛明显减少,活性物质虫草素、腺苷含量明显增多。
76.以上对本发明所提供一种有效延缓蛹虫草菌种退化提高菌种活性的方法进行了详细介绍,本文中应用了具体个例对本专利的原理及实施方式进行了阐述,以上实施例的说明只是用于帮助理解本技术的方法及其核心思想;同时,对于本领域的一般技术人员,依据本技术的思想,在具体实施方式及应用范围上均会有改变之处,综上所述,本说明书内容不应理解为对本技术的限制。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1