一种肿瘤干细胞向神经元方向分化方法与流程
1.本发明属于细胞生物学领域,尤其是涉及一种肿瘤干细胞向神经元方向分化方法。
背景技术:
2.肿瘤干细胞(cscs)是一种具有类似于体细胞干细胞能力的癌细胞亚群。cscs在肿瘤的发生、转移、复发和耐药过程中起着关键作用。绝大部分的肿瘤被认为起源于cscs,这可能是导致肿瘤临床治疗原发性和获得性耐药的重要原因之一,因此,近年来对于肿瘤干细胞的研究吸引了国内外肿瘤基础科研的广泛关注。目前已知有少数几种人类肿瘤,可自发性地从未分化的恶性肿瘤退变为完全良性肿瘤,而神经母细胞瘤细胞分化为神经元细胞就属于其中之一。
3.随着干细胞与再生医学技术的不断发展,干细胞这一具有无限自我更新复制以及分化再生能力的原始细胞群体,在组织的修复与再生方面展现出了巨大的潜力。因此,很多科研人员开始致力于利用干细胞对退行性神经系统进行修复。而经过科研人员数年的探索,截止到目前为止,干细胞干预神经退行性疾病领域,已相继取得突破,为神经退行性疾病患者带来了新的希望。目前修复神经元的干细胞主要起源于神经干细胞,由于神经干细胞来源及获得比较困难,所以制约着神经再生的研究进展。因此,cscs的定向分化不仅是一种潜在的癌症治疗策略,而且为神经再生修复提供了一种新的思路。
4.目前肿瘤干主要从肿瘤组织及肿瘤细胞系中获得,由于从临床来源的肿瘤组织获得有限,且部分肿瘤组织需要进行临床病理分析,用来分离肿瘤干的大部分肿瘤组织以癌旁组织为主,这也制约着肿瘤干细胞的获取。由于以上原因,越来越多的研究者聚焦在从肿瘤细胞系中分离肿瘤干细胞。
5.在肿瘤干细胞向神经细胞分化的研究中,大部分研究参照神经干细胞向神经元诱导方法为主,其方法为培养过程中去除血清并加入神经营养因子及atra诱导剂为主,此方法促使肿瘤干细胞向神经元分化的能力及效率偏低,且分化后的神经细胞功能有待进一步提高。
技术实现要素:
6.有鉴于此,本发明旨在提出一种肿瘤干细胞向神经元方向分化方法,通过新的诱导方法,使肿瘤干细胞能够快速向神经元分化,分化后的神经元具备神经元特异性标志物,并具备钠电流信号。
7.为达到上述目的,本发明的技术方案是这样实现的:一种肿瘤干细胞向神经元方向分化方法,该方法包括如下步骤:s1、肿瘤干细胞获取;s2、肿瘤干细胞向神经元诱导分化;s21、将肿瘤干细胞接种在分化培养基中培养3-7天,中间每2天换液1次,其中分化
培养基为包含fbs、mem-100x、青链霉素100x、全反式维甲酸atra和姜黄素的dmem/f12完全培养基;s22、将分化后的细胞导入神经元维持培养基中继续培养7-14天,神经元维持培养基为包含bdnf、ngf、mem-100x、青链霉素100x和b27的neurobasal medium a完全培养基。
8.进一步,分化培养基中fbs的体积分数为1%-8%,mem-100x的体积分数为0.5%-2%,青链霉素100x的体积分数为0.1-0.4%,atra的用量为每升1μm-10μm,姜黄素的用量为每升0.5μm-5μm。
9.进一步,每100ml分化培养基中fbs的用量为5ml,mem-100x的用量为1ml,青链霉素100x的用量为200
µ
l,atra的用量为1
µ
m,姜黄素的用量为0.5
µ
m。
10.进一步,神经元维持培养基中bdnf的浓度为10ng/ml-80ng/ml,ngf的浓度为5ng/ml-40ng/ml,mem-100x的体积分数为0.5%-2%,青链霉素100x的体积分数为0.1-0.4%,b27-50x的体积分数为0.5%-4%。
11.进一步,每100ml神经元维持培养基中bdnf的浓度为50ng/ml,ngf的浓度为10ng/ml,mem-100x的用量为1ml,青链霉素100x的用量为200
µ
l,b27-50x的用量为2ml。
12.进一步,在进行s2步骤之前先将得到的肿瘤干细胞使用胰酶消化得到单细胞。
13.进一步,步骤s21的培养条件为:37℃、5% co2培养箱中培养。
14.进一步,步骤s1具体包括如下步骤:1)胶质瘤细胞系u-118mg干性培养;将u-118mg细胞接种在肿瘤干细胞培养基中,培养3-5天,肿瘤干细胞培养基为包含1-40ng/ml的bfgf、1-20ng/ml的egf、0.5-4%的b27-50x、0.1-0.4%青链霉素100x的无血清dmem/f12完全培养基;2)免疫磁珠分选;3)分选后差速贴壁纯化;4)肿瘤干快速扩增。
15.本发明还提供了一种由上述任一项所述的分化方法得到的神经干细胞。
16.相对于现有技术,本发明所述的肿瘤干细胞向神经元方向分化方法具有以下优势:本发明所述的肿瘤干细胞向神经元方向分化方法在向神经元分化过程中全反式维甲酸(atra)与姜黄素(curcumin)联用,姜黄素协同atra抑制肿瘤干细胞增殖,并通过抑制notch1信号通路促进肿瘤干细胞向神经元分化,展现了较强的向神经元分化的能力,且分化后的神经元具有成熟神经元的标志物,并具有钠离子信号。
附图说明
17.构成本发明的一部分的附图用来提供对本发明的进一步理解,本发明的示意性实施例及其说明用于解释本发明,并不构成对本发明的不当限定。在附图中:图1为本实施例肿瘤干细胞图;图2为本实施例肿瘤干细胞流式鉴定图;图3为本实施例肿瘤干细胞向肿瘤细胞分化图;图4为本实施例肿瘤干细胞向神经元分化后透射光图;
图5为本实施例肿瘤干细胞向神经元分化后βiii tubulin荧光图;图6为本实施例肿瘤干细胞向神经元分化后钠电流i-v曲线图;图7为对比例肿瘤干细胞向神经元分化后透射光图。
具体实施方式
18.需要说明的是,在不冲突的情况下,本发明中的实施例及实施例中的特征可以相互组合。
19.下面将参考附图并结合实施例来详细说明本发明。
实施例
20.肿瘤干细胞向神经元方向分化方法包括如下步骤:1)u-118mg细胞复苏:将癌细胞培养液及dmem/f12基础培养基于水浴锅内预热至37℃,在15ml离心管中加入6ml预热的基础dmem/f12培养基。从液氮罐中取出冻存的u-118mg细胞,迅速置于37℃水浴锅内快速解冻(解冻程度以冻存管中剩余少量冰晶为宜),然后吸取细胞悬液到预先放置的盛有6 ml基础培养基的离心管中,室温1000 r/min离心5 min,弃去上清液后加入适量培养液,细胞浓度为1
×
105细胞/ml种植于培养瓶中,置于37℃、5%co2培养箱中培养,每2 d进行一次换液处理。
21.2)u-118mg细胞传代:u-118mg细胞生长密度达到培养瓶底面积的95 %以上进行细胞传代。
22.具体步骤:(1)提前将培养基及pbs 37 ℃预热。
23.(2)吸除细胞培养液,加入少量pbs润洗细胞。
24.(3)吸除pbs加入适量胰酶,使胰酶能够覆盖细胞,然后放入37℃、5% co2培养箱中消化3 min左右,当细胞趋于圆形、细胞间隙变大且有少量细胞漂起时加入2倍胰酶体积的培养基终止消化,用枪头轻轻吹打细胞,使细胞完全悬浮。
25.(4)收集细胞悬液,室温1000 r/min离心5 min,吸弃上清,用培养基吹悬,使细胞浓度为1
×
105个细胞/ml种植于培养瓶中,置于37℃、5% co2培养箱中培养。
26.3)肿瘤细胞干性培养:细胞以1
×
105个细胞/ml接种在肿瘤干细胞培养基中培养5天,每100ml培养基包含10ng/ml的bfgf、20ng/ml的egf、2ml的b27-50x、200
µ
l青链霉素100x的dmem/f12无血清完全培养基,并在培养过程中在4℃的环境下培养3次,每次15分钟。
27.4)免疫磁珠分选:严格按照miltenyi biotec磁珠分选说明书进行分选操作,具体步骤如下:(1)pbs清洗u-118mg贴壁细胞以去除死细胞,加胰酶进行消化处理。
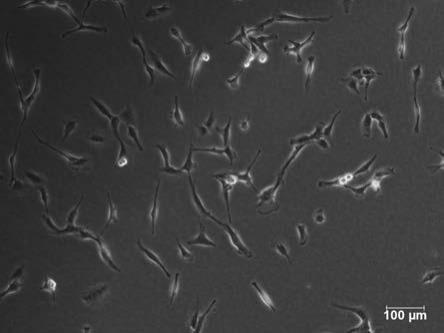
28.(2)使用基础培养基重悬细胞,1000 r/min的速度离心5 min,收集细胞沉淀。
29.(3)以107个总细胞加入60
ꢀµ
l缓冲液重悬细胞沉淀。
30.(4)每107个总细胞加入20
ꢀµ
l fcr阻断试剂。
31.(5)每107个总细胞加入20
ꢀµ
l cd133磁珠,充分混匀后在冰箱中(2-8 ℃)孵育15 min。孵育时使用macsmix旋转器缓慢连续旋转以防止细胞沉淀。
32.(6)对孵育好的细胞进行清洗,加入1-2 ml缓冲液洗涤细胞,然后以300 g/min的
速度离心10 min,吸弃上清液。
33.(7)以107个细胞使用500
ꢀµ
l缓冲液吹悬细胞(107个细胞)。
34.(8)将分离柱子(500
ꢀµ
l)放入分离器中,使用润洗液润洗分离柱。
35.(9)将孵育好的细胞缓慢的加入分离柱中,收集未标注的细胞再一次加入分离柱中。
36.(10)用适量缓冲液清洗柱子,重复3次,此步骤为了洗去未标注的细胞(cd133)细胞,使阳性细胞(cd133
+
)留在分离柱内。
37.(11)从分离架上取下分离柱,把分离柱放在收集管上进行洗脱。
38.5)分选后的细胞成球培养:将磁珠分选后的细胞以1
×
105个细胞/ml接种在肿瘤干细胞培养基中,成球培养的第一代细胞贴壁的较多,收集成球生长的细胞,进行胰酶消化,反复收集成球细胞去除贴壁细胞有利于纯化肿瘤干细胞,经过反复多次传代后获得完全悬浮成球生长的干性细胞。
39.6)肿瘤干细胞鉴定:(1)收集成球的u-118mg干性细胞,经0.05 %胰酶消化,培养基终止,1000 r/min的速度离心5 min,pbs洗涤后重悬计数。
40.(2)将细胞悬液经1000 r/min的速度离心5 min,弃上清。
41.(3)加入4 %多聚甲醛固定液固定15 min后pbs清洗,1000 r/min的速度离心5 min,pbs吹悬制成密度为1
×
106个细胞/ml的细胞悬液。
42.(4)分别加入fitc-cd133,apc-oct4,pe-cd44抗体各2
µ
l(按照美天旎抗体说明书建议比例1:50稀释抗体),室温避光孵育1 h。
43.(5)pbs清洗3次,以去除未结合的cd133,oct4,cd44抗体。
44.(6)细胞重悬于500
ꢀµ
l pbs中,进行流式细胞仪检测,结果如图2所示。
45.7)肿瘤干细胞向u-118mg细胞分化:收集悬浮生长的u-118mg干细胞,将细胞悬液经1000 r/min的速度离心5 min,去除上清,加入适量pbs清洗1次。吸弃pbs并加入0.05 %胰酶置于37℃、5 % co2培养箱中消化5 min。轻轻吹打至单细胞后加入足量pbs稀释胰酶,室温1000 r/min的速度离心5 min,去除上清液,加入适量含血清肿瘤细胞培养液(dmem/f12+10%fbs+1%青链霉素100x),调整细胞密度为1
×
105个细胞/ml接种于24孔板中培养7 d(每2 d换液1次),显微镜下观察、拍照记录,结果如图3所示。
46.8)肿瘤干细胞向神经元分化:(1)收集悬浮生长的u-118mg干细胞,将细胞悬液经1000 r/min的速度离心5 min,去除上清后加入适量pbs清洗1次。然后加入0.05%胰酶置于37℃、5% co2培养箱中消化5 min。轻轻吹打至单细胞后加入足量pbs稀释胰酶,以1000 r/min的速度离心5 min,去除上清液加入肿瘤干细胞向神经元分化培养基,每100ml分化培养基中fbs的用量为5ml,mem-100x的用量为1ml,青链霉素100x的用量为200
µ
l,atra的用量为1
µ
m,姜黄素的用量为0.5
µ
m;然后置于37℃、5% co2培养箱中培养5d,中间每2 d换液1次。
47.(2)分化后吸弃分化培养基,使用pbs清洗2次,加入神经元维持培养基继续培养10天,每100ml神经元维持培养基中bdnf的浓度为50ng/ml,ngf的浓度为10ng/ml,mem-100x 的用量为1ml,青链霉素100x的用量为200
µ
l,b27-50x的用量为2ml;每2 d进行神经元维持培养基换液1次,待细胞突触伸展开后进行神经细胞鉴定。
48.结果分析:1、肿瘤干细胞肿瘤干细胞图1为获取的肿瘤干细胞,所获得的肿瘤干细胞悬浮生长,并聚集成球生长。
49.通过流式鉴定图2可知,所获得的肿瘤干细胞具备cd133
+
cd44
+
oct4
+
三阳性特性。
50.2、肿瘤干细胞分化图3是肿瘤干细胞向u-118mg细胞分化图,从图中可以看出肿瘤干细胞在肿瘤细胞培养环境下能快速向肿瘤细胞分化,说明得到的肿瘤干具有多向分化能力。
51.图4为肿瘤干细胞向神经元分化后透射光图,说明起源于肿瘤干细胞的神经细胞具有神经元的基本特性,且有明显的突触产生,在向神经元分化环境下能迅速向神经元分化,这也验证了肿瘤干的多向分化的特性。
52.3、荧光鉴定采用免疫荧光法鉴定神经元标志物β
ⅲ‑
tubulin,步骤如下:(1)弃上清液,pbs轻轻清洗残留培养液,4 %多聚甲醛室温固定20 min后加入过量pbs轻轻混匀后离心,pbs洗2次每次3 min。然后将细胞样本与0.25%triton-x100孵育在pbs中培养30分钟以增加通透性。
53.(2)用5 %的羊血清封闭30 min,以封闭非特异性着色。
54.(3)吸除封闭液,加入已配好的鼠源一抗 anti-βiii tubulin孵育液(1μg/ml),4 ℃孵育12 h。
55.(4)pbs洗涤3次,加入山羊抗鼠fitc标记的二抗室温避光孵育2 h。
56.(5)pbs洗涤3次,加入dapi稀释液(1:200),室温避光孵育3-5 min。
57.(6)pbs洗涤3次,加入适量pbs(pbs需覆盖细胞),荧光显微镜下观察、拍照记录。
58.鉴定结果如图5所示,从图中可以看出分化后的神经细胞具有神经元特异性标志物βiii tubulin阳性特征。
59.4、分化后的神经干细胞性能测试电生理实验方法:膜片钳电生理技术是用微玻管电极(膜片吸管或膜片电极)接触细胞膜,以千兆欧姆以上的阻抗使之封接,使与电极尖开口处相接的细胞膜小区域(膜片)与其周围在电学上分隔,在此基础上固定点位,对此膜片上的离子通道的离子电流(pa级)进行监测记录的方法。
60.记录的方法是:用场效应管运算放大器构成的i-v转换器,是测量回路的核心部分。在场效应管运算放大器的正负输入端子为等电位,向正输入端子施加指令电位时,由于短路负端子以及膜片都可等电位地达到钳制的目的,当膜片微电极尖端与膜片之间形成10 gω以上封接时,其间的分流电流达到最小,横跨膜片的电流可100 %作为来自膜片电极的记录电流(l p)而被测量出来。
61.电生理检测所用微电极制备:购买洁净的玻璃毛坯直接进行电极拉制,也可购买非洁净玻璃毛坯清洗后进行电极拉制。为了降低对单通道记录中出现的噪音,最好对玻璃毛坯进行再次清洗。对玻璃毛坯清洗的方法一般为使用无水乙醇进行浸泡,超声进行10min处理,然后再用去离子水清洗3次,然后于200 ℃烘箱烘干备用。为了防止电极内产生表面
张力,不要使用清洗剂进行清洗。由于膜片钳电生理试验中所使用的微电极不需要刺入细胞内,电极尖端不要求非常尖。拉制电极时一般需要二次拉制,因为第一次拉制可以使玻璃变软且拉开一定距离,此步可以使玻璃电极拉开形成一个官腔,即形成一个电极的颈部。第二次拉制是使用偏低的温度,以便于拉断细管,形成两个相同的电极。拉制成的电极尖端直径一般为1-5
µ
m,而ringer氏液体充盈后其电阻为1-5mω。使用膜片钳放大器可以检测到其电阻。使用玻璃电极时要现用现拉,以避免电极粘附尘土。而存放缓冲液的电极盒、电极罐与玻璃皿不能隔夜放存,只能临时放存缓冲液。
62.拉制电极的仪器种类繁多:有水平式的、垂直式的以及部分设备还配备抛光系统。玻璃微电极的厂家主要包括日本的narishige公司和美国的sutter公司(产品分为p-200,p-100,p-97)。使用铂金片拉制电极的设备如:美国sutter公司的p-100和p-97。此类设备需要注意如下细节:(1)玻璃电极拉制前预热拉制仪器30min.(2)注意拉制玻璃电极时不能手触铂金片,以免影响拉制时的各个参数,甚至更换铂金片。
63.(3)铂金片要及时更换,因为长时间使用铂金片会变老化,影响电极的电阻。
64.(4)不能使用钳子更换铂金片,否则会降低其使用寿命。
65.(5)拉制电极时不易于一次性拉制多个电极以免电极间存在大的差异。
66.(6)拉制仪的冷却风出口需要放置干燥剂,当干燥剂受潮变成粉末时要及时更换新的干燥剂。
67.(7)不要随便更改拉制仪的参数,如实验要求需要更改参数时必须备份原参数或选择别的频道设定。
68.本实验使用的微电极是经过两次拉制所得,调节拉制速度、压力、拉力与温度后将玻璃软化,拉成很细的杆状结构,然后再一次从杆的中央拉成两头很尖的电极,充满电极液后使电阻在2-4mω。为了防止灰尘污染,电极在使用前拉制。由于膜电容和串联电阻补偿要求高,所以实验时微电极电阻应在2-4mω左右,以保证实验结果的准确性。
69.电生理记录:当对细胞进行封接后,在显微镜下操作电极仪,将记录电极接入检测细胞上,然后给负压进行抽吸以完成gω封接,再进行电容补偿,给予负压破膜,形成全细胞记录模式。实验数据使用epc-10放大器采集信号,并将采集到的数据存储在patchmaster软件中。
70.图6为钠电流i-v曲线图,从图中可以看出分化后的神经元具有明显的钠电流信号。
71.对比例1在上述实施例的基础上,不添加姜黄素。
72.经过同样的方法诱导培养后,不加姜黄素的神经元分化情况如图7所示,分化后的神经细胞突触较加姜黄素的实施例短,说明添加姜黄素能够促进神经细胞的分化,增强了的向神经元分化的能力,且分化后的神经元具有成熟神经元的标志物,并具有钠离子信号。
73.表1试剂名称表试剂名称中文名称及解释fbs胎牛血清
mem-100x非必须氨基酸溶液青链霉素100x青链霉素bdnf脑源性神经营养因子ngf神经生长因子b27-50xb27添加剂dmem/f12dmem/f12培养基neurobasalmediuma完全培养基神经元生长及维持基础培养基bfgf重组人成纤维细胞生长因子egf重组人上皮生长因子以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1