使用咪唑配体的Ru催化连锁加氢甲酰化/氢化/酯化的制作方法
使用咪唑配体的ru催化连锁加氢甲酰化/氢化/酯化
技术领域
1.本发明涉及使用咪唑配体进行的ru催化的连锁(domino)加氢甲酰化/氢化/酯化。
背景技术:
2.ep 0 329 252b1描述了制备羧酸或酯的方法。所述方法在此是通过使用钌化合物与酸性化合物的组合而被催化的。所述酸性化合物在此包含以下元素中的一种:磷、锑、砷、钼、钨。
3.在i.fleischer,k.m.dyballa,r.jennerjahn,r.jackstell,r. franke,a.spannenberg,m.beller,“from olefins to alcohols: efficient and regioselective ruthenium-catalyzed dominohydroformylation/reduction sequence(从烯烃到醇:有效的和区域选择性的钌催化的连锁加氢甲酰化/还原序列)”,angew.chem.int. ed.2013,52,2949
–
2953中描述了进行加氢甲酰化和随后还原的方法。所用的烯烃在此被转化成醛并最终被还原成醇。
技术实现要素:
4.本发明要解决的技术问题是提供一种方法,该方法从烯烃开始直接导致形成酯,而不用分离中间体。在此,原始的烯烃要形成所述酯的醇部分,即经由氧键合于c=o基团的碳原子上。另外,所述酯的醇部分要具有比所用的烯烃多一个碳。
5.这个问题通过根据权利要求1的方法得到解决。
6.所述方法包括以下方法步骤:
7.a)将烯属不饱和化合物初始加料;
8.b)添加式(i)的配体和包含ru的化合物:
[0009][0010]
其中
[0011]
r1选自:-(c
1-c
12
)-烷基、-(c
6-c
12
)-环烷基、-(c
6-c
20
)-芳基、
ꢀ‑
(c
5-c
20
)-杂芳基,
[0012]
其中所述-(c
6-c
12
)-环烷基基团、所述-(c
6-c
20
)-芳基基团和所述
ꢀ‑
(c
5-c
20
)-杂芳基基团可具有取代基,所述取代基选自:-(c
1-c
12
)-烷基、
ꢀ‑
o-(c
1-c
12
)-烷基;
[0013]
r2和r3选自:-(c
1-c
12
)-烷基、-(c
6-c
12
)-环烷基、-(c
6-c
20
)-芳基;
[0014]
其中所述-(c
6-c
12
)-环烷基基团和所述-(c
6-c
20
)-芳基基团可具有取代基,所述取代基选自:-(c
1-c
12
)-烷基、-o-(c
1-c
12
)-烷基;
[0015]
c)添加具有式(iia)或(iib)的酸(ii):
[0016]
[0017]
其中r4是-(c
1-c
18
)-烷基;
[0018][0019]
其中r5是-(c
1-c
18
)-烷基;
[0020]
d1)输入co;
[0021]
e)将得自a)至d)的反应混合物加热,在此将所述烯属不饱和化合物直接转化成酸(ii)的酯或二酯,而不用分离中间体。
[0022]
在此,步骤d)包括方法步骤d1)和任选另外的方法步骤d2)、 d3)和d4)。
[0023]
在此,方法步骤a)、b)、c)和d)可以任何希望的顺序实施。然而,典型地,在共反应物已经被初始加料到步骤a)至c)中之后实施co的添加。步骤d)和e)可同时实施或者相继实施。此外,也可以在两个或更多个步骤中输入co,使得例如,首先输入所述co的一部分,然后将混合物加热,和然后输入另一部分co。
[0024]
表述“(c
1-c
12
)-烷基”包括具有1至12个碳原子的直链和支化的烷基基团。合适的(c
1-c
12
)-烷基基团尤其是甲基、乙基、丙基、异丙基、正丁基、异丁基、仲丁基、叔丁基、正戊基、2-戊基、2-甲基丁基、 3-甲基丁基、1,2-二甲基丙基、1,1-二甲基丙基、2,2-二甲基丙基、1
‑ꢀ
乙基丙基、正己基、2-己基、2-甲基戊基、3-甲基戊基、4-甲基戊基、 1,1-二甲基丁基、1,2-二甲基丁基、2,2-二甲基丁基、1,3-二甲基丁基、 2,3-二甲基丁基、3,3-二甲基丁基、1,1,2-三甲基丙基、1,2,2-三甲基丙基、1-乙基丁基、1-乙基-2-甲基丙基、正庚基、2-庚基、3-庚基、2
‑ꢀ
乙基戊基、1-丙基丁基、正辛基、2-乙基己基、2-丙基庚基、壬基、癸基。
[0025]
表述(c
6-c
12
)-环烷基包括单环、二环或三环的烃基基团。
[0026]
表述(c
6-c
20
)-芳基包括具有6至20个碳原子的单环或多环的芳族烃基基团。这些优选是(c
6-c
14
)-芳基,更优选是(c
6-c
10
)-芳基。
[0027]
合适的(c
6-c
20
)-芳基基团尤其是苯基、萘基、茚基、芴基、蒽基、菲基、并四苯基、基、芘基、晕苯基。优选的(c
6-c
20
)-芳基基团是苯基、萘基和蒽基。
[0028]
表述“(c
5-c
20
)-杂芳基”包括具有5至20个碳原子的单环或多环的芳族烃基团,其中所述碳原子中的一个或多个被杂原子替代。优选的杂原子是n、o和s。所述(c
5-c
20
)-杂芳基基团具有5至20个,优选 5或6个环原子。因此,例如,在本发明范围内,吡啶基是c
6-杂芳基基团,和呋喃基是c
5-杂芳基基团。
[0029]
合适的(c
5-c
20
)-杂芳基基团尤其是呋喃基、噻吩基、吡咯基、唑基、异唑基、噻唑基、异噻唑基、咪唑基、吡唑基、呋咱基、四唑基、吡啶基、哒嗪基、嘧啶基、吡嗪基、苯并呋喃基、吲哚基、异吲哚基、苯并咪唑基、喹啉基、异喹啉基。
[0030]
在根据本发明的方法中用作反应物的烯属不饱和化合物含有一个或多个碳-碳双键。为了简化,这些化合物在下文中也被称为烯烃。所述双键可以是末端的或内部的。所述烯属不饱和化合物优选具有一个碳-碳双键。
[0031]
优选的是具有2至30个碳原子,优选2至22个碳原子,更优选 2至12个碳原子的烯属不饱和化合物。
[0032]
在一个实施方案中,所述烯属不饱和化合物选自:乙烯、丙烯、 1-丁烯、顺式-和/或反式-2-丁烯、异丁烯、1,3-丁二烯、1-戊烯、顺式
ꢀ‑
和/或反式-2-戊烯、2-甲基-1-丁烯、
3-甲基-1-丁烯、2-甲基-2-丁烯、己烯、四甲基乙烯、庚烯、1-辛烯、2-辛烯、二正丁烯或它们的混合物。
[0033]
在一个实施方案中,r1选自:-(c
1-c
12
)-烷基、-(c
6-c
20
)-芳基、
ꢀ‑
(c
5-c
20
)-杂芳基。
[0034]
在一个实施方案中,r2和r3是-(c
3-c
12
)-环烷基。
[0035]
在一个实施方案中,r2和r3是cy。
[0036]
在一个实施方案中,所述包含ru的化合物选自:ru3(co)
12
、 rucl3·
h2o、ru(cl)2(dmso)4、ru(acac)3。
[0037]
在一个实施方案中,所述包含ru的化合物是ru3(co)
12
。
[0038]
在一个实施方案中,r4是-(c
1-c
12
)-烷基。
[0039]
在一个实施方案中,r4是-(c
1-c8)-烷基。
[0040]
在一个实施方案中,r5是-(c
1-c
12
)-烷基。
[0041]
在一个实施方案中,r5是-(c
1-c8)-烷基。
[0042]
在一个实施方案中,所述方法包括额外的方法步骤d2):
[0043]
d2)输入h2。
[0044]
在一个实施方案中,所述h2的压力在1mpa(10巴)至6mpa (60巴)范围内。
[0045]
在一个实施方案中,所述方法包括额外的方法步骤d3):
[0046]
d3)添加h2o。
[0047]
在一个实施方案中,添加的h2o的量使得h2o与所述烯属不饱和化合物的摩尔比例在1:1至10:1范围内。
[0048]
在一个实施方案中,所述方法包括额外的方法步骤d4):
[0049]
d4)添加对甲苯磺酸。
[0050]
在一个实施方案中,在方法步骤c)中添加的酸(ii)的量使得酸与所述烯属不饱和化合物的摩尔比例在2:1至10:1范围内。
[0051]
在一个实施方案中,所述酸(ii)具有式(iia)。
[0052]
在一个实施方案中,所述酸(ii)具有式(iib)。
[0053]
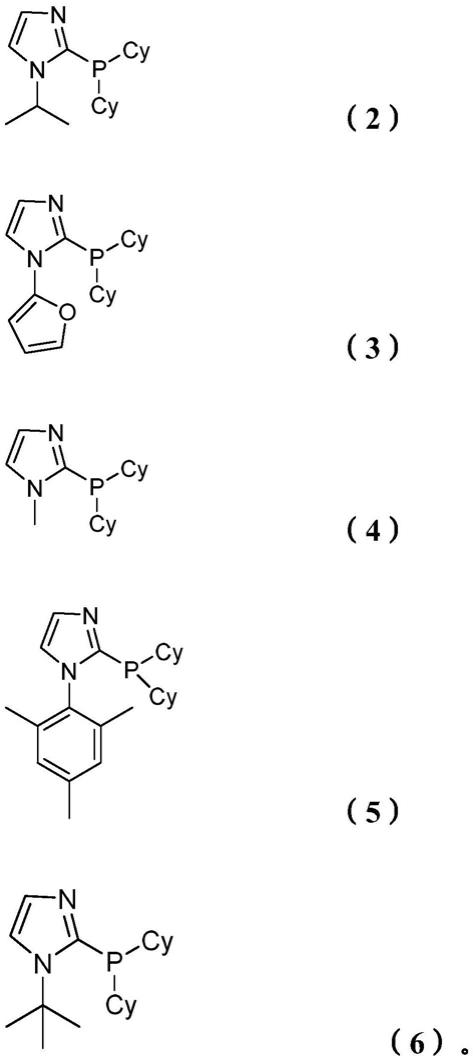
在一个实施方案中,在方法步骤b)中的配体选自:
[0054][0055][0056]
在一个实施方案中,在方法步骤e)中将所述反应混合物加热到在50℃至180℃之间,优选在80℃至160℃之间,更优选在100℃至 150℃之间的温度,以将所述烯属不饱和化合物转化成酯。
具体实施方式
[0057]
下文中通过实施例详细描述本发明。
[0058]
通用操作程序
[0059]
采用对空气和湿气敏感的物质进行的所有操作都是在氩气气氛中并使用经烘干的玻璃仪器采用希莱克(schlenk)技术进行的。化学品得自商业制造商,并且如果纯度为至少98%,则如供应时那样使用。在氩气下通过蒸馏预先准备不含氧且干燥的溶剂。合成气(co: 99.997%,h2/co:1:1+/-1%)得自公司linde。
[0060]
通过1h-nmr和
13
c-nmr波谱法对产物进行分析。在型号为bruker av 400(400mhz)、bruker av 300(300mhz)或fourier 300(mhz)的仪器上记录所述nmr波谱。相对于所用的溶剂报告化学位移δ(ppm):cdcl3的参比为7.26ppm(1h-nmr)和77.16 (
13
c-nmr)。采用宽带解耦方法记录
13
c-nmr波谱。
[0061]
使用30m hp-5柱在得自公司agilent technologies的7890a gc 系统上进行gc分析。所用的载气是氩气。通过gc或gc-ms对产物进行分析或者通过柱色谱法(二氧化硅,乙酸乙酯(etoac)/庚烷) 将产物分离。通过内部校准法计算gc收率。将十六烷用作内标。
[0062]
催化实验的实施
[0063][0064]
在具有螺旋盖和ptfe隔片的4ml玻璃小瓶中进行催化实验。所述小瓶配备有经烘箱干燥的磁力搅拌子,并且使用针头连接于气体气氛。反应批量是2ml。将所述小瓶放置在300ml parr4560高压釜中,并使用磁力搅拌器进行搅拌。在第一步骤中,将ru3(co)
12 (5mol%)、配体(5.5mol%)和ptsa
·
h2o(20.6mol%)称重到所述小瓶中。将所述小瓶用配备有隔片的螺旋盖密封,并经由套管连接于氩气气氛。将所述小瓶排空并用氩气吹扫三次。通过hamilton 注射器注射乙酸(1.17ml)、h2o(0.35ml)和1-辛烯(3mmol)。将所述小瓶在氩气气氛下转移到所述高压釜中。将所述高压釜严密密封并首先在室温下用10巴co吹扫三次。随后,施加40巴co,将所述高压釜放置在磁力搅拌器上的铝块中,并将其加热到140℃保持 20小时。在20小时后,将所述高压釜冷却到室温并小心地卸压。将 100μl十六烷作为内标引入到反应溶液中。通过gc分析测定收率。
[0065]
对于配体(1)至(6)和对于对比配体(7),在类似条件下进行反应。由于对比配体(7)是双齿配体,因此仅使用0.55mol%而非 1.1mol%。
[0066][0067]
反应条件
[0068]
1-辛烯:3mmol
[0069]
ru3(co)
12
:5mol%ru
[0070]
配体(1)至(6):基于所述烯烃计5.5mol%
[0071]
配体(7):基于所述烯烃计2.75mol%
[0072]
ptsa
·
h2o,在使用(1)-(6)的情况下:20.6mol%
[0073]
ptsa
·
h2o,在使用(7)的情况下:10.3mol%
[0074]
h2o:1-辛烯=6.5:1(摩尔比例)
[0075]
hoac:1-辛烯=6.75:1(摩尔比例)
[0076]
co压力:40巴
[0077]
温度:140℃
[0078]
反应时间:20小时
[0079]
实验结果
[0080]
配体酯收率[%](1)*28(2)*28(3)*24(4)*21(5)*25(6)*18(7)10
[0081]
*本发明的方法。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1