一种膜联蛋白V与血管生成抑制剂融合蛋白的构建方法和应用与流程
一种膜联蛋白v与血管生成抑制剂融合蛋白的构建方法和应用
技术领域
1.本发明涉及生物技术领域,具体涉及一种膜联蛋白v与血管生成抑制剂融合蛋白的构建方法和应用。
背景技术:
2.膜联蛋白(annexins)是真核生物中广泛存在的一类蛋白家族。其中,膜联蛋白v(annexin v,a5)是annexins家族中分布最广、含量最丰富的成员之一。当细胞凋亡时,其磷脂酰丝氨酸(ps)会外翻,而膜联蛋白v可与ps特异结合,因此膜联蛋白v常常被用作细胞凋亡的检测工具。
3.近年来在研究中发现,膜联蛋白v对肿瘤代谢起着一定的作用,但其具体作用机制还尚未明了。又有研究中发现肿瘤血管内皮细胞的ps暴露,所以,可以利用膜联蛋白v与肿瘤血管内皮细胞的ps结合的性质,膜联蛋白v很可能对肿瘤细能够有着导向作用。
4.自20世纪70年代folkman教授等提出肿瘤生长和转移依赖于肿瘤内部新生血管形成的观点后,国内外很多研究致力于通过阻断肿瘤新生血管形成来达到治疗肿瘤的目的,诸如interferonsα/β,angiostatin,endostatin,vasostatin,canstatin,tumstatin,platelet factor-4,thrombospodin-1,il-12,16kd prolactin片段,il-18,ip-10,53kd antithrombin iii等一系列血管生成抑制剂蛋白被先后发现。
5.血管生成抑制剂蛋白,如内皮抑素(endostatin):可过抑制内皮细胞迁移,促进其凋亡,使肿瘤内部无法形成微血管,从而延缓肿瘤的发展与转移。内皮抑素在临床中有一定的疗效,但也存在着一些问题,例如,虽然使用内皮抑素比单独化疗更有效率,但其没有靶向性,且具有副作用,60%多的病人无法从中获益。内皮抑素在大肠杆菌中表达时以不溶性的包涵体产物形式表达,需要经过复杂的体外变复性过程才能获得具有生物活性的内皮抑素。
6.因此,如何增强包括内皮抑素在内的血管生成抑制剂蛋白的抑制血管生成的活性,一直是科学家们努力的目标。
技术实现要素:
7.为解决现有技术中存在的问题,本发明通过构建膜联蛋白v与血管生成抑制剂融合蛋白,利用膜联蛋白v对肿瘤血管导向性,设计膜联蛋白v与血管生成抑制剂蛋白质分子的融合蛋白,具有显著的协同效果。
8.为了实现上述目的,本发明采用了如下技术方案:本发明的一种膜联蛋白v与血管生成抑制剂融合蛋白,所述的膜联蛋白v(annexinv)的氨基酸序列如seq id no:1所示,所述的血管生成抑制剂包括但不限于具有血管生成抑制活性的interferonsα/β、angiostatin、endostatin、vasostatin、canstatin、tumstatin、platelet factor-4、thrombospodin-1、il-12、16kd prolactin片段、il-18、ip-10或53kd antithrombin iii。
9.进一步地,所述的血管生成抑制剂为内皮抑素(endostatin),所述的内皮抑素endostatin的氨基酸序列如seq id no:2所示。
10.进一步地,所述的膜联蛋白v与血管生成抑制剂融合蛋白具有如下氨基酸序列:
11.(1)由seq id no.3或seq id no.4所示的氨基酸序列组成的蛋白质;或
12.(2)与序列seq id no.3或seq id no.4限定的氨基酸序列同源性在80%至100%编码相同功能蛋白质的氨基酸序列;或
13.(3)seq id no.3或seq id no.4所示的氨基酸序列经增加、缺失或替换一个或多个氨基酸具有同等活性的由(1)衍生的蛋白。
14.本发明的一种核酸分子,其编码所述的膜联蛋白v与血管生成抑制剂融合蛋白。
15.本发明所述的膜联蛋白v与血管生成抑制剂融合蛋白的构建方法,包括以下步骤:(1)设计膜联蛋白v与内皮抑素融合蛋白结构;
16.(2)构建包含膜联蛋白v与内皮抑素融合蛋白基因的质粒;
17.(3)获得膜联蛋白v与内皮抑素融合蛋白可溶性表达的表达菌株;
18.(4)表达和纯化可溶性的膜联蛋白v与内皮抑素融合蛋白。
19.进一步地,在步骤(1)中,设计膜联蛋白v与内皮抑素融合蛋白;
20.在步骤(2)中,构建融合蛋白的表达菌株,采用pet28a载体,膜联蛋白v与内皮抑素蛋白之间插入8个氨基酸残基来连接,设计并购买引物后,进行pcr,采用酶primer star,退火温度设为tm值-5℃;回收得的片段同载体酶切,室温过夜酶连,制得pet28a-annexinv-endostatin重组质粒;
21.在步骤(3)中,转化top10感受态菌株后涂布平板,挑单克隆存样送测序公司测序,检验是否成功构建,提取质粒转化到大肠杆菌表达菌株bl21(de3)中;
22.在步骤(4)中,表达并纯化蛋白:iptg诱导表达目的融合蛋白,sds-page检验样品分子量,确定目的蛋白;通过亲和层析初步纯化目的融合蛋白,再用阴离子交换层析进一步纯化制得目的膜联蛋白v与内皮抑素融合蛋白,得到的纯化蛋白可进行活性检验。
23.进一步地,在步骤(1)中,设计与膜联蛋白v融合的蛋白具有类似endostatin的血管生成抑制剂的效应;在步骤(2)中,采用pet28a载体,annexinv与类似endostatin的血管生成抑制剂蛋白之间插入8个甘氨酸残基来连接。设计引物后,通过pcr扩增;以bamhi-xhoi为酶切位点,通过双酶切,t4 dna连接酶连接的方法整合到载体pet-28a质粒中;
24.在步骤(3)中,通过cacl2方法制备感受态大肠杆菌bl21(de3),将含有目的基因的质粒转化到大肠杆菌表达菌株bl21(de3)中;将冻存的重组表达质粒保种菌株接入含有50mg/l卡那霉素的3ml液体lb培养基中,37℃震荡培养过夜;将活化后的菌液接种到含有相同浓度卡那霉素的3ml液体lb培养基中,37℃培养12h;次日,将过夜菌接种到500ml,含有50mg/l卡那霉素的液体lb培养基中,37℃震荡培养3~4h,至od600值达到0.6时,向培养液中加入iptg,20℃诱导表达16~20h;
25.在步骤(4)中,通过sds-page检验是否得到目的蛋白。
26.更进一步地,在步骤(3)中,通过超声破碎菌体;将培养液转移到离心管中,4℃、6000r/min离心15min,用预冷的hepes-nacl缓冲液洗涤菌体,6000r/min再次离心15min,收集菌体;菌体重悬于40ml ni结合缓冲液中,进行超声波破碎,确保超声在低温条件下进行,防止蛋白变性,超声波破碎参数设置为3s间隔8s,净超声时间20min,直至菌液澄清为止;超
声完毕后,4℃下12000r/min离心10min,取上清,备用;在步骤(4)中,由于融合蛋白以可溶性形式表达,采用亲和层析初步纯化蛋白;以ni琼脂糖凝胶介质,进行层析;ni洗脱液中缓慢加入20%~30%硫酸铵固体,并不断搅拌;然后,将溶液放置在磁力搅拌器上,4℃过夜,使目的蛋白充分沉淀;次日,4℃、12000r/min离心30min,收集沉淀,沉淀用hepes-nacl缓冲液重悬溶解,纯化得到蛋白纯度大于95%。
27.进一步地,融合蛋白具有比膜联蛋白v与血管生成抑制剂联合应用更强的抑制血管内皮细胞的活性,融合蛋白中膜联蛋白v与血管生成抑制剂的顺序不影响融合蛋白的表达、纯化和活性。
28.本发明所述的膜联蛋白v与血管生成抑制剂融合蛋白在筛选和开发相关药物中的应用。
29.有益效果:本发明利用膜联蛋白v对肿瘤血管导向性,可以显著增加被融合的血管生成抑制剂蛋白的血管生成抑制活性,以膜联蛋白v与内皮抑素融合蛋白为例,融合蛋白诱导血管内皮细胞凋亡的活性是膜联蛋白v与内皮抑素混合联用诱导血管内皮细胞凋亡的活性的2.4倍,达到了协同增效的作用效果。同时,通过与膜联蛋白v融合,包含血管生成抑制剂内皮抑素的融合蛋白获得了可溶性表达,避免了内皮抑素单独表达时易形成包涵体产物、必须经过体外复性复杂工艺才能获得生物活性的尴尬局面。
30.与现有技术相比,本发明具有如下优点:(1)本发明分别同时构建了膜联蛋白v-血管生成抑制剂融合蛋白,以及血管生成抑制剂-膜联蛋白v融合蛋白,将膜联蛋白v与血管生成抑制剂融合蛋白的顺序进行互换,既不影响其可溶性表达和分离纯化,也不影响其显著增强的抑制血管生成的生物活性。
31.(2)本发明给出了一种显著协同增强血管生成抑制剂蛋白的血管生成抑制活性的蛋白质改造方案,能提高血管生成抑制剂蛋白药物的疗效。该方案同时能够显著改善血管生成抑制剂在大肠杆菌中表达时的可溶性。
32.(3)使用sephadex g-50作为填料制作分子筛层析柱,对膜联蛋白v与内皮抑素融合蛋白进行hepes-nacl缓冲液置换,以去除阴离子交换层析洗脱组分中含有的高浓度nacl,减少对后续实验的干扰。
附图说明
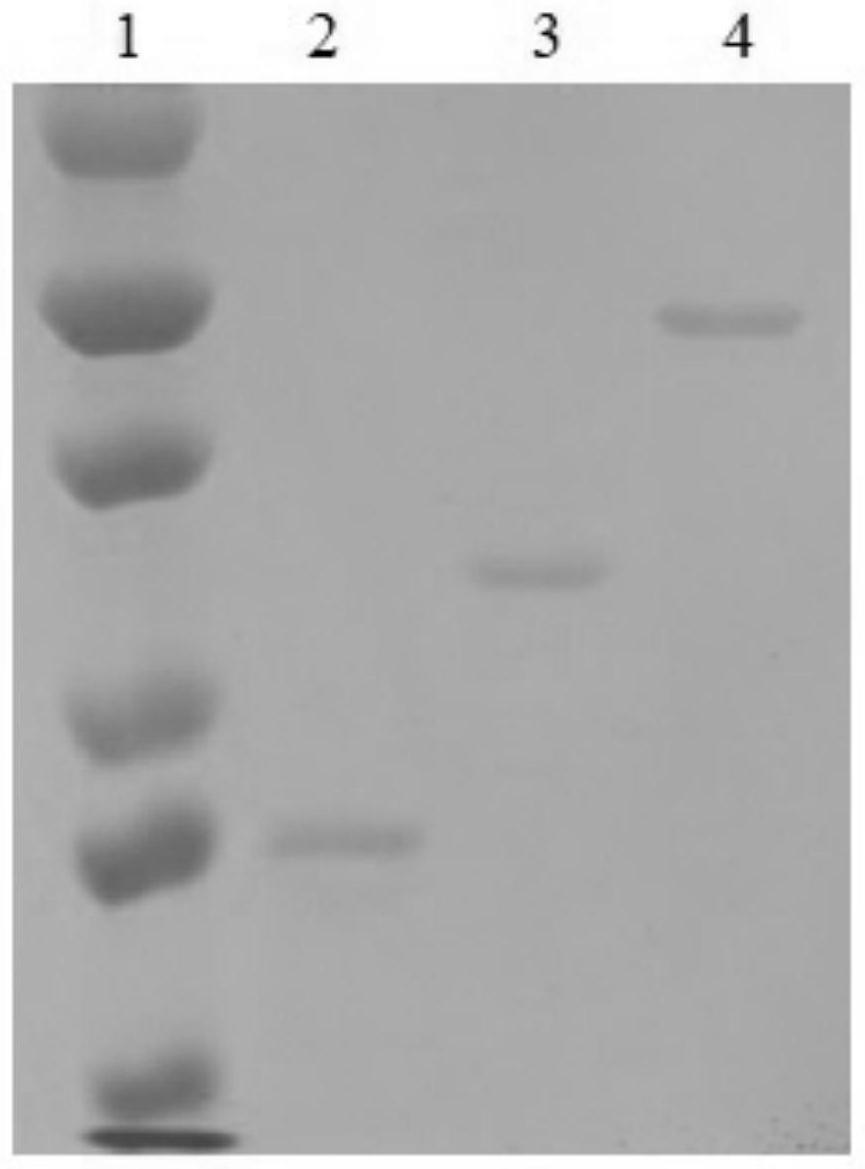
33.图1为本发明表达纯化的融合蛋白图;
34.1、蛋白质分子量标准;2、endostatin蛋白;3、annexinv蛋白;4、膜联蛋白v与内皮抑素融合蛋白(annexinv-endostatin)。
35.图2为本发明中融合蛋白初步纯化结果图;
36.图3为本发明中融合蛋白进一步纯化结果图;
37.图4为本发明融合蛋白在不同浓度下诱导huvec细胞凋亡的效果的倒置显微镜观察结果图;
38.图5为本发明融合蛋白诱导huvec细胞凋亡的效果的pi/annexinv双染色法检验结果图。
39.图6为本发明融合蛋白抑制huvec细胞增殖的结果图。
40.1、膜联蛋白v蛋白;2、内皮抑素蛋白;3、膜联蛋白v与内皮抑素融合蛋白
(annexinv-endostatin);4、膜联蛋白v与内皮抑素蛋白的联合应用。
具体实施方式
41.下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。
42.实施例1
43.本发明的一种膜联蛋白v与血管生成抑制剂融合蛋白,所述的血管生成抑制剂包括但不限于具有血管生成抑制活性的interferonsα/β,angiostatin,endostatin,vasostatin,canstatin,tumstatin,platelet factor-4,thrombospodin-1,il-12,16kd prolactin片段,il-18,ip-10,53kd antithrombin iii等。所述的膜联蛋白v与血管生成抑制剂融合蛋白包括膜联蛋白v与内皮抑素(endostatin)的融合蛋白,所述的膜联蛋白v(annexin v)的氨基酸序列如seq id no:1所示,所述的内皮抑素(endostatin)的氨基酸序列如seq id no:2所示。
44.所述的膜联蛋白v与血管生成抑制剂融合蛋白具有如下氨基酸序列:
45.(1)由seq id no.1所示的氨基酸序列组成的蛋白质;或
46.(2)与序列seq id no.1限定的氨基酸序列同源性在80%至100%编码相同功能蛋白质的氨基酸序列;或
47.(3)seq id no.1所示的氨基酸序列经增加、缺失或替换一个或多个氨基酸具有同等活性的由(1)衍生的蛋白。
48.本发明的一种核酸分子,其编码所述的膜联蛋白v与血管生成抑制剂融合蛋白。
49.实施例2
50.本发明所述的膜联蛋白v与血管生成抑制剂融合蛋白的构建方法,包括以下步骤:
51.(1)设计膜联蛋白v与内皮抑素融合蛋白;设计与annexinv融合的蛋白具有类似endostatin的血管生成抑制剂的效应;
52.(2)构建融合蛋白的表达菌株,采用pet28a载体,annexinv与具有类似endostatin的血管生成抑制剂蛋白之间插入8个氨基酸残基来连接,设计并购买引物后,进行pcr,采用酶primer star,退火温度设为tm值-5℃;回收得的片段同载体酶切,室温过夜酶连,制得pet28a-annexinv-endostatin重组质粒;采用pet28a载体,annexinv与具有类似endostatin的血管生成抑制剂蛋白之间插入8个甘氨酸残基来连接。设计引物后,通过pcr扩增;以bamhi-xhoi为酶切位点,通过双酶切,t4 dna连接酶连接的方法整合到载体pet-28a质粒中;
53.(3)转化top10感受态菌株后涂布平板,挑单克隆存样送测序公司测序,检验是否成功构建,提取质粒转化到大肠杆菌表达菌株bl21(de3)中;通过cacl2方法制备感受态大肠杆菌bl21(de3),将含有目的基因的质粒转化到大肠杆菌表达菌株bl21(de3)中。
54.将冻存的含pet28a-annexinv-endostatin重组质粒保种菌株接入含有50mg/l卡那霉素的3ml液体lb培养基中,37℃震荡培养过夜。将活化后的菌液接种到含有相同浓度卡那霉素的3ml液体lb培养基中,37℃培养12h;次日,将过夜菌接种到500ml,含有50mg/l卡那霉素的液体lb培养基中,37℃震荡培养3~4h,至od600值达到0.6时,向培养液中加入iptg,20℃诱导表达16~20h;通过超声破碎菌体;将培养液转移到离心管中,4℃、6000r/min离心
15min,用预冷的hepes-nacl缓冲液洗涤菌体,6000r/min再次离心15min,收集菌体。菌体重悬于40ml ni结合缓冲液中,进行超声波破碎,确保超声在低温条件下进行,防止蛋白变性,超声波破碎参数设置为3s间隔8s,净超声时间20min,直至菌液澄清为止。超声完毕后,4℃下12000r/min离心10min,取上清。
55.(4)取5ml ni琼脂糖凝胶介质,加入层析柱中,使填料自然沉降30min,将层析柱、蛋白质紫外吸收检测仪和恒流泵通过软管连接起来,通过恒流泵将ni结合缓冲液泵入层析柱,对填料进行预平衡,平衡体积约为5~10倍柱体积。调节紫外检测仪透光率为100%,光吸收为0。将上述上清的过滤液通过恒流泵加入层析柱,样品加载完毕后,用ni洗涤缓冲液洗脱未结合ni的杂质蛋白,直至od值下降并稳定至基线附近。使用ni洗脱缓冲液洗脱目的蛋白,收集最大吸收峰处的洗脱组分。ni柱洗脱液中含有高浓度咪唑,直接冻存会导致蛋白质变性,选用硫酸铵沉淀目的蛋白以去除咪唑。
56.表达并纯化可溶性表达的融合蛋白,iptg诱导表达目的融合蛋白,sds-page检验样品分子量,确定目的蛋白;通过亲和层析初步纯化目的融合蛋白,再用阴离子交换层析进一步纯化制得目的膜联蛋白v与血管生成抑制剂融合蛋白,得到的纯化蛋白可进行活性检验。通过sds-page检验是否得到目的蛋白。采用亲和层析初步纯化蛋白。以ni琼脂糖凝胶介质,进行层析;ni洗脱液中缓慢加入20%~30%硫酸铵固体,并不断搅拌。然后,将溶液放置在磁力搅拌器上,4℃过夜,使目的蛋白充分沉淀;次日,4℃、12000r/min离心30min,收集沉淀,沉淀用hepes-nacl缓冲液重悬溶解,纯化得到蛋白含量约为95%(图1)。
57.采用阴离子交换层析进一步纯化。阴离子交换柱装柱方法同ni柱。阴离子交换柱先用10mmol/l tris-hcl缓冲液进行预平衡。硫酸铵沉淀得到的蛋白质稀释后,用0.2微米的滤膜过滤,通过恒流泵加入阴离子交换柱。上样完毕后,用洗涤缓冲液洗脱未能结合的杂蛋白,用洗脱缓冲液洗脱目的蛋白,收集最大吸收峰处的洗脱液。
58.使用sephadex g-50作为填料制作分子筛层析柱,对膜联蛋白v与内皮抑素融合蛋白进行hepes-nacl缓冲液置换,以去除阴离子交换层析洗脱组分中含有的高浓度nacl,减少对后续实验的干扰。
59.本发明所述的膜联蛋白v与内皮抑素融合蛋白在筛选和开发相关药物中的应用。
60.试验例1
61.1.构建pet28a-annexinv-endostatin质粒
62.annexinv序列:seq id no:1;endostatin序列:seq id no:2;
63.载体采用pet28a,目的基因膜联蛋白v与内皮抑素融合蛋白annexin v-endostatin之间插入8个甘氨酸残基作为linker。设计引物后,以bamhi-xhoi为酶切位点,通过双酶切,t4 dna连接酶连接的方法整合到载体pet-28a质粒中,通过cacl2方法转化到大肠杆菌top10感受态中。
64.从含有目的基因的top10大肠杆菌中提取pet28a-annexinv-endostatin质粒,通过cacl2方法把含有目的基因的质粒转化到大肠杆菌表达菌株bl21(de3)中。
65.2.annexinv-endostatin融合蛋白的表达与纯化
66.将冻存的含pet28a-annexinv-endostatin重组质粒保种菌株接入含有50mg/l卡那霉素的3ml液体lb培养基中,37℃震荡培养过夜。将活化后的菌液接种到含有相同浓度卡那霉素的3ml液体lb培养基中,37℃培养12h。次日,将过夜菌接种到500ml,含有50mg/l卡那
霉素的液体lb培养基中,37℃震荡培养3~4h,至od600值达到0.6的时候,向培养液中加入iptg,20℃诱导表达16~20h。通过sds-page检验目的蛋白,是否成功的可溶性表达。
67.首先采用亲和层析初纯蛋白。将培养液转移到离心管中,4℃、6000r/min离心15min,用预冷的hepes-nacl缓冲液洗涤菌体,6000r/min再次离心15min,收集菌体。菌体重悬于40ml ni结合缓冲液中,进行超声波破碎,确保超声在低温条件下进行,防止蛋白变性,超声波破碎参数设置为3s间隔8s,净超声时间20min,直至菌液澄清为止。超声完毕后,4℃下12000r/min离心10min,取上清,备用。
68.取5ml ni琼脂糖凝胶介质,加入层析柱中,使填料自然沉降30min,将层析柱、蛋白质紫外吸收检测仪和恒流泵通过软管连接起来,通过恒流泵将ni结合缓冲液泵入层析柱,对填料进行预平衡,平衡体积约为5~10倍柱体积。调节紫外检测仪透光率为100%,光吸收为0。
69.将上述上清的过滤液通过恒流泵加入层析柱,样品加载完毕后,用ni洗涤缓冲液洗脱未结合ni的杂质蛋白,直至od值下降并稳定至基线附近。使用ni洗脱缓冲液洗脱可溶性表达的目的蛋白,收集最大吸收峰处的洗脱组分。ni柱洗脱液中含有高浓度咪唑,直接冻存会导致蛋白质变性,选用硫酸铵沉淀目的蛋白以去除咪唑。向ni洗脱液中缓慢加入20%~30%硫酸铵固体,并不断搅拌。然后,将溶液放置在磁力搅拌器上,4℃过夜,使目的蛋白充分沉淀。次日,4℃、12000r/min离心30min,收集沉淀,沉淀用hepes-nacl缓冲液重悬溶解。sds-page检验(如图2)。
70.如图2所示,图2为本发明中融合蛋白初步纯化结果图;上排1:蛋白质标准;上排2~3:加样穿过液;上排4~下排3:洗涤所得杂蛋白;下排4~14:洗脱所得目的蛋白,框中为目的蛋白条带。
71.采用阴离子交换层析进一步纯化。阴离子交换柱装柱方法同ni柱。阴离子交换柱先用10mmol/l tris-hcl缓冲液进行预平衡。硫酸铵沉淀得到的蛋白质稀释后,用0.2微米的滤膜过滤,通过恒流泵加入阴离子交换柱。上样完毕后,用洗涤缓冲液洗脱未能结合的杂蛋白,用洗脱缓冲液洗脱目的蛋白,收集最大吸收峰处的洗脱液。
72.使用sephadex g-50作为填料制作分子筛层析柱,对annexin v-endostatin进行hepes-nacl缓冲液置换,以去除阴离子交换层析洗脱组分中含有的高浓度nacl,减少对后续实验的干扰。sds-page检验如图3所示。图3为本发明中融合蛋白进一步纯化结果图;1:蛋白质标准;2~3:膜吸附对照组;11~12:洗脱液;红框内表示目的蛋白。
73.经过分离纯化,膜联蛋白v与内皮抑素融合蛋白的纯度大于95%(图1)
74.内皮抑素含有三对复杂构象的二硫键,这种结构使得内皮抑素在大肠杆菌中表达时易形成包涵体产物,必须经过复杂、耗时、耗力的变复性工艺,才能获得具有生物活性的重组人内皮抑素。当内皮抑素与分子量为其175%倍的膜联蛋白v融合时,融合蛋白在大肠杆菌中表达时,融合蛋白形成包涵体产物的严重程度就难以避免,融合蛋白的体外复性的难度也强远高于重组人内皮抑素。但是,由于内皮抑素与膜联蛋白v融合表达,结果包含内皮抑素的融合蛋白却大部分产物都以可溶性的形式获得表达、从而能够利用简单的层析方法进行分离纯化,避免了内皮抑素单独表达时易形成包涵体产物、必须经过体外复性复杂工艺才能获得生物活性的复杂、耗时、耗力的工艺。
75.3.检测融合蛋白诱导huvec细胞凋亡的效果。
76.倒置显微镜观察,图4为本发明融合蛋白在不同浓度下诱导huvec细胞凋亡的效果的倒置显微镜观察结果图。图4中实验分为四组:annexin v组;endostatin组;annexin v-endostatin融合蛋白组;annexin v与endostatin联合组。
77.通过流式细胞仪,采用pi/annexin v双染色法检验凋亡细胞。
78.流式细胞仪可检验细胞荧光强度,pi为细胞核染料,因无法穿过细胞膜而只能作用于已凋亡细胞,annexin v-egfp可结合早期凋亡细胞上的ps出荧光。根据这两种荧光强度的不同,判断细胞处于凋亡的哪个阶段。
79.如图5所示,图5为本发明融合蛋白诱导huvec细胞凋亡的效果的pi/annexin v双染色法检验结果图。横坐标表示annexin v-egfp荧光强度,纵坐标表示pi荧光强度。可见融合蛋白组诱导huvec细胞凋亡比例(25.1%)高于单独用药(分别为6.44%和6.69%)和联合用药(10.48%)。有效性显著提高。
80.4.检测融合蛋白抑制huvec细胞增殖的效果。
81.利用mtt法检测膜联蛋白v、内皮抑素蛋白,及其融合蛋白抑制huvec细胞增殖的效果,结果如图6所示。抑制huvec细胞增殖的效果为如下顺序:膜联蛋白v与内皮抑素融合蛋白>膜联蛋白v+内皮抑素蛋白>内皮抑素蛋白>膜联蛋白v。
82.本发明分别同时构建了膜联蛋白v-血管生成抑制剂融合蛋白(seq id no.3),以及血管生成抑制剂-膜联蛋白v融合蛋白(seq id no.4),将膜联蛋白v与血管生成抑制剂融合蛋白的顺序进行互换(seq id no.3、seq id no.4),既不影响其可溶性表达和分离纯化,也不影响其显著增强的抑制血管生成的生物活性。尽管已经示出和描述了本发明的实施例,对于本领域的普通技术人员而言,可以理解在不脱离本发明的原理和精神的情况下可以对这些实施例进行多种变化、修改、替换和变型,本发明的范围由所附权利要求及其等同物限定。
83.上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1