一种用于检测犬细环病毒的引物和TaqMan探针及其应用
一种用于检测犬细环病毒的引物和taqman探针及其应用
技术领域
1.本发明涉及分子生物学领域,特别是涉及一种用于检测犬细环病毒的引物和taqman探针及其应用。
背景技术:
2.细环病毒(torque teno virus)属于指环病毒科,于1997年在一名日本输血后的患者体内被检测到,是一种环状、单链、无囊膜、直径为30~32nm的dna病毒,基因组大小为2.1~3.8kb。最初被认为是通过输血传播,后被发现其传播方式多样,且广泛分布于全世界。它具有非常快的突变速率,使其不同分离株之间的基因组编码蛋白的差异可以达到47%~70%。
3.国际病毒分类委员会将其归为指环病毒科(anelloviridae),并进一步分为甲型细环病毒属(alphatorquevirus)、乙型细环病毒属(betatorquevirus)、丙型细环病毒(gammatorquevirus)、丁型细环病毒属(deltatorquevirus)等10个病毒属。其中犬细环病毒属于辛型细环病毒属(thetatorquevirus),目前致病作用尚不明确,其在与其他病原体合并感染中的作用迄今尚未被研究清楚。因此,从预防的角度来说,对于犬细环病毒致病作用的深入研究和检测方法的建立具有重要的意义。
4.taqman实时荧光定量pcr技术是基于传统pcr技术的基础上,添加一条具有荧光标记的核酸杂交探针,其序列的5'端有一个报告荧光基团,3'端有一个猝灭荧光基团。在pcr过程中,探针能够特异性的结合到目标基因上,由于猝灭荧光基团的作用,探针并不会对外释放荧光。到了pcr延伸阶段,伴随着聚合酶将探针水解,报告荧光基团和猝灭荧光基团分开,释放出荧光信号,并被监测系统接收到。目前虽然有用于犬细小病毒检测的产品,但是存在特异性不高、灵敏度强、检测过程复杂、时间长、易污染等问题,不能为检测犬细小病毒提供一种有效、可靠的方法。
技术实现要素:
5.本发明的目的是提供一种用于检测犬细环病毒的引物和taqman探针及其应用,以解决上述现有技术存在的问题,具有检测时间短、灵敏性高、特异性强、重复性好等优势,同时也有效的解决了传统pcr污染问题,为犬细环病毒的检测提供了一种有效的技术手段。
6.为实现上述目的,本发明提供了如下方案:
7.本发明提供一种检测犬细环病毒的引物和探针,包括:
8.上游检测引物:5'-taccgaaagtggcgaagacc-3';
9.下游检测引物:5'-gctgcgggttccattgc-3';
10.探针:5'-cgggggcaccaaaagacaatacat-3'。
11.上述引物不仅适用于犬细环病毒的实时荧光定量pcr检测,还适用于传统pcr的检测,其检测对象为犬细环病毒的orf1基因。若以待检样品提取的dna为模板,经过引物的引导进行扩增,得到的扩增产物的片段长度为178bp,则表明样品中含有犬细环病毒。
12.优选的是,所述探针的5'端的报告荧光基团为fam,3'端的猝灭荧光基团为bhq。
13.本发明还提供一种检测犬细环病毒的质粒引物,所述质粒引物能够扩增出包含所述的引物和探针的扩增片段的全部序列,所述扩增片段如seq id no:6所示;
14.所述质粒引物包括上游质粒引物:5'-tggagtcacgggctctggt-3';下游质粒引物:5'-gccgcatcctccgactaa-3'。
15.在上述引物(seq id no:1和seq id no:2)两侧的基因组序列上,设计上述的一对新的质粒引物,其扩增片段长度为395bp,涵盖了荧光定量引物扩增片段(178bp)的全部。
16.本发明还提供一种检测犬细环病毒的试剂盒,包括所述的引物和探针或者所述的质粒引物。
17.本发明还提供一种非疾病诊断目的的检测犬细环病毒的方法,包括:利用所述的引物和探针或者所述的质粒引物进行实时荧光定量反应,反应结束后,将模板dna的cq值与标准曲线对照,得到模板dna中犬细环病毒目的基因片段拷贝浓度。
18.优选的是,利用所述引物和探针进行实时荧光定量反应的反应体系包括:10μl 2
×
fastfire qpcr premix,8μl rnase-free ddh2o,1μl的标准质粒模板,0.4μl上游检测引物,0.4μl下游检测引物,0.2μl taqman探针;
19.反应程序为:94℃180s,共1个循环;94℃5s,60℃30s,共40个循环。
20.优选的是,利用所述质粒引物进行实时荧光定量反应的反应体系包括:12.5μl 2
×
tap pcr mastermix,1μl上游质粒引物,1μl下游质粒引物,1μldna样品为模板,9.5μl ddh2o;
21.反应程序为:95℃5min,共1个循环;95℃30s,60℃30s,72℃30s,共35个循环;72℃10min,共1个循环;4℃。
22.本发明还提供所述的引物和探针,或者所述的质粒引物在制备检测犬细环病毒产品中的应用。
23.本发明公开了以下技术效果:
24.(1)检测时间短。使用提取的dna为模板,传统pcr需要约一个半小时扩增结束,且经过凝胶电泳后才能得到检测结果;而taqman实时荧光定量pcr只需约50分钟(二步法)就能够完成检测的全过程,并得到检测结果。
25.(2)检测灵敏度高。本发明所使用的taqman实时荧光定量pcr技术,其灵敏度可达到101拷贝数/μl,比常规pcr灵敏约100倍。
26.(3)检测特异性强。本发明的引物和探针序列与其他物种基因相似度低,能够很好的与犬细环病毒的orf1片段结合。
27.(4)检测重复性好。本发明经过三次平行重复性实验,得到的变异系数仅为0.05%~0.40%,说明本发明具有良好的稳定性。
28.(5)鉴定简便。通过软件生成的扩增曲线就可以得到精确的检测结果,无需电泳等其它后续步骤。
附图说明
29.为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施
例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
30.图1为以标准品质粒为模板进行实时荧光定量pcr的标准曲线;
31.图2为以标准品质粒为模板进行实时荧光定量pcr的扩增曲线;
32.图3为cattv实时荧光定量pcr检测方法特异性检测的扩增结果;
33.图4为cattv实时荧光定量pcr检测方法重复性检测的扩增结果。
具体实施方式
34.现详细说明本发明的多种示例性实施方式,该详细说明不应认为是对本发明的限制,而应理解为是对本发明的某些方面、特性和实施方案的更详细的描述。
35.应理解本发明中所述的术语仅仅是为描述特别的实施方式,并非用于限制本发明。另外,对于本发明中的数值范围,应理解为还具体公开了该范围的上限和下限之间的每个中间值。在任何陈述值或陈述范围内的中间值以及任何其他陈述值或在所述范围内的中间值之间的每个较小的范围也包括在本发明内。这些较小范围的上限和下限可独立地包括或排除在范围内。
36.除非另有说明,否则本文使用的所有技术和科学术语具有本发明所述领域的常规技术人员通常理解的相同含义。虽然本发明仅描述了优选的方法和材料,但是在本发明的实施或测试中也可以使用与本文所述相似或等同的任何方法和材料。本说明书中提到的所有文献通过引用并入,用以公开和描述与所述文献相关的方法和/或材料。在与任何并入的文献冲突时,以本说明书的内容为准。
37.在不背离本发明的范围或精神的情况下,可对本发明说明书的具体实施方式做多种改进和变化,这对本领域技术人员而言是显而易见的。由本发明的说明书得到的其他实施方式对技术人员而言是显而易见的。本技术说明书和实施例仅是示例性的。
38.关于本文中所使用的“包含”、“包括”、“具有”、“含有”等等,均为开放性的用语,即意指包含但不限于。
39.实施例1cattv的实时荧光定量pcr检测方法的有效性实验
40.1、引物和taqman探针设计
41.通过从genbank中检索,获得cattv的全基因组序列12株(genbank登录号分别为ab076002.1,mk050988.1,mk050987.1,mz503911.1,mz503910.1,kx827767.1,kx827769.1,kx377522.1,kx827768.1,kx827771.1,gu951508.1,kx827770.1),用dnastar软件megalign进行基因序列比对,并在(登录号为mk050988.1为模板)orf1中的保守区域进行引物与探针的设计,并由通用公司合成。
42.上游检测引物:5'-taccgaaagtggcgaagacc-3'(seq id no:1);
43.下游检测引物:5'-gctgcgggttccattgc-3'(seq id no:2);
44.探针:fam-5'-cgggggcaccaaaagacaatacat-3'-bhq(seq id no:5)。
45.2、毒株
46.实验所用cattv由本实验室鉴定并保存,且该毒株也可以通过从ncbi中获取上述序列,然后通过本领域常用的普通生物方法合成获得。
47.3、病毒核酸的提取
48.将采取的样本按照天根基因组试剂盒(天根生物技术有限公司)说明书的方法,进行病毒基因组的提取,放置在-40℃的环境下保存至使用。
49.4、重组质粒的构建
50.4.1质粒引物的设计
51.在上述检测引物(seq id no:1和seq id no:2)两侧的基因组序列上,设计一对新的质粒引物,其扩增片段长度为395bp,涵盖了检测引物扩增片段(178bp)的全部,该对质粒引物的序列如下:
52.上游质粒引物:5
’‑
tggagtcacgggctctggt-3’(seq id no:3);
53.下游质粒引物:5
’‑
gccgcatcctccgactaa-3’(seq id no:4)。
54.质粒引物扩增片段序列(395bp,seq id no:6):tggagtcacgggctctggtgccactgccacgactggacgcaacacctcaaaaaagcaacgcgagaatgcggttccggtaccgaaagtggcgaagaccccgccgtctctttcgatctcgtagacgacgcggctatgctcgccgccgctggagacgccgagcctggggccgccggaggcgggtaaggagataccgaaggcggcgcgggggcaccaaaagacaatacatttctagtattatgcaatggaacccgcagcaccgccatctttgctatatcaaaggcatcacgtggctctgcgcagccagagcagaccgcatgtcctggccaggcattaaacagatagcggctacggactccacaagatattggagcactattttagtcggaggatgcggc;
55.检测引物扩增片段序列(178bp,seq id no:7):taccgaaagtggcgaagaccccgccgtctctttcgatctcgtagacgacgcggctatgctcgccgccgctggagacgccgagcctggggccgccggaggcgggtaaggagataccgaaggcggcgcgggggcaccaaaagacaatacatttctagtattatgcaatggaacccgcagc。
56.4.2目的条带的扩增与纯化
57.以通过检测引物检测并测序的cattv阳性样本dna为模板,利用上述质粒引物进行pcr扩增。
58.其中,25μl反应体系为:12.5μl 2
×
tap pcr mastermix,1μl上游质粒引物,1μl下游质粒引物,1μldna样品为模板,9.5μl ddh2o(双蒸馏水)。
59.反应程序为:95℃5min(预变性),共1个循环;95℃30s(变形),60℃30s(退火),72℃30s(延伸),共35个循环;72℃10min(终延伸),共1个循环;4℃(降温)。
60.将得到的pcr产物经过1.5%琼脂糖凝胶电泳鉴定片段大小,再进行胶回收,获得用于构建重组质粒的目的dna片段。
61.4.3连接
62.将经过胶回收纯化后的目的dna片段与pmd19-t载体(购自takara公司)连接。连接体系:solution i 5μl、胶回收产物4μl、pmd-19t载体1μl。连接条件:16℃2~3h。
63.4.4转化
64.转化dh5
ɑ
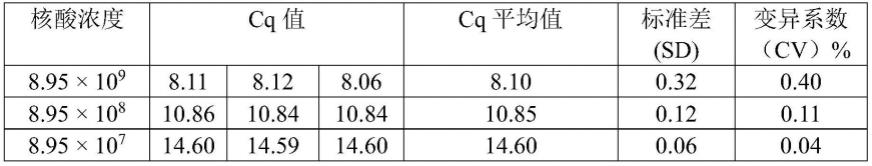
感受态细胞,具体操作如下:
65.(1)取50μl dh5
ɑ
感受态细胞置于冰盒上解冻。
66.(2)加入5μl连接产物,轻轻震荡后放置冰上30min。
67.(3)将其轻轻摇晃后插入42℃水浴锅中,进行90s的热休克,然后迅速放回冰上,静置150s。
68.(4)加入800μl 37℃不含抗生素的lb液体培养基,轻轻混匀,在置于37℃200rpm的摇床中培养1~2h。
69.(5)6000rpm离心3min,弃上清液700μl,保留100μl液体充分重悬细菌沉淀。
70.(6)将重悬后的液体涂布于带有氨苄抗性的lb固体培养基中,37℃过夜培养。
71.4.5质粒的提取和测序
72.经过过夜培养后,挑取阳性克隆,置于5ml带有氨苄抗性的lb液体培养基中,放在37℃200rpm的摇床上培养12h,将浑浊的菌液用质粒引物进行菌液pcr验证。验证含有目的条带的菌液进行质粒的提取,并取部分质粒测序进行再次验证。
73.实施例2实时荧光定量pcr反应标准曲线的建立
74.利用紫外分光光度计测量出测序后带有目的片段的重组质粒,经公式计算测得重组质粒浓度为8.95
×
10
10
copies/μl,并对其进行10倍稀释,得到拷贝数为8.95
×
101~8.95
×
108copies/μl的标准质粒,在检测引物(seq id no:1、seq id no:2)和探针(seq id no:5)的引导下进行实时荧光定量pcr反应。
75.其中,20μl的反应体系为:10μl 2
×
fastfire qpcr premix,8μl rnase-free ddh2o,1μl的标准质粒模板,0.4μl上游检测引物,0.4μl下游检测引物,0.2μl taqman探针。反应程序为:94℃180s(预变性),共1个循环;94℃5s,60℃30s,共40个循环(二步法)。
76.将各稀释梯度的标准质粒样品,根据上述反应体系和反应程序进行检测,得到犬细环病毒的taqman实时荧光定量pcr的标准曲线如图1所示。标准曲线回归方程为:y=-3.296x+41.834,横坐标为质粒拷贝数的对数,纵坐标为cq值。相关系数r2为0.9995,扩增效率为101%。表明不同浓度的目的基因扩增与cq值存在良好的线性关系,所以该反应条件和标准曲线均可以用于相应基因的定量分析。
77.实施例3实时荧光定量pcr反应灵敏性实验的建立
78.对重组质粒同实施例2,进行10倍稀释,得到梯度稀释后的标准质粒作为模板进行实时荧光定量pcr扩增,得到的扩增曲线如图2所示,结果本发明方法的最低检测线为8.95
×
101copies/μl。
79.实施例4实时荧光定量pcr反应特异性实验的建立
80.以犬细环病毒(cattv)阳性样本、犬瘟热病毒(cdv)阳性样本、犬腺病毒2型(cav-2)阳性样本、犬副流感病毒(caiv)阳性样本、犬细小病毒(cpv)阳性样本为模板进行扩增,建立同实施例2的荧光定量pcr反应。
81.反应结果如图3所示,只有cattv阳性样本具有良好的扩增曲线,其他样本均未出现特异性扩增,表明该方法具有良好的特异性。
82.实施例5实时荧光定量pcr反应重复性实验的建立
83.采用实施例2的方法,以不同浓度梯度的标准质粒为模板进行重复性实验,结果如图4所示。将每组数据列入表格,计算数据的标准差和变异系数。结果重复性实验的标准差为0.01~0.32,变异系数为0.05%~0.40%,说明该方法稳定、可靠。建立的实时荧光定量pcr的重复性实验数据如表1所示。
84.表1实时荧光定量pcr重复性实验
85.[0086][0087]
以上所述的实施例仅是对本发明的优选方式进行描述,并非对本发明的范围进行限定,在不脱离本发明设计精神的前提下,本领域普通技术人员对本发明的技术方案做出的各种变形和改进,均应落入本发明权利要求书确定的保护范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1