一种手性吡哆醛催化剂及其制备方法与应用
1.本发明属于有机催化技术领域,涉及一种手性吡哆醛催化剂及其制备方法与应用,尤其涉及一种新型手性吡哆醛催化剂与合成方法及其在炔丙胺α位c-h键官能团化反应中的应用。
背景技术:
2.在生物体内,酶催化甘氨酸对醛的直接加成生成β-羟基-α-氨基酸的反应,化学家们已有广泛的认识,该过程条件温和,甘氨酸直接参与反应,不需要任何保护基。该反应中,酶的活性中心是维生素b6,在体内以磷酸吡哆醛和磷酸吡哆胺的形式存在(pmp和plp)。但酶催化过程同时也面临着价格昂贵、易失活等局限,因此开发相应的仿生催化过程具有重要意义。kuzuhara和breslow课题组利用化学计量的手性吡哆醛模拟生物体内酶催化甘氨酸对醛的加成反应,做出了很多开创性的工作[h.kuzuhara,n.watanabe,m.ando,j.chem.soc.,chem.commun.1987,95-96;m.ando,h.kuzuhara,bull.chem.soc.jpn.1990,63,1925-1928;j.t.koh,l.delaude,r.breslow,j.am.chem.soc.1994,116,11234-11240]。但是,这些反应只能得到中等的对映选择性和较差的非对映选择性。
[0003]
基于前人对手性吡哆醛的研究,赵宝国课题组发展了多种新型高效的手性n-甲基吡哆醛类化合物,已成功应用于甘氨酸衍生物与亚胺或酮的仿生不对称mannich反应和aldol反应,分别合成了具有高立体选择性的手性α,β-二氨基酯和β-羟基-α-氨基酸酯[j.chen,x.gong,j.li,y.li,j.ma,c.hou,g.zhao,w.yuan,b.zhao,science 2018,360,1438-1442;a.cheng,l.zhang,q.zhou,t.liu,j.cao,g.zhao,k.zhang,g.song,b.zhao,angew.chem.int.ed.2021,60,20166-20172]。在以上催化过程中,催化剂均为n-甲基吡哆醛类化合物,亲核试剂均为活性较高的甘氨酸,即n-甲基吡哆醛只实现了高活性甘氨酸α位c-h键官能团化。而对于其他活性较低的伯胺如炔丙胺α位c-h键官能团化,利用现有的n-甲基吡哆醛则难以实现。因此,开发一种新型高效的手性吡哆醛类化合物,催化实现弱活化伯胺如炔丙胺α位c-h键官能团化,并应用于炔丙胺对三氟甲基酮的加成,合成手性β-胺基-α-三氟甲基醇衍生物,有着重要的理论意义和很好的应用潜力。
技术实现要素:
[0004]
本发明的目的就是提供一种新型手性吡哆醛催化剂与合成方法及其在炔丙胺α位c-h键官能团化反应中的应用,用于实现弱活化炔丙胺α位c-h键官能团化,并应用于催化炔丙胺对三氟甲基酮的不对称加成反应,合成一系列具有高立体选择性的β-胺基-α-三氟甲基醇衍生物。
[0005]
本发明的目的可以通过以下技术方案来实现:
[0006]
一种吡哆醛催化剂,具有如式1所示的结构式:
[0007][0008]
进一步包括如式(r,s)-1、式(s,r)-1、式(s,r)-1所示的手性化合物:
[0009][0010]
式中,r1为c
1-24
的烃基或羟甲基;r2、r3分别为氢或c
1-24
的烃基。
[0011]
进一步地,r1为羟甲基、甲基、乙基、正丙基、异丙基、正丁基、环戊基、环己基、环庚基、苯基、苄基、(1-苯基)乙基、1-萘基、2-萘基或卤素中的一种;
[0012]
r2、r3分别为氢、甲基、乙基、正丙基、异丙基、正丁基、叔丁基、环戊基、环己基、环庚基、苯基、苄基、2-联苯基、3-联苯基、4-联苯基、2,6-二联苯基、3,5-二联苯基、1-萘基或2-萘基中的一种。
[0013]
一种手性吡哆醛催化剂的制备方法,包括:
[0014][0015]
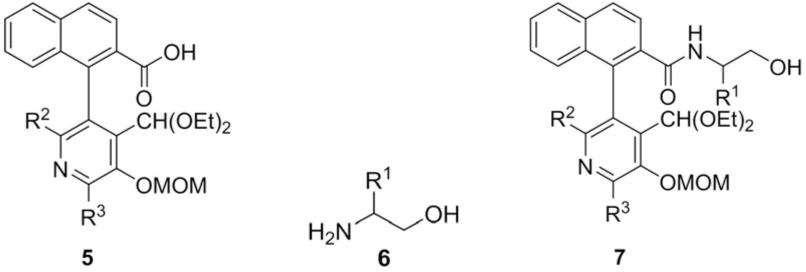
将式5所示的手性酸化合物与式6所示的氨基醇化合物在缩合剂与碱的作用下进行缩合反应,得到式7所示的化合物;再将式7所示的化合物在酸的作用下水解,即得到如式1所示的手性吡哆醛催化剂。
[0016]
其中式5所示的手性酸化合物按照文献方法制备[j.chen,x.gong,j.li,y.li,j.ma,c.hou,g.zhao,w.yuan,b.zhao,science 2018,360,1438-1442],式5所示的手性酸化合物的轴手性构型与式1所示的吡哆醛催化剂的轴手性构型保持一致。
[0017]
进一步地,所述的缩合反应中,手性酸化合物与氨基醇化合物的摩尔比为1:(1-5),反应温度为0-100℃,反应时间为1-48h。
[0018]
进一步地,所述的缩合剂包括edcl、dcc、dic、hatu、hbtu、hctu、tbtu、tstu、tntu、hoat、hobt中的至少一种,手性酸化合物与缩合剂的摩尔比为1:(1-10),缩合剂的作用为促进手性酸化合物形成活性酯或活性酰胺。
[0019]
所述的碱包括氢氧化钠、氢氧化钾、碳酸钠、碳酸钾、碳酸铯、碳酸氢钠、碳酸氢钾、氢化钠、氢化钾、氢化钙、氟化钾、三乙胺、二异丙胺、二异丙基乙基胺、四甲基乙二胺、n,n-二甲基苯胺、n,n-二乙基苯胺、1,4-二氮杂二环辛烷(dabco)、二氮杂二环十二烷(dbu)、正丁基锂、1,4-二甲基哌嗪、1-甲基哌啶、1-甲基吡咯、喹啉或吡啶中的至少一种,手性酸化合物与碱的摩尔比为1:(1-10)。
[0020]
进一步地,水解过程中,式7所示的化合物与酸的摩尔比为1:(1-50),反应温度为0-100℃,反应时间为1-48h。
[0021]
进一步地,所述的酸包括硫酸、盐酸、磷酸、氢溴酸、氢碘酸、醋酸、三氟乙酸、三氯乙酸、苯磺酸、对甲苯磺酸、甲磺酸或三氟甲磺酸中的至少一种,酸溶液的溶剂包括水、二氯甲烷、甲醇、四氢呋喃或二氧六环中的一种。
[0022]
作为优选的技术方案,手性吡哆醛催化剂的制备过程中,所用溶剂包括水、苯、甲苯、二甲苯、三甲苯、乙腈、乙醚、四氢呋喃(thf)、乙二醇二甲醚、氯仿、二氯甲烷(dcm)、甲醇、乙醇、异丙醇、叔丁醇、1,4-二氧六环、n,n
–
二甲基甲酰胺、n,n
–
二甲基乙酰胺、二甲基亚砜或n-甲基吡咯烷酮中的至少一种。
[0023]
一种手性吡哆醛催化剂的应用,包括将所述的手性吡哆醛催化剂用于三氟甲基酮的不对称加成反应,具体包括:
[0024][0025]
将式2所示的炔丙胺、式3所示的三氟甲基酮混合,并在手性吡哆醛催化剂与碱的作用下进行不对称加成反应,得到手性β-胺基-α-三氟甲基醇,即式(3r,4s)-4所示的化合物或式(3s,4s)-4所示的化合物;其中,当手性吡哆醛催化剂轴手性构型为s时,得到的产物为式(3r,4s)-4所示的化合物;当手性吡哆醛催化剂轴手性构型为r时,得到的产物为式(3s,4s)-4所示的化合物;
[0026]
式中,r4、r5分别为氢、下述基团或者含有取代基的下述基团:c1~c
24
的烃基、c3~c
30
的环烷基或芳基、c1~c
24
的羰基、c1~c
24
的磺酰基或磷酰基;
[0027]
所述的取代基包括卤素、c1~c8的烃基、c3~c
12
的环烷基或芳基、c1~c8的羰基、c1~c8的磺酰基或磷酰基、c1~c8的烷氧基或胺基中的至少一种;
[0028]
其中,所述的羰基为醛基、酮羰基、酯羰基、羧基或酰胺基。
[0029]
进一步地,所述的不对称加成反应中,式2所示的炔丙胺、式3所示的三氟甲基酮、手性吡哆醛催化剂的摩尔比为(0.5-5):1:(0.01-0.5),式2所示的炔丙胺与碱的摩尔比为1:(1-20),反应温度为-10℃至100℃,反应时间为1-72h。
[0030]
进一步地,所述的碱包括氢氧化钠、氢氧化钾、碳酸钠、碳酸钾、碳酸铯、碳酸氢钠、碳酸氢钾、氢化钠、氢化钾、氢化钙、氟化钾、三乙胺、二异丙胺、二异丙基乙基胺、四甲基乙二胺、n,n-二甲基苯胺、n,n-二乙基苯胺、1,4-二氮杂二环辛烷(dabco)、二氮杂二环十二烷(dbu)、正丁基锂、1,4-二甲基哌嗪、1-甲基哌啶、1-甲基吡咯、喹啉或吡啶中的至少一种。
[0031]
作为优选的技术方案,所述的不对称加成反应中,所用溶剂包括水、甲醇、乙醇、异丙醇、正丙醇、正丁醇、三氟乙醇、苯、甲苯、二甲苯、三甲苯、乙腈、乙醚、四氢呋喃、乙二醇二
甲醚、氯仿、二氯甲烷、n,n-二甲基甲酰胺、n,n
–
二甲基乙酰胺、二甲基亚砜或n-甲基吡咯烷酮中的至少一种。
[0032]
与现有技术相比,本发明具有以下特点:
[0033]
1)吡哆醛是一类非常重要的、具有很好生物活性的化合物,在生物体系中,它是许多生物酶的辅酶,可以催化甘氨酸衍生物对醛的加成,合成α-羟基-β-氨基酸衍生物。本发明通过模拟生物体内的酶催化过程,开发了一系列手性吡哆醛催化剂,成功实现了弱活化炔丙胺α位c-h键官能团化,并将其应用于炔丙胺对三氟甲基酮的不对称加成反应,实现具有光学活性的手性β-胺基-α-三氟甲基醇衍生物的快捷、有效合成;
[0034]
2)本发明中的手性吡哆醛催化剂可以由廉价易得的原料经多步反应制得,反应条件温和,大多易于放大,可以较大规模制备;
[0035]
3)本发明中吡哆醛催化剂催化的仿生不对称加成反应是制备手性β-胺基-α-三氟甲基醇酸衍生物的一种新方法,该方法模拟了生物体内的酶催化过程:手性吡哆醛催化剂与炔丙胺缩合形成醛亚胺,该醛亚胺的α位c-h去质子化后得到一个活性的碳负离子中间体,然后对三氟甲基酮进行加成,经过水解,生成β-胺基-α-三氟甲基醇,并且重新生成手性吡哆醛催化剂,完成该催化循环过程;
[0036]
4)本发明中吡哆醛催化剂催化该反应条件非常温和,对水和空气都不很敏感,可以在水中进行,反应稳定,容易操作,产物选择性,具有极高的dr值和ee值,收率较高,是制备手性β-胺基-α-三氟甲基醇衍生物的一种有效方法,因此本发明具有较好的应用价值。
具体实施方式
[0037]
下面结合具体实施例对本发明进行详细说明。本实施例以本发明技术方案为前提进行实施,给出了详细的实施方式和具体的操作过程,但本发明的保护范围不限于下述的实施例。
[0038]
实施例1:化合物(s)-7的合成
[0039][0040]
将化合物(s)-5(0.20g,0.47mmol)、化合物6(0.107g,1.17mmol)、1-乙基-(3-二甲基氨基丙基)碳酰二亚胺盐酸盐(edcl,0.135g,0.705mmol)、1-羟基苯并三唑(hobt,0.095g,0.705mmol)溶于新蒸的dcm(3.0ml)中,再注入et3n(0.143g,1.41mmol)。室温下搅拌15小时后,加入3ml水淬灭反应。随后,所得产物混合物用dcm萃取(5ml
×
3),合并有机相,饱和食盐水洗涤,无水na2so4干燥,过滤,浓缩滤液,柱层析得到化合物(s)-7(白色固体,0.193g,产率82%)。
[0041]
white solid;m.p.114-115℃;[α]
d25
=98.3(c=0.1,chcl3);1h nmr(400mhz,cdcl3)δ8.51(s,1h),7.93(d,j=8.4hz,1h),7.88(d,j=8.0hz,1h),7.80(d,j=8.4hz,1h),7.51(t,j=7.4hz,1h),7.37(t,j=8.0hz,1h),7.33(d,j=8.0hz,1h),7.24(d,j=
8.4hz,1h),5.35(d,j=6.8hz,1h),5.24(d,j=7.2hz,1h),5.21(s,1h),3.90-3.82(m,1h),3.62(d,j=4.8hz,2h),3.57(s,3h),3.46-3.41(m,2h),3.26(q,j=6.8hz,2h),3.14-3.02(m,h),2.01(s,3h),0.96(t,j=7.0hz,3h),0.69(t,j=7.0hz,1h);
13
c nmr(100mhz,cdcl3)δ169.4,151.9,149.6,139.1,135.5,134.00,133.97,132.3,132.1,131.4,128.8,128.3,127.1,126.7,126.6,125.8,99.4,96.4,64.8,64.2,62.8,62.6,56.6,53.0,22.3,14.9,14.3;hrms m/z calcd.for c
27h35
n2o7(m+h)
+
:499.2439;found:499.2440.
[0042]
其中例1式5所示的手性酸化合物按照文献方法制备[j.chen,x.gong,j.li,y.li,j.ma,c.hou,g.zhao,w.yuan,b.zhao,science 2018,360,1438-1442]。
[0043]
实施例2:化合物(s)-1的合成
[0044][0045]
将实施例1制备的化合物(s)-7(0.193g,0.387mmol)溶于thf(2.0ml)中,随后注入1m盐酸水溶液(2.0ml),50℃下搅拌11小时后,加入饱和碳酸氢钠水溶液中和ph至7,旋去溶剂,柱层析得到化合物(s)-1(黄色固体,0.085g,产率58%)。
[0046]
yellow solid;m.p.90-93℃;[α]
d25
=40.0(c=0.1,ch3oh);1h nmr(400mhz,cdcl3)δ10.86(brs,1h),9.36(s,1h),8.49(s,1h),8.01(d,j=8.8hz,1h),7.97(d,j=8.0hz,1h),7.70(d,j=8.4hz,1h),7.60(t,j=7.6hz,1h),7.50(t,j=7.8hz,1h),7.25(d,j=8.0hz,1h),6.64(d,j=8.0hz,1h),3.88(brs,1h),3.79(d,j=11.2hz,1h),3.60(t,j=10.4hz,2h),3.40-3.34(m,1h),2.07(s,3h);
13
c nmr(100mhz,cdcl3)δ197.4,169.0,153.3,148.2,141.4,134.5,134.0,132.6,131.9,130.0,129.8,128.8,128.4,127.9,126.0,123.71,123.66,62.8,62.6,52.0,21.3;hrms m/z calcd.for c
21h21
n2o5(m+h
+
):381.1445;found:381.1445.
[0047]
实施例3:手性吡哆醛类催化剂(r,s)-1a催化合成β-胺基-α-三氟甲基醇4a
[0048][0049]
依次将手性吡哆醛催化剂(s)-1a(4.3mg,0.01mmol)、k2co3(41.5mg,0.30mmol)加入到2ml反应瓶中,注入dcm(0.3ml),再依次注入炔丙胺2a(41.5mg,0.3mmol)、三氟酮3a(50.4mg,0.20mmol)、h2o(20μl),加入搅拌子,盖上塞子,25℃下搅拌36小时。之后加入一水合肼溶液(20μl,80wt%in h2o)搅拌30min淬灭反应,旋去溶剂,柱层析得到化合物4a(黄色固体,37.8mg,产率49%)。
[0050]
4a的dr值是通过1h nmr分析其反应粗产物得到,其dr值为大于20:1;4a的ee值是通过hplc分析其与n,n
’‑
硫羰基二咪唑衍生化后的产物得到,其ee值为-94%。
[0051]
yellow solid;m.p.67-70℃;[α]
d25
=27.1(c=0.1,chcl3);1h nmr(400mhz,cdcl3)δ8.12(d,j=8.4hz,1h),7.84(d,j=8.4hz,1h),7.75-7.70(m,1h),7.46-7.28(m,9h),4.26(s,1h),3.50-3.34(m,1h),3.33-3.21(m,1h),2.42-2.27(m,2h);
13
c nmr(100mhz,cdcl3)δ138.1,134.0,131.9,131.8,128.92,128.90,128.5,127.1,126.34(q,j
c-f
=285.4hz),126.33,126.2,125.8,125.7,123.8,122.2,86.9,85.9,75.1(q,j
c-f
=25.8hz),46.3,34.3,28.2,26.7;
19
f nmr(376mhz,cdcl3)δ-76.5;hrms m/z calcd.for c
23h21
f3no(m+h
+
):384.1570;found:384.1574.
[0052]
实施例4:手性吡哆醛类催化剂(r,s)-1b催化合成β-胺基-α-三氟甲基醇4a
[0053][0054]
与实施例3相比,区别仅在于:采用吡哆醛(r,s)-1b取代(r,s)-1a,其余同实施例3。柱层析得到化合物4a(黄色固体,34.5mg,产率45%)。
[0055]
4a的dr值是通过1h nmr分析其反应粗产物得到,其dr值为大于20:1;4a的ee值是通过hplc分析其与n,n
’‑
硫羰基二咪唑衍生化后的产物得到,其ee值为-94%。
[0056]
实施例5:手性吡哆醛类催化剂(r,s)-1c催化合成β-胺基-α-三氟甲基醇4a
[0057][0058]
与实施例3相比,区别仅在于:采用吡哆醛(r,s)-1c取代(r,s)-1a,其余同实施例3。柱层析得到化合物4a(黄色固体,30.5mg,产率45%)。
[0059]
4a的dr值是通过1h nmr分析其反应粗产物得到,其dr值为大于20:1;4a的ee值是通过hplc分析其与n,n
’‑
硫羰基二咪唑衍生化后的产物得到,其ee值为-93%。
[0060]
实施例6:手性吡哆醛类催化剂(r,s)-1d催化合成β-胺基-α-三氟甲基醇4a
[0061][0062]
与实施例3相比,区别仅在于:采用吡哆醛(r,s)-1d取代(r,s)-1a,其余同实施例3。柱层析得到化合物4a(黄色固体,34.8mg,产率44%)。
[0063]
4a的dr值是通过1h nmr分析其反应粗产物得到,其dr值为10:1;4a的ee值是通过hplc分析其与n,n
’‑
硫羰基二咪唑衍生化后的产物得到,其ee值为-91%。
[0064]
实施例7:手性吡哆醛类催化剂(r,s)-1e催化合成β-胺基-α-三氟甲基醇4a
[0065][0066]
与实施例3相比,区别仅在于:采用吡哆醛(r,s)-1e取代(r,s)-1a,其余同实施例3。柱层析得到化合物4a(黄色固体,11.9mg,产率15%)。
[0067]
4a的dr值是通过1h nmr分析其反应粗产物得到,其dr值为1.8:1;4a的ee值是通过hplc分析其与n,n
’‑
硫羰基二咪唑衍生化后的产物得到,其ee值为-88%。
[0068]
实施例8:手性吡哆醛类催化剂(r,s)-1f催化合成β-胺基-α-三氟甲基醇4a
[0069][0070]
与实施例3相比,区别仅在于:采用吡哆醛(r,s)-1f取代(r,s)-1a,其余同实施例3。柱层析得到化合物4a(黄色固体,10.3mg,产率13%)。
[0071]
4a的dr值是通过1h nmr分析其反应粗产物得到,其dr值为1.3:1;4a的ee值是通过hplc分析其与n,n
’‑
硫羰基二咪唑衍生化后的产物得到,其ee值为-88%。
[0072]
实施例9:手性吡哆醛类催化剂(r,s)-1g催化合成β-胺基-α-三氟甲基醇4a
[0073][0074]
依次将手性吡哆醛催化剂(s)-1g(7.6mg,0.02mmol)、k2co3(41.5mg,0.30mmol)加入到2ml反应瓶中,注入dcm(0.3ml),再依次注入炔丙胺2a(41.5mg,0.3mmol)、三氟酮3a(50.4mg,0.20mmol)、h2o(20μl),加入搅拌子,盖上塞子,25℃下搅拌36小时。之后加入一水合肼溶液(20μl,80wt%in h2o)搅拌30min淬灭反应,旋去溶剂,柱层析得到化合物4a(黄色固体,62.2mg,产率81%)。
[0075]
4a的dr值是通过1h nmr分析其反应粗产物得到,其dr值为大于20:1;4a的ee值是通过hplc分析其与n,n
’‑
硫羰基二咪唑衍生化后的产物得到,其ee值为95%。
[0076]
yellow solid;m.p.67-70℃;[α]
d25
=27.1(c=0.1,chcl3);1h nmr(400mhz,cdcl3)δ8.12(d,j=8.4hz,1h),7.84(d,j=8.4hz,1h),7.75-7.70(m,1h),7.46-7.28(m,9h),4.26(s,1h),3.50-3.34(m,1h),3.33-3.21(m,1h),2.42-2.27(m,2h);
13
c nmr(100mhz,cdcl3)δ138.1,134.0,131.9,131.8,128.92,128.90,128.5,127.1,126.34(q,j
c-f
=285.4hz),126.33,126.2,125.8,125.7,123.8,122.2,86.9,85.9,75.1(q,j
c-f
=25.8hz),46.3,34.3,28.2,26.7;
19
f nmr(376mhz,cdcl3)δ-76.5;hrms m/z calcd.for c
23h21
f3no(m+h
+
):384.1570;found:384.1574.
[0077]
实施例10:手性吡哆醛类催化剂(s)-1g催化合成β-胺基-α-三氟甲基醇4b
[0078][0079]
与实施例9相比,区别仅在于:采用三氟酮3b取代3a,其余同实施例3。柱层析得到化合物4b(黄色油状液体,56.0mg,产率77%)。
[0080]
4b的dr值是通过1h nmr分析其反应粗产物得到,其dr值为大于20:1;4b的ee值是通过hplc分析其与n,n
’‑
硫羰基二咪唑衍生化后的产物得到,其ee值为95%。
[0081]
yellow oil;[α]
d25
=25.4(c=0.1,chcl3);1h nmr(400mhz,cdcl3)δ7.42(d,j=6.8hz,2h),7.37-7.30(m,3h),7.14(d,j=8.0hz,2h),6.82(d,j=8.0hz,2h),4.21(s,1h),3.78(s,3h),2.87-2.74(m,2h),2.32-2.10(m,2h);
13
c nmr(100mhz,cdcl3)δ158.0,133.9,131.8,129.4,128.9,128.5,126.3(q,j
c-f
=285.5hz),122.2,114.0,86.7,85.7,74.9(q,j
c-f
=25.8hz),55.4,46.2,35.3,28.5;
19
f nmr(376mhz,cdcl3)δ-76.6;hrms m/z calcd.for c
20h21
f3no2(m+h
+
):364.1519;found:364.1521.
[0082]
实施例11:手性吡哆醛类催化剂(s)-1g催化合成β-胺基-α-三氟甲基醇4c
[0083][0084]
与实施例9相比,区别仅在于:采用三氟酮3c取代3a,其余同实施例3。柱层析得到化合物4c(黄色固体,50.8mg,产率70%)。
[0085]
4c的dr值是通过1h nmr分析其反应粗产物得到,其dr值为大于20:1;4c的ee值是通过hplc分析其与n,n
’‑
硫羰基二咪唑衍生化后的产物得到,其ee值为97%。
[0086]
yellow solid;m.p.85-89℃;[α]
d25
=12.1(c=0.1,chcl3);1h nmr(400mhz,cdcl3)δ7.43(d,j=6.8hz,2h),7.40-7.29(m,3h),7.12(q,j=7.6hz,4h),4.22(s,1h),2.94-2.79(m,2h),2.33(s,3h),2.31-2.14(m,2h);
13
c nmr(100mhz,cdcl3)δ138.8,135.7,131.8,129.3,128.9,128.5,128.4,126.3(q,j
c-f
=285.4hz),122.2,86.7,85.7,74.9(q,j
c-f
=25.7hz),46.2,35.2,28.9,21.1;
19
f nmr(376mhz,cdcl3)δ-76.6;hrms m/z calcd.for c
21h21
n2o4(m+h
+
):365.1501;found:365.1505.
[0087]
实施例12:手性吡哆醛类催化剂(s)-1g催化合成β-胺基-α-三氟甲基醇4d
[0088][0089]
与实施例9相比,区别仅在于:采用三氟酮3d取代3a,其余同实施例3。柱层析得到化合物4d(白色固体,50.4mg,产率74%)。
[0090]
4d的dr值是通过1h nmr分析其反应粗产物得到,其dr值为大于20:1;4d的ee值是
通过hplc分析其与n,n
’‑
硫羰基二咪唑衍生化后的产物得到,其ee值为93%。
[0091]
white solid;m.p.65-69℃;[α]
d25
=17.5(c=0.1,chcl3);1h nmr(400mhz,
[0092]
cdcl3)δ7.44-7.39(m,2h),7.37-7.30(m,3h),7.22(s,1h),7.18(t,j=7.6hz,2h),7.10(d,j=6.8hz,1h),4.22(s,1h),2.86(pd,j=12.0,5.6hz,2h),2.31-2.11(m,2h);
13
c nmr(100mhz,cdcl3)δ144.0,134.4,131.8,129.9,129.0,128.7,128.6,126.7,126.4,126.3(q,j
c-f
=285.5hz),122.1,86.5,86.0,74.7(q,j
c-f
=25.8hz),46.2,34.8,29.2.;
19
f nmr(376mhz,cdcl3)δ-76.7;hrms m/z calcd.for c
19h18
clf3no(m+h
+
):368.1024found:368.1024.
[0093]
实施例13:手性吡哆醛类催化剂(s)-1g催化合成β-胺基-α-三氟甲基醇4e
[0094][0095]
与实施例9相比,区别仅在于:采用三氟酮3e取代3a,其余同实施例3。柱层析得到化合物4e(黄色固体,65.3mg,产率80%)。
[0096]
4e的dr值是通过1h nmr分析其反应粗产物得到,其dr值为大于20:1;4e的ee值是通过hplc分析其与n,n
’‑
硫羰基二咪唑衍生化后的产物得到,其ee值为97%。
[0097]
yellow solid;m.p.59-62℃;[α]
d25
=42.2(c=0.1,ch3oh);1h nmr(400mhz,cdcl3)δ7.39(d,j=7.4hz,4h),7.35(d,j=8.0hz,4h),7.33-7.23(m,5h),7.19(t,j=7.4hz,2h),4.52(t,j=6.8hz,1h),4.06(s,1h),2.95(dd,j=15.2,8.0hz,1h),2.79(dd,j=15.2,5.6hz,1h);
13
c nmr(100mhz,cdcl3)δ145.2,145..0,131.8,128.8,128.7,128.5,128.1,127.8,126.6,126.4,126.2(q,j
c-f
=285.6hz),122.3,87.1,86.1,76.0(q,j
c-f
=25.4hz),47.0,46.0,36.9;
19
f nmr(376mhz,cdcl3)δ-76.8;hrms m/z calcd.for c
25h23
f3no(m+h
+
):410.1726;found:410.1728.
[0098]
实施例14:手性吡哆醛类催化剂(s)-1g催化合成β-胺基-α-三氟甲基醇4f
[0099][0100]
与实施例9相比,区别仅在于:采用三氟酮3f取代3a,其余同实施例3。柱层析得到化合物4f(黄色油状液体,58.4mg,产率84%)。
[0101]
4f的dr值是通过1h nmr分析其反应粗产物得到,其dr值为大于20:1;4f的ee值是通过hplc分析其与n,n
’‑
硫羰基二咪唑衍生化后的产物得到,其ee值为97%。
[0102]
yellow oil;[α]
d25
=1.6(c=0.1,ch3oh);1h nmr(400mhz,cdcl3)δ7.39-7.30(m,5h),7.24(d,j=7.6hz,1h),7.20-7.14(m,3h),4.15(s,1h),2.67(t,j=7.6hz,2h),2.02-1.95(m,2h),1.94-1.84(m,2h);
13
c nmr(100mhz,cdcl3)δ141.9,131.8,128.8,128.54,128.51,128.49,126.3(q,j
c-f
=285.7hz),126.0,122.2,86.6,85.6,74.9(q,j
c-f
=
25.7hz),46.2,36.6,32.7,24.7;
19
f nmr(376mhz,cdcl3)δ-76.7;hrms m/z calcd.for c
20h21
f3no(m+h
+
):348.1570;found:348.1571.
[0103]
实施例15:手性吡哆醛类催化剂(s)-1g催化合成β-胺基-α-三氟甲基醇4g
[0104][0105]
与实施例9相比,区别仅在于:采用三氟酮3g取代3a,其余同实施例3。柱层析得到化合物4g(黄色固体,74.1mg,产率79%)。
[0106]
4g的dr值是通过1h nmr分析其反应粗产物得到,其dr值为大于20:1;4g的ee值是通过hplc分析其与n,n
’‑
硫羰基二咪唑衍生化后的产物得到,其ee值为96%。
[0107]
yellow solid;m.p.95-100℃;[α]
d25
=91.3(c=0.1,chcl3);1h nmr(400mhz,cdcl3)δ8.21(d,j=9.2hz,1h),8.16(d,j=7.6hz,1h),8.12(d,j=7.6hz,1h),8.06(d,j=7.6hz,1h),8.03-7.96(m,3h),7.95(d,j=9.6hz,1h),7.87(d,j=8.0hz,1h),7.29(t,j=7.2hz,1h),7.20(d,j=7.2hz,2h),7.17(t,j=7.6hz,2h),4.14(s,1h),3.39(t,j=6.8hz,2h),2.24-2.10(m,4h);
13
c nmr(100mhz,cdcl3)δ136.1,131.6,131.5,131.0,130.0,128.7,128.4,127.6,127.4,126.7,125.9,125.2,125.1,125.0,124.9,124.8,123.4,122.0,86.5,85.6,74.8(q,j
c-f
=25.6hz),46.0,34.2,33.2,25.1;
19
f nmr(376mhz,cdcl3)δ-76.9;hrms m/z calcd.for c
30h25
f3no(m+h
+
):472.1883;found:472.1896.
[0108]
实施例16:手性吡哆醛类催化剂(s)-1g催化合成β-胺基-α-三氟甲基醇4h
[0109][0110]
与实施例9相比,区别仅在于:采用三氟酮3h取代3a,其余同实施例3。柱层析得到化合物4h(黄色固体,43.8mg,产率65%)。
[0111]
4h的dr值是通过1h nmr分析其反应粗产物得到,其dr值为大于20:1;4h的ee值是通过hplc分析其与n,n
’‑
硫羰基二咪唑衍生化后的产物得到,其ee值为96%。
[0112]
yellow solid;m.p.41-43℃;[α]
d25
=28.9(c=0.1,chcl3);1h nmr(400mhz,cdcl3)δ7.42(d,j=7.2hz,2h),7.36-7.29(m,3h),7.12(d,j=5.2hz,1h),6.92(t,j=4.4hz,1h),6.84(s,1h),4.20(s,1h),3.13(qt,j=13.0,5.2hz,2h),2.38(td,j=13.4,5.6hz,1h),2.28(td,j=13.4,5.6hz,1h);
13
c nmr(100mhz,cdcl3)δ144.6,131.8,128.9,128.5,127.0,126.2(q,j
c-f
=285.4hz),124.4,123.4,122.1,86.4,86.0,74.7(q,j
c-f
=25.8hz),46.2,35.1,23.7;
19
f nmr(376mhz,cdcl3)δ-76.7;hrms m/z calcd.for c
17h17
f3nos(m+h
+
):340.0977;found:340.0976.
[0113]
实施例17:手性吡哆醛类催化剂(s)-1g催化合成β-胺基-α-三氟甲基醇4i
[0114][0115]
与实施例9相比,区别仅在于:采用三氟酮3i取代3a,其余同实施例3。柱层析得到化合物4i(淡黄色固体,53.6mg,产率79%)。
[0116]
4i的dr值是通过1h nmr分析其反应粗产物得到,其dr值为大于20:1;4i的ee值是通过hplc分析其与n,n
’‑
硫羰基二咪唑衍生化后的产物得到,其ee值为96%。
[0117]
pale yellow solid;m.p.59-63℃;[α]
d25
=14.3(c=0.1,chcl3);1h nmr(400mhz,cdcl3)δ7.47-7.37(m,2h),7.37-7.28(m,3h),4.16(s,1h),1.99-1.90(m,2h),1.77-1.59(m,5h),1.45-1.36(m,2h),1.27-1.09(m,4h),0.91(q,j=12.0hz,2h);
13
c nmr(100mhz,cdcl3)δ131.7,128.8,128.5,126.4(q,j
c-f
=285.6hz),122.4,86.9,85.4,75.1(q,j
c-f
=25.4hz),,46.22,46.20,38.5,33.4,33.3,30.6,30.1,26.7,26.4;
19
f nmr(376mhz,cdcl3)δ-76.6;hrms m/z calcd.for c
19h25
f3no(m+h
+
):340.1883;found:340.1885.
[0118]
实施例18:手性吡哆醛类催化剂(s)-1g催化合成β-胺基-α-三氟甲基醇4j
[0119][0120]
与实施例9相比,区别仅在于:采用三氟酮3j取代3a,其余同实施例3。柱层析得到化合物4j(淡黄色固体,62.2mg,产率78%)。
[0121]
4j的dr值是通过1h nmr分析其反应粗产物得到,其dr值为大于20:1;4j的ee值是通过hplc分析其与n,n
’‑
硫羰基二咪唑衍生化后的产物得到,其ee值为96%。
[0122]
pale yellow solid;m.p.50-53℃;[α]
d25
=6.9(c=0.1,chcl3);1h nmr(400mhz,cdcl3)δ7.42(d,j=6.8hz,2h),7.33(d,j=6.2hz,2h),4.16(s,1h),1.934(t,j=8.0hz,2h),1.60-1.48(m,2h),1.36-1.20(m,18h),0.89(t,j=6.4hz,2h);
13
c nmr(100mhz,cdcl3)δ131.8,128.8,128.5,126.4(q,j
c-f
=285.6hz),122.4,86.8,85.4,75.0(q,j
c-f
=25.6hz),46.2,33.1,32.1,30.5,29.78,29.76,29.7,29.5,29.5,22.8,14.2;
19
f nmr(376mhz,cdcl3)δ-76.6;hrms m/z calcd.for c
23h35
f3no(m+h
+
):398.2665;found:398.2664.
[0123]
实施例19:手性吡哆醛类催化剂(s)-1g催化合成β-胺基-α-三氟甲基醇4k
[0124][0125]
与实施例9相比,区别仅在于:采用三氟酮3k取代3a,其余同实施例3。柱层析得到化合物4k(黄色油状液体,83.4mg,产率74%)。
[0126]
4k的dr值是通过1h nmr分析其反应粗产物得到,其dr值为大于20:1;4k的ee值是通过hplc分析其与n,n
’‑
硫羰基二咪唑衍生化后的产物得到,其ee值为95%。
[0127]
yellow oil;[α]
d25
=10.1(c=0.1,chcl3);1h nmr(400mhz,cdcl3)δ7.69(d,j=7.2hz,4h),7.46-3.62(m,8h),7.36-7.28(m,3h),4.18(brs,1h),3.65(t,j=6.4hz,2h),1.98-1.89(m,2h),1.63-1.50(m,4h),1.46-1.38(m,2h),1.36-1.27(m,2h),1.07(s,9h);
13
c nmr(100mhz,cdcl3)δ135.7,134.2,131.7,129.6,128.8,128.5,127.7,122.3,86.0,85.5,75.0(q,j
c-f
=25.5hz),64.0,46.2,33.0,32.6,30.2,27.0,25.7,22.8,19.3;
19
f nmr(376mhz,cdcl3)δ-76.55;hrms m/z calcd.for c
33h41
f3no2si(m+h
+
):568.2853;found:568.2859.
[0128]
实施例20:手性吡哆醛类催化剂(s)-1g催化合成β-胺基-α-三氟甲基醇4l
[0129][0130]
与实施例9相比,区别仅在于:采用三氟酮3l取代3a,其余同实施例3。柱层析得到化合物4l(淡黄色油状液体,51.8mg,产率73%)。
[0131]
4l的dr值是通过1h nmr分析其反应粗产物得到,其dr值为大于20:1;4l的ee值是通过hplc分析其与n,n
’‑
硫羰基二咪唑衍生化后的产物得到,其ee值为96%。
[0132]
pale yellow oil;m.p.32-35℃;[α]
d25
=9.6(c=0.1,ch3oh);1h nmr(400mhz,cdcl3)δ7.45-7.38(m,2h),7.38-7.28(m,3h),5.86-5.73(m,1h),4.98(d,j=16.8hz,1h),4.92(d,j=10.0hz,1h),2.01(q,j=7.0,14.0hz,2h),1.98-1.86(m,2h),1.59-1.46(m,2h),1.40-1.23(m,8h);
13
c nmr(100mhz,cdcl3)δ139.3,131.8,128.8,128.5,122.3,114.3,33.9,30.4,29.3,29.1,29.0,22.8;
19
f nmr(376mhz,cdcl3)δ-76.6;hrms m/z calcd.for c
20h27
f3no(m+h
+
):354.2039;found:354.2047.
[0133]
实施例21:手性吡哆醛类催化剂(s)-1g催化合成β-胺基-α-三氟甲基醇4m
[0134][0135]
与实施例9相比,区别仅在于:采用三氟酮3m取代3a,其余同实施例3。柱层析得到化合物4m(黄色油状液体,46.6mg,产率66%)。
[0136]
4m的dr值是通过1h nmr分析其反应粗产物以及hplc分析其与n,n
’‑
硫羰基二咪唑衍生化后的产物得到,其dr值为大于20:1:-:-。
[0137]
yellow oil;[α]
d25
=33.1(c=0.1,chcl3);1h nmr(400mhz,cdcl3)δ7.45-7.37(m,2h),7.37-7.28(m,3h),5.07(t,j=7.4hz,1h),4.13(s,1h),2.09-1.93(m,2h),1.93-1.83(m,2h),1.81-173(m,1h),1.65(s,3h),1.56(s,3h),1.54-1.48(m,1h),1.28-1.17(m,1h),1.04(d,j=6.4hz,3h);
13
c nmr(100mhz,cdcl3)δ131.8,131.4,128.8,128.5,126.4(q,j
c-f
=285.7hz),124.8,122.4,87.1,85.8,75.5(q,j
c-f
=25.4hz),47.15,47.13,39.0,38.9,28.2,25.8,25.6,21.5,17.7;
19
f nmr(376mhz,cdcl3)δ-77.4;hrms m/z calcd.for c
20h27
f3no(m+h
+
):354.2039;found:354.2039.
[0138]
实施例22:手性吡哆醛类催化剂(s)-1g催化合成β-胺基-α-三氟甲基醇4n
[0139][0140]
与实施例9相比,区别仅在于:采用三氟酮3n取代3a,其余同实施例3。柱层析得到化合物4n(黄色固体,84.2mg,产率64%)。
[0141]
4n的dr值是通过1h nmr分析其反应粗产物得到,其dr值为大于20:1:-:-。
[0142]
yellow solid;m.p.85-89℃;[α]
d25
=92.1(c=0.1,ch3oh);1h nmr(400mhz,cdcl3)δ7.43-7.37(m,2h),7.36-7.28(m,3h),5.04(s,1h),4.76-4.63(m,1h),4.17(s,1h),2.03(s,6h),1.93-1.74(m,4h),1.72-1.50(m,8h),1.48-1.31(m,5h),1.31-1.14(m,4h),1.13-0.94(m,3h),0.88(s,3h),0.82(d,j=6.4hz,3h),0.67(s,3h);
13
c nmr(100mhz,cdcl3)δ170.7,170.6,131.7,128.9,128.5,126.4(q,j
c-f
=286.2hz),122.3,86.8,85.5,76.1,75.0(q,j
c-f
=24.9hz),74.3,49.6,47.5,46.1,45.1,41.9,35.8,35.6,34.8,34.5,34.1,32.4,29.7,28.2,27.4,27.0,26.7,26.0,25.7,23.5,23.2,21.6,21.4,17.8,12.5;
19
f nmr(376mhz,cdcl3)δ-76.7;hrms m/z calcd.for c
38h53
f3no5(m+h
+
):660.3870;found:660.3881.
[0143]
实施例23:手性吡哆醛类催化剂(s)-1g催化合成β-胺基-α-三氟甲基醇4o
[0144][0145]
与实施例9相比,区别仅在于:采用炔丙胺2b取代2a,其余同实施例3。柱层析得到化合物4o(黄色固体,50.3mg,产率63%)。
[0146]
4o的dr值是通过1h nmr分析其反应粗产物得到,其dr值为大于20:1;4o的ee值是通过hplc分析其与n,n
’‑
硫羰基二咪唑衍生化后的产物得到,其ee值为96%。
[0147]
yellow solid;m.p.69-72℃;[α]
d25
=26.5(c=0.1,chcl3);1h nmr(400mhz,cdcl3)δ8.12(d,j=8.8hz,1h),7.86(d,j=8.0hz,1h),7.73(d,j=7.2hz,1h),7.45(t,j=7.6hz,1h),7.42-7.29(m,5h),7.00(t,j=8.4hz,2h),4.25(s,1h),3.49-3.35(m,1h),3.35-3.19(m,1h),2.43-2.27(m,2h);
13
c nmr(100mhz,cdcl3)δ162.9(q,j
c-f
=248.8hz),138.0,134.1,133.8(q,j
c-f
=8.4hz),131.8,129.0,127.1,126.33(q,j
c-f
=285.4hz),126.23(q,j
c-f
=14.9hz),125.73(q,j
c-f
=11.5hz),123.7,118.2(q,j
c-f
=3.7hz),115.8(q,j
c-f
=22.0hz),86.5,84.9,75.1(q,j
c-f
=25.6hz),46.3,34.3,26.7;
19
f nmr(376mhz,cdcl3)δ-76.4,-109.9;hrms m/z calcd.for c
23h20
f4no(m+h
+
):402.1476;found:402.1472.
[0148]
实施例24:手性吡哆醛类催化剂(s)-1g催化合成β-胺基-α-三氟甲基醇4p
[0149][0150]
与实施例9相比,区别仅在于:采用炔丙胺2c取代2a,其余同实施例3。柱层析得到化合物4p(黄色固体,62.4mg,产率71%)。
[0151]
4p的dr值是通过1h nmr分析其反应粗产物得到,其dr值为大于20:1;4p的ee值是通过hplc分析其与n,n
’‑
硫羰基二咪唑衍生化后的产物得到,其ee值为99%。
[0152]
yellow solid;m.p.68-72℃;[α]
d25
=15.9(c=0.1,chcl3);1h nmr(400mhz,cdcl3)δ8.10(d,j=8.4hz,1h),7.97(d,j=7.6hz,2h),7.85(d,j=8.4hz,1h),7.72(d,j=7.2hz,1h),7.43(q,j=8.2hz,3h),7.39-7.29(m,3h),4.27(s,1h),3.93(s,3h),3.47-3.35(m,1h),3.34-3.21(m,1h),2.41-2.27(m,2h);
13
c nmr(100mhz,cdcl3)δ166.5,138.0,134.1,131.8,130.2,129.7,129.0,127.1,126.8,126.31,126.29(q,j
c-f
=285.4hz),126.2,125.8,125.7,123.7,89.8,85.2,75.2(q,j
c-f
=25.6hz),52.4,46.4,34.3,26.7;
19
f nmr(376mhz,cdcl3)δ-76.4;hrms m/z calcd.for c
25h23
f3no3(m+h
+
):442.1625;found:442.1626.
[0153]
实施例25:手性吡哆醛类催化剂(s)-1g催化合成β-胺基-α-三氟甲基醇4q
[0154][0155]
与实施例9相比,区别仅在于:采用炔丙胺2d取代2a,其余同实施例3。柱层析得到化合物4q(黄色固体,65.5mg,产率81%)。
[0156]
4q的dr值是通过1h nmr分析其反应粗产物得到,其dr值为大于20:1;4q的ee值是通过hplc分析其与n,n
’‑
硫羰基二咪唑衍生化后的产物得到,其ee值为97%。
[0157]
yellow solid;m.p.57-61℃;[α]
d25
=26.1(c=0.1,chcl3);1h nmr(400mhz,cdcl3)δ8.14(d,j=8.4hz,1h),7.85(d,j=8.4hz,1h),7.76-7.70(m,1h),7.45(t,j=7.6hz,1h),7.42-7.33(m,3h),7.30(d,j=8.0hz,2h),7.13(d,j=7.6hz,2h),4.26(s,1h),3.47-3.26(m,2h),2.37(s,3h).
13
c nmr(100mhz,cdcl3)δ139.1,138.1,134.1,131.9,131.8,129.3,128.9,127.0,126.4(q,j
c-f
=285.3hz),126.3,126.2,125.8,125.6,123.8,119.1,86.2,86.1,75.2(q,j
c-f
=25.7hz),46.3,34.4,26.7,21.6;
19
f nmr(376mhz,cdcl3)δ-76.5;hrms m/z calcd.for c
24h23
f3no(m+h
+
):398.1726;found:398.1727.
[0158]
实施例26:手性吡哆醛类催化剂(s)-1g催化合成β-胺基-α-三氟甲基醇4r
[0159][0160]
与实施例9相比,区别仅在于:采用炔丙胺2e取代2a,其余同实施例3。柱层析得到
化合物4r(黄色油状液体,59.0mg,产率71%)。
[0161]
4r的dr值是通过1h nmr分析其反应粗产物得到,其dr值为大于20:1;4r的ee值是通过hplc分析其与n,n
’‑
硫羰基二咪唑衍生化后的产物得到,其ee值为96%。
[0162]
yellow oil;[α]
d25
=21.1(c=0.1,chcl3);1h nmr(400mhz,cdcl3)δ8.15(d,j=8.4hz,1h),7.85(d,j=8.4hz,1h),7.75-7.71(m,1h),7.45(t,j=7.6hz,1h),7.42-7.32(m,5h),6.84(d,j=8.4hz,2h),4.26(s,1h),3.82(s,3h),3.46-3.24(m,2h),2.36(t,j=8.8hz,1h);
13
c nmr(100mhz,cdcl3)δ160.0,138.1,134.0,133.3,131.8,128.9,127.0,126.4(q,j
c-f
=285.5hz),126.3,126.2,125.8,125.6,123.8,114.2,114.1,85.9,85.4,75.1(q,j
c-f
=25.6hz),55.4,46.3,34.4,26.7;
19
f nmr(376mhz,cdcl3)δ-76.5;hrms m/z calcd.for c
24h23
f3no2(m+h
+
):414.1675;found:414.1676.
[0163]
实施例27:手性吡哆醛类催化剂(s)-1g催化合成β-胺基-α-三氟甲基醇4s
[0164][0165]
与实施例9相比,区别仅在于:采用炔丙胺2f取代2a,其余同实施例3。柱层析得到化合物4s(黄色固体,60.8mg,产率73%)。
[0166]
4s的dr值是通过1h nmr分析其反应粗产物得到,其dr值为大于20:1;4s的ee值是通过hplc分析其与n,n
’‑
硫羰基二咪唑衍生化后的产物得到,其ee值为97%。
[0167]
yellow solid;m.p.63-68℃;[α]
d25
=27.6(c=0.1,chcl3);1h nmr(400mhz,cdcl3)δ8.13(d,j=8.4hz,1h),7.87(d,j=8.4hz,1h),7.74(d,j=7.6hz,1h),7.47(t,j=7.6hz,1h),7.44-7.36(m,4h),7.34(d,j=7.2hz,1h),7.29-7.21(m,2h),4.25(s,1h),3.42(td,j=12.8,5.8hz,1h),3.30(td,j=12.8,5.8hz,1h),2.44-2.27(m,1h);
13
c nmr(100mhz,cdcl3)δ144.0,134.4,131.8,130.0,129.0,128.7,128.6,126.7,126.4,126.3(q,j
c-f
=285.5hz),122.1,86.5,86.0,74.7(q,j
c-f
=25.8hz),46.2,34.8,29.2;
19
f nmr(376mhz,cdcl3)δ-76.3;hrms m/z calcd.for c
23h20
clf3no(m+h
+
):418.1180;found:418.1179.
[0168]
实施例28:手性吡哆醛类催化剂(s)-1g催化合成β-胺基-α-三氟甲基醇4t
[0169][0170]
与实施例9相比,区别仅在于:采用炔丙胺2g取代2a,其余同实施例3。柱层析得到化合物4t(黄色固体,64.5mg,产率70%)。
[0171]
4t的dr值是通过1h nmr分析其反应粗产物得到,其dr值为大于20:1;4t的ee值是通过hplc分析其与n,n
’‑
硫羰基二咪唑衍生化后的产物得到,其ee值为94%。
[0172]
yellow solid;m.p.49-51℃;[α]
d25
=15.6(c=0.1,ch3oh);1h nmr(400mhz,cdcl3)δ8.13(d,j=8.4hz,1h),7.85(d,j=8.4hz,1h),7.73(t,j=5.0hz,1h),7.56(d,j=
8.0hz,1h),7.45(t,j=7.6hz,1h),7.42-7.34(m,4h),7.24(d,j=7.6hz,1h),7.18(t,j=7.6hz,1h),4.28(s,1h),3.43(td,j=13.0,4.6hz,1h),3.32(td,j=13.2,5.0hz,1h),2.46(td,j=13.4,5.0hz,1h),2.37(td,j=13.6,4.6hz,1h);
13
c nmr(100mhz,cdcl3)δ138.1,134.0,133.7,132.6,131.8,130.0,128.9,127.2,127.0,126.32(q,j
c-f
=285.4hz),126.29,126.1,125.8,125.6,124.3,123.9,91.4,84.6,75.2(q,j
c-f
=26.0hz),46.6,34.4,26.6;
19
f nmr(376mhz,cdcl3)δ-76.3;hrms m/z calcd.for c
23h20
brf3no(m+h
+
):462.0675;found:462.0673.
[0173]
实施例29:手性吡哆醛类催化剂(s)-1g催化合成β-胺基-α-三氟甲基醇4u
[0174][0175]
与实施例9相比,区别仅在于:采用炔丙胺2h取代2a,其余同实施例3。柱层析得到化合物4u(淡黄色固体,59.1mg,产率68%)。
[0176]
4u的dr值是通过1h nmr分析其反应粗产物得到,其dr值为大于20:1;4u的ee值是通过hplc分析其与n,n
’‑
硫羰基二咪唑衍生化后的产物得到,其ee值为93%。
[0177]
pale yellow solid;m.p.115-118℃;[α]
d25
=24.1(c=0.1,ch3oh);1h nmr(400mhz,cdcl3)δ8.21(d,j=8.0hz,1h),8.13(d,j=8.4hz,1h),7.86(d,j=8.4hz,2h),7.83(d,j=8.4hz,1h),7.71(d,j=7.2hz,1h),7.65(d,j=6.8hz,1h),7.52(t,j=7.6hz,1h),7.46-7.33(m,5h),7.20(t,j=7.6hz,1h),4.41(s,1h),3.47(td,j=12.8,5.4hz,1h),3.37(td,j=12.8,5.8hz,1h),2.47(pd,j=12.8,5.2hz,2h);
13
c nmr(100mhz,cdcl3)δ138.0,134.0,133.4,133.2,131.8,131.0,129.4,128.9,128.5,127.2,127.0,126.7,126.4(q,j
c-f
=285.4hz),126.3,126.2,125.9,125.8,125.6,125.2,123.7,119.8,91.6,84.2,75.3(q,j
c-f
=25.8hz),46.6,34.5,26.7;
19
f nmr(376mhz,cdcl3)δ-76.3;hrms m/z calcd.for c
27h23
f3no(m+h
+
):434.1726;found:434.1726.
[0178]
实施例30:手性吡哆醛类催化剂(s)-1g催化合成β-胺基-α-三氟甲基醇4v
[0179][0180]
与实施例9相比,区别仅在于:采用炔丙胺2i取代2a,其余同实施例3。柱层析得到化合物4v(黄色固体,68.5mg,产率82%)。
[0181]
4v的dr值是通过1h nmr分析其反应粗产物得到,其dr值为大于20:1;4v的ee值是通过hplc分析其与n,n
’‑
硫羰基二咪唑衍生化后的产物得到,其ee值为97%。
[0182]
yellow solid;m.p.100-103℃;[α]
d25
=40.6(c=0.1,ch3oh);1h nmr(400mhz,cdcl3)δ8.15(d,j=8.8hz,h),7.87-7.82(m,2h),7.80(d,j=8.4hz,1h),7.77-7.69(m,1h),7.48(d,j=5.2hz,1h),7.43(t,j=7.4hz,2h),7.40-7.36(m,2h),7.32(t,j=8.4hz,2h),7.28(d,j=6.0hz,1h),δ4.29(s,1h),3.49-3.37(m,1h),3.37-3.24(m,1h),2.39(q,j
=9.2hz,2h);
13
c nmr(100mhz,cdcl3)δ140.2,139.6,138.1,134.0,131.8,128.9,127.7,127.3,127.1,126.4(q,j
c-f
=285.6hz),126.3,126.2,125.8,125.7,123.8,123.7,122.6,118.0,86.3,86.2,75.1(q,j
c-f
=25.8hz),46.3,34.4,26.7;
19
f nmr(376mhz,cdcl3)δ-76.4;hrms m/z calcd.for c
25h21
f3no2(m+h
+
):424.1519;found:424.1524.
[0183]
实施例31:手性吡哆醛类催化剂(s)-1g催化合成β-胺基-α-三氟甲基醇4w
[0184][0185]
与实施例9相比,区别仅在于:采用炔丙胺2j取代2a,其余同实施例3。柱层析得到化合物4w(黄色固体,67.0mg,产率76%)。
[0186]
4w的dr值是通过1h nmr分析其反应粗产物得到,其dr值为大于20:1;4w的ee值是通过hplc分析其与n,n
’‑
硫羰基二咪唑衍生化后的产物得到,其ee值为97%。
[0187]
yellow solid;m.p.85-89℃;[α]
d25
=48.3(c=0.1,ch3oh);1h nmr(400mhz,cdcl3)δ8.15(d,j=8.4hz,1h),7.84(d,j=8.4hz,1h),7.75-7.69(m,1h),7.64(d,j=5.6hz,2h),7.43(d,j=8.2hz,2h),7.38(d,j=4.8hz,2h),7.31(t,j=9.2hz,2h),6.72(s,1h),4.27(s,1h),3.49-3.37(m,1h),3.36-3.23(m,1h),2.38(t,j=8.8hz,2h),1.78(brs,2h);
13
c nmr(100mhz,cdcl3)δ154.9,146.2,138.1,134.0,131.8,128.9,128.1,127.7,127.0,126.4(q,j
c-f
=285.3hz),126.3,126.2,125.8,125.6,125.2,123.8,116.6,111.7,106.6,86.2,85.4,75.1(q,j
c-f
=25.5hz),46.3,34.4,26.7;
19
f nmr(376mhz,cdcl3)δ-76.5;hrms m/z calcd.for c
25h21
f3nos(m+h
+
):440.1290;found:440.1303.
[0188]
实施例32:手性吡哆醛类催化剂(s)-1g催化合成β-胺基-α-三氟甲基醇4x
[0189][0190]
与实施例9相比,区别仅在于:采用炔丙胺2k取代2a,其余同实施例3。柱层析得到化合物4x(黄色固体,68.1mg,产率80%)。
[0191]
4x的dr值是通过1h nmr分析其反应粗产物得到,其dr值为大于20:1;4x的ee值是通过hplc分析其与n,n
’‑
硫羰基二咪唑衍生化后的产物得到,其ee值为96%。
[0192]
yellow solid;m.p.77-81℃;[α]
d25
=21.5(c=0.1,chcl3);1h nmr(400mhz,cdcl3)δ8.13(d,j=8.8hz,1h),7.85(d,j=8.0hz,1h),7.73(d,j=7.6hz,1h),7.46(t,j=7.6hz,1h),7.43-7.36(m,3h),6.92(d,j=8.0hz,1h),6.83(s,1h),6.74(d,j=8.0hz,1h),5.98(s,2h),4.23(s,1h),3.47-3.35(m,1h),3.34-3.24(m,1h),2.41-2.28(m,2h);
13
c nmr(100mhz,cdcl3)δ148.4,147.6,138.1,134.1,131.8,128.9,127.1,126.6,126.4(q,j
c-f
=285.4hz),126.3,126.2,125.8,125.7,123.8,115.4,111.7,108.6,101.5,85.8,85.2,75.2(q,j
c-f
=25.6hz),46.3,34.3,26.7;
19
f nmr(376mhz,cdcl3)δ-76.4;hrms m/z calcd.for c
24h21
f3no3(m+h
+
):428.1468;found:428.1468.
[0193]
实施例33:手性吡哆醛类催化剂(s)-1g催化合成β-胺基-α-三氟甲基醇4y
[0194][0195]
依次将手性吡哆醛催化剂(s)-1(7.6mg,0.02mmol)、k2co3(41.5mg,0.30mmol)加入到2ml反应瓶中,注入chcl3(0.3ml),再依次注入炔丙胺2l(47.7mg,0.3mmol)、三氟酮3a(50.4mg,0.20mmol)、h2o(20μl),加入搅拌子,盖上塞子,40℃下搅拌36小时。之后加入一水合肼溶液(20μl,80wt%in h2o)搅拌30min淬灭反应,旋去溶剂,柱层析得到化合物4y(淡黄色固体,52.6mg,产率64%)。
[0196]
4y的dr值是通过1h nmr分析其反应粗产物得到,其dr值为13:1;4y的ee值是通过hplc分析其与n,n
’‑
硫羰基二咪唑衍生化后的产物得到,其ee值为89%。
[0197]
pale yellow solid;m.p.65-69℃;[α]
d25
=9.1(c=0.1,chcl3);1h nmr(400mhz,cdcl3)δ8.14(d,j=8.0hz,1h),7.89(d,j=8.4hz 1h),7.76(d,j=8.0hz,1h),7.52(q,j=7.6hz,2h),7.43(t,j=7.8hz,1h),7.35(d,j=7.2hz,1h),7.21(t,j=7.2hz,2h),7.18-7.10(m,3h),3.99(s,1h),3.35(td,j=12.8,5.4hz,1h),3.24(td,j=12.8,5.4hz,1h),2.77(t,j=7.6hz,2h),2.51(t,j=7.6hz,2h),2.22(qd,j=13.2,5.2hz,2h);
13
c nmr(100mhz,cdcl3)δ140.3,138.3,134.1,131.9,129.0,128.5,127.0,126.5,126.4(q,j
c-f
=285.5hz),126.2,126.1,125.8,125.7,123.8,85.9,78.7,74.9(q,j
c-f
=25.6hz),46.0,34.8,34.1,26.6,20.9;
19
f nmr(376mhz,cdcl3)δ-76.1;hrms m/z calcd.for c
25h25
f3no(m+h
+
):412.1883;found:412.1881.
[0198]
实施例34:手性吡哆醛类催化剂(s)-1g催化合成β-胺基-α-三氟甲基醇4z
[0199][0200]
与实施例33相比,区别仅在于:采用炔丙胺3j取代3a,其余同实施例27。柱层析得到化合物4z(淡黄色固体,52.2mg,产率61%)。
[0201]
4z的dr值是通过1h nmr分析其反应粗产物得到,其dr值为大于20:1;4z的ee值是通过hplc分析其与n,n
’‑
硫羰基二咪唑衍生化后的产物得到,其ee值为94%。
[0202]
pale yellow solid;m.p.47-52℃;[α]
d25
=2.5(c=0.1,chcl3);1h nmr(400mhz,cdcl3)δ7.31(t,j=7.4hz,2h),7.23(t,j=8.0hz,3h),3.89(s,1h),2.83(t,j=7.6hz,2h),2.52(t,j=7.6hz,2h),1.84-1.71(m,2h),1.46-1.38(m,2h),1.33-1.20(m,18h),0.90(t,j=6.8hz,h);
13
c nmr(100mhz,cdcl3)δ140.5,128.5,126.5,126.4(q,j
c-f
=285.7hz),85.3,78.7,74.8(q,j
c-f
=25.3hz),45.9,34.9,33.0,32.1,30.5,29.83,29.80,29.7,29.6,29.5,22.8,22.7,20.9,14.2;
19
f nmr(376mhz,cdcl3)δ-76.4;hrms m/z calcd.for c
25h39
f3no(m+h
+
):426.2978;found:426.2978.
[0203]
实施例35:手性吡哆醛类催化剂(s)-1g催化合成β-胺基-α-三氟甲基醇4aa
[0204][0205]
与实施例34相比,区别仅在于:采用炔丙胺2m取代2l,其余同实施例28。柱层析得到化合物4aa(黄色油状液体,69.3mg,产率71%)。
[0206]
4aa的dr值是通过1h nmr分析其反应粗产物得到,其dr值为大于13:1;4aa的ee值是通过hplc分析其与n,n
’‑
硫羰基二咪唑衍生化后的产物得到,其ee值为92%。
[0207]
yellow oil;[α]
d25
=2.6(c=0.1,chcl3);1h nmr(400mhz,chcl3)δ3.92(s,1h),2.18(t,j=7.2hz,2h),1.94-1.72(m,2h),1.54-1.40(m,4h),1.38-1.20(m,36h),0.88(t,j=6.6hz,6h);
13
c nmr(101mhz,cdcl3)δ126.5(q,j
c-f
=285.7hz),86.2,77.8,74.8(q,j
c-f
=25.2hz),45.87,45.85,33.2,32.1,30.6,29.9,29.84,29.81,29.78,29.71,29.6,29.5,29.3,29.0,28.7,22.84,22.81,18.8,14.2;
19
f nmr(376mhz,chcl3)δ-76.5;hrms m/z calcd.for c
29h55
f3no(m+h
+
):490.4230;found:490.4235.
[0208]
实施例36:手性吡哆醛类催化剂(s)-1g催化合成β-胺基-α-三氟甲基醇4ab
[0209][0210]
与实施例34相比,区别仅在于:采用炔丙胺2n取代2l,其余同实施例28。柱层析得到化合物4ab(黄色油状液体,50.0mg,产率54%)。
[0211]
4ab的dr值是通过1h nmr分析其反应粗产物得到,其dr值为19:1;4ab的ee值是通过hplc分析其与n,n
’‑
硫羰基二咪唑衍生化后的产物得到,其ee值为90%。
[0212]
yellow oil;[α]
d25
=5.5(c=0.1,chcl3);1h nmr(400mhz,cdcl3)δ5.87-5.73(m,1h),4.99(d,j=17.2hz,1h),4.93(d,j=10.0hz,1h),3.91(s,1h),2.18(t,j=7.2hz,2h),2.04(q,j=7.2hz,2h),1.90-1.76(m,2h),1.56-1.42(m,4h),1.41-1.34(m,4h),1.34-1.13(m,24h),0.88(t,j=6.6hz,3h);
13
c nmr(100mhz,cdcl3)δ139.3,126.5(q,j
c-f
=285.7hz),114.3,86.2,77.8,74.8(q,j
c-f
=25.2hz),46.9,33.9,33.2,32.1,30.5,29.84,29.82,29.81,29.80,29.6,29.5,29.24,29.22,29.1,29.0,28.7,22.83,22.80,18.8,14.2;
19
f nmr(376mhz,cdcl3)δ-76.5;hrms m/z calcd.for c
27h49
f3no(m+h
+
):460.3761;found:460.3763.
[0213]
实施例37:手性吡哆醛类催化剂(s)-1g催化合成β-胺基-α-三氟甲基醇4ac
[0214][0215]
与实施例34相比,区别仅在于:采用炔丙胺2o取代2l,其余同实施例28。柱层析得
到化合物4ac(淡黄色油状液体,61.4mg,产率64%)。
[0216]
4ac的dr值是通过1h nmr分析其反应粗产物得到,其dr值为14:1;4ac的ee值是通过hplc分析其与n,n
’‑
硫羰基二咪唑衍生化后的产物得到,其ee值为92%。
[0217]
pale yellow oil;[α]
d25
=3.4(c=0.1,chcl3);1h nmr(400mhz,cdcl3)δ7.37-7.32(m,4h),7.31-7.27(m,1h),4.51(s,2h),3.91(s,1h),3.49(t,j=6.4hz,2h),2.24(t,j=6.8hz,2h),1.89-1.78(m,2h),1.75-1.68(m,2h),1.65-1.58(m,2h),1.51-1.40(m,2h),1.32-1.24(m,17h),0.89(t,j=6.6hz,1h).
13
c nmr(100mhz,cdcl3)δ138.7,128.5,127.69,127.66,126.5(q,j
c-f
=285.8hz),85.8,78.1,74.8(q,j
c-f
=25.2hz),73.0,69.8,45.8,33.1,32.0,30.5,29.81,29.79,29.7,29.6,29.5,29.0,25.4,22.81,22.77,18.6,14.2.
19
f nmr(376mhz,cdcl3)δ-76.4;hrms m/z calcd.for c
28h45
f3no2(m+h
+
):484.3397;found:484.3405.
[0218]
上述的对实施例的描述是为便于该技术领域的普通技术人员能理解和使用发明。熟悉本领域技术的人员显然可以容易地对这些实施例做出各种修改,并把在此说明的一般原理应用到其他实施例中而不必经过创造性的劳动。因此,本发明不限于上述实施例,本领域技术人员根据本发明的揭示,不脱离本发明范畴所做出的改进和修改都应该在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1