一种过滤方法以及试剂盒与流程
一种过滤方法以及试剂盒
1.本技术是分案申请,其原案申请是国际申请日为2017年3月15日、国际申请号为pct/jp2017/010396的pct申请于2018年9月17日进入国家阶段的发明专利申请,国家申请号为201780017929.7,发明名称为“有核细胞的过滤用过滤器以及使用该过滤器的过滤方法”。
技术领域
2.本发明涉及使用了有核细胞的过滤用的过滤器的过滤方法、以及包含该过滤用的过滤器的试剂盒。
背景技术:
3.在专利文献1公开了一种使用细胞捕获过滤材料从包含红血球、有核细胞以及血小板而成的液体对单核细胞和血小板进行浓缩的方法。专利文献1的细胞捕获过滤材料捕获有核细胞和血小板,并使像红血球那样的无用的细胞通过。
4.在先技术文献
5.专利文献
6.专利文献1:日本特开2009-284860号公报
技术实现要素:
7.发明要解决的课题
8.然而,关于专利文献1的细胞捕获过滤材料,在有核细胞的回收率的提高方面尚有改善的余地。
9.本发明的目的在于,提供一种使用了能够使有核细胞的回收率提高的有核细胞的过滤用的过滤器的过滤方法、以及包含该过滤用的过滤器的试剂盒。
10.用于解决课题的技术方案
11.本发明的一个方式的过滤器,
12.是有核细胞的过滤用的过滤器,其中,
13.以金属以及金属氧化物中的至少任一者为主成分,
14.形成有正方形的贯通孔,
15.所述过滤器的表面的算术平均粗糙度小于有核细胞的核的大小。
16.本发明的一个方式的过滤方法,
17.是有核细胞的过滤方法,包括:
18.准备过滤器的步骤,所述过滤器以金属以及金属氧化物中的至少任一者为主成分,形成有正方形的贯通孔,所述过滤器的表面的算术平均粗糙度小于有核细胞的核的大小;以及
19.使包含所述有核细胞的液体通过所述过滤器的步骤。
20.本发明的一个方式的试剂盒,
21.包含有核细胞的过滤用的过滤器,并用于实施本发明的过滤方法,其中,
22.所述过滤器的表面的算术平均粗糙度小于有核细胞的核的大小。
23.发明效果
24.根据本发明,能够提供一种使用了能够使有核细胞的回收率提高的有核细胞的过滤用的过滤器的过滤方法、以及包含该过滤用的过滤器的试剂盒。
附图说明
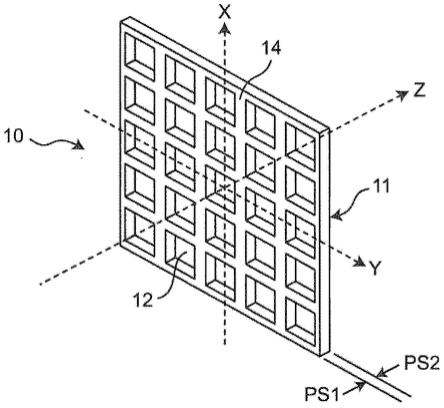
25.图1是本发明涉及的实施方式1的过滤器的概略结构图。
26.图2是本发明涉及的实施方式1的过滤器的一部分的放大立体图。
27.图3是从厚度方向观察了图2的过滤器的一部分的概略图。
28.图4是在本发明涉及的实施方式1的过滤器设置了支承基材的概略图。
29.附图标记说明
30.10:过滤器;
31.11:过滤器部;
32.12:贯通孔;
33.13:支承基材;
34.13a:开口部;
35.14:过滤器基体部;
36.15:框部;
37.ps1:第一主面;
38.ps2:第二主面。
具体实施方式
39.(完成本发明的经过)
40.在专利文献1中,使用由无纺布构成的细胞捕获过滤材料对有核细胞和血小板进行捕获,并使像红血球那样的无用的细胞通过,由此从血液中分离单核细胞。然而,在专利文献1的细胞捕获过滤器中,单核细胞的回收率为74%左右,在作为捕获对象的细胞的回收率的提高方面尚有改善的余地。
41.本发明的发明人们进行了潜心研究,结果发现,通过使用以金属以及金属氧化物中的至少任一者为主成分的过滤器对包含有核细胞的液体进行过滤,从而能够使作为捕获对象的有核细胞的回收率提高,最终完成了本发明。
42.本发明的一个方式的过滤器,
43.是有核细胞的过滤用的过滤器,其中,
44.以金属以及金属氧化物中的至少任一者为主成分,
45.形成有多个贯通孔,
46.所述贯通孔的内切圆的直径小于所述有核细胞的核的大小,所述贯通孔的内切圆是与划定所述贯通孔的开口的所有的边相切的圆。
47.通过这样的结构,能够使有核细胞的回收率提高。
48.在所述过滤器中,所述贯通孔的内切圆的直径相对于所述有核细胞的核的大小的
比例可以为0.64以下。
49.通过这样的结构,能够使有核细胞的回收率进一步提高。
50.在所述过滤器中,所述贯通孔的内切圆的直径相对于所述有核细胞的核的大小的比例可以为0.06以上。
51.通过这样的结构,能够使有核细胞的回收率进一步提高。
52.在所述过滤器中,所述贯通孔的内切圆的直径相对于所述有核细胞的核的大小的比例可以为0.07以上。
53.通过这样的结构,能够缩短过滤时间,并且能够使有核细胞的回收率进一步提高。
54.在所述过滤器中,可以在包含所述有核细胞的液体所接触的一侧具有平滑的主面。
55.通过这样的结构,能够容易地回收在过滤器部的主面捕获的有核细胞。
56.在所述过滤器中,所述金属以及所述金属氧化物中的至少任一者在磷酸缓冲生理食盐水中的以参考电极为基准的浸渍电位可以高于0.03v,所述参考电极由氯化银构成,并被浸于饱和氯化钾溶液。
57.通过这样的结构,能够防止作为过滤器的成分的金属或金属氧化物溶出到包含有核细胞的液体中。
58.在所述过滤器中,所述金属以及所述金属氧化物中的至少任一者可以含有从由金、银、铜、铂、镍、钯、它们的合金以及它们的氧化物构成的组中选择的至少一者。
59.通过这样的结构,能够使有核细胞的回收率进一步提高。
60.本发明的一个方式的过滤方法,
61.是有核细胞的过滤方法,包括:
62.准备过滤器的步骤,所述过滤器以金属以及金属氧化物中的至少任一者为主成分,形成有多个贯通孔,所述贯通孔的内切圆的直径小于所述有核细胞的核的大小,所述贯通孔的内切圆是与划定所述贯通孔的开口的所有的边相切的圆;以及
63.使包含所述有核细胞的液体通过所述过滤器的步骤。
64.通过这样的结构,能够使有核细胞的回收率提高。
65.在所述过滤方法中,所述贯通孔的内切圆的直径相对于所述有核细胞的核的大小的比例可以为0.64以下。
66.通过这样的结构,能够使有核细胞的回收率进一步提高。
67.在所述过滤方法中,所述贯通孔的内切圆的直径相对于所述有核细胞的核的大小的比例可以为0.06以上。
68.通过这样的结构,能够使有核细胞的回收率进一步提高。
69.在所述过滤方法中,所述贯通孔的内切圆的直径相对于所述有核细胞的核的大小的比例可以为0.07以上。
70.通过这样的结构,能够缩短过滤时间,并且能够使有核细胞的回收率更进一步提高。
71.在所述过滤方法中,所述过滤器可以在包含所述有核细胞的液体所接触的一侧具有平滑的主面。
72.通过这样的结构,能够容易地回收在过滤器的主面捕获的有核细胞。
73.在所述过滤方法中,所述金属以及所述金属氧化物中的至少任一者在磷酸缓冲生理食盐水中的以参考电极为基准的浸渍电位可以高于0.03v,所述参考电极由氯化银构成,并被浸于饱和氯化钾溶液。
74.通过这样的结构,能够防止作为过滤器的成分的金属或金属氧化物溶出到包含有核细胞的液体中。
75.在所述过滤方法中,所述金属以及所述金属氧化物中的至少任一者可以含有从由金、银、铜、铂、镍、钯、它们的合金以及它们的氧化物构成的组中选择的至少一者。
76.通过这样的结构,能够使有核细胞的回收率进一步提高。
77.在所述过滤方法中,使包含所述有核细胞的液体通过所述过滤器的步骤可以包含将活细胞和死细胞分离的步骤。
78.通过这样的结构,能够将活细胞和死细胞分离。
79.在所述过滤方法中,所述过滤器的所述多个贯通孔的大小的变动系数可以为0.17以下。
80.通过这样的结构,能够使有核细胞的回收率进一步提高。
81.在所述过滤方法中,所述过滤器的所述贯通孔的形状可以为正多边形。
82.通过这样的结构,能够使有核细胞的回收率进一步提高。
83.在所述过滤方法中,所述过滤器的所述贯通孔的形状也可以为正方形。
84.通过这样的结构,能够使有核细胞的回收率进一步提高。
85.本发明的一个方式的试剂盒,
86.是包含有核细胞的过滤用的过滤器的、用于实施所述过滤方法的试剂盒,其中,
87.所述过滤器以金属以及金属氧化物的至少任一者为主成分,
88.形成有多个贯通孔,
89.所述贯通孔的内切圆的直径小于所述有核细胞的核的大小,所述贯通孔的内切圆是与划定所述贯通孔的开口的所有的边相切的圆。
90.通过这样的结构,能够使有核细胞的回收率提高。
91.以下,参照附图对本发明涉及的实施方式1进行说明。此外,在各图中,为了容易说明,将各要素夸张地示出。
92.(实施方式1)
93.[过滤器的结构]
[0094]
图1是本发明涉及的实施方式1的过滤器10的概略结构图。图2是本发明涉及的实施方式1中的过滤器10的一部分的放大立体图。图1以及图2中的x、y、z方向分别示出过滤器10的纵向、横向、厚度方向。如图1所示,过滤器10具备过滤器部11和设置在过滤器部11的外周的框部15。如图2所示,过滤器10具有相互对置的第一主面ps1和第二主面ps2。过滤器部11具备形成了贯通第一主面ps1和第二主面ps2的多个贯通孔12的过滤器基体部14。贯通孔12的内切圆的直径设计为小于有核细胞的核的大小。
[0095]
过滤器10通过使包含有核细胞的液体(细胞悬浮液)通过过滤器部11,从而过滤有核细胞。
[0096]
在本说明书中,所谓“有核细胞”,是核小体和细胞质被核膜隔开的细胞。
[0097]
《材质》
[0098]
构成过滤器基体部14的材料以金属和/或金属氧化物为主成分,过滤器基体部14形成过滤器10的基体部分。过滤器基体部14例如可以为金、银、铜、铂、镍、钯、它们的合金以及它们的氧化物。
[0099]
过滤器10的最表层可以由不易溶出到细胞悬浮液的金属和/或金属氧化物构成。例如,在过滤器10的最表层被如下金属覆盖的情况下,能够抑制构成过滤器10的材料向细胞悬浮液溶出,所述金属在磷酸缓冲生理食盐水中的以参考电极为基准的浸渍电位高于0.03v,所述参考电极由氯化银构成,并被浸于饱和氯化钾溶液。由此,能够降低对细胞的压力。或者,过滤器10的最表层也可以由亲水性的材料构成。例如,在对水类的细胞悬浮液进行处理的情况下,能够缩短处理时间,因此能够降低对细胞的压力。
[0100]
《外形》
[0101]
过滤器10的外形例如是圆形、长方形或椭圆形。在实施方式1中,过滤器10的外形是大致圆形。通过使过滤器10的外形为大致圆形,从而能够对过滤器10的主面(例如,过滤器部11的第一主面ps1)均匀地流过流体。另外,在本说明书中,所谓“大致圆形”,是指长径的长度相对于短径的长度之比为1.0以上且1.2以下。
[0102]
《过滤器部》
[0103]
过滤器部11是形成有多个贯通孔12的板状构造体。过滤器部11的形状例如是圆形、长方形、椭圆形。在实施方式1中,过滤器部11的形状为大致圆形。通过使过滤器部11的形状为大致圆形,从而能够对过滤器部11的第一主面ps1均匀地流过流体。
[0104]
图3是从厚度方向(z方向)观察了过滤器部11的一部分的概略图。如图3所示,多个贯通孔12周期性地配置在过滤器部11的第一主面ps1以及第二主面ps2上。具体地,多个贯通孔12在过滤器部11中以等间隔设置为矩阵状。
[0105]
在实施方式1中,从过滤器部11的第一主面ps1侧,即,z方向观察,贯通孔12具有正方形的形状。另外,贯通孔12的从z方向观察的形状并不限定于正方形,例如也可以为三角形、菱形、正多边形等形状。
[0106]
在实施方式1中,投影到相对于过滤器部11的第一主面ps1垂直的面的贯通孔12的形状(剖面形状)为长方形。具体地,贯通孔12的剖面形状是过滤器10的半径方向的一边的长度比过滤器10的厚度方向的一边的长度长的长方形。另外,贯通孔12的剖面形状并不限定于长方形,例如,可以是平行四边形或梯形等锥形,也可以是对称形状,还可以是非对称形状。
[0107]
在实施方式1中,从过滤器部11的第一主面ps1侧(z方向)观察,多个贯通孔12在与正方形的各边平行的两个排列方向,即,图3中的x方向和y方向上,以相等的间隔设置。像这样,通过以正方格子排列来设置多个贯通孔12,从而能够提高开口率,能够降低流体对过滤器10的通过阻力。通过这样的结构,能够缩短处理时间,能够降低对细胞的压力。此外,由于多个贯通孔12的排列的对称性提高,所以过滤器的观察变得容易。
[0108]
另外,多个贯通孔12的排列并不限定于正方格子排列,例如,也可以是准周期排列或者周期排列。作为周期排列的例子,若为方形排列,则可以是两个排列方向的间隔不相等的长方形排列,也可以是三角格子排列或正三角格子排列等。另外,贯通孔12只要在过滤器部11设置有多个即可,排列并没有限定。
[0109]
贯通孔12的间隔根据分离的细胞的种类(大小、形态、性质、弹性)或量而适当地进
行设计。在此,所谓贯通孔12的间隔,如图3所示,意味着从过滤器部11的第一主面ps1侧观察贯通孔12,任意的贯通孔12的中心与相邻的贯通孔12的中心的距离b。在周期排列的构造体的情况下,贯通孔12的间隔b例如大于贯通孔12的一边d的1倍且为10倍以下,优选为贯通孔12的一边d的3倍以下。或者,例如,过滤器部11的开口率为10%以上,优选地,开口率为25%以上。通过这样的结构,能够降低流体对过滤器部11的通过阻力。因此,能够缩短处理时间,能够降低对细胞的压力。另外,所谓开口率,通过(贯通孔12所占的面积)/(假定未开贯通孔12时的第一主面ps1的投影面积)来计算。
[0110]
贯通孔12的内切圆的直径设计为小于有核细胞的核的大小。在本说明书中,所谓“贯通孔12的内切圆”,意味着从过滤器部11的第一主面ps1侧观察,在贯通孔12内描绘的圆中的直径最大的圆,即,与构成贯通孔12的过滤器部11的内壁相切的圆中的直径最大的圆。换言之,所谓“贯通孔12的内切圆”,意味着从过滤器部11的第一主面ps1侧观察,与划定贯通孔12的开口的所有的边相切的圆。此外,在本说明书中,所谓“有核细胞的核的大小”,意味着,在将有核细胞配置在液体中并用显微镜进行观察并将对有核细胞的核的外周的任意的两个点进行连结的线中的最长的线作为有核细胞的核的长度的情况下,多个有核细胞的核的长度的平均值。
[0111]
关于贯通孔12的尺寸,优选所述贯通孔的内切圆的直径相对于所述有核细胞的核的大小的比例为0.64以下。此外,贯通孔12的内切圆的直径相对于有核细胞的核的大小的比例优选为0.06以上。更优选地,贯通孔12的内切圆的直径相对于有核细胞的核的大小的比例为0.07以上。
[0112]
多个贯通孔12的尺寸设计为大致相同。在是将相同的形状的多个贯通孔12进行了周期排列的结构的情况下,优选多个贯通孔12的大小的标准偏差小。具体地,在进行贯通孔12的一边d的长度测量并根据100个贯通孔12的一边d的平均值和标准偏差求出了变动系数的情况下,优选变动系数为40%以下。
[0113]
过滤器部11的厚度优选大于贯通孔12的大小(一边d)的0.1倍且为100倍以下。更优选地,过滤器部11的厚度大于贯通孔12的大小(一边d)的0.5倍且为10倍以下。通过这样的结构,能够降低过滤器10对流体的阻力,能够缩短处理时间。其结果是,能够降低对细胞的压力。
[0114]
过滤器部11的表面(第一主面ps1)的算术平均粗糙度优选小于有核细胞的核的大小。通过这样的结构,能够降低细胞向过滤器部11的表面(第一主面ps1)的附着,能够提高细胞的回收率。另外,关于算术平均粗糙度的测定,利用株式会社ulvac制造的触针式表面形状测定机dektak150(注册商标),将过滤器部11的表面中的5处的测定值的平均值作为过滤器部11的算术平均粗糙度。
[0115]
在过滤器部11中,包含有核细胞的液体所接触的第一主面ps1也可以形成得平滑。具体地,过滤器部11的第一主面ps1可以没有凹凸而以均匀的平面形成。换言之,过滤器部11的第一主面ps1上的多个贯通孔12的开口形成在同一平面上。此外,过滤器部11中的作为未形成贯通孔12的部分的过滤器基体部14相连而形成为一体。通过这样的结构,能够降低细胞向过滤器部11的表面(第一主面ps1)的附着,能够容易地回收捕获的有核细胞。
[0116]
在过滤器部11的贯通孔12中,第一主面ps1侧的开口和第二主面ps2侧的开口通过连续的壁面连通。具体地,贯通孔12设置为第一主面ps1侧的开口能够投影到第二主面ps2
侧的开口。即,在从第一主面ps1侧观察过滤器部11的情况下,贯通孔12设置为第一主面ps1侧的开口与第二主面ps2侧的开口重叠。在实施方式1中,贯通孔12设置为其内壁相对于第一主面ps1以及第二主面ps2垂直。
[0117]
《框部》
[0118]
框部15设置在过滤器部11的外周,是与过滤器部11相比每单位面积的贯通孔12的数目少的部分。框部15处的贯通孔12的数目为过滤器部11处的贯通孔12的数目的1%以下。框部15的厚度可以比过滤器部11的厚度厚。通过这样的结构,能够提高过滤器10的机械强度。
[0119]
在将过滤器10连接于装置进行使用的情况下,框部15也可以作为将过滤器10和装置连接的连接部而发挥功能。此外,也可以在框部15显示过滤器的信息(贯通孔12的尺寸等)。
[0120]
从过滤器部11的第一主面ps1侧观察,框部15形成为环状。从第一主面ps1侧观察过滤器10,框部15的中心与过滤器部11的中心一致。即,框部15与过滤器形成在同心圆上。
[0121]
从操作容易性以及与系统的接合的容易性的观点出发,过滤器10也可以固定于夹具进行使用。夹具例如能够由能够进行伽马灭菌的材料构成。夹具例如可以由如下的材料形成,该材料包含聚乙烯、聚对苯二甲酸乙二醇酯、聚氨酯、聚苯乙烯、硅橡胶、abs树脂、聚酰胺、聚酰胺酰亚胺、聚砜、天然橡胶、乳胶、聚氨酯橡胶、乙烯醋酸乙烯、聚酯类、环氧类、酚类、二氧化硅、氧化铝、金、铂、镍、不锈钢、钛等。通过用这样的材料构成夹具,从而能够降低对细胞的压力。
[0122]
[过滤方法]
[0123]
对使用了过滤器10的过滤方法进行说明。
[0124]
首先,准备过滤器10。在该工序中,准备根据有核细胞的核的大小选择了贯通孔12的尺寸的过滤器10。具体地,准备具有小于成为过滤对象的有核细胞的核的大小的贯通孔12的过滤器10。
[0125]
例如,在准备过滤器10的工序中,也可以通过使用测微计或血球计算板等对多个有核细胞的核的大小进行确认,从而选择具有小于有核细胞的核的大小的贯通孔12的尺寸的过滤器10。或者,也可以通过对多个有核细胞进行照片拍摄并对多个有核细胞的核的大小进行长度测量,从而选择具有小于有核细胞的核的大小的贯通孔12的尺寸的过滤器10。另外,过滤器10的选择并不限定于这些。
[0126]
过滤器10被装配于装置。具体地,通过夹持过滤器10的框部15,从而过滤器10被装配于装置。
[0127]
接着,使细胞悬浮液通过过滤器10。在本说明书中,所谓“细胞悬浮液”,是包含有核细胞的流体。在多数情况下,包含有核细胞的流体是液体。作为液体,例如是包含氨基酸、蛋白质、血清等的培养溶液、磷酸缓冲生理食盐水或水。在细胞悬浮液中,除了细胞和流体以外,还可以包含树脂制粒子等来源于非生物的物质、骨片或肉片等组织的一部分、死细胞等。
[0128]
像这样,通过使包含有核细胞的液体通过过滤器部11,从而从液体分离有核细胞。在实施方式1中,过滤器部11的贯通孔12的内切圆的直径被设计为小于有核细胞的核的大小。因此,有核细胞不通过贯通孔12,被捕获在过滤器部11的第一主面ps1上。
[0129]
作为使细胞悬浮液通过过滤器10的方法,例如有对过滤器部11的第一主面ps1从大致铅直上方利用重力使细胞悬浮液通过的方法。除此以外,还有在使细胞悬浮液接触过滤器部11的第一主面ps1之后对细胞悬浮液施加压力而使其通过的方法(推压)、或者使细胞悬浮液接触过滤器部11的第一主面ps1并从第二主面ps2进行吸引而使细胞悬浮液通过的方法(吸引)等。另外,在使包含有核细胞的液体通过过滤器部11的工序中,优选尽量不对细胞造成压力。例如,在施加压力的情况下,优选设为有核细胞不变形的程度的压力。更优选的是,不施加压力而通过液体的自重使液体通过过滤器部11。或者,优选通过提高过滤器部11的开口率而缩短处理时间,减少对有核细胞施加压力的时间。
[0130]
此外,也可以在有核细胞浮游在液体中的状态下使细胞悬浮液通过过滤器10。浮游在液体中的有核细胞成为大致球形状,因此能够使作为捕获对象的有核细胞的回收率提高。即,能够使想要捕获的有核细胞的尺寸精度提高。
[0131]
此外,通过多次通过过滤器10,从而能够提高作为捕获对象的有核细胞的尺寸精度。
[0132]
在使用了过滤器10的过滤方法中,例如,也可以使用过滤用容器进行过滤。过滤用容器例如是外形为14mm、内径为6mm、高度为55mm的圆筒形状的容器,能够在底部装配过滤器10。另外,过滤容器并不限定于此,也可以使用各种各样的形状以及尺寸的容器。
[0133]
[过滤器的制造方法]
[0134]
对过滤器10的代表性的制造方法进行说明。过滤器10通过以下的工序进行制造。
[0135]
《供电膜的形成》
[0136]
使用溅射装置,在硅基板的上表面形成cu的供电膜。该供电膜成为形成后述的过滤器10的过滤器基体部14时的供电源。此时,也可以以确保硅基板与供电膜的粘接性为目的而形成ti等的中间层。
[0137]
形成cu的供电膜的条件如下。
[0138]
溅射气体:氩气
[0139]
溅射装置的真空度:5.0
×
10-4
pa
[0140]
施加功率:dc500w
[0141]
溅射时间:形成cu膜时/27分钟
[0142]
形成ti膜时/3分钟5秒
[0143]
《抗蚀剂像的形成》
[0144]
在形成于硅基板的上表面的供电膜上形成抗蚀剂像。
[0145]
使用旋涂机等,在形成于硅基板的上表面的供电膜上形成给定的膜厚的抗蚀剂膜。接着,经由形成了给定的图案的光掩模对抗蚀剂进行曝光,并进行显影处理,由此形成抗蚀剂像。
[0146]
涂敷抗蚀剂膜的条件如下。
[0147]
抗蚀剂:酚醛清漆类树脂+有机溶剂
[0148]
旋涂机的旋转数:1130rpm
[0149]
抗蚀剂膜厚:2μm
[0150]
在用旋涂机将上述抗蚀剂涂敷在硅基板上表面之后,在氮环境下以130℃使溶剂挥发,然后进行冷却,由此形成抗蚀剂膜。
[0151]
将包含365nm的波长的能量密度为2500j/m2的光线照射0.25秒,对抗蚀剂进行曝光。
[0152]
使曝光部分与碱性溶液接触而进行显影处理。
[0153]
《过滤器基体部的形成》
[0154]
在抗蚀剂像的开口部形成过滤器基体部14。将之前形成的供电膜作为供电源,使用电解镀敷法形成由镀镍膜构成的过滤器基体部14。
[0155]
过滤器基体部14的形成的条件如下。
[0156]
预处理:通过在稀硫酸中浸渍60秒,从而将供电膜的表面活性化。
[0157]
镀敷液:氨基磺酸镍镀敷液,液体温度55℃,ph=4.0
[0158]
镀敷速度:0.5μm/min
[0159]
镀敷:一边摇动一边进行电解镀敷。
[0160]
《抗蚀剂的溶解以及剥离》
[0161]
通过在丙酮溶液中对过滤器基体部14施加15分钟的超声波,从而使抗蚀剂膜溶解,将抗蚀剂剥离。
[0162]
《支承基材的形成》
[0163]
在使用过滤器10进行过滤时,也可以根据需要在过滤器10设置支承基材。通过这样,从而能够防止在过滤中过滤器10破损。支承基材通过以下的工序进行制作。另外,支承基材相当于在后述的图4中用附图标记“13”示出的构件。
[0164]
在形成了过滤器10的基体的硅基板的上表面再次涂敷感光性抗蚀剂而形成抗蚀剂膜,然后经由光掩模对抗蚀剂进行曝光,并进行显影处理,由此形成抗蚀剂像。此时,进行曝光、显影处理,使得抗蚀剂像跨越多个过滤器10的基体。另外,抗蚀剂像跨越过滤器10的基体的部分在完成过滤器10之后成为过滤器10的开口部。即,抗蚀剂像所跨越的过滤器10的基体的数目根据过滤器10所要求的开口率而适当地决定。
[0165]
在抗蚀剂像的开口部形成过滤器基体部14。将之前形成的供电膜作为供电源,使用电解镀敷法,形成由镀镍膜构成的支承基材。另外,支承基材的宽度根据过滤器10所要求的强度而适当地决定。
[0166]
通过在丙酮溶液中对支承基材施加15分钟的超声波,从而使抗蚀剂膜溶解,由此将抗蚀剂剥离。
[0167]
《供电膜的去除》
[0168]
去除供电膜,并将过滤器基体部14以及支承基材从硅基板分离,由此完成有核细胞的过滤用的过滤器10。
[0169]
供电膜的去除通过在如下的水溶液中在25℃的环境下浸渍48小时而进行,该水溶液是将60%的双氧水、醋酸和纯水以1∶1∶20的混合比制作的。
[0170]
[效果]
[0171]
根据实施方式1涉及的过滤器10,能够达到以下的效果。
[0172]
过滤器10以金属以及金属氧化物中的至少任一者为主成分。此外,过滤器10具备形成了多个贯通孔12的过滤器部11。通过这样的结构,过滤器部11的贯通孔12不易变形,能够捕获作为捕获对象的有核细胞,能够使有核细胞的回收率提高。
[0173]
贯通孔12的内切圆的直径被设计为小于有核细胞的核的大小。通过这样的结构,
能够使有核细胞的回收率进一步提高。
[0174]
过滤器部11的第一主面ps1形成得平滑。通过这样的结构,能够使在第一主面ps1捕获的有核细胞容易地从过滤器部11分离,因此回收变得简单。
[0175]
关于有核细胞的核的形状,除了正圆以外还存在椭圆形等各种各样的形状。在过滤器10中,贯通孔12的内切圆的直径形成得小于有核细胞的核的大小,且贯通孔12的内切圆是与划定贯通孔12的开口的所有的边相切的圆。通过这样的结构,对于正圆形状的核以外的各种各样的形状的核也能够可靠地进行捕获,能够使回收率提高。
[0176]
此外,在使用了过滤器10的过滤方法中,通过使包含有核细胞的液体通过过滤器10,从而能够可靠地捕获作为捕获对象的有核细胞,因此能够使回收率提高。
[0177]
有核细胞的核的大小根据种类、培养条件、传代数等而变动。例如,即使是相同的细胞,核的大小也会根据进行培养的温度、时间或环境等培养条件而不同。因此,即使是相同的有核细胞,核的大小也是各种各样的,在不着眼于核的大小而准备了过滤器10的情况下,有时有核细胞会通过贯通孔12。在使用了过滤器10的过滤方法中,准备根据有核细胞的核的大小选择了贯通孔12的尺寸的过滤器10。即,在使用了过滤器10的过滤方法中,选择具有小于过滤对象的有核细胞的核的大小的贯通孔12的过滤器10,从而准备了用于过滤的过滤器10。因此,在使用了过滤器10的过滤方法中,能够在过滤器10上可靠地捕获有核细胞,能够使回收率提高。
[0178]
另外,虽然在实施方式1中,对贯通孔12的尺寸大致相同的例子进行了说明,但是并不限定于此。例如,贯通孔12的尺寸也可以分别不同。在该情况下,贯通孔12的最大尺寸只要设计为小于有核细胞的核的大小即可。
[0179]
虽然在实施方式1中,关于过滤器10的制造方法,说明了包括形成衬里层基体部的工序的例子,但是并不限定于此。例如,过滤器10的制造方法也可以不包括形成衬里层基体部的工序。
[0180]
虽然在实施方式1中,说明了通过使包含有核细胞的液体通过过滤器10而对有核细胞进行过滤的例子,但是并不限定于此。例如,也可以使用过滤器10,从包含活细胞和死细胞的液体分离活细胞和死细胞。
[0181]
作为分离活细胞和死细胞的方法,例如,可以通过过滤器10在过滤器部11的第一主面ps1上捕获活细胞,并使死细胞通过。此外,也可以通过过滤器10在过滤器部11的第一主面ps1上捕获死细胞,并使活细胞通过。
[0182]
虽然在实施方式1中,对过滤器10和过滤方法进行了说明,但是并不限定于此。例如,也可以作为包含有核细胞的过滤用的过滤器10的、用于实施过滤方法的试剂盒进行使用。
[0183]
实施例
[0184]
使用实施例1~8以及比较例1进行了实施方式1涉及的过滤器10的性能评价。
[0185]
(1)关于实施例1~8和比较例1的过滤器
[0186]
关于实施方式1涉及的过滤器10,以表1所示的规格进行了制作。
[0187]
[表1]
[0188][0189]
实施例1~8以及比较例1的外形的直径为7.8mm,过滤器部11的直径为6mm。在实施例1~7中,过滤器基体部14为镍(ni),实施例8中的过滤器基体部14为金(au)。从第一主面ps1侧观察,在过滤器部11以正方格子排列设置了正方形的贯通孔12。另外,因为贯通孔12的形状为正方形,所以如表1所示,贯通孔12的一边d的长度和内切圆的直径成为相同的尺寸。
[0190]
图4示出装配了支承基材13的过滤器10的概略结构。如图4所示,在实施例1~6中,在过滤器10的第二主面ps2侧设置有支承基材13。在支承基材13设置有正方形的多个开口部12a。支承基材13的厚度为14μm,开口部13a的一边,即,隔条(strip)的间隔a为260μm,隔条的宽度b为14μm。
[0191]
将这些实施例1~8以及比较例1的过滤器分别设置于过滤装置,并对细胞悬浮液进行过滤,由此进行了实施例1~8以及比较例1的过滤器的性能评价。
[0192]
(2)关于细胞悬浮液
[0193]
使用100mm培养皿,在包含10vol%的胎牛血清和1vol%的青霉素-链霉素的rpmi1620培养基(含有l-谷氨酰胺)中,将浮游细胞hl-60培养了5天,该浮游细胞是白血病细胞株。
[0194]
从100mm培养皿将培养液的一部分通过移液移动到15ml的离心管。接着,对装入了培养液的离心管,以1000rpm的旋转数进行3分钟的离心分离,然后去除了上清。接着,添加磷酸缓冲生理食盐水,生成了细胞悬浮液。另外,调整了磷酸缓冲生理食盐水的添加量,使得细胞悬浮液的细胞浓度成为105个/ml。
[0195]
将30μl的细胞悬浮液和15μl的荧光试剂dapi在微型管中进行混合而对细胞进行染色,将进行了染色的细胞悬浮液(细胞染色液)在遮光下以37℃培育了20分钟。然后,在玻璃载片上滴下10μl的细胞染色液,并重叠玻璃盖片,使用波长为345nm的激励光源,通过以455nm为中心的带通滤波器,并利用荧光显微镜进行了荧光观察。对发出蓝紫色的核的尺寸进行了测定,结果hl-60的核的大小按直径为7.0μm。另外,在实施例中,hl-60的核的大小是通过对100个hl-60的核的大小进行测定而算出的平均值。
[0196]
对100mm培养皿中的培养液的一部分,通过移液使细胞分散,然后使用微量移液管取出10μl,用细胞数计(thermo fisher制造自动细胞计数器,countess(注册商标)ii fl)
对细胞浓度、生存率、细胞的大小的平均值进行了测定。其结果是,细胞浓度为5
×
105个/ml,有活性的细胞(hl-60)的大小的平均值为13.4μm,生存率为90%。具体地,将细胞悬浮液和0.4%的台盼蓝溶液以1∶1的体积比例进行混合而将细胞膜染色为蓝色,将细胞悬浮液和台盼蓝溶液的混合液10μl滴下至细胞计数板(thermo fisher制造countess(注册商标)cell counting chamber slide),对细胞的形态进行了观察。在细胞计数中,通过将被染色的细胞膜作为标记的图像分析,分别求出了细胞的个数(浓度)、细胞的大小的平均值、生存率。
[0197]
对100mm培养皿中的培养液,进一步以任意的比率混合rpmi1620培养基,由此制作了以下的hl-60细胞悬浮液。
[0198]
有活性的细胞(hl-60)的浓度:3.06
×
105个/ml
[0199]
液量:1ml
[0200]
另外,对于在室温下的净化台内放置了4小时的100mm培养皿中的培养液,用上述的方法测定了细胞的生存率,其结果是,生存率下降为81%。这意味着,由于将细胞在室温下长时间放置,从而活性下降。
[0201]
(3)关于过滤方法
[0202]
在装配于过滤装置的实施例1~8以及比较例1的过滤器中,在使细胞悬浮液接触过滤器部11的第一主面ps1的状态下,从第二主面ps2侧吸引细胞悬浮液,由此进行了细胞悬浮液的过滤。作为操作条件,以2kpa的压力进行了吸引。
[0203]
(4)关于评价结果
[0204]
在表2示出评价结果。
[0205]
[表2]
[0206][0207]
在实施例1~8中,细胞(hl-60)的回收率为100%。相对于此,在比较例1中,细胞的
回收率为67.6%。在比较例1中,贯通孔12的内切圆的直径为7.2μm,因此大于细胞(hl-60)的核的大小7.0μm。因此,可认为细胞通过了贯通孔12。另一方面,在实施例1~8中,贯通孔12的内切圆的直径为0.4μm以上且4.5μm以下,小于细胞的核的大小。因此,可认为,在实施例1~8中,与比较例1相比,能够在过滤器部11的第一主面ps1捕获大量细胞。另外,在本说明书中,所谓“回收率”,意味着投入的有活性的细胞数相对于在过滤器的第一主面ps1上捕获的细胞的比例,通过(投入的有活性的细胞数-通过液包含的活性细胞的数目)/(投入的有活性的细胞数)进行了计算。另外,在表2中,在不同的日子进行了实施例1~7以及比较例1的评价和实施例8的评价,因此有活性的细胞(hl-60)的浓度不同,但是对评价的结果没有影响。
[0208]
另外,关于通过液包含的活性细胞的数目,在通过移液使通过液中的细胞分散之后,使用微量移液管将10μl的通过液取出10个检测体,用细胞数计(thermo fisher制造自动细胞计数器,countess(注册商标)ii fl)对上述检测体中的细胞的数目进行了计测。
[0209]
像这样,通过将贯通孔12的内切圆的直径设计为小于细胞核的大小,从而能够捕获更多的细胞,能够使回收率提高。作为其理由,在于如下方面,即,包围细胞核的细胞质容易变形,细胞核不易变形。
[0210]
在像比较例1那样,贯通孔12的内切圆的直径大于细胞核的大小的情况下,即使贯通孔12的内切圆的直径小于细胞的大小,有时也会由于细胞质变形,从而细胞通过过滤器10。
[0211]
另一方面,在像实施例1~8那样,将贯通孔12的内切圆的直径设计为小于细胞核的情况下,由于细胞核不易变形,所以与比较例1相比,在过滤器10上容易捕获细胞。
[0212]
此外,过滤器10为金属制这一点也有助于细胞的回收率的提高。通过使用由金属构成的过滤器10,从而过滤器10的贯通孔12自身的变形量与隔膜(membrane)等树脂性的过滤器相比变少。因此,在过滤器10中,更加容易捕获细胞。
[0213]
如表2所示,为了使细胞的回收率提高,贯通孔12的内切圆的直径(x)相对于细胞的核的大小(y)的比例优选为0.64以下。此外,贯通孔12的内切圆的直径(x)相对于细胞的核的大小(y)的比例优选为0.06以上。
[0214]
此外,如表2所示,实施例1与实施例2~7相比过滤时间变长。根据该情况,通过将贯通孔12的内切圆的直径(x)相对于细胞的核的大小(y)的比例设为0.07以上,从而能够缩短过滤时间。
[0215]
此外,在实施例1~8的过滤器部11中设置有贯通孔12的部分的面积为0.28cm2。处理能力(投入的细胞数/设置有贯通孔的部分的面积)成为1.1
×
106个/cm2。另一方面,在专利文献1的过滤器中,处理能力为0.37
×
106个/cm2。像这样,在实施例1~8中,与专利文献1的过滤器相比,处理能力高。
[0216]
此外,在过滤有核细胞时,优选抑制杂质向细胞悬浮液的混入,即,构成过滤器10的金属向细胞悬浮液的溶出,这是不言而喻的。
[0217]
在实施例1~7中,在过滤细胞(hl-60)时,使用了镍制的金属过滤器,在实施例1~7中,能够在不损害细胞的活性的情况下完成过滤。此外,在实施例8中,在过滤细胞(hl-60)时,使用了au制的金属过滤器,在实施例8中,也与实施例1~7同样地,能够在不损害细胞的活性的情况下完成过滤。
[0218]
对镍和au实施了作为金属的离子化倾向的指标的浸渍电位的测定。将磷酸缓冲生理食盐水中的以参考电极为基准的浸渍电位测定了3分钟,所述参考电极由氯化银构成,并被浸于饱和氯化钾溶液,结果镍的浸渍电位在比0.03v高的范围推移,au的浸渍电位在比0.3v高的范围推移。即,可以说,在以相同条件进行了测定时,只要是示出至少比0.03v高的浸渍电位的金属和/或金属氧化物,就能够在不损害细胞的活性的情况下进行过滤。
[0219]
此外,在实施例1~8中,能够在过滤器部11的第一主面ps1上捕获hl-60,另一方面,能够使磷酸缓冲生理食盐水通过。液体的通过容易度取决于过滤器的开口率,实施例之中开口率最低的是实施例1以及2中的23.3%(参照表1)。即,可以说,只要本发明的金属制的过滤器的开口率至少为23.3%,就能够使液体通过。此外,从液体的通过容易度的观点考虑,优选形成在金属制过滤器的贯通孔12的偏差小。在过滤处理时间短的情况下(例如,不足100秒),实施例之中变动系数最大的是实施例3中的0.17。即,可以说,变动系数优选为0.17以下。
[0220]
(5)关于实施例9~16的过滤器
[0221]
关于实施方式1涉及的过滤器10,以表3所示的规格进行了制作。
[0222]
[表3]
[0223][0224]
实施例9~16的外形的直径为7.8mm,过滤器部11的直径为6mm。在实施例9~15中,过滤器基体部14为镍,在实施例16中,过滤器基体部14为au。从第一主面ps1侧观察,在过滤器部11以正方格子排列设置了正方形的贯通孔12。另外,由于贯通孔12的形状为正方形,所以如表3所示,贯通孔12的一边d的长度和内切圆的直径成为相同的尺寸。
[0225]
(6)关于细胞悬浮液
[0226]
制作了以下的两种细胞悬浮液。
[0227]
(i)hela悬浮液
[0228]
使用100mm培养皿,在包含10vol%的胎牛血清和1vol%的青霉素-链霉素的rpmi1620培养基(含有l-谷氨酰胺)中,将粘接细胞hela培养了5天,该粘接细胞hela是来源于人类子宫颈癌的人类细胞株。
[0229]
培养后,从100mm培养皿吸引去除了培养基。接着,在100mm培养皿上的hela细胞加
入2ml的磷酸缓冲生理食盐水,并通过移液对hela细胞的细胞培养面(细胞的表面)进行了清洗。进而,加入1ml的磷酸缓冲生理食盐水,并通过移液再次进行hela细胞的细胞培养面的清洗,并进行了pbs吸引去除。然后,在清洗后的hela细胞加入0.8ml的0.25%胰蛋白酶/0.02%edta液,并在co2培养箱内静置5分钟。在用显微镜确认hela细胞已从100mm培养皿剥离之后,从100mm培养皿通过移液将细胞悬浮液的一部分移到了15ml的离心管。进而,用1ml的培养基对100mm培养皿进行洗涤,并将细胞悬浮液的一部分移到了离心管。使用离心分离机以1000rpm进行5分钟的离心分离,去除了上清。然后,用1ml的培养基进行移液,使细胞分散。
[0230]
利用附带对物测微计的显微镜,以40倍的倍率对细胞悬浮液的一部分进行放大观察,由此测定了hela细胞的核的大小。hela细胞的核的大小为直径10.0μm。另外,在实施例中,hela细胞的核的大小是通过对100个hela细胞的核的大小进行测定而算出的平均值。
[0231]
使用微量移液管将该细胞悬浮液取出10μl,用细胞数计(thermo fisher制造自动细胞计数器,countess(注册商标)ii fl)对细胞浓度、生存率、细胞的大小的平均值进行了测定。其结果是,细胞浓度为7
×
106个/ml,有活性的细胞(hela)的大小的平均值为17.1μm,生存率为95%。具体地,将细胞悬浮液和0.4%的台盼蓝溶液以1∶1的体积比例进行混合而将细胞膜染色为蓝色,将细胞悬浮液和台盼蓝溶液的混合液10μl滴下至细胞计数板(thermo fisher制造countess(注册商标)cell counting chamber slide),对细胞的形态进行了观察。在细胞计数中,通过将被染色的细胞膜作为标记的图像分析,分别求出了细胞的个数(浓度)、细胞的大小的平均值、生存率。
[0232]
将包含所培养的hela细胞的细胞悬浮液用rpmi1620培养基进行稀释,从而制作了hela细胞悬浮液。
[0233]
(ii)导入了ras基因的nih3t3(以下,有时记载为nih3t3(ras))悬浮液
[0234]
使用100mm培养皿,在包含5vol%的胎牛血清和1vol%的青霉素-链霉素的dmem培养基(含有4.5g/l葡萄糖l-谷氨酰胺酸)中,将导入了ras基因的胎鼠成纤维株粘接细胞nih3t3(ras)培养了3天。
[0235]
培养后,从100mm培养皿吸引去除了培养基。接着,在残留于100mm培养皿上的nih3t3(ras)加入2ml的磷酸缓冲生理食盐水,通过移液对细胞培养面(细胞的表面)进行了清洗。进而,加入1ml的磷酸缓冲生理食盐水,通过移液再次进行细胞培养面的清洗,并进行了pbs吸引去除。加入0.8ml的0.25%胰蛋白酶/0.02%edta液,并在co2培养箱内静置了3分钟。在用显微镜确认细胞已从100mm培养皿剥离之后,从100mm培养皿通过移液将细胞悬浮液的一部分移到了15ml的离心管。进而,用1ml的培养基对100mm培养皿进行洗涤,将细胞悬浮液的一部分移到了离心管。使用离心分离机以1000rpm进行5分钟的离心分离,去除了上清。然后,用1ml培养基进行移液,使细胞分散。
[0236]
使用附带对物测微计的显微镜,以40倍的倍率对细胞悬浮液的一部分进行放大观察,由此测定了nih3t3(ras)的核的大小。nih3t3(ras)的核的大小按直径为11.5μm。另外,在实施例中,nih3t3(ras)的核的大小是通过对100个nih3t3(ras)的核的大小进行测定而算出的平均值。
[0237]
对该细胞悬浮液,使用微量移液管取出10μl,用细胞数计(thermo fisher制造自动细胞计数器,countess(注册商标)ii fl)对细胞浓度、生存率、细胞的大小的平均值进行
了测定。其结果是,细胞浓度为4
×
106个/ml,有活性的细胞(nih3t3(ras))的大小的平均值为15.4μm,生存率为89%。具体地,将细胞悬浮液和0.4%的台盼蓝溶液以1:1的体积比例进行混合而将细胞膜染色为蓝色,将细胞悬浮液和台盼蓝溶液的混合液10μl滴下至细胞计数板(thermo fisher制造countess(注册商标)cell counting chamber slide),对细胞的形态进行观察。在细胞计数中,通过将被染色的细胞膜作为标记的图像分析,分别求出了细胞的个数(浓度)、细胞的大小的平均值、生存率。
[0238]
将包含所培养的nih3t3(ras)的细胞悬浮液用该dmem培养基(含有4.5g/l葡萄糖l-谷氨酰胺酸)进行稀释,从而制作了nih3t3(ras)细胞悬浮液。
[0239]
此外,关于hela细胞的核的大小和nih3t3(ras)的核的大小,还使用荧光显微镜进行了测定。具体地,使用荧光显微镜,以40倍的倍率对这些细胞悬浮液的一部分进行放大观察,由此测定了hela细胞的核的大小和nih3t3(ras)的核的大小。使用荧光显微镜进行了测定的结果,hela的核的大小按直径为10.0μm,nih3t3(ras)的核的大小为11.5μm。
[0240]
此外,对这些细胞悬浮液,使用微量移液管分别取出10μl,用细胞数计(thermo fisher制造自动细胞计数器,countess(注册商标)ii fl)对细胞浓度、生存率、细胞的大小的平均值进行了测定。其结果是,关于细胞浓度,hela为3.17
×
105个/ml,nih3t3(ras)为2.97
×
105个/ml,关于有活性的细胞的大小的平均值,hela为17.1μm,nih3t3(ras)为15.4μm,关于生存率,hela为98%,nih3t3(ras)为89%。具体地,将细胞悬浮液和0.4%的台盼蓝溶液以1:1的体积比例进行混合而将细胞膜染色为蓝色,将细胞悬浮液和台盼蓝溶液的混合液10μl滴下至细胞计数板(thermo fisher制造countess(注册商标)cell counting chamber slide),对细胞的形态进行了观察。在细胞计数中,通过将被染色的细胞膜作为标记的图像分析,分别求出了细胞的个数(浓度)、细胞的大小的平均值、生存率。
[0241]
通过对包含hela细胞的细胞悬浮液进一步以任意的比率混合磷酸缓冲生理食盐水,从而制作了以下的hela细胞悬浮液。
[0242]
有活性的细胞(hela)的浓度:3.17
×
105个/ml
[0243]
液量:1ml
[0244]
通过对包含nih3t3(ras)的细胞悬浮液进一步以任意的比率混合磷酸缓冲生理食盐水,从而制作了以下的nih3t3(ras)细胞悬浮液。
[0245]
有活性的细胞(nih3t3(ras))的浓度:2.97
×
105个/ml
[0246]
液量:1ml
[0247]
(7)关于过滤方法
[0248]
在装配于过滤装置的实施例9~16的过滤器中,在使细胞悬浮液接触过滤器部11的第一主面ps1的状态下,从第二主面ps2侧吸引细胞悬浮液,由此进行了细胞悬浮液的过滤。作为操作条件,以2kpa的压力进行了吸引。
[0249]
(8)关于评价结果
[0250]
在表4以及表5示出评价结果。
[0251]
[表4]
[0252][0253]
[表5]
[0254][0255]
如表4以及表5所示,在实施例9~16中,hela、nih3t3(ras)的回收率均为100%。在实施例9~16中,贯通孔12的内切圆的直径为0.4μm以上且7.2μm以下,小于hela以及nih3t3(ras)中的细胞的核的大小。因此,可认为,在实施例9~16中,也与实施例1~8同样地,能够在过滤器部11的第一主面ps1捕获更多细胞。
[0256]
此外,如表4以及表5所示,实施例9与实施例10~16相比,过滤时间变长。即,与实
施例1~8同样地,通过将贯通孔12的内切圆的直径(x)相对于细胞的核的大小(y)的比例设为0.07以上,从而能够缩短过滤时间。
[0257]
此外,在实施例9~16的过滤器部11中设置有贯通孔12的部分的面积为0.28cm2。处理能力(投入的细胞数/设置有贯通孔的部分的面积)为1.1
×
106个/cm2。另一方面,在专利文献1的过滤器中,处理能力为0.37
×
106个/cm2。像这样,在实施例1~8中,与专利文献1的过滤器相比,处理能力高。
[0258]
此外,在实施例9~15中,使用镍制的金属过滤器,在实施例16中,使用au制的金属过滤器,与实施例1~8同样地,能够在不损害细胞的活性的情况下完成过滤。
[0259]
另外,虽然在实施例中,对如下的例子进行了说明,即,对在细胞悬浮液中存在105个/ml以上的有核细胞的浓度比较高的细胞悬浮液进行过滤,从而捕获有核细胞,但是即使在对细胞悬浮液中有核细胞为几个/ml程度的极低浓度的细胞悬浮液进行过滤的情况下,过滤器10也能够捕获作为回收对象的有核细胞。
[0260]
本发明参照附图并与优选的实施方式相关联而进行了充分记载,但是对于熟悉该技术的人们来说,各种变形、修正是显然的。应理解为,这样的变形、修正只要不脱离基于所附的权利要求书的本发明的范围,就包含于本发明的范围。
[0261]
产业上的可利用性
[0262]
本发明的过滤器能够使有核细胞的回收率提高,因此对于从细胞悬浮液分离有核细胞的用途是有用的。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1