一种血浆来源的外泌体lncRNA在制备药物性肝损伤生物标志物中的应用的制作方法
一种血浆来源的外泌体lncrna在制备药物性肝损伤生物标志物中的应用
技术领域
1.本发明属于生物技术领域,具体涉及血浆来源的外泌体lncrna在制备药物性肝损伤生物标志物中的用途。
背景技术:
2.肝脏是体内最重要的代谢器官,也是外源性毒物在体内的主要靶器官之一。肝脏对化学物质损伤的易感性是由其特殊的解剖学位置和生理生化功能所决定的。由于肝脏在解剖学上接近来自消化道的血液供应,是经消化道吸收的毒物发挥其毒性作用的首要靶位;肝脏具有浓聚和转化外源性化学物质的能力,在排泄外源性化合物质及其代谢产物到胆汁的过程中发挥重要作用。因此,当机体接触外源性毒物时,肝脏比其他器官更常发生毒性反应。因此急需建立发现和确证新的肝损伤生物标志物,能够早期发现肝损伤,并可以反映肝脏损伤的改善或加重,甚至能反映损伤的机制。
3.药物诱导的肝损伤(drug induced liver injury,dili)或称为药物性肝损害,是指由于药物和/或其代谢产物引起的肝脏损伤,其可以发生于以往没有肝病史的健康者或原来就有严重疾病的病人,在使用某种药物后发生程度不同的肝脏损伤。临床上dili是导致急性肝衰竭并导致死亡的主要原因,同时也是导致市售药品撤市的一项主要因素。据统计,美国至少13 %的急性肝衰竭是由dili引起。另外,目前临床上使用的药物中至少已超过1100种药物与肝脏损伤相关,尽管报道的dili的发生率在1/10000~1/100000范围之内,但由于一些病例的失诊或未及时报告,dili的实际发生率要远远高于上述范围。
4.针对dili可能导致严重的临床不良事件发生,欧洲药品管理局(emea)于2008年颁布了“non-clinical guideline on drug-induced hepatotoxicity”指导原则,美国fda也于2009年颁布了“drug-induced liver injury:premarketing clinical evaluation”指导原则,以帮助医药企在新药研发过程中全面深入地评估dili的风险。
5.近半世纪以来,传统的生物标志物一直在临床上用于dili的检测,如丙氨酸转移酶(alt)、谷草转氨酶(ast)、碱性磷酸酶(alp)及总胆红素(tbd)等。alt与ast存在于肝细胞内,在药物性肝损伤的过程中,血清中的alt及ast升高,这与肝细胞的死亡及其释放内容物相关。血清alp的升高和胆管上皮细胞损伤相关,tbil的升高可能反映了肝细胞功能受损,或与胆红素生产与加工有关。然而,尽管现有的肝损伤生物标志物如丙氨酸氨基转移酶(alt)、天冬氨酸氨基转移酶(ast)等可标识肝脏损伤或功能改变,但这些指标因缺乏特异性(其他脏器或组织损伤也可致其活性增加)及其与组织形态学数据的一致性较差导致其已不能满足及早并准确地评估dili风险。
6.随着肝损伤研究的逐渐深入,发现了一些新的肝脏毒性损伤的检测指标。最近发现2种新的dili生物标志物:谷氨酸脱氢酶(gldh)和mirna-122这2种生物标志物均已收到美国食品和药物管理局和欧洲药物管理局的支持信,支持作为肝脏特异性候选生物标志物。
7.外泌体是细胞外囊泡的一种,细胞外囊泡分为三种:凋亡小体、微泡和外泌体。外泌体的产生过程涉及质膜的双重内陷和含有腔内小泡(ilv)的细胞内多泡体(mvb)的形成。ilv最终通过mvb融合到质膜,经过胞吐作用,以直径为40~160nm的外泌体形式分泌。外泌体的密度为1.15
–
1.19 g/ml。在其表面发现的四聚体跨膜蛋白cd63、cd9和cd81通常作为外泌体的表面生物标志物。同时,大多数细胞可分泌外泌体,它广泛存在于各种体液中,如血液、唾液、尿液、脑脊液等。外泌体将各种分子从亲代细胞运送到其他细胞,包括蛋白质、dna、mrna/mirna、lncrna等。外泌体的组成类似于亲代细胞,因此能够提供可追踪的亲本细胞的特异信息。扫描电子显微镜(sem)、透射电子显微镜、动态光散射和纳米粒子跟踪分析广泛用于测量外泌体的物理特征,如囊泡的大小、分布和浓度。
8.长链非编码rna(lncrna)是一类长度超过200个核糖核苷酸的缺乏开放阅读框的非编码rna分子,没有编码蛋白质的能力,或者编码功能有限。最初发现时被认为是基因组转录的“噪音”,是rna聚合酶ⅱ转录的副产物,没有生物学作用。经过深入研究发现,lncrna在细胞中参与了重要的调控过程,如:调节细胞分化、衰老、增殖、凋亡、坏死以及肿瘤的发生发展。研究发现,尽管与信使rna相比,lncrna比较倾向于以低水平表达,但是lncrna表达比mrna表达更具有细胞特异性,表明lncrna可能是细胞命运的关键调节因子。同时有研究显示,lncrna与肝脏相关疾病和损伤密切相关。但lncrna数据库非常庞大(迄今共有172,216个),临床检测上尚未开发出与肝损伤尤其是外源性化合物(例如对乙酰氨基酚)引起的肝损伤密切相关的lncrna。
9.目前已有大量研究报道,在病理条件下,许多外泌体lncrna的表达水平与正常对照组显著不同,表明外泌体可以选择性地包装、分泌和运输lncrna,并特异性地发挥生物学功能。外泌体可以保护lncrna免受rna酶的降解,因此它们可以稳定地存在于体液中。
技术实现要素:
10.本发明所要解决的技术问题是为了克服现有技术中药物性肝损伤生物标志物存在敏感度不高、检测方法过于复杂、试剂昂贵、需要联合其他指标共同评价肝损伤以及不能及时准确地预测药物性肝损伤等缺陷,提供了一种外泌体来源的长链非编码rna(lncrna)在制备肝损伤生物标志物中的用途及含其的试剂盒。所述的用途能够将lncrna应用于肝损伤生物标志物的制备,尤其是用来检测外源性化合物引起的肝损伤,检测的敏感度高且检测方法和试剂简单,能够被广泛应用于及时检测药物性肝损伤,能在早期及时发现药物性肝损伤,其检测结果可靠,可以单独检测或者联合其他指标共同评价肝损伤。
11.本发明人对肝损伤进行长期研究,并经过大量实验,意外地发现一些外泌体来源的lncrna可以作为外源性化合物引起的药物性肝损伤的特异性的生物标志物,在外源性化合物引起的药物性肝损伤的血浆中高表达,能够发挥其在制备肝损伤生物标志物中用途,从而检测由外源性化合物引起的肝损伤。
12.为了解决上述技术问题,本发明第一方面提供了一种lncrna标志物在制备用于检测肝损伤(例如药物性肝损伤)的试剂盒和/或芯片中的应用,所述lncrna标志物包括noncode transcript id为nonratt018001.2的lncrna。
13.如本发明第一方面所述的应用,所述lncrna标志物作为唯一的检测肝损伤生物标志物单独使用,或者所述lncrna标志物和常规的检测肝损伤生物标志物联合使用。
14.按照本领域常规,所述常规的检测肝损伤生物标志物可以选自丙氨酸氨基转移酶和天冬氨酸氨基转移酶。
15.如本发明第一方面所述的应用,所述检测为检测样本中所述lncrna标志物的转录层面表达水平。
16.按照本领域常规,本发明所述转录层面表达水平的检测可以为rna全转录组测序、实时荧光定量pcr检测或表达谱芯片。
17.在本发明的优选实施例中,所述检测为rna全转录组测序。
18.在本发明的优选实施例中,所述样本为血浆。
19.如本发明第一方面所述的应用,所述肝损伤为外源性化合物引起的肝损伤。
20.在本发明的优选实施例中,所述外源性化合物是对乙酰氨基酚(apap)。
21.为了解决上述技术问题,本发明第二方面提供了一种检测肝损伤的试剂盒,所述试剂盒包括检测lncrna的试剂;所述lncrna包括noncode transcript id为nonratt018001.2的lncrna。
22.如本发明第二方面所述的试剂盒,所述试剂为检测样本中所述lncrna标志物的转录层面表达水平的试剂。
23.在本发明的优选实施例中,所述检测包括rna全转录组测序;和/或,所述样本为血浆;和/或,所述试剂盒还包括外泌体rna抽提试剂。
24.如本发明第二方面所述的试剂盒,所述肝损伤为外源性化合物引起的肝损伤。
25.在本发明的优选实施例中,所述外源性化合物是对乙酰氨基酚。
26.为了解决上述技术问题,本发明第三方面提供了一种检测肝损伤的芯片;所述芯片上设置包括检测lncrna的试剂;所述lncrna包括noncode transcript id为nonratt018001.2的lncrna。
27.如本发明第三方面所述的芯片,所述试剂为检测样本中所述lncrna标志物的转录层面表达水平的试剂。
28.在本发明的优选实施例中,所述检测包括rna全转录组测序;和/或,所述样本为血浆。
29.如本发明第三方面所述的芯片,所述肝损伤为外源性化合物引起的肝损伤。
30.在本发明的优选实施例中,所述外源性化合物是对乙酰氨基酚。
31.为了解决上述技术问题,本发明第四方面提供了用于检测noncode transcript id为nonratt018001.2的lncrna转录层面表达水平的试剂、如本发明第二方面所述的试剂盒或如本发明第三方面所述的芯片在制备用于检测肝损伤的产品中的应用。
32.在符合本领域常识的基础上,上述各优选条件,可任意组合,即得本发明各较佳实例。
33.本发明所用试剂和原料均市售可得。
34.本发明的积极进步效果在于:本发明公开了能够将外泌体来源的lncrna应用于肝损伤生物标志物的制备,尤其是用来检测外源性化合物引起的肝损伤,检测的敏感度高且检测方法和试剂简单,能够被广泛应用于检测肝损伤,其检测结果可靠,可以单独检测或者联合其他指标共同评价肝损伤。
附图说明
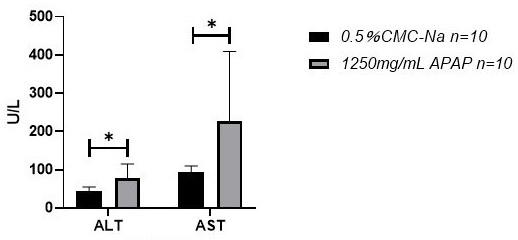
35.图1为对乙酰氨基酚给药组大鼠血清alt、ast活性的改变,其中﹡代表与溶媒组相比p《0.05。
36.图2为给药组大鼠和对照组大鼠roc曲线。
具体实施方式
37.下面通过实施例的方式进一步说明本发明,但并不因此将本发明限制在所述的实施例范围之中。下列实施例中未注明具体条件的实验方法,按照常规方法和条件,或按照商品说明书选择。
38.实施例1 寻找肝损伤生物标志物1.1肝损伤模型的建立1.1.1实验试剂和仪器、实验动物(1)阳性药:对乙酰氨基酚(批号:d2114266,购自上海阿拉丁生化科技股份有限公司);(2)溶媒对照品:0.5%羧甲基纤维素钠(0.5%cmc-na);alt,ast检测试剂盒由日本和光纯药工业株式会社生产;hitachi 7060型全自动生化分析仪购于日本日立产业株式会社。
39.(3)实验动物雄性sd大鼠10只,雌性大鼠10只,spf级,体重180~320g,6~9周龄,购自北京维通利华实验动物技术有限公司[许可证号:scxk(京)2016-0006]。动物采用芯片和笼牌标识,5只/笼,动物饲养于上海益诺思生物技术股份有限公司的spf级动物房,动物房温度控制在22~26摄氏度,湿度控制在40~70%之间,每分钟通气次数≥15次,12小时/12小时的明暗光照周期,动物自由摄食,经钴60辐照灭菌的spf大鼠维持饲料由北京科澳协力饲料有限公司提供,动物通过饮水瓶自由饮用自制的去离子水。
[0040]
1.1.2实验方法1.1.2.1 阳性药的配制对乙酰氨基酚(apap)的混悬液配制:分别称量3.75 g对乙酰氨基酚,转移至玻璃瓶中并加入适量的0.5% cmc-na(w/w)。用玻棒初步进行搅拌,打开匀浆机进行工作,充分分散后关机,加入0.5% cmc-na至所需体积后将其混匀,配制成1250 mg/kg的混悬液,保证上下均一性,室温、避光、放置待用。配制过程需避光。
[0041]
1.1.2.2 动物试验剂量设置采用随机区组设计的分组,将20只大鼠根据体重随机分配到2组:溶媒对照组(0.5%cmc-na)、给药组(1250mg/kg对乙酰氨基酚),详见表1。
[0042]
表1 实验剂量设计
1.1.2.3给药及观察检查溶媒对照组和对乙酰氨基酚给药组的给药途径均为经口灌胃给药,单次给药,给药容量为10 ml/kg。给药体积根据最近一次测得的体重进行计算。
[0043]
在给药后24小时后,采用40mg/ml舒泰+5mg/ml赛拉嗪注射液混合制剂麻醉,腹主动脉采集全血少部分置于分离胶真空采血管中用于血清的分离:3500 rpm,4℃,5 min,吸取血清分装于ep管中,保存于-80℃冰箱,用于肝功能指标的检测。大部分置于edta-k2真空采血管中用于分离血浆:800g,4℃,10min,吸取上层血浆分装于ep管中,保存于-80℃冰箱,用于进行外泌体rna全转录组测序。
[0044]
1.1.2.4 血清生化检测结果本实验主要检测了临床前和临床中肝损伤评价普遍使用的血液学指标alt(丙氨酸氨基转移酶)、ast(天冬氨酸氨基转移酶)的变化。如图1结果显示,1250 mg/kg对乙酰氨基酚给药24 h后,给药组大鼠血清中alt、ast与溶媒对照组相比显著性升高(*:p《0.05)。
[0045]
1.1.2.5组织病理学检查结果肝脏组织病理学检查显示,溶媒对照组大鼠未见明显异常,给药组见不同程度肝细胞坏死,并伴炎细胞浸润,小叶周边细胞空泡变性,甚至坏死。详细评分见表2所示。
[0046]
表2 乙酰氨基酚暴露24 h后肝脏组织病理形态学观察结果“n”代表无明显异常。
[0047]“肝细胞坏死,伴炎细胞浸润”一栏中,“0”代表无肝细胞坏死,未伴有炎细胞浸润;“1”代表较少肝细胞坏死,伴有较轻微伴炎细胞浸润;“2”代表少许肝细胞坏死,伴有轻微炎细胞浸润;“3”代表中度的肝细胞坏死,伴有中度炎细胞浸润;“4”代表重度的肝细胞坏死,
伴有重度炎细胞浸润。
[0048]“小叶周边空泡变性”一栏中,“0”代表小叶周边空泡无变性;“1”代表小叶周边空泡较轻微变性;“2”代表小叶周边空泡轻微变性;“3”代表小叶周边空泡中度变性;“4”代表小叶周边空泡重度变性。
[0049]
1.1.2.6 结论本部分实验采用sd大鼠经口灌胃给予1250 mg/kg对乙酰氨基酚和0.5%羧甲基纤维素钠,24小时后采血进行血清生化检测和组织病理学检查,考察对乙酰氨基酚诱导的肝损伤情况。
[0050]
在血清生化检测中,给药后24小时后,1250 mg/kg apap组动物的alt和ast均显著升高。病理组织学检查主要可见不同程度肝细胞坏死,并伴炎细胞浸润,小叶周边细胞空泡变性,坏死。
[0051]
综上可见,sd大鼠经口灌胃给予对乙酰氨基酚后成功地诱导了大鼠肝损伤,因此对乙酰氨基酚诱导肝损伤模型成立,可用于肝损伤生物标志物的筛选和验证。
[0052]
外泌体rna全转录组测序1.2.1 外泌体抽提采用 exorneasy serum/plasma maxi kit (qiagen) 试剂盒,根据生产厂商提供的标准操作流程进行操作,分离样本中的外泌体。
[0053]
步骤如下:1)500ul 血浆样本-80 ℃取出,25 ℃水浴解冻;2) 13000g, 4℃离心 10 分钟3)按照 1:1 的样本体积加入 buffer xbp,上下颠倒 5 次;4)样本与 buffer xbp 混合液转移至 exoeasy spin column,500g 4℃离心 1min;弃除底部废液;5)加入 3.5m 的 buffer xwp 到 exoeasy spin column 中,5000g 4℃离心 5 分钟;弃除底部废液;6)转移 spin column 到新的收集管中;7)加入 200ul buffer xe,5000g 4℃离心 5 分钟收集底部外泌体到 1.5ml 离心管中;8)外泌体分装,-80℃保存。
[0054]
1.2.2 外泌体相关指标鉴定1.2.2.1外泌体标志物 wb 鉴定取一定量外泌体的pbs重悬液,加入等体积的ripa(强)裂解液进行裂解提取蛋白,之后进行蛋白浓度测定以及wb检测外泌体标志物。
[0055]
1.2.2.2外泌体纳米微粒追踪检测(nta)1)取冻存样本,25 ℃水浴解冻,冰上放置;2)取外泌体样本用 1
×
pbs 进行稀释,直接用于 nta 检测。
[0056]
3)测试所用仪器信息仪器名称:纳米粒度颗粒跟踪分析仪生产公司:particle metrix
仪器型号:zetaview s/n 17-310分析用软件版本:zetaview 8.04.021.2.3 rna质量鉴定测序实验起始样本为总rna,外泌体总rna由qiagen exorneasy midi kit(cat no./id: 77144)试剂盒获得,由agilent 4200 tapestation进行质检,质检合格的rna可进行后续的全转录组测序。
[0057]
1.2.4 文库构建与质检分离外泌体进而抽提得到的总rna,用针对外泌体 rna 的超高敏微量样本链特异性试剂盒进行建库,构建的文库使用 qubit
®ꢀ
2.0 fluorometer 检测浓度,agilent2100 检测文库大小。
[0058]
1.2.5 上机测序质检合格的文库,准备进行 illumina 测序,测序策略为 pe150。测序基本原理为边合成边测序(sbs,sequencing by synthesis):将携有 cluster 的 flow cell 上机,并在 flow cell 中加入四种荧光标记的 dntp、dna 聚合酶以及接头引物进行扩增,在每一个测序簇延伸互补链时,每加入一个被荧光标记的 dntp 就能释放出相对应的荧光,测序仪通过捕获荧光信号,并通过计算机软件将光信号转化为测序峰,从而获得待测片段的序列信息。
[0059]
1.2.6 数据质控获得测序原始数据(raw data)后,首先需要对数据进行过滤、去接头序列及对低质量 reads 进行处理,再对测序质量进行评估,重复检验获得高质量数据(clean data)。并将 clean data 与参考基因组进行比对,对已知 mrna 和 lncrna 进行定量分析;未比对上的 reads 采用 acfs 分析环状 rna。
[0060]
1.2.7 数据预处理原始测序数据中含有测序接头序列,也有些 reads 中含有质量较低的碱基、reads 末端质量偏低等不合格情况,这些可能影响到后续分析结果的可靠性,故在此先对原始数据进行预处理,去除接头序列、低质量 reads。数据预处理软件使用 seqtk。
[0061]
主要步骤如下:1)去除 reads 中所含有的接头序列;2)去除 3’端质量 q 低于 20 的碱基,即碱基错误率小于 0.01,其中,q=-10log(error_ratio);3)去除长度小于 25 的 reads;4)去除所属物种的 ribosome rna reads。
[0062]
经过原始数据预处理后,得到后续分析使用的 clean reads。
[0063]
1.2.8 比对分析使用 hisat2 软件将预处理后的测序序列进行基因组 mapping 分析。通常我们将 clean no rna reads 比对到基因组,这也是后续分析的基础。hisat2 采用全局和局部搜索的方法,能够高效进行 mapping,且能够有效比对到 rna seq 测序数据中的 spliced reads,参数设置默认参数,参考基因组版本为 rnor_6.0.95,结果为 bam 文件。
[0064]
1.2.9 lncrna 定量与差异分析
1.2.9.1新lncrna预测应用 cufflinks(version:2.1.1)中的 cuffcompare 将 mapping 得到的注释信息与参考注释(noncode 和 ensembl 数据库)进行比较,得到未能与已知注释基因匹配的新转录本,提取{i、u、x}三类转录本进行 lncrna 预测,具体步骤如下:1)转录长度大于 200bp 且 exon 》 2;2)覆盖 fragment counts 》 3;3)预测的 orf 《 300;4)phylocsf(目前仅限于人、大小鼠)、pfam、cpc、cnci预测,对4种(或3种)预测结果取交集,选择phylocsf score 《0 & pfam比对不显著&cpc score《0&cnci score《0的转录本作为潜在的lncrna。
[0065]
5)与已知lncrna比较,去除与known lncrna相同的序列。
[0066]
1.2.9.2 lncrna表达定量应用 stringtie(version:1.3.0)对预测的 novel lncrna 和 noncode 数据库(version: noncode 2016;http://www.noncode.org/),以及 ensembl 数据库中的已知 lncrna 进行表达定量。其中mstrg开头的id为novel lncrna,non开头的id为数据库中已知的lncrna,ens开头的id为ensembl 数据库中已知的 lncrna。
[0067]
1.2.9.3 lncrna差异表达分析应用 edger 进行样本间差异 lncrna 分析。并对差异的 lncrna 进行火山图和 heatmap 图绘制展示。
[0068]
1.2.9.4 lncrna 靶基因预测与靶基因富集分析lncrna与 mrna的相互作用关系分为顺式(cis)与反式(trans),这种与lncrna发生相互作用关系的mrna被称为lncrna的靶基因。
[0069]
高通量测序得到的差异基因比较多,从几百到上千都有可能。为更好的理解这些差异基因可能在细胞中行使的生物学功能或者可能扰动的信号通路,我们对差异的基因进行 gene ontology 及 kegg 数据库的注释与功能富集。
[0070]
全转录组测序结果1.3.1 概述利用聚类分析绘制样本中差异有统计学意义(p《0.05)且log2fc(fold changes,fc)值》2倍以上变化且至少一组count最小值》10的lncrna。结果显示(表3中列出了部分lncrna的变化倍数):与溶媒对照组比较,给药组log2fc(abs,绝对值)2倍以上变化且p《0.05的有24条,其中上调的有18条,下调的有6条;4倍以上变化且p《0.05的有2条,其中上调的有1条,下调的有1条。提示这些差异表达的lncrna可能与药物性肝损伤发生,发展及分子调控密切相关。其中lncrna(noncode transcript id: nonratt018001.2)在给药组大鼠血浆外泌体中的表达量是溶媒对照组中的159.7倍。
[0071]
表3 部分lncrna的变化倍数
1.3.2 go分析结果差异表达基因利用 fisher 精确检验进行go分析。fisher 精确检验计算得到 p-value,并进行多重假设检验校正得到q-value。筛选 q-value 小于 0.05的 go 条目作为显著富集的go条目。go功能注释分析发现,差异表达的lncrnas的靶基因mrnas主要集中在生物学过程:染色体分离的正调控;分子功能:酮甾体单加氧酶活性,醛糖醇:nadp+1
−
氧化还原酶活性。
[0072]
1.3.3 kegg分析结果进一步对差异表达的lncrnas预测靶基因mrnas进行kegg分析。与go分类统计类似,对kegg各个pathway大类上的差异表达基因数目进行统计。kegg分析发现差异表达的lncrnas预测靶基因mrnas主要集中在机体系统:免疫系统,内分泌系统;代谢通路:整体代谢通路;细胞通路:信号传导。提示差异表达的lncrnas可能通过调控预测靶基因mrnas从而参与这些通路的调节。
[0073]
实时定量pcr验证1.4.1 试剂反转录试剂: toyobo revertra ace qpcr rt kit定量 pcr 试剂: abi power sybr green pcr master mix引物合成:上海生工生物工程有限公司1.4.2仪器:定量 pcr 仪: abi 7500 实时荧光定量 pcr 系统1.4.3 实验步骤1.4.3.1 cdna 第一链合成1)从-80℃冰箱中取出rna,在4℃下解冻,然后在0.2 ml pcr管中配制反应溶液,如表4所示,其中x1和x2的值根据不同样品抽提的rna浓度不同,根据浓度换算取用的体积。
[0074]
表4 反应溶液体系
2)将pcr管置于pcr仪,运行程序:37℃孵育15 min,98℃变性5 min,4℃,保温。
[0075]
1.4.3.2 sybr green qpcr1)在 0.2ml pcr 管中配制反应液,如表5所示,其中x3的值根据不同样品cdna浓度不同,根据浓度换算取用的体积。
[0076]
表5 反应溶液体系2)将反应液加入 96 孔板中3)将96孔板置于 abi 7500 实时荧光定量 pcr 仪中。运行程序:50 ℃孵育 2min;95℃,10min;40个循环:95℃,15 秒,60℃,1min。
[0077] roc曲线使用medcalc(version 19.1.2)进行roc(receiver operating characteristic curves)曲线的绘制。
[0078]
结果如图2所示,auc=0.750,敏感性为100%,特异性为66.67%,由此可见,该lncrna在区别给药组大鼠和对照组大鼠方面具有一定意义。
[0079]
1.6 特异性验证1.6.1实验试剂和仪器、实验动物(1)阳性药:盐酸异丙肾上腺素(批号:wxbd4216v,购自上海阿拉丁生化科技股份有限公司);(2)溶媒对照品:0.9%氯化钠注射液(批号:21111304b,购自安徽双鹤药业有限责任公司);alt,ast检测试剂盒由日本和光纯药工业株式会社生产;hitachi 7060型全自动生化分析仪购于日本日立产业株式会社。
[0080]
(3)实验动物
雄性sd大鼠10只,雌性大鼠10只,spf级,体重180~320g,6~9周龄,购自北京维通利华实验动物技术有限公司[许可证号:scxk(京)2016-0006]。动物采用芯片和笼牌标识,5只/笼,动物饲养于上海益诺思生物技术股份有限公司的spf级动物房,动物房温度控制在22~26摄氏度,湿度控制在40~70%之间,每分钟通气次数≥15次,12小时/12小时的明暗光照周期,动物自由摄食,经钴60辐照灭菌的spf大鼠维持饲料由北京科澳协力饲料有限公司提供,动物通过饮水瓶自由饮用自制的去离子水。
[0081]
1.6.2实验方法1.6.2.1 阳性药的配制2.5mg/kg (0.25mg/ml) 盐酸异丙肾上腺素溶液,配制体积为60 ml的阳性给药制剂:称取15mg的盐酸异丙肾上腺素;转移至烧杯中并加入适量的0.9%氯化钠注射液。用玻璃棒初步进行搅拌,加入转子,打开磁力搅拌器,充分分散后关机,加入0.9%氯化钠注射液至所需体积(60ml)后将其混匀,以保证上下均一性,室温、避光、放置待用。配制过程需避光,需无菌操作。
[0082]
1.6.2.2 动物试验剂量设置采用随机区组设计的分组,将20只大鼠根据体重随机分配到2组:溶媒对照组(0.9%氯化钠注射液)、给药组(2.5mg/kg盐酸异丙肾上腺素),详见表6。
[0083]
表6 实验剂量设计1.6.2.3给药及观察检查溶媒对照组和盐酸异丙肾上腺素给药组的给药途径均为尾静脉注射,单次给药,给药容量为10 ml/kg。给药体积根据最近一次测得的体重进行计算。
[0084]
在给药后4小时后,采用40mg/ml舒泰+5mg/ml赛拉嗪注射液混合制剂麻醉,腹主动脉采集全血少部分置于分离胶真空采血管中用于血清的分离:3500 rpm,4℃,5 min,吸取血清分装于ep管中,保存于-80℃冰箱,用于肝功能指标的检测。大部分置于edta-k2真空采血管中用于分离血浆:800g,4℃,10min,吸取上层血浆分装于ep管中,保存于-80℃冰箱,用于随后的pcr验证。
[0085]
1.6.2.4 血清生化检测结果本实验主要检测了临床前和临床中肝损伤评价普遍使用的血液学指标alt(丙氨酸氨基转移酶)、ast(天冬氨酸氨基转移酶)的变化。2.5 mg/kg盐酸异丙肾上腺素给药4 h后,给药组大鼠血清中alt、ast与溶媒对照组相比略有升高,但不存在显著性差异。
[0086]
1.6.2.5 pcr验证具体过程同1.4。
[0087]
总结本实验大鼠血浆外泌体的lncrna测序结果显示,外泌体中差异表达的lncrna数量较多,其中lncrna(noncode transcript id: nonratt018001.2)在给药组大鼠血浆外泌体中的表达量是溶媒对照组中的159.7倍,表达差异倍数非常高,说明lncrna(noncode transcript id: nonratt018001.2)可以作为一种肝损伤生物标志物检测外源性化合物引起的肝损伤。
[0088]
使用实时荧光定量pcr进行验证,验证结果显示:lncrna(noncode transcript id: nonratt018001.2)在给药组大鼠血浆外泌体中的表达量是溶媒对照组中的2.72倍(p《0.05)。这证明了使用nonratt018001.2作为生物标志物时,能够及时检测,检测结果可靠,说明使用nonratt018001.2作为生物标志物针对外源性化合物引起的肝损伤的检测具有良好的特异性。
[0089]
使用roc曲线考察lncrna(noncode transcript id: nonratt018001.2)能否较好地区别给药组大鼠及对照组大鼠。曲线下面积auc=0.750,敏感性为100%,特异性为66.67%,显示出该lncrna具有一定的鉴别能力。
[0090]
通过使用盐酸异丙肾上腺素建立大鼠心肌损伤模型,考察lncrna(noncode transcript id: nonratt018001.2)的特异性。pcr验证结果显示,该lncrna未在心肌损伤模型中升高,因此,显示出它具有良好的特异性。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1