一种单胺氧化酶及其应用的制作方法
1.本发明属于生物催化技术领域,具体地说,涉及一种单胺氧化酶在催化潜手性氮杂环化合物去对称氧化反应合成手性亚胺中的应用。
背景技术:
2.手性胺广泛存在于天然生物活性分子中,是重要的手性药物结构单元,也是制药、精细化工等领域中广泛使用的重要合成前体。据估计,目前市场上约40%的手性药物都含有手性胺的结构砌块。例如,帕罗韦德(paxlovid)是美国辉瑞公司开发的一种新冠口服药,它可将轻度或中度covid-19患者的住院或死亡风险降低约89%(science,2021,374(6575):1586-1593)。2021年12月22日,帕罗韦德获得美国fda紧急使用授权,用来治疗新冠患者。帕罗韦德的药物活性组分是奈玛特韦(nirmatrelvir),其化学结构如下所示:
[0003][0004]
除此之外,波普瑞韦(boceprevir)和特拉匹韦(telaprevir)均是美国fda批准的治疗丙型肝炎病毒(hcv)药物,其化学结构式如下所示:
[0005][0006]
由于手性胺砌块在药物分子合成中具有巨大应用价值,其合成技术已成为新药领域的研究热点。目前手性胺的制备主要以化学不对称拆分和合成为主,普遍存在反应条件苛刻、使用有毒有害过渡金属等化学试剂、反应操作过程繁琐和对映选择性不高等问题。相对于化学法,生物催化法具有反应条件温和、选择性高和环境友好等优点,并且利用单胺氧化酶催化氮杂环化合物的去对称氧化反应,已被成功应用于手性胺药物中间体的合成。
[0007]
2009年,曼彻斯特大学的nicholas j.turner等报道了来源于黑曲霉
(aspergillus niger)的单胺氧化酶突变体(mao-n d5)可以去对称氧化多种3,4-取代的内消旋吡咯烷,进一步合成波普瑞韦和特拉匹韦的中间体。但是,在这些例子中,mao-n d5所催化的氮杂环底物浓度均低于25mm(angew.chem.int.ed.2010,49,2182-2184;angew.chem.int.ed.2010,49,5289-5292;chem.commun.2010,46,7918-7920)。2010年,美国专利us 8178333和us 8859784公开了一种来源于米曲霉(aspergillus oryzae)的单胺氧化酶,其活性高于黑曲霉来源的野生型单胺氧化酶,但是稳定性较差。2012年,美国merck和codexis公司以黑曲霉和米曲霉来源的两种单胺氧化酶为母本,利用蛋白质工程获得了一个活性为17.7u/mg的最优突变体maon401,可以将6,6-二甲基-3-氮杂双环[3.1.0]己烷去对称氧化为(1r,5s)-6,6-二甲基-3-氮杂双环[3.1.0]己烷-2-烯,后者可以作为进一步合成波普瑞韦的中间体。但是maon401活力依然很低,并且有严重的底物和产物抑制,导致最终的底物上载量仅为65g/l(j.am.chem.soc.2012,134,6467-6472)。
[0008]
2014年,中国专利cn201410441595.4公开了一种来源于环境的新型单胺氧化酶,其可以不对称氧化6,6-二甲基-3-氮杂双环[3.1.0]己烷或(3ar,6as)-八氢环戊[c]吡咯,分别生成(1r,5s)-6,6-二甲基-3-氮杂双环[3.1.0]己烷-2-烯和(3s,7r)-3-氮杂双环[3,3,0]辛-2-烯,它们分别可以作为进一步合成波普瑞韦和特拉匹韦的中间体,但是底物浓度依然很低,最高浓度仅达到100mm,难以实现工业规模化应用。
[0009]
综上所述,通过酶法催化氮杂环化合物的去对称氧化,合成(1r,5s)-6,6-二甲基-3-氮杂双环[3.1.0]己烷-2-烯(奈玛特韦、波普瑞韦前体),以及(3s,7r)-3-氮杂双环[3,3,0]辛-2-烯(特拉匹韦前体)具有立体选择性高和环境友好等优势,但是依然存在许多不足之处,目前已知的单胺氧化酶存在着催化活性低,底物耐受浓度低以及生产效率不高等问题。因此,还需要开发催化性能更好的酶催化剂来满足工业化应用的需求。
技术实现要素:
[0010]
为了探索生物催化法制备手性胺的工业化可行性,发明人对数百种微生物来源的单胺氧化酶进行了筛选,通过实验比较,筛选出较为理想的单胺氧化酶,它们能够有效催化氮杂环化合物发生去对称氧化反应从而合成手性亚胺,例如催化6,6-二甲基-3-氮杂双环[3.1.0]己烷、八氢环戊[c]吡咯及其结构类似物的去对称氧化,具有反应底物浓度高、产品产率高和光学纯度高等显著优点。具体地,本发明包括如下技术方案。
[0011]
一种单胺氧化酶或其突变体在催化潜手性氮杂环化合物去对称氧化反应中的应用,所述单胺氧化酶氨基酸序列为seq id no.1(来源于青霉属penicillium sp.,本文中简称为psmao)、seq id no.2(来源于酵母菌zymoseptoria sp.,本文中简称为zsmao)或者seq id no.3(来源于链格孢菌alternaria sp.,本文中简称为asmao);所述突变体是与seq id no.1有90%以上同源性、且酶活力相比seq id no.1提高的多肽。
[0012]
例如,上述突变体是选自下组的多肽:
[0013]
(1)将seq id no.1所示氨基酸序列的第13位谷氨酸替换为苏氨酸,第16位丙氨酸替换为苏氨酸,第62位精氨酸替换为赖氨酸;
[0014]
(2)将seq id no.1所示氨基酸序列的第13位谷氨酸替换为苏氨酸,第16位丙氨酸替换为苏氨酸,第62位精氨酸替换为赖氨酸,第316位酪氨酸替换为丝氨酸;
[0015]
(3)将seq id no.1所示氨基酸序列的第13位谷氨酸替换为苏氨酸,第16位丙氨酸
替换为苏氨酸,第62位精氨酸替换为赖氨酸,第316位酪氨酸替换为丝氨酸,第383位天冬酰胺替换为组氨酸;
[0016]
(4)将seq id no.1所示氨基酸序列的第7位苯丙氨酸替换为酪氨酸,第19位异亮氨酸替换为缬氨酸,第34位甘氨酸替换为苏氨酸;
[0017]
(5)将seq id no.1所示氨基酸序列的第7位苯丙氨酸替换为酪氨酸,第19位异亮氨酸替换为缬氨酸,第34位甘氨酸替换为苏氨酸,第320位天冬氨酸替换为丝氨酸;
[0018]
(6)将seq id no.1所示氨基酸序列的第34位甘氨酸替换为苏氨酸,第53位丙氨酸替换为苏氨酸,第62位精氨酸替换为赖氨酸,第111位苏氨酸替换为天冬酰胺,第113位甲硫氨酸替换为亮氨酸,第134位苏氨酸替换为丝氨酸,第148位苏氨酸替换为丝氨酸,第168位丙氨酸替换为脯氨酸,第182位丝氨酸替换为谷氨酸,第208位缬氨酸替换为异亮氨酸,第241位丝氨酸替换为半胱氨酸,第264位丝氨酸替换为甘氨酸,第278位丙氨酸替换为丝氨酸,第284位丝氨酸替换为天冬氨酸,第288位亮氨酸替换为缬氨酸,第311位天冬酰胺替换为丝氨酸,第313位异亮氨酸替换为缬氨酸,第314位丝氨酸替换为组氨酸,第316位酪氨酸替换为丝氨酸,第320位天冬氨酸替换为丝氨酸,第321位苏氨酸替换为脯氨酸,第329位谷氨酰胺替换为异亮氨酸,第342位异亮氨酸替换为缬氨酸,第361位甲硫氨酸替换为丙氨酸,第382位苯丙氨酸替换为丙氨酸,第383位天冬酰胺替换为组氨酸,第387位组氨酸替换为谷氨酰胺,第422位酪氨酸替换为苯丙氨酸,第462位丝氨酸替换为甘氨酸;
[0019]
(7)将seq id no.1所示氨基酸序列的第53位丙氨酸替换为苏氨酸;
[0020]
(8)将seq id no.1所示氨基酸序列的第53位丙氨酸替换为苏氨酸,第382位苯丙氨酸替换为丙氨酸;
[0021]
(9)将seq id no.1所示氨基酸序列的第16位丙氨酸替换为苏氨酸,第34位甘氨酸替换为苏氨酸;第62位精氨酸替换为赖氨酸;
[0022]
(10)将seq id no.1所示氨基酸序列的第16位丙氨酸替换为苏氨酸,第34位甘氨酸替换为苏氨酸;第62位精氨酸替换为赖氨酸,第342位异亮氨酸替换为缬氨酸,第462位丝氨酸替换为甘氨酸;
[0023]
(11)将seq id no.1所示氨基酸序列的第53位丙氨酸替换为苏氨酸,第111位苏氨酸替换为天冬酰胺,第134位苏氨酸替换为丝氨酸,第168位丙氨酸替换为脯氨酸;
[0024]
(12)将seq id no.1所示氨基酸序列的第53位丙氨酸替换为苏氨酸,第111位苏氨酸替换为天冬酰胺,第134位苏氨酸替换为丝氨酸,第168位丙氨酸替换为脯氨酸,第361位甲硫氨酸替换为丙氨酸;
[0025]
(13)将seq id no.1所示氨基酸序列的第53位丙氨酸替换为苏氨酸,第111位苏氨酸替换为天冬酰胺,第134位苏氨酸替换为丝氨酸,第168位丙氨酸替换为脯氨酸,第313位异亮氨酸替换为缬氨酸;
[0026]
(14)将seq id no.1所示氨基酸序列的第113位甲硫氨酸替换为亮氨酸,第134位苏氨酸替换为丝氨酸,第148位苏氨酸替换为丝氨酸,第314位丝氨酸替换为组氨酸,第329位谷氨酰胺替换为异亮氨酸,第387位组氨酸替换为谷氨酰胺;
[0027]
(15)将seq id no.1所示氨基酸序列的第113位甲硫氨酸替换为亮氨酸,第134位苏氨酸替换为丝氨酸,第148位苏氨酸替换为丝氨酸,第329位谷氨酰胺替换为异亮氨酸,第387位组氨酸替换为谷氨酰胺;
[0028]
(16)将seq id no.1所示氨基酸序列的第182位丝氨酸替换为谷氨酸,第208位缬氨酸替换为异亮氨酸,第241位丝氨酸替换为半胱氨酸,第321位苏氨酸替换为脯氨酸;
[0029]
(17)将seq id no.1所示氨基酸序列的第208位缬氨酸替换为异亮氨酸,第241位丝氨酸替换为半胱氨酸,第264位丝氨酸替换为甘氨酸;
[0030]
(18)将seq id no.1所示氨基酸序列的第7位苯丙氨酸替换为酪氨酸,第13位谷氨酸替换为苏氨酸,第16位丙氨酸替换为苏氨酸,第19位异亮氨酸替换为缬氨酸,第34位甘氨酸替换为苏氨酸,第53位丙氨酸替换为苏氨酸,第62位精氨酸替换为赖氨酸,第111位苏氨酸替换为天冬酰胺,第113位甲硫氨酸替换为亮氨酸,第134位苏氨酸替换为丝氨酸,第148位苏氨酸替换为丝氨酸,第168位丙氨酸替换为脯氨酸,第182位丝氨酸替换为谷氨酸,第208位缬氨酸替换为异亮氨酸,第241位丝氨酸替换为半胱氨酸,第264位丝氨酸替换为甘氨酸,第278位丙氨酸替换为丝氨酸,第284位丝氨酸替换为天冬氨酸,第288位亮氨酸替换为缬氨酸,第311位天冬酰胺替换为丝氨酸,第313位异亮氨酸替换为缬氨酸,第314位丝氨酸替换为组氨酸,第316位酪氨酸替换为丝氨酸,第320位天冬氨酸替换为丝氨酸,第321位苏氨酸替换为脯氨酸,第329位谷氨酰胺替换为异亮氨酸,第342位异亮氨酸替换为缬氨酸,第361位甲硫氨酸替换为丙氨酸,第382位苯丙氨酸替换为丙氨酸,第383位天冬酰胺替换为组氨酸,第387位组氨酸替换为谷氨酰胺,第422位酪氨酸替换为苯丙氨酸,第462位丝氨酸替换为甘氨酸,本文中简称为psmao
m18
;
[0031]
(19)将seq id no.1所示氨基酸序列的第208位缬氨酸替换为异亮氨酸,第241位丝氨酸替换为半胱氨酸,第264位丝氨酸替换为甘氨酸,第387位组氨酸替换为谷氨酰胺,第422位酪氨酸替换为苯丙氨酸;
[0032]
(20)将seq id no.1所示氨基酸序列的第264位丝氨酸替换为甘氨酸,第278位丙氨酸替换为丝氨酸;
[0033]
(21)将seq id no.1所示氨基酸序列的第264位丝氨酸替换为甘氨酸,第278位丙氨酸替换为丝氨酸,第288位亮氨酸替换为缬氨酸、第311位天冬酰胺替换为丝氨酸,第320位天冬氨酸替换为丝氨酸;
[0034]
(22)将seq id no.1所示氨基酸序列的第62位精氨酸替换为赖氨酸,第111位苏氨酸替换为天冬酰胺,第113位甲硫氨酸替换为亮氨酸,第134位苏氨酸替换为丝氨酸,第148位苏氨酸替换为丝氨酸,第168位丙氨酸替换为脯氨酸,第182位丝氨酸替换为谷氨酸,第208位缬氨酸替换为异亮氨酸,第241位丝氨酸替换为半胱氨酸,第264位丝氨酸替换为甘氨酸,第278位丙氨酸替换为丝氨酸,第284位丝氨酸替换为天冬氨酸,第288位亮氨酸替换为缬氨酸,第311位天冬酰胺替换为丝氨酸,第361位甲硫氨酸替换为丙氨酸,第382位苯丙氨酸替换为丙氨酸,第383位天冬酰胺替换为组氨酸,第387位组氨酸替换为谷氨酰胺,第422位酪氨酸替换为苯丙氨酸;
[0035]
(23)将seq id no.1所示氨基酸序列的第264位丝氨酸替换为甘氨酸,第288位亮氨酸替换为缬氨酸,第311位天冬酰胺替换为丝氨酸,第320位天冬氨酸替换为丝氨酸。
[0036]
在一种实施方式中,上述潜手性氮杂环化合物是选自如下所述的化合物:
[0037][0038]
式i中,a为-h或-cr1r2,其中r1和r2各自独立地选自-h、-cooh、-ch3、-cx3、-ch2ch3,其中x选自f、cl和br;
[0039]
式ii和iii中,b为-cr3r4,其中r3和r4各自独立地选自-h、-nh2、-ch3、-cx3、-ch2ch3,其中x选自f、cl和br;
[0040]
式iii中,m为亚甲基-ch2,其中n选自1、2、3的整数。
[0041]
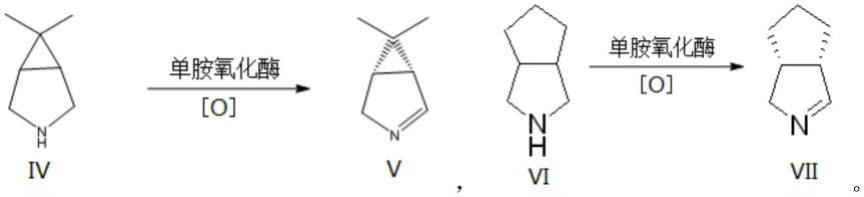
例如,上述氮杂环化合物是式iv所示化合物6,6-二甲基-3-氮杂双环[3.1.0]己烷、或者式vi所示化合物八氢环戊[c]吡咯,相应的反应产物手性亚胺是式v所示(1r,5s)-6,6-二甲基-3-氮杂双环[3.1.0]己烷-2-烯、或者式vii所示(3s,7r)-3-氮杂双环[3,3,0]辛-2-烯:
[0042][0043]
上述氮杂环化合物的去对称氧化反应在氧化环境中进行。
[0044]
在一种实施方式中,上述氧化环境是指反应体系中存在过氧化氢酶,并且通氧气或者加入过氧化氢(双氧水)。
[0045]
上述反应体系中,所述单胺氧化酶或者所述突变体既可以呈酶形式,也可以呈其表达微生物菌体静息细胞形式。
[0046]
所述酶形式为游离酶或者固定化酶。所述微生物选自枯草芽孢杆菌、短乳杆菌、大肠杆菌、木兰假丝酵母、毕赤酵母、酿酒酵母,优选所述微生物是大肠杆菌,更优选是大肠杆菌bl21(de3)。
[0047]
例如,所述反应条件可以为:潜手性氮杂环化合物浓度为10~120g/l,重组单胺氧化酶的浓度为10~100u/ml,过氧化氢酶的用量为0.1~2g/l,反应液水相ph为5.0~9.0,反应温度为10~30℃,反应过程中通入持续氧气或空气;所述的去对称氧化反应的时间以反应转化率停止增长的时间为准。
[0048]
去对称氧化反应体系可以是缓冲液体系,所用的缓冲溶液可以是本领域常规的任何缓冲液,比如磷酸钠、磷酸钾、tris-hcl或者甘氨酸-naoh缓冲液,其ph范围在5.0~9.0、优选ph 7.0~8.0,例如是ph 7.4的磷酸钾缓冲液。缓冲液的浓度可以为0.05~0.2mol/l。
[0049]
去对称氧化反应的温度为10~50℃,优选15~45℃,优选20~40℃,例如25~35℃。
[0050]
本发明第二方面提供了一种单胺氧化酶突变体,即上述的多肽psmao
m18
,其氨基酸序列是seq id no.4,其为seq id no.1所示氨基酸序列的第7位苯丙氨酸替换为酪氨酸、第
13位谷氨酸替换为苏氨酸、第16位丙氨酸替换为苏氨酸、第19位异亮氨酸替换为缬氨酸、第34位甘氨酸替换为苏氨酸、第53位丙氨酸替换为苏氨酸、第62位精氨酸替换为赖氨酸、第111位苏氨酸替换为天冬酰胺、第113位甲硫氨酸替换为亮氨酸、第134位苏氨酸替换为丝氨酸、第148位苏氨酸替换为丝氨酸、第168位丙氨酸替换为脯氨酸、第182位丝氨酸替换为谷氨酸、第208位缬氨酸替换为异亮氨酸、第241位丝氨酸替换为半胱氨酸、第264位丝氨酸替换为甘氨酸、第278位丙氨酸替换为丝氨酸、第284位丝氨酸替换为天冬氨酸、第288位亮氨酸替换为缬氨酸、第311位天冬酰胺替换为丝氨酸、第313位异亮氨酸替换为缬氨酸、第314位丝氨酸替换为组氨酸、第316位酪氨酸替换为丝氨酸、第320位天冬氨酸替换为丝氨酸、第321位苏氨酸替换为脯氨酸、第329位谷氨酰胺替换为异亮氨酸、第342位异亮氨酸替换为缬氨酸、第361位甲硫氨酸替换为丙氨酸、第382位苯丙氨酸替换为丙氨酸、第383位天冬酰胺替换为组氨酸、第387位组氨酸替换为谷氨酰胺、第422位酪氨酸替换为苯丙氨酸、第462位丝氨酸替换为甘氨酸的多肽。
[0051]
本发明第三方面提供了编码上述单胺氧化酶突变体seq id no.4的基因。
[0052]
优选地,上述基因的核苷酸序列可以为seq id no.5。
[0053]
相应地,本发明还提供了包含上述单胺氧化酶突变体seq id no.4编码基因seq id no.5的重组表达载体。该重组表达载体可以是任何适于表达上述基因的质粒,优选载体是pet系列,比如载体是pet22b、pet24a、pet28a等质粒,但并不受限于此。
[0054]
本发明的另一方面还提供了一种用于表达上述单胺氧化酶突变体seq id no.4的微生物。例如,该微生物是转化了上述质粒的转化子。优选微生物能满足重组表达载体可稳定地自行复制,并且其所编码的单胺氧化酶基因能被有效表达。
[0055]
上述微生物可以选自枯草芽孢杆菌、短乳杆菌、大肠杆菌、木兰假丝酵母、毕赤酵母、酿酒酵母,优选所述微生物是大肠杆菌,更优选是大肠杆菌bl21(de3)。
[0056]
显然,上述单胺氧化酶突变体seq id no.4或者其表达微生物可以用于催化潜手性氮杂环化合物进行去对称氧化反应从而合成手性亚胺。
[0057]
相比现有技术的单胺氧化酶,本发明筛选的单胺氧化酶psmao、zsmao、asmao以及psmao突变体例如psmao
m18
在催化潜手性氮杂环化合物进行氧化反应时表现出很高的立体选择性和热稳定性,且反应底物浓度高、产品光学纯度高,具有开发应用前景。
具体实施方式
[0058]
本发明从众多微生物来源的野生型单胺氧化酶中,筛选出了三种对于潜手性氮杂环化合物氧化的立体选择性高、底物和产物(手性亚胺)抑制性小的野生酶psmao、zsmao和asmao。
[0059]
为了进一步提高酶活力,以它们为基础,通过易错pcr技术进行随机突变,筛选出一些突变体,包括酶活力显著提高、并且热稳定性高的突变体psmao
m18
。在突变中,发现了psmao即seq id no.2上一些具有挖掘潜力的氨基酸位点,包括:第7位苯丙氨酸、第13位谷氨酸、第16位丙氨酸、第19位异亮氨酸、第34位甘氨酸、第53位丙氨酸、第62位精氨酸、第111位苏氨酸、第113位甲硫氨酸、第134位苏氨酸、第148位苏氨酸、第168位丙氨酸、第182位丝氨酸、第208位缬氨酸、第241位丝氨酸、第264位丝氨酸、第278位丙氨酸、第284位丝氨酸、第288位亮氨酸、第311位天冬酰胺、第313位异亮氨酸、第314位丝氨酸、第316位酪氨酸、第320
位天冬氨酸、第321位苏氨酸、第329位谷氨酰胺、第342位异亮氨酸、第361位甲硫氨酸、第382位苯丙氨酸、第383位天冬酰胺、第387位组氨酸、第422位酪氨酸或第462位丝氨酸等。这些位点有待于进一步研究开发,例如通过理性分析及半理性设计,对野生酶或出发酶进行突变,用于增加酶活性和/稳定性,同时保持出发酶的较高立体选择性。
[0060]
上述所用术语“(酶活力)提高”或“增加”表示相较于参考水平提高至少10%,例如相较于参考水平提高至少约20%、或至少约30%、或至少约40%、或至少约50%、或至少约60%、或至少约70%、或至少约80%、或至少约90%、或最高达并包括100%的提高,或者在10%-100%之间的任意提高,或相较于参考水平的至少约2倍、或至少约3倍、或至少约4倍、或至少约5倍、或至少约10倍的提高,或2倍-10倍之间或更多的任意提高。
[0061]
在本文中,术语“野生(型)”、“野生酶”表示相同的意义,都是指氨基酸序列分别为seq id no.1、seq id no.2、seq id no.3的单胺氧化酶psmao、zsmao、asmao。相应地,野生酶的突变体可以称为“突变酶”。为了表述方便起见,在本文中可以将野生型单胺氧化酶与其突变体比如psmao
m18
等统称为“单胺氧化酶”。
[0062]
为描述方便起见,本文中有时将术语“式x所示(化合物)”表述为“式x”、“底(产)物x”或“化合物x”,这是本领域技术人员能够理解的。比如,式iv所示化合物和底物iv都是指代相同的化合物6,6-二甲基-3-氮杂双环[3.1.0]己烷。
[0063]
容易理解,本文中使用的术语“潜手性”也可称为“前手性”,“去对称”也可称为“不对称”。
[0064]
单胺氧化酶及其突变体可以通过基因工程菌发酵方法得到,基于seq id nos.1-3或其突变体的氨基酸序列,本领域技术人员很容易获得其编码基因、包含这些基因的表达盒和质粒、以及包含该质粒的转化体。
[0065]
本领域技术人员通过所熟知的基因工程构建方式可以容易地获得这些基因、表达盒、质粒、转化体。
[0066]
为了在微生物宿主例如基因工程中最常用的大肠杆菌中最佳地表达单胺氧化酶例如seq id no.4等,本发明对其表达基因进行了密码子优化。
[0067]
密码子优化是可用于通过增加感兴趣基因的翻译效率使生物体中蛋白质表达最大化的一种技术。不同的生物体由于突变倾向和天然选择而通常示出对于编码相同氨基酸的一些密码子之一的特殊偏好性。例如,在生长快速的微生物如大肠杆菌中,优化密码子反映出其各自的基因组trna库的组成。因此,在生长快速的微生物中,氨基酸的低频率密码子可以用用于相同氨基酸的但高频率的密码子置换。因此,优化的dna序列的表达在快速生长的微生物中得以改良。例如,经过密码子优化,单胺氧化酶seq id no.4的编码基因可以是seq id no.5。
[0068]
在催化潜手性氮杂环化合物进行氧化的反应体系中,单胺氧化酶既可以呈现酶的形式,也可以呈现菌体的形式。所述酶的形式包括游离酶、固定化酶,包括纯化酶、粗酶、发酵液、载体固定的酶等;所述菌体的形式包括存活菌体和死亡菌体。
[0069]
生物催化领域公知,与游离酶法相比,应用固定化酶技术具有生产过程简化、生产效率提高等优点。同时,由于酶可多次使用,且酶的稳定性提高,从而有效提高了单位酶的生产力;其次,固定化酶极易与底物、产物分开,简化了提纯工艺,产率较高,产品质量较好。
[0070]
本发明具有如下有益效果:筛选出的单胺氧化酶psmao、zsmao、asmao及其突变体
可高效催化6,6-二甲基-3-氮杂双环[3.1.0]己烷、八氢环戊[c]吡咯及其结构类似物发生去对称氧化,制备光学纯的(1r,5s)-6,6-二甲基-3-氮杂双环[3.1.0]己烷-2-烯、(3s,7r)-3-氮杂双环[3,3,0]辛-2-烯及其结构类似物,理论产率可达100%。在氮杂环类化合物底物浓度高达120g/l时,实现99%以上的转化率,产物的光学纯度大于99%。相对于其他的氮杂环底物不对称氧化方法,本发明的酶促去对称化反应不仅具有酶催化活性高,底物上载量大,产物收率高、光学纯度好等优势,开发前景广阔。
[0071]
下面将结合具体实施例,对本发明中的技术方案和技术效果进行清楚、完整的描述,但是本发明的保护范围并不限于这些实施例,凡是不背离本发明构思的改变或等同替代均包括在本发明的保护范围之内。
[0072]
实施例
[0073]
实施例中涉及到多种物质的添加量、含量及浓度,其中所述的百分含量,除特别说明外,皆指质量百分含量。
[0074]
材料和方法
[0075]
实施例中的全基因合成、引物合成及测序皆由南京金斯瑞生物科技有限公司完成。
[0076]
实施例中的分子生物学实验包括质粒构建、酶切、感受态细胞制备、转化等主要参照《分子克隆实验指南》(第三版),j.萨姆布鲁克,d.w.拉塞尔(美)编著,黄培堂等译,科学出版社,北京,2002)进行。必要时可以通过简单试验确定具体实验条件。
[0077]
pcr扩增实验根据质粒或dna模板供应商提供的反应条件或试剂盒说明书进行。必要时可以通过简单试验予以调整。
[0078]
质粒载体pet28a购自novagen公司。
[0079]
大肠杆菌e.coli dh5α和e.coli bl21(de3)感受态细胞、2
×
taq pcr mastermix、琼脂糖凝胶dna回收试剂盒均购自北京天根生化科技有限公司。
[0080]
限制性内切酶ecor i、xho i、和t4 dna连接酶均为new england biolabs(neb)公司的市售产品。
[0081]
lb培养基:10g/l胰蛋白胨、5g/l酵母提取物、10g/l氯化钠,ph7.2,121℃高温高压灭菌20min;
[0082]
单胺氧化酶的活力测定方法:在含有10mm底物(6,6-二甲基-3-氮杂双环[3.1.0]己烷)、1.5mmol/l4-氨基安替比林(4-aminoantipyrine)、50μl2%(利用dmso溶解)的2,4,6-三溴-3-羟基苯甲酸(3-hydroxy-2,4,6-tribromobenzoic acid)、4u/ml辣根过氧化物酶(hrp)的200μl反应体系(100mmol/l磷酸钾缓冲液,ph 7.4)中,加入适量的单胺氧化酶,30℃保温反应,在分光光度计上检测510nm处吸光度变化,记录5分钟内吸光度的变化值。1个酶活力单位(u)定义为上述条件下每分钟催化1μmol底物氧化所需的酶量。
[0083]
氮杂环化合物去对称氧化反应转化率采用气相色谱(gc-fid)法进行分析,分析条件:sh-rxi-5 sil ms(5%diphenyl/95%dimethyl pol)30meter,0.25mm id,0.25μm df,以氮气为载气,50℃保留2min,10℃升/温至100min,℃20℃升/温至150min℃。
[0084]
反应产物的光学纯度ee值采用液相色谱法进行分析:使用的色谱柱为ad-h柱(250mm
×
4.6mm,5μm,日本大赛璐公司),流动相为90%正庚烷,10%乙醇,0.1%三氟乙酸,检测柱温25,℃流动相流速为1ml/min,检测波长为220nm。
[0085]
实施例1:单胺氧化酶的基因克隆
[0086]
通过生物信息学分析方法预测可能对6,6-二甲基-3-氮杂双环[3.1.0]己烷具有明显活性的单胺氧化酶,并将其分选出来进行克隆表达,验证其功能。采用这种方法,分别从青霉菌(penicillium sp.)、酵母(zymoseptoria sp.)和链格孢菌(alternaria sp.)克隆得到三种新的单胺氧化酶基因。
[0087]
作为示例,以青霉菌的基因组dna为模板,采用本领域常规技术方法(如聚合酶链式反应pcr),获得编码所述单胺氧化酶seq id no.1的完整核酸分子。其中涉及的合成引物为:
[0088]
上游引物:ccggaattcatgacctctcgcgacggt,
[0089]
下游引物:ccgctcgagtagccgaagccgtgg。
[0090]
其中上游引物下划线所示序列为ecor i的酶切位点,下游引物下划线所示序列为xho i的酶切位点。
[0091]
以青霉属(penicillium sp.)的基因组dna为模板,利用聚合酶链式反应pcr进行基因扩增。pcr体系(50μl):2
×
taq pcr mastermix 25μl,基因组dna(100ng/μl)1μl,上下游引物(10μm)各2.5μl,加灭菌蒸馏水补足至50μl。pcr反应程序:(1)95℃预变性5min;(2)94℃变性30s;(3)55℃退火30s;(4)72℃延伸2min;步骤(2)~(4)共进行30个循环;最后72℃延伸10min,4℃保存产物。pcr产物经琼脂糖凝胶电泳分析验证后切胶纯化,并用dna回收试剂盒回收目的片段。
[0092]
经测序,单胺氧化酶seq id no.1编码基因的核苷酸序列为seq id no.6。
[0093]
利用同样的方法即可分别克隆出酵母菌(zymoseptoria sp.)和链格孢菌(alternaria sp.)中的单胺氧化酶zsmao(seq id no.2)和asmao(seq id no.3)的基因。
[0094]
实施例2:单胺氧化酶重组表达载体和重组表达转化体的制备
[0095]
将实施例1中pcr扩增获得的单胺氧化酶基因与空载质粒pet28a分别用限制性内切酶ecor i和xho i在37℃双酶切12h。双酶切产物经琼脂糖凝胶电泳分析验证后切胶纯化回收,用t4 dna连接酶将得到的线性化pet28a质粒与纯化后的目的基因片段置于16℃连接过夜,将连接产物转化到大肠杆菌e.coli bl21(de3)感受态细胞(novagen)中,并均匀涂布于含有50μg/ml卡那霉素的lb琼脂平板上,置于37℃培养箱中静置培养约12h,对长出来的菌落进行菌落pcr验证,挑取菌落pcr为阳性的克隆进行测序验证。经测序验证正确后,提取相应的质粒,即得到单胺氧化酶的重组表达载体pet28a-psmao。
[0096]
利用同样的方法即可分别获得酵母菌和链格孢菌中单胺氧化酶的重组表达载体pet28a-zsmao、pet28a-asmao。
[0097]
将所得到的重组表达载体进一步转化至e.coli bl21(de3)感受态细胞中,挑取阳性克隆,获得单胺氧化酶的重组表达转化体e.coli bl21(de3)/pet28a-psmao。
[0098]
利用同样的方法即可分别获得酵母菌和链格孢来源的单胺氧化酶zsmao和asmao的重组表达转化体e.coli bl21(de3)/pet28a-zsmao、e.coli bl21(de3)/pet28a-asmao。
[0099]
实施例3:单胺氧化酶突变体的构建及高通量平板筛选
[0100]
单胺氧化酶psmao为母本,采用易错pcr技术构建单胺氧化酶的随机突变体库:以pet28a-psmao为模板,以实施例1中的上游引物和下游引物为引物对,用rtaq dna聚合酶进行易错pcr,构建随机突变库。pcr体系(50μl):rtaq dna聚合酶0.5μl,10
×
pcr buffer(mg
2+
plus)5.0μl,dntp mixture(各2.0mm)4.0μl,终浓度为100μmol/l的mncl2,pet28a-psmao质粒0.5ng,上下游引物(10μm)各2μl,加灭菌蒸馏水补足至50μl。pcr反应程序:(1)95℃预变性5min;(2)94℃变性30s;(3)55℃退火30s;(4)72℃延伸2min;步骤(2)~(4)共进行30个循环;最后72℃延伸10min,4℃保存产物。pcr产物经琼脂糖凝胶电泳分析验证后切胶纯化回收,对回收后的目的基因与空载质粒pet28a分别用限制性内切酶ecor i和xho i在37℃双酶切12h。双酶切产物经琼脂糖凝胶电泳分析验证后切胶纯化回收,用t4 dna连接酶将得到的线性化pet28a质粒与纯化后的目的基因片段置于16℃连接过夜。将连接产物转化到大肠杆菌e.coli bl21(de3)感受态细胞中,并均匀涂布在覆盖有硝酸纤维素膜的含有50μg/ml卡那霉素的lb琼脂平板上,置于37℃培养箱中静置培养约12h。将上述平板上的硝酸纤维素膜揭下,转移到新鲜的含有50μg/ml卡那霉素、0.2mm iptg的lb琼脂平板上,16℃培养箱中静置培养约12h。将硝酸纤维素膜转移到灭菌的培养皿中,置于-20℃保存。
[0101]
将上述贮存于-20℃培养皿取出解冻,向培养皿中倒入适量显色液,所述显色液的组成为:100mm磷酸钾缓冲液(ph 7.4)含0.5mg/ml 3,3'-二氨基联苯胺(dab)、10mm底物(6,6-二甲基-3-氮杂双环[3.1.0]己烷)、4u/ml辣根过氧化物酶(hrp)、1%琼脂糖。待显色液凝固后,将平板放入37℃培养箱培养1-2h,挑出明显暗粉色的菌落进行孵育培养,对阳性突变体进行纯化表征,对相应的基因进行测序。
[0102]
通过筛选,得到了活性显著提高的突变体库。进而对这些突变体的热稳定性进行了表征,优选热稳定性增高的系列突变体,这些突变体的序列以及这些突变体的酶活性和热稳定性列于表1中。在表1中,序列标号分别对应于表1后面的一系列序列。在酶活性列中,与母本psmao相比,一个加号“+”表示突变体蛋白的活性提高了1-100倍;两个加号“++”表示突变体蛋白的活性提高了101-200倍;三个加号“+++”表示突变体蛋白的活性提高了201-250倍。在热稳定性列中,一个加号“+”对应于50℃保温30min后,突变体蛋白的残余活性保留5.0-20.0%;两个加号“++”对应于50℃保温30min后,突变体蛋白的残余活性保留20.1-50.0%;三个加号“+++”对应于50℃保温30min后,突变体蛋白的残余活性保留50.1-80.0%。
[0103]
表1:单胺氧化酶psmao突变体序列和相应的酶活性/热稳定性改进列表
[0104][0105][0106]
对应序列标号的单胺氧化酶突变体相对于seq id no.1的氨基酸突变分别如下:
[0107]
(1)第13位谷氨酸替换为苏氨酸,第16位丙氨酸替换为苏氨酸,第62位精氨酸替换为赖氨酸;
[0108]
(2)第13位谷氨酸替换为苏氨酸,第16位丙氨酸替换为苏氨酸,第62位精氨酸替换为赖氨酸,第316位酪氨酸替换为丝氨酸;
[0109]
(3)第13位谷氨酸替换为苏氨酸,第16位丙氨酸替换为苏氨酸,第62位精氨酸替换为赖氨酸,第316位酪氨酸替换为丝氨酸,第383位天冬酰胺替换为组氨酸;
[0110]
(4)第7位苯丙氨酸替换为酪氨酸,第19位异亮氨酸替换为缬氨酸,第34位甘氨酸替换为苏氨酸;
[0111]
(5)第7位苯丙氨酸替换为酪氨酸,第19位异亮氨酸替换为缬氨酸,第34位甘氨酸替换为苏氨酸,第320位天冬氨酸替换为丝氨酸;
[0112]
(6)第34位甘氨酸替换为苏氨酸,第53位丙氨酸替换为苏氨酸,第62位精氨酸替换为赖氨酸,第111位苏氨酸替换为天冬酰胺,第113位甲硫氨酸替换为亮氨酸,第134位苏氨酸替换为丝氨酸,第148位苏氨酸替换为丝氨酸,第168位丙氨酸替换为脯氨酸,第182位丝氨酸替换为谷氨酸,第208位缬氨酸替换为异亮氨酸,第241位丝氨酸替换为半胱氨酸,第264位丝氨酸替换为甘氨酸,第278位丙氨酸替换为丝氨酸,第284位丝氨酸替换为天冬氨酸,第288位亮氨酸替换为缬氨酸,第311位天冬酰胺替换为丝氨酸,第313位异亮氨酸替换为缬氨酸,第314位丝氨酸替换为组氨酸,第316位酪氨酸替换为丝氨酸,第320位天冬氨酸替换为丝氨酸,第321位苏氨酸替换为脯氨酸,第329位谷氨酰胺替换为异亮氨酸,第342位异亮氨酸替换为缬氨酸,第361位甲硫氨酸替换为丙氨酸,第382位苯丙氨酸替换为丙氨酸,第383位天冬酰胺替换为组氨酸,第387位组氨酸替换为谷氨酰胺,第422位酪氨酸替换为苯丙氨酸,第462位丝氨酸替换为甘氨酸;
[0113]
(7)第53位丙氨酸替换为苏氨酸;
[0114]
(8)第53位丙氨酸替换为苏氨酸,第382位苯丙氨酸替换为丙氨酸;
[0115]
(9)第16位丙氨酸替换为苏氨酸,第34位甘氨酸替换为苏氨酸;第62位精氨酸替换为赖氨酸;
[0116]
(10)第16位丙氨酸替换为苏氨酸,第34位甘氨酸替换为苏氨酸;第62位精氨酸替换为赖氨酸,第342位异亮氨酸替换为缬氨酸,第462位丝氨酸替换为甘氨酸;
[0117]
(11)第53位丙氨酸替换为苏氨酸,第111位苏氨酸替换为天冬酰胺,第134位苏氨酸替换为丝氨酸,第168位丙氨酸替换为脯氨酸;
[0118]
(12)第53位丙氨酸替换为苏氨酸,第111位苏氨酸替换为天冬酰胺,第134位苏氨酸替换为丝氨酸,第168位丙氨酸替换为脯氨酸,第361位甲硫氨酸替换为丙氨酸;
[0119]
(13)第53位丙氨酸替换为苏氨酸,第111位苏氨酸替换为天冬酰胺,第134位苏氨酸替换为丝氨酸,第168位丙氨酸替换为脯氨酸,第313位异亮氨酸替换为缬氨酸;
[0120]
(14)第113位甲硫氨酸替换为亮氨酸,第134位苏氨酸替换为丝氨酸,第148位苏氨酸替换为丝氨酸,第314位丝氨酸替换为组氨酸,第329位谷氨酰胺替换为异亮氨酸,第387位组氨酸替换为谷氨酰胺;
[0121]
(15)第113位甲硫氨酸替换为亮氨酸,第134位苏氨酸替换为丝氨酸,第148位苏氨酸替换为丝氨酸,第329位谷氨酰胺替换为异亮氨酸,第387位组氨酸替换为谷氨酰胺;
[0122]
(16)第182位丝氨酸替换为谷氨酸,第208位缬氨酸替换为异亮氨酸,第241位丝氨酸替换为半胱氨酸,第321位苏氨酸替换为脯氨酸;
[0123]
(17)第208位缬氨酸替换为异亮氨酸,第241位丝氨酸替换为半胱氨酸,第264位丝氨酸替换为甘氨酸;
[0124]
(18)第7位苯丙氨酸替换为酪氨酸,第13位谷氨酸替换为苏氨酸,第16位丙氨酸替换为苏氨酸,第19位异亮氨酸替换为缬氨酸,第34位甘氨酸替换为苏氨酸,第53位丙氨酸替换为苏氨酸,第62位精氨酸替换为赖氨酸,第111位苏氨酸替换为天冬酰胺,第113位甲硫氨酸替换为亮氨酸,第134位苏氨酸替换为丝氨酸,第148位苏氨酸替换为丝氨酸,第168位丙氨酸替换为脯氨酸,第182位丝氨酸替换为谷氨酸,第208位缬氨酸替换为异亮氨酸,第241位丝氨酸替换为半胱氨酸,第264位丝氨酸替换为甘氨酸,第278位丙氨酸替换为丝氨酸,第284位丝氨酸替换为天冬氨酸,第288位亮氨酸替换为缬氨酸,第311位天冬酰胺替换为丝氨
酸,第313位异亮氨酸替换为缬氨酸,第314位丝氨酸替换为组氨酸,第316位酪氨酸替换为丝氨酸,第320位天冬氨酸替换为丝氨酸,第321位苏氨酸替换为脯氨酸,第329位谷氨酰胺替换为异亮氨酸,第342位异亮氨酸替换为缬氨酸,第361位甲硫氨酸替换为丙氨酸,第382位苯丙氨酸替换为丙氨酸,第383位天冬酰胺替换为组氨酸,第387位组氨酸替换为谷氨酰胺,第422位酪氨酸替换为苯丙氨酸,第462位丝氨酸替换为甘氨酸;
[0125]
(19)第208位缬氨酸替换为异亮氨酸,第241位丝氨酸替换为半胱氨酸,第264位丝氨酸替换为甘氨酸,第387位组氨酸替换为谷氨酰胺,第422位酪氨酸替换为苯丙氨酸;
[0126]
(20)第264位丝氨酸替换为甘氨酸,第278位丙氨酸替换为丝氨酸;
[0127]
(21)第264位丝氨酸替换为甘氨酸,第278位丙氨酸替换为丝氨酸,第288位亮氨酸替换为缬氨酸、第311位天冬酰胺替换为丝氨酸,第320位天冬氨酸替换为丝氨酸;
[0128]
(22)第62位精氨酸替换为赖氨酸,第111位苏氨酸替换为天冬酰胺,第113位甲硫氨酸替换为亮氨酸,第134位苏氨酸替换为丝氨酸,第148位苏氨酸替换为丝氨酸,第168位丙氨酸替换为脯氨酸,第182位丝氨酸替换为谷氨酸,第208位缬氨酸替换为异亮氨酸,第241位丝氨酸替换为半胱氨酸,第264位丝氨酸替换为甘氨酸,第278位丙氨酸替换为丝氨酸,第284位丝氨酸替换为天冬氨酸,第288位亮氨酸替换为缬氨酸,第311位天冬酰胺替换为丝氨酸,第361位甲硫氨酸替换为丙氨酸,第382位苯丙氨酸替换为丙氨酸,第383位天冬酰胺替换为组氨酸,第387位组氨酸替换为谷氨酰胺,第422位酪氨酸替换为苯丙氨酸;
[0129]
(23)第264位丝氨酸替换为甘氨酸,第288位亮氨酸替换为缬氨酸,第311位天冬酰胺替换为丝氨酸,第320位天冬氨酸替换为丝氨酸。
[0130]
其中,第(18)号突变体的酶活性和热稳定性都比较突出,简称为psmao
m18
,氨基酸序列为seq id no.4,其编码基因为seq id no.5。
[0131]
实施例4:单胺氧化酶的诱导表达及活力测定
[0132]
将实施例2和3中获得的重组表达转化体分别接种至含50μg/ml卡那霉素的lb培养基中,37℃摇床振荡培养12h,之后按1%(v/v)的接种量接入装有100ml lb培养基(含50μg/ml卡那霉素)的500ml三角烧瓶中,置于37℃、180rpm摇床振荡培养,当培养液的od
600
达到0.6时,加入终浓度为0.2mmol/l的iptg作为诱导剂,16℃诱导24h。将培养液以8000
×
g离心10min,收集细胞,并用生理盐水洗涤两次,得到静息细胞。将100ml培养液中获得的细胞悬浮于10ml的磷酸钾缓冲液(100mm,ph 7.4)中,冰水浴中进行如下超声破碎:400w功率,工作4s,间歇6s,进行99个循环,4℃下12000
×
g离心40分钟,收集上清粗酶液,进行酶活力测定。经测定,本发明单胺氧化酶突变体psmao
m18
的粗酶液的酶活力为60u/ml,冻干酶粉的活力为8u/mg。
[0133]
实施例5-7:单胺氧化酶催化6,6-二甲基-3-氮杂双环[3.1.0]己烷的去对称氧化
[0134]
在20ml夹套反应器中进行反应,通过氧气气球提供氧气,10ml磷酸钾缓冲液(100mm,ph 7.4)中加有10g/l底物6,6-二甲基-3-氮杂双环[3.1.0]己烷(化合物iv),0.1g/l过氧化氢酶,10u/ml的单胺氧化酶psmao、zsmao或者asmao的粗酶液。在25℃条件下磁力搅拌反应。通过自动电位滴定仪控制滴加naoh溶液(3.0m),维持反应液ph为7.4。间歇取样检测反应转化率,反应12h后,用10mol/l的naoh终止反应,用等体积的甲基叔丁基醚萃取三次,加入无水硫酸钠干燥过夜,然后旋转蒸发除去溶剂,得到产物。测定底物iv转化率和氧化产物v((1r,5s)-6,6-二甲基-3-氮杂双环[3.1.0]己烷-2-烯)的对映体过量(ee)值,结果
见表2。
[0135]
表2:单胺氧化酶催化6,6-二甲基-3-氮杂双环[3.1.0]己烷去对称氧化的实验结果
[0136][0137]
由表2可知,三种单胺氧化酶psmao、zsmao和asmao都具有高立体选择性,产物v的ee值都达到95%以上。而且,底物iv转化率都达到99%,几乎都完全转化,表明不存在底物和产物抑制性。
[0138]
实施例8-10:突变酶psmao
m18
催化潜手性氮杂环化合物的去对称氧化
[0139]
在20ml夹套反应器中进行反应,通过氧气气球提供氧气,10ml磷酸钾缓冲液(100mm,ph 7.4)中加有100g/l底物氮杂环化合物(式i、ii和iii),1g/l过氧化氢酶,50u/ml的重组单胺氧化酶psmao
m18
的粗酶液。在25℃条件下磁力搅拌反应。通过自动电位滴定仪控制滴加naoh溶液(3.0m),维持反应液ph为7.4。间歇取样,利用气相色谱检测反应的转化率,当转化率大于99%,用10mol/l的naoh终止反应,用等体积的甲基叔丁基醚萃取三次,加入无水硫酸钠干燥过夜,然后旋转蒸发除去溶剂,得到相应的产物,利用液相色谱测得:产物的ee值均达到99%。计算产品的得率,结果见表3。
[0140]
表3:突变体psmao
m18
催化氮杂环化合物的去对称氧化的实验结果
[0141][0142]
由表3可知,单胺氧化酶突变体psmao
m18
对于多种氮杂环化合物(式i、ii和iii)都具有高立体选择性,具有底物广谱性。而且,多种底物的转化率都达到99%,几乎都完全转化,表明不存在底物和产物抑制性。经后处理后的产品得率也都达到85%以上。
[0143]
实施例11:公升规模反应器的底物iv去对称氧化试验
[0144]
在2l夹套反应器中进行单胺氧化酶突变体psmao
m18
催化反应,1l磷酸钾缓冲液(10mm,ph 7.4)中加有120g/l底物6,6-二甲基-3-氮杂双环[3.1.0]己烷,2g/l过氧化氢酶,
100u/ml的单胺氧化酶psmao
m18
的冻干酶粉。利用通气装置向反应体系中持续通入空气。在25℃条件下磁力搅拌反应。通过自动电位滴定仪控制滴加naoh溶液(3.0m),维持反应液ph为7.4。间歇取样检测反应转化率,反应8h后,测得转化率大于99%,产物v((1r,5s)-6,6-二甲基-3-氮杂双环[3.1.0]己烷-2-烯)的ee值99%。用10mol/l的naoh终止反应,用等体积的甲基叔丁基醚萃取三次,将萃取液混合,用等体积饱和食盐水洗涤两次,洗涤后的萃取液用无水硫酸钠干燥过夜。旋转蒸发除去溶剂,获得产品110g,分离得率为91.6%。
[0145]
实施例12:公升规模反应器的八氢环戊[c]吡咯的去对称氧化试验
[0146]
在2l夹套反应器中进行单胺氧化酶突变体psmao
m18
催化反应,1l磷酸钾缓冲液(10mm,ph 7.4)中加有120g/l底物八氢环戊[c]吡咯(vi),2g/l过氧化氢酶,100u/ml的单胺氧化酶psmao
m18
的冻干酶粉。利用通气装置向反应体系中持续通入空气。在25℃条件下磁力搅拌反应。通过自动电位滴定仪控制滴加naoh溶液(3.0m),维持反应液ph为7.4。间歇取样检测反应转化率,反应12h后,测得转化率大于99%,产物vii((3s,7r)-3-氮杂双环[3,3,0]辛-2-烯)的ee值99%。用10mol/l的naoh终止反应,用等体积的甲基叔丁基醚萃取三次,将萃取液混合,用等体积饱和食盐水洗涤两次,洗涤后的萃取液用无水硫酸钠干燥过夜。旋转蒸发除去溶剂,获得产品106g,分离得率为88.3%。
[0147]
上述对实施例的描述是为便于该技术领域的普通技术人员能理解和使用发明。熟悉本领域技术的人员显然可以容易地对这些实施例做出各种修改,并把在此说明的一般原理应用到其他实施例中而不必经过创造性的劳动。因此,本发明不限于上述实施例,本领域技术人员根据本发明的提示,不脱离本发明范畴所做出的改进和修改都应该视为仍在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1