一种控制小麦株高的QTL及其候选基因TaDHL-7B和应用
一种控制小麦株高的qtl及其候选基因tadhl-7b和应用
技术领域
1.本发明属于小麦分子遗传育种技术领域,具体涉及一种控制小麦株高的qtl及其候选基因tadhl-7b和应用。
背景技术:
2.小麦(triticum aestivum l.,2n=6x=42,aabbdd)是世界上最重要的粮食作物之一,提高小麦总产量一直是我国面临的重大问题,我国人口众多,耕地面积有限,提高单产是实现我国小麦总产量提升的主要途径。小麦产量性状qtl一直是小麦遗传研究热点,但已克隆的基因仍很少。株高是影响产量的重要性状,分离和鉴定小麦株高基因,对小麦产量的遗传改良具有重要意义。
3.目前,小麦中命名了25个降低株高基因(rht)。其中绿色革命基因rht1(rht-b1b)、rht2(rht-d1b)、rht8、rht9在世界范围内得到广泛应用。迄今,只克隆了数个株高基因。rht1(rht-b1b)和rht2(rht-d1b)早在1999年就克隆出来;近几年克隆了rht8(traescsu02g024900或traescsu03g0022100)、rht24(traescs6a02g221900)和tawus-like(wus chel-related homeobox-like)。
4.crispr/cas9基因组编辑技术可以充分利用现有的基因组信息,快速验证初步获得的候选基因,加快性状改良,进而加速育种进程。通过对株高基因进行crispr/cas9基因编辑验证,可为利用该基因进行株高的遗传改良提供理论依据。
技术实现要素:
5.本发明的目的是提供一种控制小麦株高的qtl及其候选基因tadhl-7b和应用。所述qtl及其候选基因tadhl-7b有利于矮秆小麦品种的选育。
6.为实现上述发明目的,本发明采取的技术方案为:
7.本发明提供了一种控制小麦株高的qtl,所述qtl为qph-7b-1242,位于7b染色体上,其遗传距离为1234.5~1252.5cm。
8.进一步的,所述qtl的加性效应为正值,其增加株高等位基因来自母本品种泰农18。
9.本发明还提供了所述的控制小麦株高的qtl的候选基因,所述候选基因为tadhl-7b,其核苷酸序列如seq id no.1所示。
10.本发明还提供了所述的候选基因的编码蛋白,所述编码蛋白的氨基酸序列如seq id no.2所示。
11.本发明还提供了所述的qtl或所述的候选基因在小麦株高性状的遗传改良中的应用。
12.进一步的,在应用时,通过敲除所述候选基因能够降低小麦的株高。
13.进一步的,通过敲除所述候选基因得到的小麦株系的突变基因型为aabbdd(-5bp)和aabbdd(-1bp)。
14.进一步的,所述突变基因型aabbdd在候选基因tadhl-7b的第2外显子区域的285bp处缺失5bp,其编码seq id no.3所示的氨基酸序列。
15.进一步的,所述突变基因型aabbdd在候选基因tadhl-7b的第2外显子区域的286bp处缺失1bp,其编码seq id no.4所示的氨基酸序列。
16.本发明还提供了所述的qtl或所述的候选基因在鉴定或筛选小麦矮秆品种或品系中的应用。
17.进一步的,利用所述候选基因来检测小麦品种或品系中该候选基因等位变异,从而加快鉴定或筛选矮秆小麦品种或品系的进程。
18.进一步的,在检测过程中,所述候选基因的扩增引物为:
19.tadhl-7b-f:cctctctcgaatcattcgcc;
20.tadhl-7b-r:tgaagaaggaacctaaatg。
21.与现有的技术相比,本发明的有益效果和优点是:
22.1、本发明从普通小麦中根据qtl分析结果,在7b染色体定位了一个株高稳定主效qtl
‑‑‑‑
qph-7b-1242;并在其峰值区间内筛选到一个候选基因tadhl-7b,所述tadhl-7b基因编码一个atp依赖性dna解旋酶。共线性分析和表达水平分析表明,tadhl-7b是一个组成型表达且相对保守的基因。
23.2、本发明利用crispr/cas9系统对tadhl-7b基因的b亚组进行基因编辑,t2代共获得aabbdd(-5bp)和aabbdd(-1bp)两种纯合突变基因型,这两种突变基因型会导致移码突变,并使终止密码子提前出现,导致蛋白质功能失活。池栽和盆栽试验表明,纯合突变体比野生型株高显著降低,证明tadhl-7b基因控制株高。因此,tadhl-7b基因有利于小麦株高性状的遗传改良和分子育种,并可以加快对矮秆小麦品种进行筛选,或者用来调控小麦的株高。
附图说明
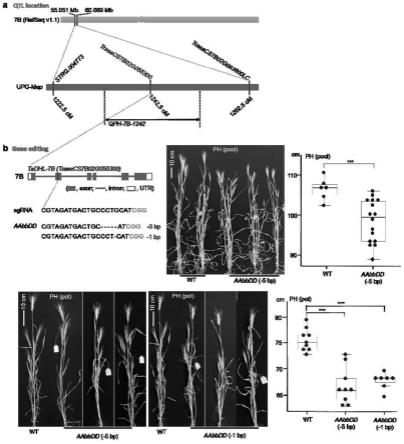
24.图1为tadhl-7b的物理区间、qtl定位和基因编辑;其中,a:利用tl-ril群体及其unigene遗传图谱(upg-map)定位到1个株高qtl——qph-7b-1242,其峰值区间包括1个候选基因traescs7b02g055300;b:利用crispr/cas9系统对tadhl-7b进行基因编辑,证明tadhl-7b控制株高。
25.图2为泰农18(tn18)、临麦6号(lm6)、fielder和突变基因型aabbdd(-5bp)和aabbdd(-1bp)的dna序列。
26.图3为tadhl-7b的特性;其中,a:tadhl-7b基因的系统发育树;b:共线性分析;c:tadhl-7b基因在不同组织和时期的表达水平。
具体实施方式
27.下面结合附图和具体实施方式对本发明的技术方案进一步的详细说明,但本发明要求保护的范围并不局限于实例表述的范围。下述实施例中,如无特殊说明,所使用的实验方法均为常规方法,所用材料、试剂等均可从生物或化学试剂公司购买。
28.本发明所用到的小麦品种:qtl定位材料为冬小麦品种(系)“泰农18”和“临麦6号”及其重组自交系群体(tl-rils);基因编辑材料为fielder,上述材料均可由山东农业大学
处获得。
29.实施例1:小麦株高候选基因的确定
30.采用icimapping 4.1、winqtlcart 2.5和mapqtl 6.0软件对tl-ril群体(泰农18/临麦6号)株高性状进行qtl分析。
31.tl-ril群体qtl分析发现(表1),3个软件同时获得了株高的稳定qtl——qph-7b-1242;该qtl上不涉及产量构成性状。qph-7b-1242的加性效应为正值,表明其增加株高效应来源于母本泰农18。qtl的峰值位置为1234.5~1252.5cm之间,仅包含一个候选基因traescs7b02g055300(图1a)。该基因编码一个atp依赖性dna解旋酶,我们将其命名为tadhl-7b基因。在tadhl-7b外显子1451bp处(atg起始)有一个非同义替换的snp(由泰农18的精氨酸突变为临麦6号的色氨酸)。这些结果表明,tadhl-7b是qph-7b-1242的候选基因。
32.表1:tl-ril群体株高qtl分析结果(qph-7b-1242)
[0033][0034]
注:f,大田试验;m,营养元素试验.ck,正常n,p和k;ln,低n;lp,低p;lk,低k.11,2011年;14,2014年;15,2015年;16,2016年.
[0035]
实施例2:tadhl-7b基因的特性
[0036]
1、实验方法:
[0037]
利用tadhl-7b扩增引物进行pcr扩增:
[0038][0039]
pcr扩增体系:
[0040][0041]
pcr扩增程序:预变性94℃5min;变性94℃30s,退火56℃30s,延伸72℃5min,重复30个循环;72℃延伸10min。
[0042]
将用3
‰
浓度的h2o2催芽的fielder种子胚部向下平整摆放在装有双层滤纸的9cm培养基上,清水浸泡2-3d使其露白生根并移栽到花盆中。在其整个生育时期内,按照分蘖期(取主茎、分蘖和根)、拔节期(取穗、叶和茎)、挑旗期(取穗、旗叶、倒二叶和茎)、抽穗期(穗、旗叶、倒二叶和茎)、开花期(取穗、旗叶和茎)和灌浆期(取籽粒、颖壳、旗叶和茎)分别进行取样工作。
[0043]
小麦的总rna提取试参照北京天根生化科技有限公司提供的方法进行实验操作。以上述提取的rna为模板,参照北京天根生化科技有限公司提供的第一链合成方法进行。将模板rna、10
×
lnr rt buffer、lnr rt enzyme mix、lnr-rt primer mix和rnase-free ddh2o放在冰上解冻,反应体系如下:
[0044][0045]
将得到的cdna保存于-20℃以备用作下一步的试验。
[0046]
根据中国春refseqv1.1注释可知,tadhl-7b的同源基因为tadhl-7a(traescs7a02g151300)和tadhl-7d)(traescs7d02g153200)。
[0047]
针对tadhl及其编码区,通过primer 5设计特异引物,以taactin作为反应的内参基因,对上一步反转录好的cdna为模板进行qrt-pcr定量实验,分析tadhl基因在不同生物学时期和不同组织部位的表达差异。引物设计如下:
[0048][0049][0050]
用sybr green的方法,每组sample设置3个生物学重复,反应体系如下:
[0051][0052]
反应程序为:95℃30s,95℃5s,60℃30s,共40个循环。
[0053]
2、实验结果:
[0054]
对tadhl-7b基因进行序列分析,该基因全长6125bp(seq id no.1),包含6个外显子部分和5个内含子区,编码序列为1593bp(图2所示),编码530个氨基酸(seq id no.2所示)。
[0055]
为了研究不同物种的tadhl蛋白的进化关系,我们构建了不同物种的tadhl蛋白系统发育树。结果表明,tadhl-7b(traescs7b02g055300)、tadhl-7a(traescs7a02g151300)和tadhl-7d(traescs7d02g153200)在不同的分支中。tadhl-7b蛋白与triticum turgidum的tritd7bv1g021310和triticum dicoccoides的tridc7bg008090蛋白亲缘关系密切;tadhl-7a与triticum turgidum的tritd7av1g047410亲缘关系密切;而tadhl-7d与aegilops tauschii的aet7gv2038300亲缘关系密切(图3a)。
[0056]
为了探究近缘种之间的共线性关系,我们进行了共线性分析,发现tadhl-7b区域在基因组a、b、d和e之间保守,而在基因组r发生了逆序(图3b)。
[0057]
不同组织和时期的表达水平表明,tadhl-7b是一个组成型基因,在挑旗期和抽穗期的茎中表达量较高(图3c)。说明tadhl-7b是一个组成型表达且相对保守的基因。
[0058]
实施例3:利用crispr/cas9系统验证tadhl-7b基因的功能
[0059]
如图1b所示,利用crispr/cas9系统对tadhl基因的b亚组(tadhl-7b)进行基因编辑,步骤如下:
[0060]
(1)sgrna的设计
[0061]
利用crispr技术对其进行靶向定点编辑。通过ensembl blast数据库得到的中国春以及fielder的序列作为参考基因组,利用sgrna在线网站crispr-p(http://crispr.hzau.edu.cn/cgi-bin/crispr/crispr)设计候选基因的sgrna序列:
[0062]
traescs7b02g055300-sgrna:ccgatgcagggcagtcatctacg
[0063]
(2)crispr编辑载体构建
[0064]
质粒的提取方法参照艾科瑞生物工程有限公司提供的steadypure质粒提取试剂盒说明说进行操作。
[0065]
根据sgrna以及中间载体和大载体的特性设计扩增引物为:
[0066][0067]
pcr扩增体系和反应程序如下:
[0068][0069]
pcr反应程序:98℃预变性2min;98℃变性10s,60℃退火30s,68℃延伸5s,35个循环;68℃延伸5min。
[0070]
产物经琼脂糖凝胶回收。bsa i酶过夜酶切大载体1246,bsa酶与t4连接酶对小载体3561、3571和大载体边切边连。连接产物转化大肠杆菌后涂至卡纳抗性的板上培养,特定引物检测并筛选重组质粒。农杆菌转化、阳性苗筛选实验委托山东省农业科学研究院李根英团队的转基因中心完成。
[0071]
t1代共获得28株阳性苗,按单穗收获。t2代于2021年8月种植于山东农业大学温室,包括池栽和盆栽。在小麦拔节期,对t2代每一单株下部幼嫩叶片进行取样,采用天根生化科技(北京)有限公司的高效植物基因组dna提取试剂盒,按照说明书进行dna提取。对每组sgrna序列设计特异序列进行pcr扩增,引物序列如下(小写字母为接头序列):
[0072][0073]
反应体系如下:
[0074][0075]
pcr程序如下:预变性94℃10min;变性94℃30s,退火68℃30s,延伸72℃30s,重复30个循环;72℃延伸10min。
[0076]
pcr产物寄送到中国农科院水稻所测序组进行hi-tom测序,获取变异位点。在fielder及转基因植株收获前,测量其主茎株高。fielder及转基因株系之间表型数据显著性比较采用t测验方法。
[0077]
t2代共获得aabbdd(-5bp)和aabbdd(-1bp)两个纯合突变基因型。aabbdd(-5bp)在tadhl-7b的第2外显子区域的285bp处缺失5bp(atg起始点);aabbdd(-1bp)在第2外显子区域的286bp处缺失1bp(图1b和图3)。aabbdd(-5bp)编码102个氨基酸(seq id no.3所示),aabbdd(-1bp)编码122个氨基酸(seq id no.4所示)。这两种突变基因型均导致移码突变,并使终止密码子提前出现,致使其蛋白质功能失活。
[0078]
将t2代的野生型和敲除的突变株分别进行池栽和盆栽试验(图1b和表2)。在池栽试验中,获得16株纯合突变型aabbdd(-5bp);野生型和aabbdd(-5bp)的株高分别为106.6和98.6cm,两者差异显著;aabbdd(-5bp)的株高比野生型降低8.0cm。在盆栽试验中,分别获得9株和7株植株aabbdd(-5bp)和aabbdd(-1bp)的纯合突变型。野生型、aabbdd(-5bp)和aabbdd(-1bp)的株高分别为75.7、66.8和67.8cm,差异显著。与野生型相比,aabbdd(-5bp)和aabbdd(-1bp)的株高分别降低了8.9和7.9cm。以上结果表明,tadhl-7b基因控制小麦株高。
[0079]
表2:池栽和盆栽的野生型和突变体t2代株高
[0080][0081]
以上实施例仅用以说明本发明的技术方案,而非对其进行限制;尽管参照前述实施例对本发明进行了详细的说明,对于本领域的普通技术人员来说,依然可以对前述实施例所记载的技术方案进行修改,或者对其中部分技术特征进行等同替换;而这些修改或替换,并不使相应技术方案的本质脱离本发明所要求保护的技术方案的精神和范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1