催化RebA生产RebM的重组糖基转移酶
催化reb a生产reb m的重组糖基转移酶
技术领域
1.本发明属于生物工程领域,具体地涉及催化reb a生产reb m的重组糖基转移酶、编码该酶的重组基因及表达催化reb a生产reb m的重组糖基转移酶的重组菌株及应用。
背景技术:
2.甜菊糖苷(stevia)又称作甜菊糖(stevia sugar),是一种从植物甜菊叶片中提取获得的新型甜味剂。由于甜菊糖苷不产生热量,也不增加血糖水平,且甜度比蔗糖高出300倍,已作为非营养性甜味剂在某些国家被用于甜味食品几百年。莱鲍迪苷a(rebaudioside a,reb a)是其中主要的甜菊糖苷,为蔗糖甜度的300倍。然而,reb a的苦涩味影响口感,研究发现莱鲍迪苷m(rebaudioside m,reb m)口感好苦涩味小,甜度可达蔗糖的400倍,被认为是新一代的甜菊源甜味剂。2014年,含有reb m的甜菊源甜味剂获得了美国食品药品管理局(usfda)的安全(generally recognized as safe,gras)认证。
3.但reb a含量为细胞干重的3.8%,reb m含量为细胞干重的0.4%,仅微量存在于甜菊叶片中,传统的提取方法很难扩大生产规模。而随着编码合成甜菊糖苷reb m的基因的鉴定,使酶法合成reb m成为可能。有研究报道,天然甜菊叶中可通过尿苷二磷酸糖基转移酶(uridine diphosphate glycosyltransferase,ugts)催化reb a生成莱鲍迪苷d(rebaudioside d,reb d),再将reb d催化生成reb m。
4.但是,reb d水溶性(~0.04%)低于reb a(~0.8%),且价格与reba相比更昂贵。因此,目前以reb d为底物酶法生产reb m的方式,存在底物reb d水溶性低、价格昂贵等缺点。有研究使用两酶的混合物进行双酶体外级联催化,以reb a为底物生产reb m。但由于中间产物reb d的水溶性较低限制了反应的正向进行,产物reb m生成率仅为37.9%,限制了其工业应用。
5.因此,目前的生产reb m的方法存在生产成本高,底物水溶性差,产率较低等问题。使用reb a催化生产reb m的方法可降低底物生产成本,但无法避免副产物的积累及较低的催化效率,需要采用有效措施减少副产物的积累并提高催化效率。
技术实现要素:
6.本发明的目的是克服现有技术的不足,提供催化reb a生产reb m的重组糖基转移酶。
7.本发明的第二个目的是提供一种编码上述重组糖基转移酶的重组基因。
8.本发明的第三个目的是提供一种表达催化reb a生产reb m的重组糖基转移酶的重组菌株。
9.本发明的第四个目的是提供上述重组菌株的诱导表达。
10.本发明的第五个目的是提供含有催化reb a生产reb m的重组糖基转移酶的菌体细胞催化reb a生产reb m的方法。
11.本发明的第六个目的是提供催化reb a生产reb m的重组糖基转移酶的酶液催化
reb a生产reb m的方法。
12.本发明的技术方案概述如下:
13.催化reb a生产reb m的重组糖基转移酶。
14.编码上述重组糖基转移酶的重组基因,所述重组基因的核苷酸序列如seq id no.1、seq id no.2、seq id no.3、seq id no.4、seq id no.5、seq id no.6、seq id no.7或seq id no.8所示。
15.表达催化reb a生产reb m的重组糖基转移酶的重组菌株,用下述方法构建:将上述重组基因构建至表达载体,获得重组载体;将所述重组载体转化宿主菌株中获得重组菌株。
16.表达载体优选为ppic9k、ppic9、ppinkα-hc、pet-28a、pmal或pbad30。
17.宿主菌株优选为大肠杆菌或巴斯德毕赤酵母菌。
18.上述重组菌株的诱导表达,包括如下步骤:将上述重组菌株进行培养并加入诱导剂,在15
–
37℃,诱导表达6
–
27h,获得含有催化reb a生产reb m的重组糖基转移酶的菌体细胞;将所述菌体细胞破胞,得到催化reb a生产reb m的重组糖基转移酶的酶液。
19.含有催化reb a生产reb m的重组糖基转移酶的菌体细胞催化reb a生产reb m的方法,包括如下步骤:
20.取终od
600
为25
–
250权利要求6所述的含有催化reb a生产reb m的重组糖基转移酶的菌体细胞或经过通透性处理的含有催化reb a生产reb m的重组糖基转移酶的菌体细胞,加入终浓度为1
–
10g/l reb a、终浓度为4
–
10mm尿苷二磷酸葡萄糖和终浓度为0.4
–
1mm的mn
2+
,加入终浓度为50mm的ph为7.2
–
8.0的pbs,在26℃
–
42℃、转速为50
–
250rpm、反应10
–
24h,催化生成reb m;
21.所述经过通透性处理的含有催化reb a生产reb m的重组糖基转移酶的菌体细胞用下述方式制备:
22.方式一:将含有催化reb a生产reb m的重组糖基转移酶的菌体细胞在-20
°
~-80℃冷冻0.5
–
24h;
23.方式二:将含有催化reb a生产reb m的重组糖基转移酶的菌体细胞用终浓度为0.15
–
0.45g/l的细胞通透剂重悬,在20
–
30℃静置5min
–
1h;所述细胞通透剂为十六烷基三甲基溴化铵、曲拉通x-100、聚山梨酯-80或十二烷基硫酸钠。
24.催化reb a生产reb m的重组糖基转移酶的酶液催化reb a生产reb m的方法,包括如下步骤:
25.取终浓度为1
–
5g/l上述的催化reb a生产reb m的重组糖基转移酶的酶液,加入终浓度为1
–
10g/lreb a,终浓度为1
–
8mm尿苷二磷酸葡萄糖和终浓度为0.1
–
6mm金属离子,加入终浓度为50mm的ph为5.5
–
10.5的缓冲液,在26℃
–
42℃反应12
–
96h,催化生成reb m;
26.所述金属离子为mg
2+
、mn
2+
、ba
2+
、ca
2+
或pb
2+
。
27.本发明的优点
28.(1)本发明的一种催化reb a生产rebm的重组糖基转移酶能直接以reb a作为底物高效催化生成reb m,避免了由reb a两步催化或由reb d催化生产reb m。避免了以低溶解度且更昂贵的reb d生产reb m的方式,极大节约了底物的生产成本。
29.(2)相比传统两步体外级联催化法,本发明实现了一步催化,整体操作流程精简
化,有效减少耗材损耗及操作时间,降低生产成本;
30.(3)本发明的方法具有更高的底物可及性,能有效避免级联催化中间产物reb d溶解度低对催化活性的限制,显著提高reb m产量,为工业化应用奠定基础。
附图说明
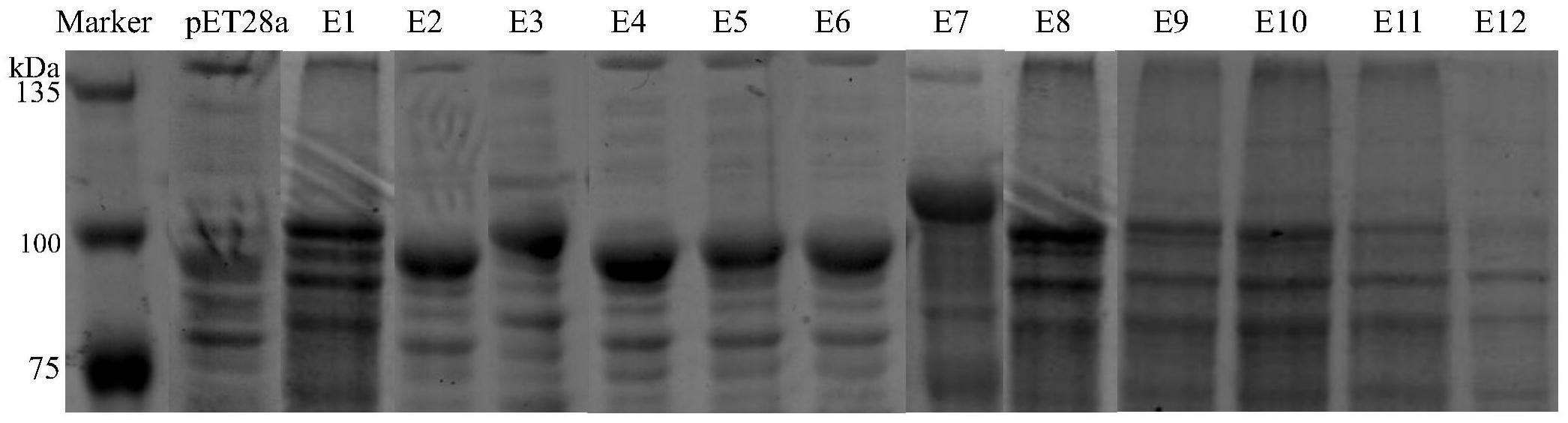
31.图1为实施例2中得到的重组菌粗酶液的sds-page凝胶蛋白电泳图谱。
具体实施方式
32.本文中所涉及物质简称如下:
33.莱鲍迪苷a简称reb a;莱鲍迪苷d简称reb d;尿苷二磷酸葡萄糖简称udpg;异丙基-β-d-硫代半乳糖苷简称iptg。
34.实施例1表达催化reb a生产reb m的重组糖基转移酶的重组菌株的构建
35.本发明的发明人设计并由华大基因合成12个催化reb a生产reb m的重组糖基转移酶的重组基因,分别是sl1e(seq id no.1)、sl2e(seq id no.2)、sl3e(seq id no.3)、sl4e(seq id no.4)、sl5e(seq id no.5)、sl6e(seq id no.6)、s1sl2e(seq id no.7)、el5s(seq id no.8)、el1s(seq id no.9)、el3s(seq id no.10)、el4s(seq id no.11)和el6s(seq id no.12),并通过无缝克隆技术分别构建至ncoⅰ和xhoⅰ双酶切后的pet28a线性化载体上,获得相对应的重组质粒pet28a-sl1e、pet28a-sl2e、pet28a-sl3e、pet28a-sl4e、pet28a-sl5e、pet28a-sl6e、pet28a-s1sl2e、pet28a-el5s、pet28a-el1s、pet28a-el3s、pet28a-el4s和pet28a-el6s。
36.将重组质粒分别转化至e.coli bl21(de3)感受态细胞中,采用含有50μg/ml卡那霉素的lb(1%蛋白胨,0.5%酵母粉,1%nacl,1.6%琼脂粉)固体平板进行筛选,将筛选出的单克隆转化子进行菌落pcr鉴定,得到对应的重组菌株bl21(pet28a-sl1e)、bl21(pet28a-sl2e)、bl21(pet28a-sl3e)、bl21(pet28a-sl4e)、bl21(pet28a-sl5e)、bl21(pet28a-sl6e)、
37.bl21(pet28a-s1sl2e)、bl21(pet28a-el5s)、bl21(pet28a-el1s)、bl21(pet28a-el3s)、bl21(pet28a-el4s)和bl21(pet28a-el6s)。
38.实验证明,用商用表达载体ppic9k、ppic9、ppinkα-hc、pmal或pbad30替代pet-28a,可以获得相应的重组质粒。
39.上述重组质粒也可分别转化至tuner(de3)、bl21star(de3)、bl21-ai等大肠杆菌感受态细胞或x33、km71、gs115等毕赤酵母感受态细胞,得到相应的重组菌株。
40.实施例2重组菌株的诱导表达,包括如下步骤:
41.(1)将实施例1获得的各个重组菌株在含有50μg/ml卡那霉素的lb液体培养基(1%蛋白胨,0.5%酵母粉,0.5%nacl)中于37℃、220rpm条件下培养至od
600
在0.5
–
0.9;
42.(2)加入诱导剂iptg,使终浓度为0.1mm,在18℃条件下诱导表达18h;
43.(3)离心(12000rpm、4℃、10min),弃去上清液,收集菌体细胞。再将收集的菌体细胞用10mm pbs(ph7.2)洗涤1次除净菌体细胞上残留的培养基;用10mm pbs(ph7.2)重悬菌体,获得含有催化reb a生产reb m的重组糖基转移酶的菌体细胞,并分别命名为c1
–
c12;
44.将各个菌体细胞在冰浴中超声破胞,条件:150w,工作5s,间歇8s,全程15min,将破
胞菌液离心(12000g、4℃、10min)收集上清,上清即为催化reb a生产reb m的重组糖基转移酶的粗酶液,并分别命名为e1
–
e12,将所得粗酶液进行纯化。
45.各取20μl粗酶液e1-e12,加入5μl 5
×
蛋白上样loading buffer,混匀后,100℃条件下进行10min的变性失活处理,然后离心(12000g、4℃、2min),上清用于10%sds-page凝胶蛋白电泳,结果见图1。sds-page分析发现所有重组菌株均在约108kda处有一条明显的条带,与预估的目的蛋白的大小基本一致,表明重组融合蛋白均成功表达。其中e1-e8目的蛋白条带较亮,表达水平较高;e9-e12表达水平较低。
46.实施例3重组菌株的诱导表达,包括如下步骤:
47.(1)将重组菌株bl21(pet28a-sl2e)在含有50μg/ml卡那霉素的lb液体培养基(1%蛋白胨,0.5%酵母粉,0.5%nacl)中于37℃、220rpm条件下培养至od
600
在0.5
–
0.9;
48.(2)加入诱导剂iptg,使终浓度为0.1mm,在15℃条件下诱导表达27h;
49.(3)同实施例2步骤(3),获得含有催化reb a生产reb m的重组糖基转移酶的菌体细胞命名为2c2。
50.将菌体细胞2c2在冰浴中超声破胞,条件:150w,工作5s,间歇8s,全程15min,将破胞菌液离心(12000g、4℃、10min)收集上清,上清即为催化reb a生产reb m的重组糖基转移酶的粗酶液,命名为2e2,将所得粗酶液进行纯化。
51.sds-page分析表明2e2在约108kda处有一条明显的条带,与预估的目的蛋白的大小基本一致,表明重组融合蛋白成功表达。
52.实施例4重组菌株的诱导表达,包括如下步骤:
53.(1)将重组菌株bl21(pet28a-sl2e)在含有50μg/ml卡那霉素的lb液体培养基(1%蛋白胨,0.5%酵母粉,0.5%nacl)中于37℃、220rpm条件下培养至od
600
在0.5
–
0.9;
54.(2)加入诱导剂iptg,使终浓度为0.1mm,在37℃条件下诱导表达6h;
55.(3)同实施例2步骤(3),获得含有催化reb a生产reb m的重组糖基转移酶的菌体细胞命名为3c2。
56.将菌体细胞3c2在冰浴中超声破胞,条件:150w,工作5s,间歇8s,全程15min,将破胞菌液离心(12000g、4℃、10min)收集上清,上清即为催化reba生产rebm的重组糖基转移酶的粗酶液,命名为3e2,将所得粗酶液进行纯化。
57.sds-page分析表明3e2在约108kda处有一条明显的条带,与预估的目的蛋白的大小基本一致,表明重组融合蛋白成功表达。
58.实施例5
59.菌体细胞c1
–
c12(实施例2获得)催化reb a生产reb m的方法,包括如下步骤:
60.将终od
600
为160的c1
–
c12分别加入终浓度为1g/l reb a、终浓度为6mm udpg、终浓度为1mm的mncl2和终浓度为50mm的ph为7.5的pbs,在34℃、转速为150rpm、反应10h,催化生成reb m。
61.反应完成后,加入200μl色谱乙腈,振荡混匀后,静置10min,室温下12000rpm离心10min,上清液过0.22μm有机膜后使用hplc进行分析。hplc采用luna c18反相键合硅胶分离柱(4.6mm
×
250mm,5μm),流动相采用25%乙腈,流速1ml/min,柱温40℃,采用紫外检测器vwd,vwd检测器波长210nm,进样量5μl。通过液相分析可得知底物reb a和产物reb m的浓度变化,c1
–
c12的reb m生成率见表1。
62.实施例6
63.菌体细胞2c2(实施例3获得)催化reb a生产reb m的方法,包括如下步骤:
64.将终od
600
为25的2c2加入终浓度为5g/l reb a、终浓度为10mm udpg、终浓度为0.4mm的mncl2和终浓度为50mm的ph为7.2的pbs,在26℃、转速为50rpm、反应24h,催化生成reb m,使用hplc进行分析reb m生成率见表1。
65.实施例7
66.菌体细胞3c2(实施例4获得)催化reb a生产reb m的方法,包括如下步骤:
67.将终od
600
为250的3c2加入终浓度为10g/l reb a、终浓度为4mm udpg、终浓度为0.7mm的mncl2和终浓度为50mm的ph为8.0的pbs,在42℃、转速为250rpm、反应14h,催化生成reb m,使用hplc进行分析reb m生成率见表1。
68.实施例8菌体细胞fc1
–
fc12的制备及其催化reb a生产reb m的方法,包括如下步骤:
69.将c1
–
c12分别在-20℃冷冻24h进行通透性处理,使用10mm pbs(ph7.5)重悬即获得经过通透性处理的含有催化reba生产rebm的重组糖基转移酶的菌体细胞,分别命名为fc1
–
fc12;
70.取终od
600
为160的fc1
–
fc12分别加入终浓度为1g/l reba、终浓度为6mm udpg、终浓度为1mm的mncl2和终浓度为50mm的ph为7.5的pbs,在34℃、转速为150rpm、反应10h,催化生成rebm,使用hplc进行分析reb m生成率见表1。
71.实施例9菌体细胞f2c2的制备及其催化reb a生产reb m的方法,包括如下步骤:
72.将2c2在-50℃冷冻12h进行通透性处理,使用10mm pbs(ph7.5)重悬即获得经过通透性处理的含有催化reb a生产reb m的重组糖基转移酶的菌体细胞,命名为f2c2;
73.取终od
600
为25的f2c2加入终浓度为5g/l reba、终浓度为10mm udpg、终浓度为0.4mm的mncl2和终浓度为50mm的ph为7.2的pbs,在26℃、转速为50rpm、反应24h,催化生成rebm,使用hplc进行分析reb m生成率见表1。
74.实施例10菌体细胞f3c2的制备及其催化reb a生产reb m的方法,包括如下步骤:
75.将3c2在-80℃冷冻0.5h后,使用10mm pbs(ph7.5)重悬即获得经过通透性处理的含有催化reb a生产reb m的重组糖基转移酶的菌体细胞,命名为f3c2;
76.将终od
600
为250的f3c2加入终浓度为10g/l reba、终浓度为4mm udpg、终浓度为0.7mm的mncl2和终浓度为50mm的ph为8.0的pbs,在42℃、转速为250rpm、反应14h,催化生成rebm,使用hplc进行分析reb m生成率见表1。
77.实施例11菌体细胞pc1
–
pc12的制备及其催化reb a生产reb m的方法,包括如下步骤:
78.将c1
–
c12分别用终浓度为0.3g/l的细胞通透剂十六烷基三甲基溴化铵重悬,在20℃静置5min后,使用10mm pbs(ph7.5)重悬上述菌体细胞,分别命名为pc1
–
pc12;
79.将终od
600
为160的pc1
–
pc12加入终浓度为1g/l reba、终浓度为6mm udpg、终浓度为1mm的mncl2和终浓度为50mm的ph为7.5的pbs,在34℃、转速为150rpm、反应10h,催化生成reb m,使用hplc进行分析reb m生成率见表1。
80.实施例12菌体细胞p2c2的制备及其催化reb a生产reb m的方法,包括如下步骤:
81.将2c2用终浓度为0.15g/l的细胞通透剂聚山梨酯-80重悬,在30℃静置30min,使
用10mm pbs(ph7.5)重悬上述菌体细胞,命名为p2c2;
82.将终od
600
为25的p2c2加入终浓度为5g/l reba、终浓度为10mm udpg、终浓度为1mm的mncl2和终浓度为50mm的ph为7.2的pbs,在26℃、转速为50rpm、反应24h,催化生成reb m,使用hplc进行分析reb m生成率见表1。
83.实施例13菌体细胞p3c2的制备及其催化reb a生产reb m的方法,包括如下步骤:
84.将3c2用终浓度为0.45g/l的细胞通透剂曲拉通x-100重悬(实验证明用十二烷基硫酸钠也可以),在25℃静置1h后,使用10mm pbs(ph7.5)重悬上述细胞,命名为p3c2;
85.将终od
600
为250的p3c2加入终浓度为10g/l reb a、终浓度为4mm udpg、终浓度为0.7mm的mncl2和终浓度为50mm的ph为8.0的pbs,在42℃、转速为250rpm、反应14h,催化生成reb m,使用hplc进行分析reb m生成率见表1。
86.表1为实施例5
–
13中的含有催化reb a生产reb m的重组糖基转移酶的菌体细胞的活性结果。
87.反应编号菌体细胞反应体系reb m生成率反应编号菌体细胞反应体系reb m生成率1-1c1实施例565%1-22fc8实施例863%1-2c2实施例575%1-23fc9实施例843%1-3c3实施例569%1-24fc10实施例855%1-4c4实施例578%1-25fc11实施例851%1-5c5实施例570%1-26fc12实施例847%1-6c6实施例566%1-27f2c2实施例963%1-7c7实施例563%1-28f3c2实施例1065%1-8c8实施例561%1-29pc1实施例1187%1-9c9实施例540%1-30pc2实施例1195%1-10c10实施例553%1-31pc3实施例1189%1-11c11实施例551%1-32pc4实施例11100%1-12c12实施例544%1-33pc5实施例1193%1-132c2实施例661%1-34pc6实施例1181%1-143c2实施例765%1-35pc7实施例1186%1-15fc1实施例864%1-36pc8实施例1184%1-16fc2实施例879%1-37pc9实施例1154%1-17fc3实施例871%1-38pc10实施例1163%1-18fc4实施例881%1-39pc11实施例1166%1-19fc5实施例876%1-40pc12实施例1158%1-20fc6实施例866%1-41p2c2实施例1283%1-21fc7实施例869%1-42p3c2实施例1388%
88.实施例14催化reb a生产reb m的重组糖基转移酶的酶液(实施例2获得的e1
–
e12)催化reb a生产reb m的方法,包括如下步骤:
89.取终浓度为2.5g/l e1
–
e12,加入终浓度为1g/l reb a,终浓度为6mm udpg、终浓度为1mm mncl2和终浓度为50mm的ph为7.5的pbs,在37℃反应48h,催化生成reb m;使用hplc进行分析reb m生成率见表2。
90.实施例15催化reb a生产reb m的重组糖基转移酶的酶液(实施例3获得的2e2)催化reb a生产reb m的方法,包括如下步骤:
91.向终浓度为1g/l 2e2中,加入终浓度为5g/l reb a,终浓度为8mm udpg、终浓度为6mm mgcl2,和终浓度为50mm的ph为5.5的柠檬酸-柠檬酸钠缓冲液,在26℃反应96h,催化生成reb m;使用hplc进行分析reb m生成率见表2。
92.将bacl2或cacl2替代本实施例的mgcl2,其它同本实施例,reb m的生成率与本实施例相近。
93.实施例16催化reb a生产reb m的重组糖基转移酶的酶液(实施例4获得的3e2)催化reb a生产reb m的方法,包括如下步骤:
94.向终浓度为5g/l 3e2中,加入终浓度为10g/l reb a,终浓度为1mm udpg、终浓度为0.1mm(ch3coo)2pb和终浓度为50mm的ph为10.5的甘氨酸-氢氧化钠缓冲液,在42℃反应12h,催化生成reb m;使用hplc进行分析reb m生成率见表2。
95.表2催化reb a生产reb m的重组糖基转移酶的酶液的活性结果
96.反应编号酶液反应体系reb m生成率反应编号酶液反应体系reb m生成率2-1e1实施例1462%2-8e8实施例1468%2-2e2实施例1473%2-9e9实施例1442%2-3e3实施例1466%2-10e10实施例1451%2-4e4实施例1474%2-11e11实施例1449%2-5e5实施例1470%2-12e12实施例1444%2-6e6实施例1463%2-132e2实施例1561%2-7e7实施例1465%2-143e2实施例1663%
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1