一种基于荧光素酶的新冠病毒膜融合抑制剂筛选方法
1.本发明涉及到生物医药领域,公开了一种基于荧光素酶的新冠病毒膜融合抑制剂筛选方法。
背景技术:
[0002][0003]
组织细胞被病毒感染之后所形成的合胞体是一种非常普遍的细胞病变效应 (cpe),所形成的合胞体可以加速病毒的传播并且可以帮助病毒逃脱宿主免疫系统的反应。相关病例报道和分析发现在感染新冠病毒并出现严重症状的患者肺部上皮组织细胞也都出现了合胞体,并且新冠死亡病例中合胞体数量远远高于其他因素所造成的死亡病例中合胞体的数量,提示合胞体的出现与新冠病理损伤相关。目前认为由新冠病毒所引起的合胞体是由新冠病毒表面的刺突蛋白 (spike)与临近细胞表面ace2受体结合并导致膜融合而产生的。目前检测合胞体的方法通常是通过显微镜直接观察检测样本中多核细胞来进行相应的评估,但是这种方法不能准确定量合胞体产生的情况,需要花费很多的时间成本,而且可能由于细胞聚集而导致普通显微镜下观察错误从而得出不准确的结果。所以尽早的发现组织细胞出现合胞体并筛选出相应的治疗药物显得尤为的重要。
[0004]
先前有研究显示,分割型绿色荧光蛋白(split gfp)互补系统已被用于合胞体的检测。绿色荧光蛋白由大小两个亚基组成,只有当大小两个亚基组合到一起才会被激发出绿色荧光。将两种分别表达绿色荧光蛋白的大小亚基的细胞共培养,之后在荧光显微镜下观察,出现合胞体的部分就会被激发出绿色荧光。
[0005]
经过本发明发明人亲身的试验,验证了上述系统虽然可以更好地观察细胞形态的变化和合胞体的产生,但是需要很长时间(大于12小时)才能观测到合胞体并且灵敏度不高,更重要的是,绿色荧光合胞体的观测和定量需要高内涵荧光显微技术,这限制了其在高通量药物筛选中的应用。所以建立合胞体快速、准确、方便的检测方法并且用来进行高通量药物筛选找出可以抑制合胞体形成的药物,可以在一定程度上作为治疗新冠的新药,具有非常重大的意义。
技术实现要素:
[0006]
为了解决上述技术问题,本发明提供了一种基于分割型荧光素酶 (splitnanoluc)的新冠病毒膜融合抑制剂筛选方法,通过测量发光的发光强度能快速定量检测新冠病毒刺突蛋白所造成的细胞病变合胞体并进行相关抑制剂的筛选。
[0007]
本发明通过以下技术方案实现:
[0008]
本发明一种基于荧光素酶的新冠病毒膜融合抑制剂筛选方法,包括以下步骤:
[0009]
1)建立表达新冠病毒刺突蛋白特异性受体ace2的细胞系,这一步骤是为了下面将荧光素酶(nanoluc)的大小亚基表达标记做准备。
[0010]
2)将荧光素酶的大亚基表达标记在上一步已经做好的表达ace2的细胞系中,得到
表达ace2/大亚基的细胞系;将荧光素酶的小亚基表达标记在293t 细胞系中,然后向293t-小亚基细胞系中转染并表达新冠病毒刺突蛋白spike 或spike突变体,得到表达小亚基/spike的细胞系。
[0011]
3)将上述构建好的表达ace2/大亚基的细胞系和表达小亚基/spike的细胞系共培养在一个体系之中,如果产生了合胞体,荧光素酶的大小亚基就会组合到一起,可以通过荧光素酶反应底物反应快速准确检测到。
[0012]
4)利用相应测量的发光数值就可以来进一步检测添加的药物是否对产生的合胞体有相应的抑制作用。
[0013]
作为优选,本发明采用293t细胞来建立检测和抑制剂筛选方法。采用293t 细胞来建立检测合胞体和抑制剂筛选方法的原因是293t细胞操作相对简单并且比较容易转染外源基因而且极少表达细胞外配体所需的内生受体。
[0014]
作为优选,在步骤2)应该使用慢病毒来构建相应的稳定细胞系,并且在进行慢病毒感染的时候细胞的汇合度应在70%。
[0015]
作为优选,本发明验证实验使用了传播性、致病性更强的新冠病毒变异类型delta变异病毒的刺突蛋白spike,这样可以使本发明更加具有实际应用的价值。
[0016]
作为优选,步骤3)利用仪器就可将通过荧光素酶反应底物反应的发光快速准确检测到。只需要测量发光量的有无或者是波动情况就可以判断出细胞所产生的合胞体的情况,在检测合胞体的时候荧光素酶发光数值的差异在共培养后的15分钟就可以检测到,并在测试期间继续扩大,表明本发明可以非常快速和灵敏地检测产生的合胞体。
[0017]
作为优选,步骤4)利用相应的发光的情况判断是否测试药物对于合胞体有抑制的效果,初步比较上述细胞共培养中在加入测试药物之前和加入测试药物之后的发光数据,若有抑制的情况,则理论上细胞产生合胞体的数量降低,则发光数值较低。
[0018]
作为优选,步骤3)和步骤4)中所述统一经过荧光素酶与底物反应的发光值为荧光素酶与live-cellnanoglosubstrate反应然后经过biotek neo2多功能微孔板读数仪测量出的读数。
[0019]
总之,本发明建立的高通量抑制剂药物筛选方法的目的是:1)通过荧光素酶与底物反应发光的情况快速准确检测合胞体。2)作为科研用途可以研究细胞内哪些因素会影响合胞体的形成。3)利用相应的发光的情况来筛选出对于合胞体有抑制的效果的药物。
[0020]
与现有技术相比,本发明具有如下的有益效果:
[0021]
本发明的筛选方法,通过将荧光素酶(nanoluc)的大小亚基分别表达标记在两种已经分别表达新冠病毒刺突蛋白和特异性受体ace2的细胞中,然后通过共培养这两种细胞,只有当大小亚基相结合才能与相应底物反应从而产生化学发光,通过测量发光的发光强度从而快速定量检测新冠病毒刺突蛋白所造成的细胞病变合胞体,比较细胞共培养中在加入测试药物之前和加入测试药物之后的发光数据,若有抑制的情况,则细胞产生合胞体的数量降低,则发光数值较低,据此可以进行相关药物的筛选。本发明能够通过共培养本两种细胞系,对由新冠病毒感染形成的合胞体快速、准确、方便的检测并且能进行高通量药物筛选从而选择出可以抑制合胞体形成的药物,抑制合胞体形成的药物在一定程度上可以作为治疗新冠的新药。不需要成本高昂的荧光显微成像系统,降低检测成本。
[0022]
进一步的,采用假病毒来构建细胞系,能得到比较稳定的细胞系。
[0023]
进一步的,由于spike蛋白长期表达会产生毒性,故稳定表达细胞中不表达spike蛋白,在共培养开始前再转染表达spike蛋白,提高细胞系稳定性。
附图说明
[0024]
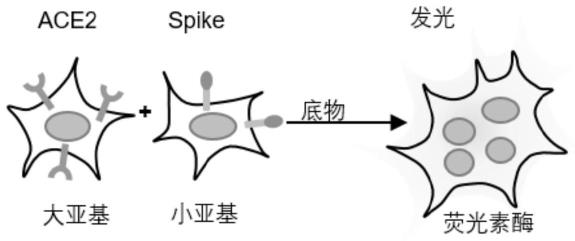
图1为共培养体系化学发光检测合胞体示意图。
[0025]
图2为不同蛋白组合产生的化学发光信号结果。
[0026]
图3为共孵育系统在不同时间点检测化学发光信号。
[0027]
图4为不同spike突变体引起合胞体形成能力检测。
[0028]
图5为三种化合物对合胞体形成能力的抑制作用。
[0029]
图6为共孵育系统的特异性及重复性测试。
具体实施方式
[0030]
为了进一步理解本发明,下面结合实施例对本发明进行描述,这些描述只是进一步解释本发明的特征和优点,并非用于限制本发明的权利要求。
[0031]
实施例1
[0032]
建立一种快速定量检测新冠病毒刺突蛋白所造成的细胞病变合胞体形成的共孵育系统。包括以下步骤:
[0033]
(1)培养基:
[0034]
采用dulbecco’s modified eagle medium(dmem,gibco),并向其中添加 10%胎牛血清、100u/ml青霉素、1μg/ml链霉素。
[0035]
(2)构建ace2和spike表达载体质粒:
[0036]
利用pcr方法从人的cdna文库中扩增出ace2的基因序列,并将ace2 的基因序列连接到psmpuw骨架上,得到ace2表达载体质粒,为了筛选出稳定的细胞系,psmpuw骨架上带有blastcidin抗性。sars-cov-2的密码子优化刺突蛋白基因(购自genscript),接到pcdna3.1上,得到spike表达载体质粒。
[0037]
(3)构建nanoluc的大亚基和小亚基表达载体质粒:
[0038]
以nanoluc为模板利用pcr技术扩增出大亚基的基因并将其连接到 psmpuw骨架上,得到nanoluc大亚基表达载体质粒,为了筛选出稳定的细胞系psmpuw骨架上带有puromycin抗性。由上海生工生物技术公司合成本发明人设计的小亚基寡核苷酸链,经过退火过程然后连接到psmpuw骨架上,得到nanoluc小亚基表达载体质粒,为了筛选出稳定的细胞系psmpuw骨架上带有puromycin抗性。
[0039]
(4)测序验证构建表达载体的正确性:
[0040]
将上述两个步骤构建出的表达载体质粒送相关生物公司(擎科生物)进行测序以保证载体构建的准确性。
[0041]
(5)共培养体系的构建与优化:
[0042]
先将293t细胞接种于12孔细胞培养板上,24小时后用nanoluc大亚基表达载体质粒、nanoluc小亚基表达载体质粒、spike表达载体质粒或ace2 表达载体质粒按照不同的组合方式(如下表1所示)共转染293t细胞。转染的293t细胞培养16小时之后,按1:1比例共培养细胞群1和细胞群2,然后进行合胞体检测(如图1所示)。
[0043]
表1质粒共转组合方式的优化
[0044]
组合方式12345细胞群1ace2/大亚基ace2/大亚基spike/大亚基spike/大亚基spike细胞群2小亚基spike/小亚基小亚基ace2/小亚基ace2/小亚基
[0045]
(6)检测化学发光以监测合胞体的形成:
[0046]
293t细胞首先用pbs清洗一次,然后将nanoluclivecellreagent根据试剂制造商(promega corporation)的推荐配好相应的反应液,将其加入培养板并轻轻旋转培养板使其完全覆盖293t细胞,充分混匀后,取30μl加入384孔板中,用biotek neo2酶标仪测定rlu(relative light unit)。结果显示,ace2/ 大亚基细胞群与spike/小亚基细胞群共孵育的系统产生的信号最强(图2)。
[0047]
(7)构建分别稳定表达ace2/大亚基、小亚基的293t细胞系:
[0048]
根据上述优化组合筛选,发现最优组合为ace2/大亚基+spike/小亚基组合。为方便后续研究,构建稳定表达上述组合的293t-ace2/大亚基细胞系和293t
‑ꢀ
小亚基细胞系,由于spike蛋白长期表达会产生毒性,故稳定表达细胞中不表达spike蛋白。具体是利用ace2表达载体质粒包装得到含有ace2的vsv-g 假病毒,利用荧光素酶的大亚基表达载体质粒包装得到含有荧光素酶的大亚基的vsv-g假病毒;利用荧光素酶的小亚基表达载体质粒包装得到含有荧光素酶小亚基的vsv-g假病毒;待293t细胞70%左右时,用含有ace2的vsv-g 假病毒和含有荧光素酶的大亚基的假病毒感染293t细胞;待293t细胞70%左右时,用含有荧光素酶小亚基的vsv-g假病毒感染293t细胞,用blasticidin 或puromycin筛选出了分别稳定表达ace2/大亚基、小亚基的293t-ace2/大亚基细胞系、293t-小亚基细胞系。
[0049]
(8)稳定表达细胞共培养体系的构建:
[0050]
首先在293t-小亚基细胞系中通过转染来表达spike蛋白,然后将其与 293t-ace2/大亚基细胞系以1:1的比例共孵育,并在指定的时间检测合胞体形成。
[0051]
图3结果显示,细胞共孵育0.5小时即可产生明显的化学发光信号,提示细胞融合的产生,表明本系统比传统的荧光方法快速、灵敏。随着时间的延长,信号会一直升高。
[0052]
实施例2
[0053]
使用上述共孵育系统检测不同spike突变体引起合胞体的能力。据报道,不同变异的新冠病毒毒株的刺突蛋白具有不同的融合原性。为了验证本发明针对不同变异的新冠病毒毒株的刺突蛋白具有普遍性,本发明使用不同变异的刺突蛋白来对本发明的方法进行测试,根据实验结果显示不同类型的突变毒株刺突蛋白都适用于本发明。
[0054]
包括以下步骤:
[0055]
(1)spike突变体质粒的构建:
[0056]
以野生型spike质粒为模板,通过quikchangesite-directedmutagenesis 试剂盒构建一系列spike突变体,包括furin切割位点突变(fur/mut),delta 突变株spike蛋白(delta)及在s1-s2之间添加2a切割位点(2a)。通过测序确定序列正确。
[0057]
(2)spike突变体引起的细胞合胞体形成能力检测:首先在293t-小亚基细胞系中通过转染来表达spike突变体,然后将其与293t-ace2/大亚基细胞系以1:1的比例共孵育,并在共孵育8小时后检测合胞体形成。结果如图4所示,结果显示delta毒株蛋白引起合胞体能力最强,而2a突变体则基本不会引起合胞体形成。
[0058]
实施例3
[0059]
使用上述共孵育系统检测不同化合物对合胞体形成的抑制作用。本系统可以用来检测或筛选化合物对合胞体形成的抑制作用。包括以下步骤:
[0060]
(1)药物处理共孵育系统:在293t-小亚基细胞系中通过转染来表达spike,然后将其与293t-ace2/大亚基细胞系以1:1的比例共培养。同时在共培养系统中添加化合物,本发明选择用抗艾滋病毒药物甲磺酸耐非那韦、抗蠕虫药物氯硝柳胺和抗菌药物沙利霉素验证本发明的方法,这三种化合物是经过报道已知的合胞体抑制剂,能抑制spike诱导的合胞体形成,所以对本发明进行验证的结果更具有说服力。
[0061]
(2)使用艾滋病毒药物甲磺酸耐非那韦(0μm、5μm、10μm、20μm)、抗寄生虫药物niclosamide(0μm、0.5μm、1.5μm、5μm)或者抗菌药 salinomycin(0μm、2.5μm、5μm、10μm)药物作用8小时后,通过检测荧光素酶活性检测化合物对合胞体形成的抑制作用。结果如图5所示:当这三种药物加入到的共培养体系中,三种药物对合胞体均表现出较强的抑制作用,说明本发明适合于检测或筛选具有抑制合胞体形成作用的药物。
[0062]
重复性及特异性验证:对于本发明的共培养系统产生的化学发光信号的特异性及多次重复试验来验证可靠性和准确性。结果如图6所示,合胞体仅在 spike和ace2同时表达的情况下才能形成并产生很强的化学发光信号,三次重复,合胞体形成产生的化学发光信号分别是背景(noace2)的83倍、132 倍及109倍。提示此系统可以产生非常特异的信号。本发明对于监测合胞体的形成以及对于抑制合胞体药物筛选都是通过biotek neo2多功能微孔板读数仪测量相应的nanoluciferase化学发光数值作为相应的观测值,发光数值越高代表着形成的合胞体的数量就越多;对于筛选抑制合胞体药物来说,发光数值通过比较加药之前与加药之后的相比得出结论,理论上,加药之后发光数值变低,并且随着药物浓度的升高,发光强度相比于加药前少50%,而且细胞活力相比于加药之前并没有明显波动才可以认为药物对于细胞合胞体的形成具有抑制作用。
[0063]
本发明中所用原料、设备,若无特别说明,均为本领域的常用原料、设备;本发明中所用方法,若无特别说明,均为本领域的常规方法。
[0064]
以上所述,仅是本发明的较佳实施例,并非对本发明作任何限制,凡是根据本发明技术实质对以上实施例所作的任何简单修改、变更以及等效变换,均仍属于本发明技术方案的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1