一种双启动子质粒及其构建方法和应用与流程
1.本技术涉及质粒构建技术领域,尤其涉及一种双启动子质粒、构建方法及其应用,更具体的是,通过所构建的双启动子质粒瘤内表达细胞因子抑制肿瘤生长。
背景技术:
2.载体构建是分子生物学研究常用的手段之一。主要包括已有载体多克隆位点(mcs)的改造和已有载体启动子、增强子、筛选标记等功能元件的改造。是为把dna分子运送到受体细胞中去,必须寻找一种能进入细胞、在装载了外来的dna片段后仍能照样复制的运载体。理想的运载体是质粒(plasmid),在基因工程中,常用人工构建的质粒作为载体,载体构建即是构建含外源dna的质粒。
3.现有技术中,利用基因工程制备重组免疫蛋白时,通过应用质粒中cmv promoter(巨细胞病毒启动子)等强启动子的在真核表达系统(如肿瘤细胞)里表达获得相关免疫蛋白,这种方法具有表达量较低、获得的重组蛋白含量少、成本较高等问题。
4.因此,亟需构建一种质粒载体,该质粒载体通过与目标基因精确结合,并载入表达系统,获得更高表达量的目标蛋。
技术实现要素:
5.针对以上技术问题,本技术构思在于,提供一种连续双启动子质粒,优化基因的表达结构,即构建区别于现有技术的重组质粒结构,使其在表达系统中能够更高量地表达目标蛋白。
6.结合以上构思,本技术提供了一种具备双启动子的全新结构的质粒载体,所述质粒载体进入肿瘤细胞后,首先由巨细胞病毒(下简称“cmv”)启动子启动t7 rna聚合酶基因转录,翻译产生的t7 rna聚合酶,所述t7 rna聚合酶识别质粒上的t7启动子,转录目的基因(goi)翻译成蛋白质,由于,利用t7 rna聚合酶对t7启动子转录具有一个放大的作用,因此,所述质粒在进入肿瘤细胞后可以产生更多量的目标蛋白。
7.第一方面,本技术实施例公开了一种质粒,所述质粒包括:cmv启动子;所述的cmv启动子序列如seq id no:1所示;核糖体结合位点(ires);所述ires的序列如seq id no:2所示;t7 rna聚合酶基因;所述t7 rna聚合酶基因的序列如seq id no:3所示;t7启动子;所述t7启动子的序列如seq id no:4所示;多聚腺嘌呤核苷酸(pa)序列;所述pa序列为多个腺嘌呤a连在一起组成的rna序列;牛生长激素多腺苷酸化信号(bghpa)序列;所述bghpa序列如seq id no:5所示;以及目的基因(goi)。
8.进一步地,在构建的质粒中,t7 rna聚合酶基因序列位于真核cmv启动子下游,
bghpa序列位于t7 rna聚合酶基因下游,t7启动子位于bghpa序列下游,ires的序列位于t7启动子下游,目的基因(goi)位于ires下游。
9.进一步地,在构建上述质粒过程中,原核表达的t7启动子来源于t7噬菌体,是一种大肠杆菌表达系统常用的强启动子,它能够对t7 rna聚合酶有特异性反应,被识别后的转录非常活跃;cmv启动子作为增强子/启动子元件,这类元件来源于病毒基因组,cmv启动子是公认的启动真核基因表达最有力量的启动子,在很多真核细胞中都有很强的促进转录的作用,启动效率比较高;ires能够介导不依赖末端的翻译启始过程,ires可在同一个启动子下,表达两个乃至更多基因;因此,通过在目的基因(goi)的上游插入ires序列将能引导t7rnap/启动子转录的mrna在真核细胞中翻译,重组载体中cmv启动子启动t7 rna聚合酶基因转录,翻译产生的t7rna聚合酶,识别质粒上的t7启动子,转录目的基因(goi)翻译成蛋白质。
10.进一步地,牛生长激素多腺苷酸化信号(bghpa)序列作为转录t7 rna聚合酶基因的终止子序列。
11.第二方面,本技术实施例公开了前述质粒的构建方法,所述方法包括以下步骤:合成目的基因(goi);构建含有目的基因(goi)的第一重组真核表达质粒;将cmv启动子、核糖体结合位点(ires)、t7 rna聚合酶基因、多聚腺嘌呤核苷酸(pa)序列及牛生长激素多腺苷酸化信号(bghpa)序列序列重组至第一重组真核表达质粒,获得第二重组真核表达质粒;对所述第二重组真核表达质粒进行筛选,验证,即获得前述质粒。
12.进一步地,合成目的基因(goi)的方法包括化学合成法、pcr扩增法中的至少一种。
13.第三方面,本技术实施例公开了一种前述质粒在肿瘤药物中的应用。
14.第四方面,本技术实施例公开了一种前述质粒在制备mrna药物的应用。
15.第五方面,本技术实施例公开了一种药物,其药物的有效成份包含前述质粒及用于药物组合的辅料。
16.进一步地,所述质粒包含的目的基因(goi)为mgm-csf基因。
17.第六方面,本技术实施例公开了前述质粒在肿瘤细胞的应用。
18.第七方面,本技术实施例公开了前述药物在肿瘤细胞的应用。
19.第八方面,本技术实施例公开了一种重组细胞,所述重组细胞包含前述质粒。
20.第九方面,本技术实施例公开了一种基因工程菌,所述基因工程菌包含第八方面所述重组细胞。
21.与现有技术相比,本技术至少具有以下有益效果:本技术中涉及一种双启动子质粒、构建方法及其应用,所述质粒包括:真核cmv启动子、核糖体结合位点(ires)、t7 rna聚合酶基因、t7启动子、多聚腺嘌呤核苷酸(pa)序列、牛生长激素多腺苷酸化信号(bghpa)序列以及目的基因(goi)。所述质粒载体进入肿瘤细胞后,首先由cmv启动子启动t7 rna聚合酶基因转录,翻译产生的t7 rna聚合酶,所述t7 rna聚合酶识别质粒上的t7启动子,转录目的基因(goi)翻译成蛋白质。所述质粒载体通过与目
标基因精确结合,并载入表达系统,获得表达量更高的目标蛋白。
附图说明
22.图1为本技术实施例提供的重组质粒表达结构示意图。
23.图2为本技术实施例提供的小鼠肿瘤体积平均趋势图。
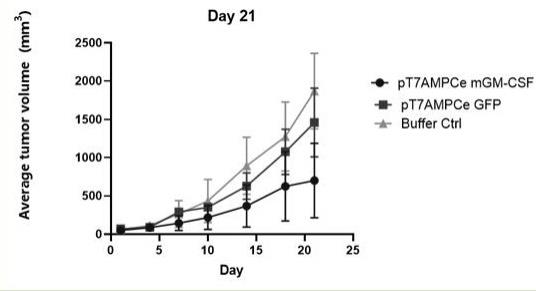
24.图3为本技术实施例提供的小鼠第21天肿瘤平均体积变化图。
25.图4为本技术实施例提供的活体成像观察小鼠荧光信号图。
具体实施方式
26.为了使本技术的目的、技术方案及优点更加清楚明白,以下结合实施例对本技术进行进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本技术,并不用于限定本技术。
27.在本技术中,术语“基因”指表达特定蛋白质或功能rna分子的核酸片段,该核酸片段可包含位于编码序列之前的调节序列(5
′
非编码区)和之后的调节序列(3
′
非编码区)。“元件”是指(upstream promoter elements)包括通常位于-70bp附近的caat盒和gc盒、以及距转录起始点更远的上游元件。
28.在本技术中,“启动子”指能够控制编码序列或功能rna的表达的dna序列。一般来讲,编码序列位于启动子序列的3
′
端。启动子可整个源于天然基因,或者由源于不同的天然存在的启动子的不同元件组成,或者甚至包含合成的dna片段。本领域技术人员应当理解,不同的启动子可以在不同的组织或细胞类型中,或者在不同的发育阶段,或者响应不同的环境条件而引导基因的表达。通常将在大多数细胞类型中、在大多数情况下引起基因表达的启动子称为“组成型启动子”。
29.在本技术中,术语“表达”指转录和衍生自基因的编码rna (mrna)或功能rna的稳定积聚,也可指将mrna翻译成多肽或蛋白。
30.在本技术中,术语“信使rna(mrna)”指无内含子并且可以由细胞翻译成蛋白质的rna。
31.在本技术中,术语“转化”指将核酸片段转移至宿主生物体内,导致在基因上稳定遗传。转化的核酸可以是宿主细胞中保留的质粒形式,或者一些转化的核酸可以被整合进宿主细胞基因组中。含有转化核酸片段的宿主生物被称为“转基因”或“重组”或“转化”生物体。
32.在本技术中,术语“质粒”和“载体”是指通常携带有不属于细胞中心代谢的部分的基因的染色体外元件,并且常常是环状双链dna 分子的形式。这类元件可以是源自任何来源的自主复制序列、基因组整合序列、噬菌体或单链或双链dna或rna的核苷酸序列(线性或环状),其中多个核苷酸序列已连接或重组进入一种独特构建体中,该独特构建体能够将所选基因产物的启动子片段和dna序列与相应的3
′
末端非翻译序列一起引入细胞中。
33.质粒的构建此处目的基因(goi)的合成采用pcr扩增的方法。
34.以mgm-csf为目的基因(goi)为例,本实施例详述重组质粒的构建过程,所述mgm-csf基因的序列如seq id no:6所示。
35.1.设计并合成pcr扩增引物对,所述引物对的核苷酸序列为:p1:如seq id no:7所示;p2:如seq id no:8所示。
36.2.pcr扩增pcr扩增反应体系如表1所示:表1试剂使用量takarataqversion2.025μl模板dna1μlp1(10μm)1μlp2(10μm)1μlddh2o混合液至50μlpcr扩增程序如表2所示:表2步骤温度时间198℃5min298℃10sec355℃30sec472℃35sec 重复步骤2~34个循环 572℃5min3.构建含有mgm-csf目的基因(goi)的第一重组真核表达质粒。
37.分别对pcr扩增产物和原始质粒进行双酶切,电泳检测并回收酶切后的mgm-csf序列和线性化质粒dna。
38.酶切过程中,50μl目的片段酶切体系设计如下:10
×
h buffer ,7μl;酶,各1μl(10u/μl);pcr扩增产物35μl补足双蒸水至50μl;充分混匀后,37℃酶切(针对pcr扩增产物,酶切4h)。
39.20μl载体酶切体系设计如下:10
×
m buffer ,7μl;酶,各1μl(10u/μl);质粒(1ug/μl)2μl补足双蒸水至20μl;充分混匀后,37℃酶切(针对pcr扩增产物,酶切4h)。
40.对于所回收的mgm-csf序列和线性化质粒dna,利用t4 dna酶进行连接。
41.连接时,20μl连接体系设计如下:2
×
quick ligation buffer,10μl;
线性质粒dna,200ng;酶切后的mgm-csf序列片段,87.2ng;t4连接酶,1μl(350u/μl);补足双蒸水至20μl;16℃连接过夜。
42.4.将cmv启动子、核糖体结合位点(ires)、t7 rna聚合酶基因、多聚腺嘌呤核苷酸(pa)序列及牛生长激素多腺苷酸化信号(bghpa)序列序列重组至第一重组真核表达质粒,获得第二重组真核表达质粒;所获得的第二重组真核表达质粒结构,其表达结构如图1所示。
43.5.转化、筛选。
44.利用氯化钙法制备e.colidh5α感受态细胞,将重组质粒分别转化至e. colidh5α中,涂布在含有100μg/ml氨苄霉素(amp)的lb平板,挑选阳性菌落在含氨苄霉素100μg/ml的lb中培养。筛选出重组质粒体外表达量高且经限制性内切酶鉴别正确的菌种于-70 ℃以下保存,用于扩大培养。
45.重组质粒的应用前述构建质粒包含的目的基因(goi)为mgm-csf基因,其中mgm-csf为表达人巨噬细胞集落刺激因子,刺激树突细胞成熟。
46.本实施例通过前述方法构建目的基因(goi)为mgm-csf基因及绿色荧光蛋白(gfp)基因的重组质粒,其中运载体质粒为pt7ampce,构建的重组质粒分别为pt7ampce mgm-csf、pt7ampce gfp;以小鼠结肠癌模型为实验对象,验证pt7ampce mgm-csf的应用于抗肿瘤的效果。
47.首先,构建ct26结肠癌小鼠模型。
48.在小鼠右侧胁腹皮下注射100 μl含有1
×
10
6 ct26细胞悬液。待荷瘤鼠肿瘤体积达到50~80 mm3时,将所有小鼠随机分为7组。
49.其次,设计重组质粒分组方案,如表3所示。
50.表3is buffer为溶剂对照不含有质粒。
51.所上表所示,pt7ampce gfp组为质粒对照组;is buffer组为非质粒空白对照组。
52.下一步,小鼠体积达到1500mm3后安乐处死小鼠,每周测量小鼠肿瘤体积两次,采用student-t-test统计学分析小鼠体内肿瘤体积结果数据。
53.结果:如图2~3所示,小鼠的肿瘤体积变化对比,经统计学分析表明,pt7ampce mgm-csf质粒组抗肿瘤效果显著优于pt7ampce gfp组。
54.重组质粒在制备mrna药物的应用
本技术实施例中,前述重组质粒可用于制备mrna药物。
55.第一步,通过前述质粒构建方法构建重组质粒;根据要制备的mrna药物的种类,选择不同的目的基因(goi)构建于重组质粒中,如制备一种抗肿瘤细胞的mrna药物,采用一种溶瘤病毒即ii型单纯疱疹病毒(hsv2)的d型囊膜蛋白基因 gd
ed
为目的基因构建重组质粒;第二步,将所述重组质粒进行体外转化(ivt),将将dna 链转化为 mrna,在这一步中,rna 聚合酶(rna polymerase)会将 dna 转录为 mrna。
56.第三步,递送系统装载。此步是将 mrna 包裹进脂质载体(lnp)中,脂质悬浮于酒精溶液中,与 mrna接触并将其包裹,两种物质通过相反电荷相吸引。
57.第四步,检验灌装,即得到mrna药物。
58.本技术实施例中,用于包封mrna的递送系统采用目前常用或已公开的脂质载体(lnp),本领域技术人员应用常规技术手段可以得到,这里不做赘述。
59.小鼠肌肉注射质粒观察荧光表达首先,通过前述方法构建目的基因(goi)为萤火虫荧光蛋白(fluc)基因的重组质粒pt7ampce-fluc;其次,选择7周龄的雌性balb/c小鼠为实验小鼠,其中实验组小鼠左右大腿肌肉各注射30μg的pt7ampce-fluc重组质粒,对照组小鼠注射等剂量的is buffer溶剂。48h后小鼠腹腔注射15mg/ml的荧光素底物,小动物活体成像观察小鼠荧光信号。
60.结果:如图4所示:结果表明pt7ampce-fluc重组质粒在肌肉细胞中表达了萤火虫荧光蛋白酶;其中1号小鼠为对照组小鼠,2号小鼠注射了30μg的pt7ampce-fluc重组质粒。
61.综上所述,本技术中涉及一种双启动子质粒、构建方法及其应用,所述质粒包括:真核cmv启动子、核糖体结合位点(ires)、t7 rna聚合酶基因、t7启动子、多聚腺嘌呤核苷酸(pa)序列、牛生长激素多腺苷酸化信号(bghpa)序列以及目的基因(goi)。所述质粒载体进入肿瘤细胞后,首先由cmv启动子启动t7 rna聚合酶基因转录,翻译产生的t7 rna聚合酶,所述t7 rna聚合酶识别质粒上的t7启动子,转录目的基因(goi)翻译成蛋白质。所述质粒载体通过与目标基因精确结合,并载入表达系统,获得目标免疫蛋白表达量更高。按所述方法,以mgm-csf基因为目的基因(goi),构建重组质粒,并将该重组质粒用于抗肿瘤治疗,能明显抑制肿瘤细胞的生长速度,治疗效果好。
62.以上所述,仅为本技术较佳的具体实施方式,但本技术的保护范围并不局限于此,任何熟悉本技术领域的技术人员在本技术揭露的技术范围内,可轻易想到的变化或替换,都应涵盖在本技术的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1