燕窝特征性肽段、其筛选方法及应用与流程
1.本发明涉及分子生物学技术领域,尤其是涉及一种基于蛋白质组学技术的燕窝特征性肽段的筛选方法及应用。
背景技术:
2.可食用燕窝一般指是雨燕科金丝燕属的六种鸟类在繁殖过程中分泌出的唾液与羽毛等混合凝结而筑成的巢穴。同时,有雨燕科雨燕属某些鸟类的巢穴也可以作为燕窝。燕窝在我国有悠久的历史,早在唐代就有食用燕窝的记录。直到现在,人们一直将燕窝作为高级保健品食用。
3.从成分上看,燕窝主要含蛋白质、糖类、脂质、一些无机元素、维生素、激素等。有研究分析了燕窝中含有的氨基酸,发现其含有天冬氨酸、谷氨酸等20种常见氨基酸,不含羟脯氨酸和肌氨酸,而含有8种必需氨基酸。燕窝中糖类的含量仅次于蛋白质,主要有唾液酸、甘露糖、葡萄糖胺、半乳糖胺等。脂质大约占燕窝的0.14-0.28%,脂肪酸成分有硬脂酸、棕榈酸、亚麻酸、亚油酸等。燕窝中无机元素含量较高,且含有人类所必需的微量元素。研究表明,燕窝中含量较高的元素为四种常量元素ca>mg>na>k,其次为五种必需微量元素fe>zn>mn>cr>cu。
4.然而,燕窝本身是一个复杂体系,尽管进行了多年的研究,燕窝的物质基础依然不够明确,造假或以次充好的事件时有发生。2011年,我国发生了“血燕”造假导致产生大量亚硝酸盐的食品安全事件,给燕窝行业带来了严重打击,也暴露出燕窝质量和安全性很大程度上无法得到保证的问题。对燕窝的鉴别和质量控制研究也更加重视。而随着各种分析技术以及分子生物学的发展,燕窝的研究也更加深入。
5.目前,研究者针对燕窝的真伪鉴定已经开发了各种各样的方法,利用紫外灯照射、特异性的化学反应能够定性鉴别燕窝。而多种仪器分析技术也可以用于燕窝的鉴别中,比如红外光谱、高效液相色谱等。分子生物学的发展为燕窝研究提供了新的技术,分子生物学技术不仅可以用于分析燕窝本身,还可以识别其物种来源。主要用于燕窝分析的技术有实时荧光pcr和双向电泳。
6.蛋白质是燕窝的最主要成分,对燕窝中的蛋白质进行研究是燕窝研究的重点。而蛋白质组学技术作为近年快速发展的一项新兴技术,为燕窝研究提供了重要参考。蛋白质组学的概念于1994年提出,意指“一个细胞或一个组织基因组所表达的全部蛋白质”,是一门从整体上系统研究蛋白质如何发挥作用的工具学科。经过二十多年的发展,蛋白质组学已经发展成为研究蛋白质及其功能的最重要学科之一,并且在药物分析、药物靶点发现方面发挥重要作用。
7.聚丙烯酰胺凝胶电泳(sds-page)是蛋白质分离的重要方法,也是蛋白质组学研究的第一步。它能够根据分子量将蛋白质分开。分离后的蛋白质可以被切下,进行后续的生物质谱分析。而如果在另一方向上使蛋白质依据电荷进行分离,就是二维电泳技术(2d-page)。目前已有一些蛋白质组学研究鉴定了燕窝的蛋白质。2010年,有研究者利用双向电
泳技术初步对燕窝进行了分析。2012年liu等报道了基于双向电泳的燕窝蛋白质组研究结果,这是最早的一项关于燕窝蛋白质组的详细研究。作者鉴定了燕窝中的一种蛋白质,为amcase-like蛋白。然而,由于数据库中金丝燕的蛋白数据缺乏,这个蛋白是从与金丝燕具有一定同源性的火鸡蛋白质数据库中鉴定出来的。
8.2019年,相关文献报道了一种利用蛋白质组学进行燕窝特异性肽段鉴定的方法。该方法首先将燕窝在液氮中研磨成粉末,并利用7m尿素+2m硫脲进行蛋白提取,提取后加入120mm dtt和600mm iaa对蛋白质进行还原和烷基化,此后加入胰蛋白酶进行蛋白酶解,将蛋白酶解成肽段。
9.水解后的肽段经纳升液相色谱串联四极杆-飞行时间质谱分析,并与蛋白质数据库搜索比对后确定肽段来源。燕窝样本和不同掺假物所使用的物种数据库分别为apodidae,sus,tremella fuciformis,gallus,cypriniformes。后续利用多反应监测(mrm)方法进行初步的定量分析。蛋白质组学搜库结果显示,在多个不同的燕窝样本中鉴定到了lysyl oxidase 3,acidic mammalian chitinase,actin,cytoplasmic type 5,hemojuvelin,deleted in malignant brain tumors 1 protein,actin,gamma-enteric smooth muscle等蛋白。但在燕窝的掺假物银耳、鱼鳔、蛋清等食品中也鉴定到了相应的蛋白。
10.以6-20个氨基酸组成的无任何缺失或修饰的肽段作为筛选条件,从燕窝及掺假物种发现了72个特征性肽段。在燕窝中选出的肽段分别为tlftvlvk,emvaafeqear,slwscpyr,ssewgticddr,iwldnvncaggek。
11.接着利用lc-qtrap-ms系统对所有候选肽段进行了验证,在燕窝肽段中tlftvlvk和emvaafeqear肽段具有更高的响应值,大约是其他3个肽段的10倍。利用mrm方法发现了32个在cid碎裂条件下稳定的mrm跃迁,其中10个来自蛋清,6个来自鱼鳔,6个来自猪皮,9个来自燕窝。对这些片段离子的定量特征进行了评价,线性实验表明这32个稳定的mrm跃迁均为潜在的可定量片段离子。经过校正后,发现燕窝中emvaafeqear肽段的线性最优。
12.该技术开发了一种燕窝特征肽段的鉴定方法,同时能够区分燕窝及其掺假物,同时能对其进行初步定量。但是该技术有以下几个缺点:
13.1.蛋白质组学搜索的物种数据库偏少。燕窝样本仅选用了一个物种的数据库进行匹配,导致获得的信息可能较少。
14.2.该技术直接进行溶液内的蛋白酶切,无法判断不同分子量的燕窝蛋白和肽段信息。
15.3.该技术仅依靠一次蛋白质组学运行找出对应肽段,可靠性相对较低。
技术实现要素:
16.为了克服上述技术缺陷,本发明最主要的技术目的是提供可用于燕窝真伪鉴定的特征性肽段。
17.本发明的第二目的在于提供所述的燕窝特征性肽段在燕窝真伪鉴定中的应用。
18.本发明的第三目的在于提供一种燕窝蛋白质溯源数据库。
19.本发明的第四目的在于提供一种燕窝真伪鉴定方法。
20.本发明的第五目的在于提供所述的特征性肽段的筛选方法。
21.燕窝特征性肽段,其氨基酸序列如seq id no.1~21任一氨基酸序列所示:
[0022][0023][0024]
所述的燕窝特征性肽段在燕窝真伪鉴定中的应用。
[0025]
一种燕窝蛋白质和肽段溯源数据库,包含如一个或多个如seq id no.1~21任一氨基酸序列所示的肽段。
[0026]
优选的,所述的燕窝蛋白质和肽段溯源数据库还含有烟囱雨燕(chaetura pelagica),凤头树燕(hemiprocne comata)、家燕(hirundo rustica rustica)的蛋白质和肽段数据库。
[0027]
优选的,所述的燕窝蛋白质和肽段溯源数据库还包括与燕窝和掺假物相关的物种的蛋白质和肽段数据库。例如,绿头鸭(anas platyrhynchos)、灰雁(anser anser)、白翅栖鸭(asarcornis scutulata)、凤头潜鸭(aythya fuligula)、野牦牛(bos mutus)、普通牛(bos taurus)、野山羊(capra hircus)、鲫鱼(carassius auratus)、银鲫(carassius gibelio)、鲤鱼(cyprinus carpio)、斑马鱼(danio rerio)、原鸡(gallus gallus)、大豆(glycine max)、蓝黑鲮(labeo calbasu)、野鲮(labeo rohita)、白甲鱼(onychostoma macrolepis)、绵羊(ovis aries)、金线鲃(sinocyclocheilus anshuiensis)、野猪(sus scrofa)、银耳(tremella fuciformis)、黄金银耳(tremella mesenterica)。可用于燕窝是否掺假的鉴别,如在待检品中检测到不属于烟囱雨燕、凤头雨燕和家燕的肽段,则可以认为待检品中掺入了伪品。
[0028]
优选的,所述的燕窝蛋白质和肽段溯源数据库可通过将来自不同产地的燕窝原
料、不同品牌的燕窝成品以及不同掺假物的蛋白混合在一起,进行还原、烷基化以及胰酶酶切,进行定性蛋白质组学研究,并将研究得到的所有蛋白和肽段信息建立。
[0029]
一种燕窝真伪鉴定的方法,包括以下步骤:
[0030]
(1)待检品蛋白中加入裂解液,加入丙酮混合,收集沉淀;沉淀中加入四乙基溴化铵(teab),使沉淀分散后,加入胰蛋白酶进行酶解;再经二硫苏糖醇(dtt)还原,碘乙酰胺(iaa)烷基化,得到蛋白质提取液;
[0031]
(2)将步骤(1)得到的蛋白质提取液用流动相a溶解后进行高效液相色谱后,再进行高分辨质谱分析,其中,所述的高效液相色谱,流动相a为含0.1%甲酸(fa)和2%乙腈(acn)的水溶液,流动相b为含0.1%甲酸和90%乙腈的水溶液,流动相梯度洗脱程序如下:
[0032]
时间流动相a流动相b0-68min77%~94%6%~23%68-82min68%~77%23%~32%82-86min20%~68%32%~80%86-90min20%80%;
[0033]
(3)对高分辨质谱获得的数据进行检索分析,鉴定是否含有如seq id no.1~21任一氨基酸序列所示的特征性肽段。
[0034]
优选的,步骤(1)中所述的胰蛋白酶按与蛋白的质量比1∶50加入。
[0035]
优选的,步骤(1)中使沉淀分散的方式是通过超声打散。
[0036]
优选的,步骤(2)中所述的梯度洗脱中,流动相的流速为500nl/min。
[0037]
优选的,步骤(2)中所述的高分辨质谱的离子源为nsi离子源;质量分析器为轨道离子阱分析器;更优选的,所述的质量分析器为orbitrapexploris
tm
480质谱。
[0038]
优选的,步骤(2)中所述的高分辨率质谱为二级串联质谱。
[0039]
优选的,所述二级串联质谱中,数据采集模式使用数据依赖型扫描(dda)程序;即在一级扫描后选择信号强度最高的前25肽段母离子依次进入hcd碰撞池,使用27%的碎裂能量进行碎裂,同样依次进行二级质谱分析。
[0040]
优选的,所述的二级串联质谱中,一级质谱扫描范围设置为400-1200m/z,扫描分辨率设置为60000。
[0041]
优选的,所述的二级串联质谱中,二级质谱扫描范围固定起点为110m/z,二级扫描分辨率设置为15000,turbotmt设置为off。
[0042]
优选的,自动增益控制(agc)设置为100%,信号阈值设置为5e4 ions/s,最大注入时间设置为auto,串联质谱扫描的动态排除时间设置为20s避免母离子的重复扫描。
[0043]
优选的,所述的二级质谱数据用proteome discoverer进行检索。
[0044]
优选的,步骤(3)中所述的检索分析是在所述的燕窝蛋白质和肽段溯源数据库中进行。
[0045]
本发明进一步提供了上述特征性肽段的筛选方法,包括下述步骤:
[0046]
(1)构建燕窝蛋白质溯源数据库:将来自不同产地的燕窝原料、不同品牌的燕窝成品以及不同掺假物的蛋白混合在一起,进行还原、烷基化以及胰酶酶切,进行定性蛋白质组学研究,并将研究得到的所有蛋白和肽段信息建立为燕窝蛋白质溯源数据库;
[0047]
(2)筛选燕窝特征性肽段:对若干真实燕窝样品进行蛋白质组学研究,经聚丙烯酰胺凝胶电泳后,经切胶、还原、烷基化以及胶内酶切,得到不同分子量的燕窝蛋白,经与步骤(1)的数据库分析对比筛选后得到所述21个肽段。
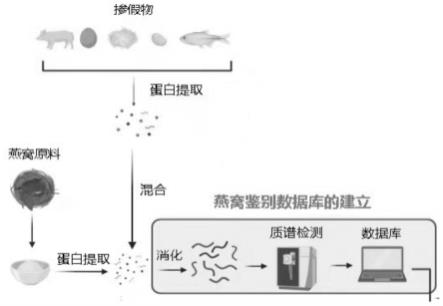
[0048]
上述筛选方法,其中所述步骤(1)中定性蛋白质组学研究的方法具体地包括:
[0049]
(a)各样品蛋白取等量进行酶解,用裂解液将体积调整至一致;加入1倍体积的预冷丙酮,涡旋混匀后再加入4倍体积的预冷丙酮,20℃沉淀2h;4500g,离心5min,弃上清,用预冷的丙酮洗涤沉淀2次;晾干沉淀后加入终浓度200mm的teab,超声打散沉淀,以1∶50的比例(蛋白酶:蛋白,m/m)加入胰蛋白酶,酶解过夜;加入二硫苏糖醇(dtt)使其终浓度为5mm,56℃还原30min;之后加入碘乙酰胺(iaa)使其终浓度为11mm,室温避光孵育15min;
[0050]
(b)得到的肽段用液相色谱流动相a相溶解后使用easynlc1200超高效液相系统进行分离;流动相a为含0.1%甲酸和2%乙腈的水溶液;流动相b为含0.1%甲酸和90%乙腈的水溶液;液相梯度设置:0-68min 6%~23%b;68-82min23%~32%b;82-86min 32%~80%b;86-90min 80%b,流速维持在500nl/min;肽段经由超高效液相系统分离后被注入nsi离子源中进行电离,然后进入orbitrapexploris
tm
480质谱进行分析;离子源电压设置为2.3kv faims补偿电压;一级质谱扫描范围设置为400-1200m/z,扫描分辨率设置为60000;二级质谱扫描范围固定起点为110m/z,二级扫描分辨率设置为15000,turbotmt设置为off;数据采集模式使用数据依赖型扫描(dda)程序,即在一级扫描后选择信号强度最高的前25肽段母离子依次进入hcd碰撞池,使用27%的碎裂能量进行碎裂,同样依次进行二级质谱分析;自动增益控制(agc)设置为100%,信号阈值设置为5e4 ions/s,最大注入时间设置为auto,串联质谱扫描的动态排除时间设置为20s避免母离子的重复扫描;二级质谱数据使用proteomediscoverer(v2.4.1.15)进行检索。
[0051]
优选地,所述步骤(b)中二级质谱数据的检索参数设置为:数据库添加了反库以计算随机匹配造成的假阳性率成的假阳性率(fdr),并且在数据库中加入了常见的污染库,用于消除鉴定结果中污染蛋白的影响;酶切方式设置为trypsin(full);漏切位点数设为2;肽段最小长度设置为6个氨基酸残基;肽段最大修饰数设为3;一级母离子质量误差容忍度设为10ppm,二级碎片离子的质量误差容忍度为质量误差容忍度为0.02da;将carbamidomethyl(c)设置为固定修饰,将oxidation(m),acetyl(n-terminus),met-loss(m),metmet-loss+acetyl(m)设置为可变修饰;蛋白,肽段,psm鉴定的fdr都设置为1%。
[0052]
上述筛选方法,其中所述步骤(2)中蛋白质组学研究的方法具体地包括:
[0053]
(a)向不同的燕窝蛋白溶液中加入5
×
loading buffer,95℃金属浴处理5-10min;将煮好的样品加入sds-page中进行凝胶电泳,电压:0-15min 80v;15-70min 120v;将凝胶使用考马斯亮蓝染液染色并用脱色液脱色;
[0054]
(b)将已脱色并提取图片的胶用高纯水清洗两次,根据图片确定需要切的部分,准备1.5ml离心管;用乙醇冲洗离心管,静置后移去管底存液;用乙醇冲洗玻璃板,刀片和一个100μl枪头,静置待干;换新手套,将胶置于玻璃板上切下所需部分,并切成1-1.5mm见方的小粒,装进相应管子;
[0055]
(c)加500μl脱色剂稍作涡旋,低速震荡脱色;待胶粒全部为无色透明,离心并去除液体;加500μl脱水剂稍作涡旋,低速震荡10min或置于冰箱中脱水;待胶粒全部为白色,离心并去除液体;加10mm 50μl dtt,56℃下孵育30-40min;离心去除液体;加55mm 50μl iaa
室温下黑暗中孵育60min;离心去除液体,用500μl高纯水清洗胶粒,涡旋,离心去除液体;加500μl脱水剂,稍作涡旋,低速震荡10min,待胶粒为白色,离心并去除液体;按每1mm胶粒为1μl计,加足够的胰蛋白酶,放冰箱45-60min充分溶胀,按每1mm胶条2μl比例加入50mm碳酸氢铵(abc),30℃孵育过夜,12-16h;
[0056]
(d)加50μl提取液:50%acn 5%fa,室温下高速震荡25min,离心并将液体移入新标注好的1.5ml离心管;重复提取一次,合并提取液,真空离心浓缩;
[0057]
(e)上样前,将样品用液相色谱流动相a相溶解后15000rpm离心45min,取上清液至样品瓶;使用easynlc1200超高效液相系统进行分离;流动相a为含0.1%甲酸的水溶液;流动相b为含0.1%甲酸的乙腈;液相梯度设置:0-2min4%~12%b;2-23min 12%~30%b;23-27min 30%~50%b;27-28min 50%-100%b,流速维持在300nl/min;肽段经由超高效液相系统分离后被注入nsi离子源中进行电离,然后进入orbitrap fusion lumos质谱进行分析;离子源电压设置为2.2kv,肽段母离子及其二级碎片都使用高分辨的orbitrap进行检测和分析;一级质谱扫描范围设置为375-1500m/z,扫描分辨率设置为120000;二级质谱扫描范围固定起点为100m/z,二级扫描分辨率设置为30000;二级质谱数据使用pfind3进行检索。
[0058]
优选地,所述步骤(c)中,脱色剂为50%acn 25-50mm abc;脱水剂为acn;足够的胰蛋白酶为1-10ng/μl 50mm abc。
[0059]
优选地,所述一级质谱中,数据采集模式使用数据依赖型扫描(dda)程序,即在一级扫描后选择信号强度最高的前25肽段母离子依次进入hcd碰撞池,使用30%的碎裂能量进行碎裂,同样依次进行二级质谱分析;自动增益控制(agc)设置为100%,信号阈值设置为5e4 ions/s,最大注入时间设置为100ms,串联质谱扫描的动态排除时间设置为30s避免母离子的重复扫描。
[0060]
优选地,所述二级质谱的检索参数设置:数据库为chaetura pelagica+hemiprocne comata+hirundo rustica rustica,添加了反库以计算随机匹配造成的假阳性率成的假阳性率(fdr),并且在数据库中加入了常见的污染库,用于消除鉴定结果中污染蛋白的影响;酶切方式设置为trypsin(full);漏切位点数设为3;肽段最小长度设置为6个氨基酸残基;肽段最大修饰数设为3;一级母离子质量误差容忍度设为20ppm,二级碎片离子的质量误差容忍度为质量误差容忍度为0.02da;将carbamidomethyl(c)设置为固定修饰,将oxidation(m),acetyl(anyn-term),met-loss(proteinn-termm),
[0061]
metmet-loss+acetyl(proteinn-termm)设置为可变修饰;蛋白,肽段,psm鉴定的fdr都设置为1%。
[0062]
本发明采用上述筛选方法,经过重重筛选,首先是对01-08样本进行了合并搜库后,总共鉴定出了42个蛋白和130条肽段。在蛋白中按照匹配到该蛋白的肽段数(psm)进行排序,选取了psm≥10的12个蛋白,其中最大psm为62。其中出现了名称类似或相同的蛋白,原因是它们的物种不同。
[0063]
然后又列出了匹配到这些蛋白的所有肽段。并进一步根据肽段序列去除重复,方法是只要序列相同就认为是同一条肽段,仅保留蛋白序号小的一个数据。在12个蛋白中得到了68条不同的肽段。
[0064]
为了进一步缩小候选肽段的数量,将这68条肽段与真伪建库数据(base库)中鉴定
到的肽段进行比较,找出了28条在base库中也被鉴定出的肽段,其中21条肽段三次都被鉴定出来。这21条肽段最终可以作为燕窝的标志性肽段(特征性肽段),它们分别来自于不同的燕窝蛋白。
[0065]
本发明采用上述的技术方案,可以取得的技术效果包括:
[0066]
1.从燕窝中鉴定出了21个特征性肽段,大大丰富了燕窝特征性肽段的数目。克服了现有技术中蛋白质组学搜索的物种数据库偏少、信息少的缺陷。
[0067]
2.基于蛋白质组学技术,利用胶内酶切方法鉴定了不同分子量的燕窝蛋白和肽段,并且建立了一种燕窝特征性肽段的筛选方法。该技术可以判断不同分子量的燕窝蛋白和肽段信息,可靠性高。
附图说明
[0068]
图1为燕窝蛋白溯源数据库的建立流程;
[0069]
图2是在数据库建立中鉴定出的蛋白数(1167)和肽段数(5435);
[0070]
图3是在不同物种中鉴定出的蛋白数目;
[0071]
图4是燕窝蛋白的sds-page图谱;
[0072]
图5是在胶内酶切样本中鉴定出的燕窝蛋白数;
[0073]
图6是基于蛋白质组学方法筛选出的21条燕窝特征性肽段。
具体实施方式
[0074]
为进一步说明本发明,结合以下实施例具体说明。非特殊说明,本发明实施所采用的试剂均为市售商品,本发明实施所采用的数据库均为公开的在线数据库。以下实施例是示例性的,仅用于解释本发明,而不能理解为对本发明的限制。
[0075]
实施例1:燕窝溯源蛋白质数据库的建立
[0076]
本实施例首先构建了燕窝蛋白质溯源数据库,将来自不同产地的燕窝原料、不同品牌的燕窝成本以及不同掺假物的蛋白混合在一起,进行还原、烷基化以及胰酶酶切,并进行定性蛋白质组学研究。图1为燕窝蛋白溯源数据库的建立流程图。
[0077]
研究方法:
[0078]
各样品蛋白取等量进行酶解,用裂解液将体积调整至一致。加入1倍体积的预冷丙酮,涡旋混匀后再加入4倍体积的预冷丙酮,20℃沉淀2h。4500g,离心5min,弃上清,用预冷的丙酮洗涤沉淀2次。晾干沉淀后加入终浓度200mm的四乙基溴化铵(teab),超声打散沉淀,以1∶50的比例(蛋白酶:蛋白,m/m)加入胰蛋白酶,酶解过夜。加入二硫苏糖醇(dtt)使其终浓度为5mm 56℃还原30min。之后加入碘乙酰胺(iaa)使其终浓度为11mm,室温避光孵育15min。
[0079]
肽段用液相色谱流动相a相溶解后使用easynlc1200超高效液相系统进行分离。流动相a为含0.1%甲酸和2%乙腈的水溶液;流动相b为含0.1%甲酸和90%乙腈的水溶液。液相梯度设置:0-68min 6%~23%b;68-82min 23%~32%b;82-86min 32%~80%b;86-90min 80%b,流速维持在500nl/min。肽段经由超高效液相系统分离后被注入nsi离子源中进行电离,然后进入orbitrapexploris
tm
480质谱进行分析。离子源电压设置为2.3kv faims补偿电压(设置为-45v,,-65v),肽段母离子及其二级碎片都使用高分辨的orbitrap进行检
测和分析。一级质谱扫描范围设置为400-1200m/z,扫描分辨率设置为60000;二级质谱扫描范围固定起点为110m/z,二级扫描分辨率设置为15000,turbotmt设置为off。数据采集模式使用数据依赖型扫描(dda)程序,即在一级扫描后选择信号强度最高的前25肽段母离子依次进入hcd碰撞池,使用27%的碎裂能量进行碎裂,同样依次进行二级质谱分析。为了提高质谱的有效利用率,自动增益控制(agc)设置为100%,信号阈值设置为5e4 ions/s,最大注入时间设置为auto,串联质谱扫描的动态排除时间设置为20s避免母离子的重复扫描。
[0080]
二级质谱数据使用proteomediscoverer(v2.4.1.15)进行检索。检索参数设置:数据库为表1显示的所有物种数据库,添加了反库以计算随机匹配造成的假阳性率成的假阳性率(fdr),并且在数据库中加入了常见的污染库,用于消除鉴定结果中污染蛋白的影响;酶切方式设置为trypsin(full);漏切位点数设为2;肽段最小长度设置为6个氨基酸残基;肽段最大修饰数设为3;一级母离子质量误差容忍度设为10ppm,二级碎片离子的质量误差容忍度为质量误差容忍度为0.02da。将carbamidomethyl(c)设置为固定修饰,将oxidation(m),acetyl(n-terminus),met-loss(m),metmet-loss+acetyl(m)设置为可变修饰。蛋白,肽段,psm鉴定的fdr都设置为都设置为1%。
[0081]
为了提高该数据库所包含的蛋白规模,在蛋白数据库搜索时,本方案选取了多种相关物种的数据库进行整合(表1),其中包括了所有可能与燕窝和掺假物相关的物种,与燕窝有关的物种包括烟囱雨燕(chaetura pelagica),凤头树燕(hemiprocne comata),家燕(hirundo rustica rustica)。
[0082]
[0083]
利用该数据库,在3次重复上样中共鉴定出了1167个蛋白和5435个肽段(如图2所示),在相对应的物种中,鉴定到蛋白数目最多的为大豆,此外,还鉴定出了烟囱雨燕、凤头雨燕和家燕的相应蛋白(如图3所示)。
[0084]
该实施例建立了一个燕窝蛋白和肽段溯源数据库,此数据库包含了在燕窝生产过程中可能引入的所有蛋白和肽段,并给出了它们的物种归属。该数据库可用于燕窝是否掺假的鉴别,如在样品中检测到不属于烟囱雨燕、凤头雨燕和家燕的肽段,则可以认为燕窝样本中掺入了伪品。
[0085]
实施例2:基于胶内酶切-蛋白质组学的燕窝蛋白鉴定
[0086]
为了鉴定不同分子量燕窝蛋白的特征并进行燕窝标志性肽段的筛选,本实施例进行了胶内酶切-蛋白质组学鉴定。首先对不同燕窝原料(y1-y8)和成品(c1,j1,j3)进行了聚丙烯酰胺凝胶电泳(sds-page)。从电泳谱图中可以看到不同分子量的燕窝蛋白分布,原料和成品在100-150kda均有较大条带(如图4所示)。
[0087]
此后,对不同条带(条带1-8)分别进行了切胶、还原、烷基化以及胶内酶切,并进行了蛋白质组学分析。在数据库搜索过程中,同时搜索了烟囱雨燕、凤头雨燕和家燕的数据库,与前期方案一致。结果表明,在三种不同物种的数据库中分别鉴定了8,9,23个不同的蛋白质(图5)。不同条带中也鉴定出了不同数目的蛋白,在条带1-8中分别鉴定出了9,18,11,24,11,7,15,12个蛋白,以及23,31,33,32,15,11,32,18条肽段(表2)。将不同条带中鉴定出的蛋白与其分子量进行比对(表3),在不同的位置分别找出了chia chitinase,acidic mammalian chitinase,lysyl oxiase homolog,muc5ac等蛋白。
[0088]
研究方法:
[0089]
分别对燕窝原料(y1-y8)和成品(c1,j1,j3)进行蛋白提取,获得对应的燕窝蛋白溶液。提取方法如下:
[0090]
先将样品在液氮中研磨成干粉,称取干粉0.15-0.2g,加入5ml 8m尿素混匀,取1ml超声破碎,15000g离心30min,取上清液。上清液加入5倍量的冷乙腈沉淀蛋白,4h后800rpm离心10min,倒掉上清,沉淀用冷乙腈洗涤一次,用8m尿素或50mm碳酸氢铵(abc)重悬,之后用bca蛋白定量试剂盒进行蛋白质浓度测定。
[0091]
向不同的燕窝蛋白溶液中加入上样缓冲液loading buffer(5
×
),95℃金属浴处理5-10min。将煮好的样品加入sds-page中进行凝胶电泳。电压:0-15min 80v;15-70min 120v。将凝胶使用考马斯亮蓝染液染色并用脱色液脱色。
[0092]
将已脱色并提取图片的胶用高纯水清洗两次,根据图片确定需要切的部分,准备1.5ml离心管。用乙醇冲洗离心管,静置后移去管底存液。用乙醇冲洗玻璃板,刀片和一个100μl枪头,静置待干。换新手套,将胶置于玻璃板上切下所需部分,并切成1-1.5mm见方的小粒,装进相应管子。
[0093]
加500μl脱色剂(50%acn 25-50mm abc)稍作涡旋,低速震荡脱色。待胶粒全部为无色透明,离心并去除液体。加500μl脱水剂(acn)稍作涡旋,低速震荡10min或置于冰箱中脱水。待胶粒全部为白色,离心并去除液体。加10mm 50μl dtt(或1mm胶带10μl的比例),56℃下孵育30-40min。离心去除液体。加55mm 50μl iaa(或1mm胶带10μl的比例)室温下黑暗中孵育60min。离心去除液体,用500μl高纯水清洗胶粒,涡旋,离心去除液体。加500μl脱水剂,稍作涡旋,低速震荡10min,待胶粒为白色,离心并去除液体。按每1mm胶粒为1μl计,加足
够的胰蛋白酶(1-10ng/μl 50mm abc),放冰箱45-60min充分溶胀,按每1mm胶条2μl比例加入50mm abc,30℃孵育过夜,12-16h。
[0094]
加50μl提取液(50%acn 5%fa),室温下高速震荡25min,离心并将液体移入新标注好的1.5ml离心管。重复提取一次,合并提取液,真空离心浓缩。
[0095]
上样前,将样品用液相色谱流动相a相溶解后15000rpm离心45min,取上清液至样品瓶。使用easynlc1200超高效液相系统进行分离。流动相a为含0.1%甲酸的水溶液;流动相b为含0.1%甲酸的乙腈。液相梯度设置:0-2min4%~12%b;2-23min 12%~30%b;23-27min 30%~50%b;27-28min 50%-100%b,流速维持在300nl/min。肽段经由超高效液相系统分离后被注入nsi离子源中进行电离,然后进入orbitrap fusion lumos质谱进行分析。离子源电压设置为2.2kv,肽段母离子及其二级碎片都使用高分辨的orbitrap进行检测和分析。一级质谱扫描范围设置为375-1500m/z,扫描分辨率设置为120000;二级质谱扫描范围固定起点为100m/z,二级扫描分辨率设置为30000。数据采集模式使用数据依赖型扫描(dda)程序,即在一级扫描后选择信号强度最高的前25肽段母离子依次进入hcd碰撞池,使用30%的碎裂能量进行碎裂,同样依次进行二级质谱分析。为了提高质谱的有效利用率,自动增益控制(agc)设置为100%,信号阈值设置为5e4 ions/s,最大注入时间设置为100ms,串联质谱扫描的动态排除时间设置为30s避免母离子的重复扫描。
[0096]
二级质谱数据使用pfind3进行检索。检索参数设置:数据库为chaetura pelagica+hemiprocne comata+hirundo rustica rustica,添加了反库以计算随机匹配造成的假阳性率成的假阳性率(fdr),并且在数据库中加入了常见的污染库,用于消除鉴定结果中污染蛋白的影响;酶切方式设置为trypsin(full);漏切位点数设为3;肽段最小长度设置为6个氨基酸残基;肽段最大修饰数设为3;一级母离子质量误差容忍度设为20ppm,二级碎片离子的质量误差容忍度为质量误差容忍度为0.02da。将carbamidomethyl(c)设置为固定修饰,将oxidation(m),acetyl(anyn-term),met-loss(proteinn-termm),
[0097]
metmet-loss+acetyl(proteinn-termm)设置为可变修饰。蛋白,肽段,psm鉴定的fdr都设置为都设置为1%。
[0098]
[0099][0100]
实施例3:燕窝特征性肽段的筛选
[0101]
本实施例进行了燕窝特征性肽段的筛选,为了挑选可能用于鉴别的标志性肽段,对01-08样本进行了合并搜库,数据库来源及搜库参数同实施例1。总共鉴定出了42个蛋白和130条肽段。在蛋白中按照匹配到该蛋白的肽段数(psm)进行排序,选取了psm≥10的12个蛋白,其中最大psm为62。其中出现了名称类似或相同的蛋白,原因是它们的物种不同。
[0102][0103]
列出了匹配到这些蛋白的所有肽段。并进一步根据肽段序列去除重复,方法是只要序列相同就认为是同一条肽段,仅保留蛋白序号小的一个数据。在12个蛋白中得到了68条不同的肽段。
[0104]
为了进一步缩小候选肽段的数量,将这68条肽段与3.1.1中真伪建库数据(base库)中鉴定到的肽段进行比较,找出了28条在base库中也被鉴定出的肽段,其中21条肽段三次都被鉴定出来。这21条肽段可以作为燕窝的标志性肽段(如图6所示),它们分别来自于不同的燕窝蛋白。
[0105]
本发明从燕窝中鉴定出了21个特征性肽段,大大丰富了燕窝特征性肽段的数目。
克服了现有技术中蛋白质组学搜索的物种数据库偏少、信息少的缺陷。本发明的筛选方法基于蛋白质组学技术,利用胶内酶切方法鉴定了不同分子量的燕窝蛋白和肽段,并且建立了一种燕窝特征性肽段的筛选方法。该技术可以判断不同分子量的燕窝蛋白和肽段信息,可靠性高。
[0106]
虽然已经详细说明了本发明及其优点,但是应当理解在不超出由所附的权利要求所限定的本发明的精神和范围的情况下可以进行各种改变、替代和变换。而且,本技术的范围不仅限于说明书所描述的过程、设备、手段、方法和步骤的具体实施例。本领域内的普通技术人员从本发明的公开内容将容易理解,根据本发明可以使用执行与在此所述的相应实施例基本相同的功能或者获得与其基本相同的结果的、现有和将来要被开发的过程、设备、手段、方法或者步骤。因此,所附的权利要求旨在它们的范围内包括这样的过程、设备、手段、方法或者步骤。
[0107]
[0108]
[0109]
[0110]
[0111]
[0112]
[0113]
[0114]
[0115]
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1