病毒和抗原纯化和偶联的制作方法
病毒和抗原纯化和偶联
1.相关申请的交叉引用
2.本国际专利申请要求2019年12月10日提交的美国非临时专利申请第16/709,063号的优先权和权益,该申请为部分继续申请,并要求2019年6月11日提交的美国非临时专利申请第16/437,734号的优先权和权益,该申请要求2018年6月12日提交的美国临时专利申请序列号62/683,865的优先权和权益,其教导和全部公开均通过引用纳入本文。
技术领域
3.本文所述的实施方式包括用于生产高度纯化的重组病毒作为抗原运载体的多重(multi-set)过程的应用,并且进一步的各种实施方式涉及使用纯化的病毒和纯化的抗原的疫苗生产。
背景技术:
4.病毒在蛋白质外壳中具有核酸分子,仅在其他生物体的活细胞内复制。通常被认为是有害的,各种病毒能够感染所有类型的生命形式,例如人、牲畜和植物。然而,从积极的一面来看,人们越来越有兴趣将病毒用于一系列治疗目的,包括但不限于疫苗创造、基因治疗和癌症治疗,举几个为例。然而,为了研究病毒,了解其结构,并使病毒适用于分子工具以及疾病治疗载体和运载体,必须首先纯化病毒以去除任何细胞碎片、大分子纤维、细胞器、脂质及其他会干扰病毒预期功能的杂质。
5.纯化后,病毒适合用于多种用途。与当前公开内容有关的一个传统观念是使用病毒(在本文中被视为病原体)来研究和开发针对病毒的遗传学策略。但在本
技术实现要素:
中进一步讨论的是使用纯化的病毒作为抗原运载体来制备疫苗。抗原是分子,当适当地递送至生物体时,能够通过与生物体内的与抗原分子结构匹配的抗体结合来刺激抗体产生,从而在该生物体中产生免疫应答。由重组dna产生重组抗原,将其通过已知技术克隆到载体中,然后将其导入特定的宿主细胞,例如细菌、哺乳动物细胞、酵母细胞和植物细胞等中。然后利用宿主细胞的翻译器表达重组抗原。表达后,重组抗原可被收集并通过称为偶联的过程通过共价键附接至病毒。抗原与病毒偶联后,病毒可充当运载体以将抗原递送至生物体并激活免疫系统应答。这样,病毒-抗原偶联物可以提供治疗用途。抗原需要适当的病毒-抗原偶联来激活免疫应答,其在源生物的宿主细胞中产生抗体。病毒和抗原的纯化可以促进这种适当的偶联。
6.目前纯化病毒的方法通常仅限于以较小的生化量使用,例如以纳克至毫克的数量级,并且尚未在以克至千克的数量级的工业量中得到证明。例如,先前使用的被称为“粗感染细胞裂解物”的方法利用来自病毒感染细胞的粗细胞裂解物或细胞培养基。通过冻融或其他已知方法将感染的哺乳动物细胞裂解,通过低速离心去除碎片,然后将上清液用于实验。将完整的受感染的生物体破裂或进行物理研磨,使用离心或过滤澄清所产生的提取物以产生粗制病毒制剂。然而,这种方法受到许多非病毒因素的高度污染,影响了进行实验和操纵病毒的能力。
7.现有的纯化步骤的第二个例子是高速超速离心,通过该方法将病毒沉淀,或通过用低密度蔗糖溶液沉淀而进一步纯化,或悬浮在各种密度的蔗糖溶液之间。该方法的限制包括由于高速分离的有限的大小和可扩展性而只能少量地生产纯化的病毒,以及由于经常与病毒样品共纯化的其他宿主蛋白质而导致病毒纯度低下。
8.以前用于提高病毒纯度的第三种方法是密度梯度超速离心法。在这种方法中,氯化铯、蔗糖、碘克沙醇或其他溶液的梯度被用来分离组装的病毒颗粒或去除缺乏遗传成分的颗粒。这种方法的限制包括纯化病毒所需的时间(通常为2-3天),样品数量有限,一次可以分析的样品数量(每个转子通常为6个),以及可以纯化的病毒量少(通常为几微克至几毫克的最终产物)。
9.有机提取和聚乙二醇沉淀也已用于纯化病毒,包括从植物中纯化病毒,例如通过去除脂质和叶绿体。然而,这些已知方法同样存在纯度低下的问题,产物通常仍附着于宿主蛋白质、核酸、脂质和糖上,这导致所得病毒产物强烈地聚集。这些限制降低了最终产品符合美国食品和药物管理局(fda)执行的现行良好生产规范(cgmp)法规的效用。
10.fda颁布的现行cgmp法规包含对药品的制造、加工和包装中使用的方法、设施和控制的最低要求。这些法规旨在确保产品的安全性,并确保其具有它所声称的成分和强度。因此,对于用于疫苗生产、基因治疗、癌症治疗及其他临床环境的病毒,最终的病毒产品必须符合cgmp法规。如果最终的病毒产品不符合cgmp法规,如来自聚乙二醇沉淀法的产品,那么它在临床上使用的效用要么不存在,要么被大大削弱。
11.可扩展性是指即使产品量增加,例如从实验室规模(<0.1平方米)增加到至少>20平方米的系统,仍可一致地且可重现地生产相同产品的过程。以上所确定的先前使用的方法均存在缺乏一致性、可扩展性低(即仅以生化量生产产品)、以及不符合cgmp法规的问题。
12.在大规模生产方面,基于植物的生产受到关注,尽管其应用存在明显的限制。基于植物的生产系统能够以比动物细胞生产系统(如中国仓鼠卵巢(cho))低得多的成本产生工业规模的产量。然而,在一些规模下适用于非植物病毒的某些常规纯化方法却不能用于植物制的病毒和抗原。这些限制是由于纯化植物病毒与纯化动物细胞培养物中的病毒之间存在大量差异而产生的。虽然动物细胞产生主要的蛋白质和核酸杂质,但植物也是动物细胞中所没有的重要和额外的杂质的来源。其中一些包括叶绿体膜和液泡膜的脂质成分,简单和复杂的碳水化合物杂质,以及纳米颗粒状的细胞器杂质。事实上,粗制植物提取物经常会弄脏用于处理和纯化从植物中获得的病毒和抗原物质的设备,例如,由于杂质在主要介质床或设备的分离膜上的积累。这种污垢不可避免地导致压力流动失败,过滤效果差,最终导致产品产量低。另一个问题是这些杂质倾向于聚集,并能够与植物所需的任何蛋白质、病毒或其他“产品”共纯化。因此,目前纯化病毒的方法不会充分去除所有或甚至足够量的杂质,包括但不限于在植物提取物中发现的杂质,也没有证明能适当地产生纯化的病毒。
13.因此,非常需要病毒和抗原纯化平台,其始终能够以符合cgmp法规的方式以商业规模(即克级至千克级或更高)生产高纯度的病毒。这样的改进将允许临床开发,以便在疫苗创造、基因治疗和癌症治疗中使用工具。与本文概述的其他特征和优点一起,本文描述的根据多个实施方式和替代性方式的平台满足了这一需求和其他需求。
14.发明内容概述
15.在根据本公开的一些实施方式中,病毒纯化方法涉及多重过程,包括:从源生物体中收获含有至少一种病毒的病毒材料;从至少一种病毒中去除细胞碎片,从而阐明至少一种病毒的结构;将分离并澄清的病毒浓缩,其在一些实施方式中用包括膜的过滤装置进行,该膜所具有的孔的尺寸不超过使用者选择的预定限值;通过对浓缩的病毒进行一系列分离程序并在每个分离程序后收集病毒来对其进行加工,其中至少一个分离程序包括离子交换色谱法,其从病毒中分离宿主细胞污染物,并且至少一个分离程序包括多峰色谱法,其至少根据病毒和杂质之间的尺寸差异以及杂质与一种或多种色谱配体之间发生的化学相互作用,从病毒中分离残留的杂质。在一些实施方式中,植物是经历病毒的重组表达的源生物体,作为非限制性实例有本氏烟草(nicotiana benthamiana)和浮萍(lemna minor)。当源生物体是植物时,收获可以包括种子生产和植物萌发,并诱导瞬时基因表达以形成所需蛋白质,如下所述。或者,经历病毒的重组表达的源生物体是非植物宿主,例如但不限于细菌、藻类、酵母、昆虫或哺乳动物生物体。
16.另外,本文所述的多个实施方式的各个方面涉及产生和/或纯化可与病毒颗粒偶联的抗原。在本实施方式和替代方式中,病毒颗粒包括但不限于病毒和/或其片段中的一种、一些或全部,如杆状病毒、二十面体病毒、包膜病毒以及上述一种或多种的片段。在一些实施方式中,植物是经历抗原的重组表达的源生物体;或者,经历抗原的重组表达的源生物体是非植物宿主,例如但不限于细菌、藻类、酵母、昆虫或哺乳动物生物体。
17.有利地,根据本文所述的各种实施方式实施的多重过程以商业规模产生高度纯化的病毒和/或重组抗原。采用各种步骤来改进上游纯化工艺,例如富集植物病毒。一些实施方式利用尺寸排阻色谱法以及其他特征来产生纯化的重组病毒和重组抗原。因此,本文所述的各种实施方式提供了一种或多种病毒和一种或多种抗原,适合于制备一种或多种偶联的病毒和抗原的疫苗。
18.关于病毒,通过实施本文所述的本发明的病毒纯化平台的一些实施方式,已实现杆状植物病毒(例如烟草花叶病毒,即“tmv”)和二十面体植物病毒(例如红三叶草花叶病毒)的纯化。根据本文的多个实施方式,实现了tmv和红三叶草花叶病毒的纯化,就尺寸和结构而言代表两种结构上有所差别的病毒。例如,像红三叶草花叶病毒这样较小的二十面体病毒具有t=3的对称性,尺寸大约为31-34nm,约180个衣壳蛋白。相反,tmv的直径约为18nm,长度为300nm,含有2160个衣壳蛋白。鉴于这种的差别,本发明的过程已经基于两种结构上不同的病毒进行了工作,以允许病毒穿透至渗透物中而同时保留不需要的细胞碎片。在使用中,可以控制操作参数,以使所有类型的病毒都穿透至渗透物中而同时保留叶绿素/细胞碎片,并且切向流(tff)系统继续高效运行,而不会不适当地或不合时宜地发生污染。额外的tff步骤被设计用来保留病毒,同时允许较小的蛋白质进入渗透物,双色谱步骤被控制用来排除大的和小的病毒,同时捕获宿主细胞蛋白质、宿主细胞dna、内毒素和植物多酚类。
19.基于红三叶草花叶病毒和tmv的成功纯化,预计根据多个实施方式和替代方式的病毒纯化平台可以成功纯化多种病毒颗粒,包括:病毒,其包括的范围有遗传物质(例如双链和单链dna病毒以及rna病毒)、几何形状(例如杆状、弯曲杆和二十面体)以及科(花椰菜病毒科(caulimoviridae)、双生病毒科(geminiviridae)、雀麦花叶病毒科(bromoviridae)、长线形病毒科(closteroviridae)、豇豆花叶病毒科(comoviridae)、马铃
薯y病毒科(potyviridae)、伴生病毒科(sequiviridae)、番茄丛矮病毒科(tombusviridae))。
20.预期本文所述的实施方式可在其上获得成功的非限制性病毒包括如下所述的属:杆状去氧核糖核酸病毒属(badnavirus)(如鸭跖草黄斑驳病毒);花椰菜花叶病毒属(caulimovirus)(如花椰菜花叶病毒);sbcmv样病毒(如大豆褪绿斑驳病毒);csvmv样病毒(如木薯叶脉花叶病毒);rtbv样病毒(如水稻东格鲁杆状病毒);碧冬茄脉明样病毒(如碧冬茄脉明病毒);玉米线条病毒属(mastrevirus)(双生病毒亚组i)(如玉米线条病毒)和曲顶病毒属(curtovirus)(双生病毒亚组ii)(如甜菜曲项病毒)和菜豆金色花叶病毒属(begomovirus)(双生病毒亚组iii)(如菜豆金色花叶病毒);苜蓿花叶病毒属(alfamovirus)(如苜蓿花叶病毒);等轴不稳环斑病毒属(ilarvirus)(如烟草线条病毒);雀麦花叶病毒属(bromovirus)(如雀麦花叶病毒);黄瓜花叶病毒属(cucumovirus)(如黄瓜花叶病毒);长线形病毒属(closterovirus)(如甜菜黄化病毒);毛形病毒属(crinivirus)(如莴苣传染性枯黄病毒);豇豆花叶病毒属(comovirus)(如豇豆花叶病毒);蚕豆病毒属(fabavirus)(如蚕豆萎蔫病毒1);多角体病毒属(nepovirus)(如烟草环斑病毒);马铃薯y病毒属(potyvirus)(如马铃薯y病毒);黑麦草花叶病毒属(rymovirus)(如黑麦草花叶病毒);大麦黄花叶病毒属(bymovirus)(如大麦黄花叶病毒);伴生病毒属(sequivirus)(如欧防风黄点病毒);矮化病毒属(waikavirus)(如水稻东格鲁球状病毒);香石竹斑驳病毒属(carmovirus)(如香石竹斑驳病毒);香石竹环斑病毒属(dianthovirus)(如香石竹环斑病毒);玉米褪绿斑驳病毒属(machlomovirus)(如玉米褪绿斑驳病毒);坏死病毒属(necrovirus)(如烟草坏死病毒);番茄丛矮病毒属(tombusvirus)(如番茄丛矮病毒);发形病毒属(capillovirus)(如苹果茎沟病毒);香石竹潜隐病毒属(carlavirus)(如香石竹潜隐病毒);耳突花叶病毒属(enamovirus)(如豌豆耳突花叶病毒);真菌传杆状病毒属(furovirus)(如小麦土传花叶病毒);大麦病毒属(hordeivirus)(如大麦条纹花叶病毒);悬钩子病毒属(idaeovirus)(如悬钩子丛矮病毒);大麦黄矮病毒属(luteovirus)(如大麦黄矮病毒);玉米雷亚朵非纳病毒属(marafivirus)(如玉米雷亚朵非纳病毒);马铃薯x病毒属(potexvirus)(如马铃薯x病毒和三叶草花叶病毒);南方菜豆花叶病毒属(sobemovirus)(如南方菜豆花叶病毒);纤细病毒属(tenuivirus)(如水稻条纹病毒);烟草花叶病毒(tobamovirus)(如烟草花叶病毒);烟草脆裂病毒属(tobravirus)(如烟草脆裂病毒);纤毛病毒属(trichovirus)(如苹果褪绿叶斑病毒);芜菁黄花叶病毒属(tymovirus)(如芜菁黄花叶病毒);以及幽影病毒属(umbravirus)(如胡萝卜斑驳病毒)。
21.已经以商业规模完成了成功的病毒纯化,并符合cgmp法规。在一些实施方式中,源生物体是植物,但尽管本实施方式的一些变体包括产生基于植物的病毒,本文所述的实施方式不限于在植物中制造或纯化病毒。在一些实施方式中,病毒纯化平台首先让植物在受控的生长室中生长,通过病毒复制感染植物,用破碎器破碎细胞并通过螺旋挤出从液体中去除植物纤维,藉此回收病毒。
22.在同时涉及基于植物的病毒和非植物病毒的一些实施方式中,纯化步骤包括使用切向流系统将澄清的提取物浓缩,其中,盒的孔径、跨膜压力和每平方米膜表面积的澄清提取物载量是受控的。跨膜压力(tmp)是分离膜上游和下游两侧的压力差,根据以下公式计算:((进料压力+截留压力)/2)-渗透压力。为了确保病毒穿过陶瓷以产生澄清的提取物,在
一些实施方式中,对进料压力、截留压力和渗透压力分别进行控制以获得合适的tmp。澄清的提取物用离子交换柱体积进一步浓缩,并用离子交换色谱平衡缓冲液进行洗涤。在一些实施方式中,使capto q离子交换柱达到平衡,将进料上样并收集在流穿级分中。然后将柱洗涤至基线,并用高盐将宿主细胞污染物从柱上剥离。
23.在与基于植物的病毒有关的一些实施方式中,在使用切向流陶瓷过滤去除叶绿素及其他大细胞碎片如大分子纤维、细胞器、脂质等之前,添加提取缓冲液。在一些实施方式中,陶瓷过滤促进了植物宿主的叶绿素、细胞碎片和其他杂质的截留,同时优化了病毒的穿过。无论是基于植物的病毒还是非植物病毒,这种方法(其中所需物质(病毒或抗原)都作为渗透物穿过,杂质作为截留物保留下来)均可提高工艺的可扩展性。此外,跨膜压力、陶瓷孔径和每平方米载荷的生物量等参数都是受控的,以确保病毒穿过陶瓷,形成澄清的提取物。陶瓷tff系统具有高度可扩展性,并且可容易地缩放诸如tmp、错流速度、孔径和表面积之类的参数,以接受更大量的生物质。额外的陶瓷模块可以很容易地添加到系统中。也可以控制进料、截留和渗透压力,以维持高效的错流速度,从而几乎不污染系统。在一些实施方式中,设定并控制错流速度和压力差,以产生约10-20psi的tmp,以使较小和较大规模的病毒能够高效地穿过。陶瓷tff系统可以经受住高效的清洁化学品,如硝酸、漂白剂和氢氧化钠,允许进行清洁研究,满足gmp要求。
24.无论是基于植物的病毒还是非植物病毒,根据多个实施方式和替代方式的纯化方法、以及与可扩展的高通量病毒纯化方法的开发相一致的其他方法中,采用至少一种使用多峰色谱法的分离程序,至少根据病毒和杂质之间的尺寸差异以及杂质与一种或多种色谱配体之间发生的化学相互作用,从病毒中分离残留的杂质。例如,用core 700色谱树脂(ge医疗生命科学公司(ge healthcare bio-sciences))进行至少一个分离过程包括于本实施方式的范围内。core 700
‘
珠’包括辛胺配体,其设计为具有疏水性和正电荷性,可捕获一定大小的分子,例如700千道尔顿(kda)。因为某些病毒非常大(例如大于700kda),而珠外部是不活跃的,core 700允许通过尺寸排阻法纯化病毒,其中所需物质(病毒或抗原)作为渗透物穿过,杂质作为截留物保留。
25.在一些实施方式中,同样是对于基于植物的病毒和非植物病毒,都在多峰色谱柱之前用五倍柱体积的平衡缓冲液进行平衡。在一些实施方式中,将来自capto q离子交换色谱的合并的流穿级分和洗涤级分上样到多峰色谱柱上,并将病毒收集在柱的空白体积中。将柱洗涤至基线,并用高电导率氢氧化钠剥离。一些实施方式的方面提供了在该步骤期间控制上样比例、柱床高度、停留时间和色谱缓冲液。
26.将纯化的病毒例如通过渗滤进行无菌过滤,并储存。
27.关于抗原,通过实施本文所述的本发明的抗原纯化平台的一些实施方式,产生并纯化了重组抗原h5重组流感血凝素(rha)、h7 rha、西尼罗河病毒的结构域iii(wnv rdiii)和拉沙热病毒重组蛋白1/2(lfv rgp1/2),h1n1(甲型流感(influenza a)/密歇根(michigan))、h1n1(甲型流感/布里斯班(brisbane))、h3n2(甲型流感/新加坡(singapore))、h3n2(甲型流感/堪萨斯(kansas))、b/科罗拉多(colorado)和b/普吉岛(phuket)。本文各种实施方式的抗原可以有很多来源,可以使用传统的重组蛋白制造策略,包括细菌、酵母、昆虫、哺乳动物或基于植物的表达方法来生产。
28.在一些实施方式中,抗原制造平台首先让植物在受控的生长室中生长,感染植物
以进行重组抗原复制,接着使用破碎器回收抗原,然后通过螺旋挤出从水性液体中去除纤维。加入提取缓冲液,以协助通过过滤去除叶绿素(在植物的情况下)和大的细胞碎片。无论是基于植物的还是非植物抗原,进料压力、过滤孔径、澄清剂和每平方米膜表面载荷的生物量都是受控的,以促进抗原穿过过滤器。对适合实现大规模病毒和抗原纯化的各种过程中控制的描述(尽管是非限制性的),在实施例部分进一步详细表述。
29.在一些实施方式中,对于基于植物的抗原和非植物抗原,随后都用切向流系统将澄清的提取物浓缩。在这个任选的步骤中,包括盒的孔径、跨膜压力和每平方米膜表面的澄清提取物的载荷等因素都是受控的。在一些实施方式中,任选步骤被完全跳过。在这之后,澄清的提取物接下来被浓缩,并用离子交换色谱平衡缓冲液进行清洗。进行这一步骤的一种方法是将进料装入平衡的capto q离子交换柱,然后用平衡缓冲液洗涤,用盐洗脱/剥离。然后将抗原级分收集在洗脱物中,以备钴固定化金属亲和色谱(imac)。平衡imac,进料,然后用平衡缓冲液洗涤并洗脱。稀释洗脱级分并检测ph,然后将其上样到多峰陶瓷羟基磷灰石(cht)色谱柱上。用平衡缓冲液平衡cht树脂,并洗脱抗原。上样比例、柱床高度、停留时间和色谱缓冲液是受控的因素。最后,抗原被浓缩,并用生理盐水缓冲液进行渗滤。重组抗原被灭菌过滤,然后储存。
30.再者,根据本文公开的各种实施方式,已经成功地偶联了以下单价制剂:h7 rha偶联至tmv、h1n1(甲型流感/密歇根)偶联至tmv、h3n2(甲型流感/新加坡)偶联至tmv、h3n2(甲型流感/新加坡)偶联至tmv、b/科罗拉多偶联至tmv以及b/普吉岛偶联至tmv。根据本文的多种实施方式,tmv与两种乙型流感(influenza b)病毒(b/科罗拉多和b/普吉岛)的二价制剂也已成功偶联,以及tmv与h1n1(甲型流感/密歇根)、h3n2(甲型流感/新加坡)、b/普吉岛和b/科罗拉多的四价偶联也已成功偶联。“四价”流感疫苗旨在预防四种不同的流感病毒:两种甲型流感病毒和两种乙型流感病毒。多年来,三价疫苗被普遍使用,但现在四价疫苗是最常见的,因为它们可能通过增加另一种乙型病毒而对循环的流感病毒提供更广谱的保护。在一些实施方式中,根据多个实施方式和替代方式,所述蛋白质由能够与病毒偶联以产生疫苗、然后被递送至源生物体以产生免疫应答的任何类型的治疗剂组成。因此,本文的发明提供了包含一系列病毒-蛋白质偶联物的组合物,其包括病毒-抗原偶联物。在一些实施方式中,所选择的病毒是tmv或由本文的技术启示认识和/或指示的多种病毒中的任何一种。此外,在一些实施方式中,蛋白质可以是抗原,例如但不限于流感血凝素抗原(ha),包括但不限于本段中列出的抗原。在一些实施方式中,ha表现出至少约50%的三聚体形成。ha在临床上很重要,因为它们趋于被生物体产生的某些抗体所识别,提供了对多种流感感染的主推力保护。因为ha的抗原性,所以ha的免疫原性与构象有关,已知ha三聚化在引发免疫应答方面优于单体形式。
31.在一些实施方式中,偶联首先将纯化的抗原和病毒浓缩并渗滤至微酸性缓冲液中。然后基于摩尔浓度将抗原和病毒组合并混合。将新鲜制备的水溶性碳二亚胺,例如1-乙基-3-(3-二甲基氨基丙基)碳二亚胺(也称为edc)添加到混合物中,并同时基于摩尔浓度混合。然后基于摩尔浓度添加用于将羧基转化为可与胺反应的n-羟基磺基琥珀酰亚胺酯的化学试剂,例如赛默飞世尔公司(thermofisher)的sulfo-nhs。继续反应直到预定的停止时间。然后将反应淬灭,其中一个示例涉及添加胺基(例如含有游离胺的液体),并通过多峰色谱步骤或渗滤去除用于促进反应的任何化学接头(例如edc、sulfo-nhs),然后将混合物稀
释至目标浓度。在一些实施方式中,用蛋白质和抗原装饰的偶联和纯化的病毒颗粒可用于疫苗和/或诊断工具。这些颗粒可以用作诊断工具,因为它们有能力追踪宿主生物体内的抗原。
32.在一些实施方式中,除本文公开的各种实施方式外,纯化的病毒-抗原融合物还可源自基因融合物。抗原和病毒结构蛋白(位于外壳中)形成单一的连续开放阅读框。在一些实施方式中,该阅读框在植物中产生抗原-外壳蛋白质,使得外壳蛋白自我组装成病毒颗粒。接下来,根据本文公开的实施方式,收获植物材料并纯化病毒颗粒。然后,根据所公开的各种实施方式,用融合外壳蛋白装饰的病毒颗粒可用作疫苗和/或诊断工具。
33.一些病毒(例如作为非限制性实例的二十面体病毒)在某些ph条件下溶胀,并且在一些实施方式中,该“溶胀”可用于偶联。根据多个实施方式和替代方式,纯化的病毒可以通过将病毒结构置于酸性ph条件下,使病毒“膨胀(swell)”,从而偶联至治疗剂。通过用中性ph条件处理病毒结构,病毒结构松弛并在病毒的五聚体或其他结构亚基之间形成孔。接着,将治疗剂(例如化疗剂)添加到缓冲液中,并使其扩散至松弛的病毒颗粒中。通过再次改变ph值,病毒颗粒会收紧并去除将五聚体或结构亚基包装在一起的孔结构,从而防止化学物扩散进入或流出病毒颗粒。接下来,根据本文公开的实施方式,收获植物材料、纯化病毒颗粒,并将含有治疗剂的病毒颗粒用于药物递送。
34.因此,多个实施方式和替代方式包括一种或多种高度纯化的病毒的产生。更进一步地,多个实施方式和替代方式涵盖了重组抗原的生产或纯化或二者都有。更进一步地,多个实施方式和替代方式涵盖纯化的抗原和病毒的偶联,以用作疫苗。根据本发明的实施方式,病毒的纯化可以自身实施。同样地,重组抗原的生产或纯化也可以根据本发明的实施方式单独进行。任选地,这些多个实施方式的不同方面也可以组合,其中除其他实施这些实施方式的方法外,组合的实施方式将包括:从一种或多种源生物体开始,从中产生一种或多种病毒和一种或多种抗原,然后纯化该病毒和抗原,然后形成疫苗,该疫苗是至少一种抗原和至少一种病毒之间的偶联物。
35.附图简要说明
36.本文所述的附图和实施方式说明了本文公开的多个实施方式和替代方式的多个替代结构、方面和特征,并且它们不应被理解为限制这些实施方式和替代方式中的任一个的范围。还应理解,本文描述和提供的附图并不是按比例绘制的,并且本发明的实施方式并不限于所示的精确设置、描述和工具。
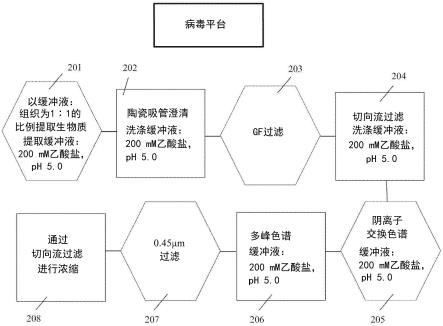
37.图1是显示根据多个实施方式和替代方式的,在本公开范围内的特定病毒纯化平台中的步骤的流程图。
38.图2是根据多个实施方式和替代方式的,纯化的二十面体红三叶草花叶病毒。
39.图3是根据多个实施方式和替代方式的,二十面体红三叶草花叶病毒的纯化物的蛋白质印迹分析。
40.图4是根据多个实施方式和替代方式的,纯化的二十面体红三叶草花叶病毒。
41.图5是根据多个实施方式和替代方式的,二十面体红三叶草花叶病毒的纯化物的蛋白质印迹分析。
42.图6是根据多个实施方式和替代方式的,纯化的杆状烟草花叶病毒。
43.图7是根据多个实施方式和替代方式的,杆状烟草花叶病毒的纯化物的蛋白质印
迹分析。
44.图8是显示根据多个实施方式和替代方式的抗原制造平台的步骤的流程图。
45.图9是显示根据多个实施方式和替代方式的抗原制造平台的一些步骤的蛋白质印迹分析。
46.图10是显示根据多个实施方式和替代方式的抗原制造平台的一些步骤的蛋白质印迹分析。
47.图11是显示根据多个实施方式和替代方式的抗原制造平台的一些步骤的蛋白质印迹分析。
48.图12是显示根据多个实施方式和替代方式的,通过抗原制造平台进行的各种抗原纯化的蛋白质印迹分析。
49.图13是根据多个实施方式和替代方式的,重组抗原偶联至病毒的图示。
50.图14是根据多个实施方式和替代方式的,抗原偶联至病毒的sds-page分析。
51.图15是根据多个实施方式和替代方式的,抗原偶联至病毒的sds-page分析。
52.图16是根据多个实施方式和替代方式的,抗原偶联至病毒的sds-page分析。
53.图17是根据多个实施方式和替代方式的,游离tmv产品的尺寸排阻高效液相色谱(sec-hplc)报告。
54.图18是根据多个实施方式和替代方式的,在病毒和抗原之间偶联15分钟的sec-hplc报告。
55.图19是根据多个实施方式和替代方式的,在病毒和抗原之间偶联2小时的sec-hplc报告。
56.图20是根据多个实施方式和替代方式的,病毒和抗原之间的偶联的蛋白质印迹分析。
57.图21是显示根据多个实施方式和替代方式的,用各种水平的uv辐射处理的病毒的感染性的图。
58.图22是根据多个实施方式和替代方式的,重组抗原与病毒的偶联平台的一些步骤的图示。
59.图23是根据多个实施方式和替代方式的,抗原偶联至病毒的sds-page分析。
60.图24是根据多个实施方式和替代方式的,重组抗原的负染色透射电子显微镜(tem)图像。
61.图25是根据多个实施方式和替代方式的,病毒的负染色tem图像。
62.图26是根据多个实施方式和替代方式的,与添加了病毒的另一种重组抗原偶联的重组抗原的负染色tem图像。
63.图27是根据多个实施方式和替代方式的,以1∶1的病毒:重组抗原比例与病毒偶联的重组抗原的负染色tem图像。
64.图28是根据多个实施方式和替代方式的,以1∶1的病毒:重组抗原比例与病毒偶联的重组抗原的负染色tem图像。
65.图29是根据多个实施方式和替代方式的,以4∶1的病毒:重组抗原比例与病毒偶联的重组抗原的负染色tem图像。
66.图30是根据多个实施方式和替代方式的,以16∶1的病毒:重组抗原比例与病毒偶
联的重组抗原的负染色tem图像。
67.图31是根据多个实施方式和替代方式的抗原的标准化沉降系数分布。
68.图32是根据多个实施方式和替代方式的病毒的标准化沉降系数分布。
69.图33是根据多个实施方式和替代方式的,以1∶1的病毒:重组抗原比例与病毒偶联的重组抗原的标准化沉降系数分布。
70.图34是根据多个实施方式和替代方式的,以1∶1的病毒:重组抗原比例与病毒偶联的重组抗原的标准化沉降系数分布。
71.图35是根据多个实施方式和替代方式的,以1∶1的病毒:重组抗原比例与病毒偶联的重组抗原的标准化沉降系数分布。
72.图36是根据多个实施方式和替代方式的,以4∶1的病毒:重组抗原比例与病毒偶联的重组抗原的标准化沉降系数分布。
73.图37是根据多个实施方式和替代方式的,以16∶1的病毒:重组抗原比例与病毒偶联的重组抗原的标准化沉降系数分布。
74.图38是根据多个实施方式和替代方式的,以各种病毒:重组抗原比例给予病毒-抗原产品之后的源生物体中抗原相关滴度的散点图。
75.图39是根据多个实施方式和替代方式的,显示以各种病毒:重组抗原比例给予病毒-抗原产品之后的源生物体中抗原相关滴度的几何平均数检验。
76.图40是根据多个实施方式和替代方式的,纯化的重组抗原的sds-page分析。
77.多个实施方式和替代方式
78.根据本文的多个实施方式和替代方式的多重过程改进了上游纯化工艺,进一步富集了植物病毒,并促进了病毒和抗原的偶联以形成疫苗。根据多个实施方式和替代方式生产和纯化病毒的步骤如表1和图1中列出并讨论。同样地,生产和纯化抗原的步骤如表2中列出并讨论。尽管多个平台都有下面描述的具体实施方式,但本文所包含的实施方式的范围不限于任何一个具体的实施方式。
79.病毒产生和纯化
80.表1和图1显示根据多个实施方式和替代方式的病毒纯化平台的步骤。
81.表1.病毒的产生和纯化
82.[0083][0084]
该纯化平台设计成有商业可扩展性并符合cgmp法规,并在整个纯化过程中使用一种缓冲液。根据多个实施方式和替代方式,给出了病毒纯化平台的步骤,与植物表达有关。然而,如下所述的在气生组织收获和细胞破碎之后的步骤也将适用于非植物病毒(除非上下文与植物明显相关,例如,提及去除植物纤维)。
[0085]
根据本文所述的多个实施方式和替代方式,病毒表达通过适合于特定宿主的方法完成。在一些实施方式中,基于病毒向植物宿主递送基因是通过修饰的tmv表达载体使烟草植物重组地形成病毒来完成的。一种此类可用替代方式是美国专利7,939,318“灵活的疫苗组装和疫苗递送平台”中描述的平台。该专利中描述的这种基于植物的瞬时表达平台采用了植物病毒tmv来利用植物蛋白生产机制,在接种后很短的收获时间内(例如,少于21天)表达各种病毒。接种了病毒基因的烟草植物在受感染的细胞中表达特定的病毒,并在收获时提取病毒。作为本文所述方法的使用者选择的例子,接种是通过对叶片表面
的手工接种、对植物床的机械接种、对叶片的高压喷雾或真空渗透进行的。
[0086]
除本氏烟草(nicotiana benthamiana)外,本公开还考虑了其他植物和非植物宿主,包括发明内容中提到的那些。除平台外,可以采用其他策略将基因递送至植物(作为非限制性实例有膨胀浮萍(lemna gibba)或小浮萍(lemna minor))和非植物生物体(作为非限制性实例有藻类)。这些其他策略包括农杆菌渗透,它通过农杆菌(agrobacterium)细菌载体将病毒基因引入整个转染植物的许多细胞。另一种是电穿孔法,在宿主的细胞膜上开孔,引入重组产生病毒和抗原的基因,例如但不限于以下实施例1和3中所述的那些。另一个策略是基于tmv rna的过表达(trbo)载体,它利用缺少tmv外壳蛋白基因序列的35s启动子驱动的tmv复制子,如john lindbo,“trbo:高效的基于烟草花叶病毒rna的过表达载体”,plant physiol.vol 145,2007中所述。
[0087]
在一些实施方式中,本氏烟草野生型植物在受控的生长室中生长。植物生长受控于灌溉、光照和施肥周期。植物在无土培养基中生长,并且在整个过程中控制温度。
[0088]
在适当的播种后天数(dps),例如23-25dps后,通过病毒复制感染植物。感染后,仅用水灌溉植物,并在一定的感染后天数(dpi)内根据病毒类型通过光照周期和温度进行控制。
[0089]
检查植物的高度、感染症状,并收获气生组织。
[0090]
采用配置有优化好的刀片/筛尺寸的破碎器进行病毒回收/细胞破碎,然后从水性液体中去除残留的纤维素植物纤维(例如通过螺旋挤出)。
[0091]
将适当的提取缓冲液(例如200mm乙酸钠,ph 5.0;作为非限制性实例有图1的步骤201)以1∶1的缓冲液:组织比例添加至所得提取物中。在中试规模(pilot scale)上,去除叶绿素和大的细胞碎片涉及使用切向流(tff)陶瓷过滤(1.4微米/5.0微米)。跨膜压力、陶瓷孔径和每平方米膜表面载荷的生物量都是受控的,以确保病毒穿过陶瓷。在一些实施方式中,设置并控制进料压力、截留压力和渗透压力,以产生约1.5-2巴tmp范围内的跨膜压力。
[0092]
通过使用玻璃纤维深度过滤进一步澄清陶瓷渗透物(作为非限制性实例有图1的步骤203)。
[0093]
用tff系统(购自sartorius ag)将澄清的提取物浓缩。盒的孔径(100-300kda)、适当的tmp(如本文所述),以及每平方米膜表面积的澄清提取物的载荷都是受控的。
[0094]
将澄清的提取物浓缩至2倍于离子交换柱体积的nmt,并用离子交换色谱平衡缓冲液(200mm乙酸钠,ph 5.0,图1的步骤204提供了一个非限制性实例)洗涤7次。将capto q离子交换柱用五倍柱体积的200mm乙酸钠,ph 5.0平衡(图1的步骤205提供了一个非限制性实例),将进料上样并收集在流穿级分中。将柱洗涤至基线,并用高盐将宿主细胞污染物从柱上剥离。
[0095]
收集流穿级分和洗涤级分,合并以备多峰core 700色谱。将多峰色谱柱用五倍柱体积的平衡缓冲液(200mm醋酸钠,ph 5.0;图1的步骤206提供了一个非限制性实例)平衡。
[0096]
将来自capto q离子交换色谱的合并的流穿级分和洗涤级分上样到柱上,并将病毒收集在柱的空白体积中。将柱洗涤至基线,并用高电导率氢氧化钠剥离。上样比例、柱床高度、停留时间和色谱缓冲液都是受控的。在一些实施方式中,病毒的配制和浓缩(图2的步骤208)是用tff系统(例如sartorius ag系统)进行的。孔径(30-300kda)、合适的tmp(如本
文所述),以及每平方米膜表面积的载荷和孔材料都是受控的。病毒被浓缩到合适的浓度,如10mg/ml,在一些实施方式中,用合适的缓冲液(如磷酸钠)进行渗滤。将配制好的病毒消毒并适当保存。在一些实施方式中,用pes滤器进行消毒。
[0097]
本文提供的所有实例都意在说明病毒产生、病毒纯化、抗原产生、抗原纯化和病毒-抗原偶联的任何或全部的多个实施方式和替代方式的各个方面。这些例子是非限制性的,只是本文多个替代性实施方式的特征。
[0098]
实施例1-二十面体红三叶草花叶病毒的纯化
[0099]
作为检测混合物中各种蛋白质的已知技术,图3中提供的蛋白质印迹(western blot),其中显示图2所示的二十面体红三叶草花叶病毒的成功纯化。类似地,图5中的蛋白质印迹显示成功地纯化了图4中说明的二十面体红三叶草花叶病毒。这两种病毒都是根据本文所述的实施方式纯化的。根据已知的检测技术,从组织中提取目的蛋白。然后根据等电点、分子量、电荷或这些因素的不同组合,用凝胶电泳分离样品的蛋白质。然后,样品被加载到凝胶的各个泳道,其中一个泳道保留用于
″
梯标
″
,其包含具有确定分子量的已知蛋白质的混合物。例如,在图3中,泳道12为梯标。然后在凝胶上施加电压,使各种蛋白质根据上述因素以不同的速度迁移通过凝胶。在分别在图3和5中给出的每个泳道内,不同的蛋白质被分离成可见的条带。对于蛋白质印迹,更纯的产物的特征是有清晰可见的条带,这些图中就有这样的特征。
[0100]
图3和图5显示成功纯化二十面体红三叶草花叶病毒的病毒纯化平台。蛋白质印迹的每个泳道均显示在病毒纯化平台的不同步骤完成后的病毒的纯度。图3中,泳道包括:泳道1-绿汁,泳道2-tff陶瓷澄清截留物,泳道3-tff陶瓷澄清渗透物,泳道4-tff盒截留物,泳道5-tff盒渗透物,泳道6-离子交换,泳道7-离子交换,泳道8-多峰,泳道9-多峰,泳道10-30k tff渗透物,泳道11-30k截留物,泳道12-标记物。图5中,蛋白质印迹的泳道包括如下泳道:泳道1-绿汁,泳道3-tff陶瓷澄清截留物,泳道5-tff陶瓷澄清渗透物,泳道7-tff盒截留物,泳道9-tff盒渗透物,泳道11-离子交换,泳道13-多峰,泳道14-标记物。
[0101]
一旦在病毒纯化平台中进行完最后一步,就将所得病毒产品高度纯化,如图3泳道11和图5泳道13中的可见条带所示。
[0102]
实施例2-杆状tmv的纯化
[0103]
图6显示纯化的杆状tmv,图7显示在本文公开的多个实施方式和替代方式的范围内的、用于实现该纯化的tmv的病毒纯化平台。与图3和图5类似,图7说明了当前病毒纯化平台的各个步骤结束后病毒产物的纯度。在最后的纯化步骤之后,得到的产物是高度纯化的病毒产物,与图7第13泳道中清晰可见的条带一致。
[0104]
因此,本发明的病毒纯化平台已经成功地纯化出发明人应用了这些方法的每种病毒,包括二十面体病毒和杆状病毒,并且该平台有望以商业规模可重现地且一致地纯化几乎任何类型(如果不是所有类型)的病毒。
[0105]
重组抗原的产生和纯化
[0106]
表2和图8显示根据多个实施方式和替代方式的抗原纯化平台的步骤。
[0107]
表2.重组抗原的产生和纯化
[0108]
[0109][0110]
该纯化平台设计成有商业可扩展性并符合cgmp法规,并在整个纯化过程中使用一种缓冲液。根据多个实施方式和替代方式,抗原纯化平台的步骤如下:
[0111]
本氏烟草野生型植物在受控的生长室中生长。植物生长受控于灌溉、光照和施肥周期。植物在无土培养基中生长,并且在整个过程中控制温度。在适当数量的dps之后,例如23至25,植物被感染以进行所选抗原的蛋白质复制。一旦加标,蛋白质就足以保留在转基因植物细胞的er中。感染后,仅用水灌溉植物,在合适的感染后天数通过光照周期和温度进行控制,例如7-14天,取决于抗原的类型。检查植物的高度和感染症状,并收获气生组织。
[0112]
采用配置有优化好的刀片/筛尺寸的破碎器进行植物产生的抗原的回收,然后从水性液体中去除残留的纤维素植物纤维(例如通过螺旋挤出)。
[0113]
将合适的提取缓冲液以合适的比例(例如1∶1的缓冲液:组织比例或2∶1的缓冲液:组织比例)添加到所得提取物中。在一些实施方式中,提取缓冲液可以是50-100mm磷酸钠+2mm edta+250mm nacl+0.1%tween80,ph 8.5。叶绿素和大的细胞碎片的去除涉及使用过滤。以33g/l的比例加入celpure300并混合15分钟。进料压力(<30psi)、过滤孔径(0.3微米)、澄清剂(celpure300)和每平方米膜表面载荷的生物量都是受控的,以确保抗原的穿过。
[0114]
用tff系统(例如sartorius ag系统)将澄清的提取物浓缩。在一些实施方式中,盒的孔径(例如,30kda)、适当的tmp(如本文所述),以及每平方米膜表面积的澄清提取物的载荷都是受控的。
[0115]
将澄清的提取物浓缩,并用适当的离子交换色谱平衡缓冲液(例如50mm磷酸钠+75mmnacl,ph 6.5)洗涤7次。capto q离子交换柱用50mm磷酸钠+75mm氯化钠,ph6.5平衡5个柱体积,进料上样,用平衡缓冲液洗涤,用高盐洗脱/剥离柱。
[0116]
将抗原级分收集在洗脱液中,以备钴imac色谱。imac用50mm磷酸钠+500mm氯化钠,ph8.0平衡5个柱体积,进料上样,用平衡缓冲液洗涤,用咪唑洗脱。
[0117]
稀释洗脱级分至一定导电率,并检测ph,将其上样到多峰陶瓷羟基磷灰石(cht)色谱柱上。将cht树脂用五倍柱体积的平衡缓冲液(5mm磷酸钠,ph 6.5)平衡。使用梯度磷酸盐和nacl洗脱抗原。上样比例、柱床高度、停留时间和色谱缓冲液都是受控的。抗原的配制和浓缩使用tff系统(如sartorius ag系统)进行。孔径(以kda)、tmp、每平方米膜表面积的载荷和孔材料都是受控的,在此进一步讨论。
[0118]
接着,将抗原浓缩至合适的浓度,例如3mg/ml,并用合适的缓冲液(例如磷酸盐缓冲盐水,ph 7.4)渗滤。将配制好的抗原消毒并适当保存。在一些实施方式中,用pes滤器进行消毒。
[0119]
图9、10和11显示根据多个实施方式和替代方式的抗原纯化平台的各个步骤。图9显示了capto q色谱步骤结束后抗原产物的纯度,图10显示了亲和色谱步骤后抗原产物的纯度,图11显示了cht色谱柱后的纯度。
[0120]
实施例3、4、5和6-h5 rha、h7 rha、wnv rdiii和lfv rgp1/2
[0121]
如图12所示,根据多个实施方式和替代方式的抗原纯化平台已经成功地纯化了h5 rha、h7 rha、wnv rdiii和lfv rgp1/2。图12包含两张从抗原纯化平台的结果中拍摄的图像:左图包含sds page凝胶,表明病毒载体tmv ntk(其中ntk是n末端赖氨酸的缩写)和流感抗原的纯度,右图包含蛋白质印迹,表明对西尼罗河和拉沙热抗原的免疫反应性。如图12中清晰可见的条带所示,每种抗原产品都是高纯度的。因此,根据多个实施方式和替代方式的抗原纯化平台在其使用的商业规模上一致地纯化了每种类型的抗原,其方式也符合cgmp法规。以同样的方式,该平台有望在纯化几乎任何类型(如果不是所有类型)的抗原方面具有可重复性。
[0122]
重组抗原-病毒偶联物的产生
[0123]
表3显示根据多个实施方式和替代方式的重组抗原偶联的步骤。
[0124]
表3.重组抗原的产生和纯化
[0125][0126][0127]
在一个实施方式中,偶联平台的步骤如下:
[0128]
将纯化的抗原和病毒分别浓缩并渗滤至微酸性缓冲液中,例如含有nacl的2-(n-吗啉代)乙磺酸(mes)缓冲液。
[0129]
将水溶性碳二亚胺,例如1-乙基-3-(3-二甲基氨基丙基)碳二亚胺(称为edc)在纯净水中配制成0.5m的摩尔浓度。
[0130]
将羧基转化为可与胺反应的n-羟基磺基琥珀酰亚胺酯的化学试剂,例如赛默飞世尔公司(thermofisher)的sulfo-nhs在纯净水中配制成0.1m的摩尔浓度。
[0131]
基于重量或摩尔浓度将抗原和病毒合并,并混合至均匀(例如以1∶1mg∶mg添加)。
[0132]
将新鲜制备的水溶性碳二亚胺(例如edc)添加到混合物中,并同时基于摩尔浓度混合。
[0133]
在添加edc的一分钟内,基于摩尔浓度添加将羧基转化为可与胺反应的酯的化学试剂(例如sulfo-nhs)。开始偶联反应并继续直到预定的混合停止时间,例如4小时,并控制室温。
[0134]
通过添加游离胺淬灭反应,并通过多峰色谱步骤(例如core 700)或渗滤到磷酸盐缓冲盐水中来除去化学接头(例如edc和sulfo-nhs)。根据多个实施方式和替代方式,根据作为截留物的杂质和作为渗透物的偶联物混合物之间的大小差异,从偶联反应的结果(有时在本文中称为偶联物混合物)中去除残留的杂质。
[0135]
偶联物混合物被稀释到目标浓度。此时,将病毒-抗原偶联物制备成用作纯化的疫苗/药物物质。疫苗的合适的递送机制包括液体小瓶,或待用生理缓冲液重建以用于进行注射的冻干材料。注射可以是肌肉内的或皮下的。还考虑了其他递送方法,包括但不限于鼻内。
[0136]
实施例7-h7 rha偶联至tmv
[0137]
图13提供了重组抗原(记作“疫苗抗原”)偶联至病毒的图示,其中浅色和深色阴影的椭圆形表示实施例中所示的疫苗抗原的偶联程度。较浅的色度代表游离病毒,而较深的色度代表偶联至病毒的蛋白外壳的抗原。同样,如图13所示,一些病毒在rna基因组周围含有位于外壳上的蛋白。例如,病毒载体tmv ntk包括n末端赖氨酸,作为与外壳蛋白的连接点。在一些实施方式中,对与n末端赖氨酸残基结合的病毒部分进行修饰,以更强地呈现重组抗原的结合,从而提供蛋白质(例如抗原)与病毒的胺靶向偶联。结合本文中的径向测量的讨论,在重组抗原偶联至病毒外壳蛋白后,病毒半径大大增加。在一些实施方式中,在包膜的病毒发生改变时进行修饰,以增强其残基的呈现。
[0138]
如图14-20所示,重组抗原与病毒的偶联平台已经成功地将h7 rha偶联至tmv。图14-16显示基于十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(“sds-page”)在ph 5.50下对h7 rha和tmv之间的偶联的分析。如这些数字所示,几乎所有的h7 rha都在2小时内偶联至tmv。rha蛋白条带的消失和同时出现的高于200kda标志物的复合物的染色表明复合物的形成。所述条带与ha特异性抗体的反应性进一步证实了这一结论。
[0139]
sec-hplc报告还表明,根据偶联平台的当前实施方式成功地将h7 rha偶联至tmv。图17显示游离tmv产品的sec-hplc报告。图17中,游离tmv产品的sec-hplc报告产生了下表4中详细示出的信号数据。
[0140]
表4.游离tmv的sec-hplc数据
[0141]
rt[分钟]宽度[分钟]面积高度面积%峰对称性13.2330.771078.3923.411000.39
[0142]
图18显示根据偶联平台的当前实施方式将h7 rha偶联至tmv 15分钟后的sec-hplc报告。图18中,将h7 rha偶联至tmv 15分钟后的sec-hplc报告产生了下表5中详细示出的信号数据。
[0143]
表5.将h7 rha偶联至tmv 15分钟后的sec-hplc数据
[0144]
rt[分钟]宽度[分钟]面积高度面积%峰对称性26.5390.52553.7517.651000.83
[0145]
图19显示根据偶联平台的当前实施方式在将h7 rha偶联至tmv 2小时后的sec-hplc报告。图19中,根据偶联平台的当前实施方式将h7 rha偶联至tmv 2小时后获取的sec-hplc报告产生了下表6中详细示出的信号数据。
[0146]
表6.将h7 rha偶联至tmv 2小时后的sec-hplc数据
[0147][0148][0149]
如图19和20所示,sec-hplc报告表明,在偶联15分钟后,所有tmv杆均被一些h7 rha包被,并且在最多2小时内有更多的h7 rha添加至杆中。2小时后,没有检测到额外的偶联。根据多个实施方式和替代方式,sec-hplc报告表明,偶联反应使未偶联的天然分子量的病毒外壳蛋白减少了至少约50%,并且在偶联发生4小时后,剩余约3%的游离tmv。
[0150]
如图20所示,偶联物产品的蛋白质印迹分析表明,h7 rha通过共价连接成功地偶联至tmv。图20显示根据当前实施方式的偶联平台的各个步骤的蛋白质印迹分析,其中所有样品均以10μl上样。不同的泳道说明了抗原和病毒之间不同的偶联反应时间。第14和第13泳道显示,15分钟后,所有的tmv杆都被抗原包被。两小时后,第6-9泳道说明没有发生额外的偶联。
[0151]
实施例8-tmv ntk的uv灭活
[0152]
为了避免生物制药产品的病毒污染,通常需要将病毒灭活(或消毒),以确保病毒不再具有感染性。此外,许多监管机构已经制定了规则(例如cgmp法规),要求在病毒产物的纯化过程中有至少一个有效的灭活步骤。虽然uv-c辐射已在水处理系统中使用多年,但其
在生物制药产品中的使用仍未得到探索,关于其有效灭活病毒的能力研究有限。
[0153]
因此,在病毒产生和纯化之后但在与重组抗原偶联之前,评估了各种uv-c条件(即能量密度和波长)和各种tmv浓度,以有效地将tmv ntk灭活和消毒。尽管测试了许多能量密度,但只有更高水平的能量密度成功地将tmv ntk灭活。此外已确定,成功的病毒灭活是浓度依赖性的,因为未将tmv溶液稀释至合适的浓度时,uv-c辐射不能有效地将样品中的每种病毒消毒。因此,tmv溶液必须适当稀释,以允许uv-c辐射与各个病毒相互作用并有效灭活。
[0154]
如图21所示,在烟草(nicotiana tabacum)植物上测试了各种量的uv-c辐射(能量密度在300j/m2和2400j/m2之间)以评估感染性。如图21所示,在2400j/m2的uv-c能量剂量后,病变减少到零,因此表明病毒被成功灭活。此外,还测试了高得多的水平的能量剂量,并且确定在4800j/m2至5142j/m2范围内的能量密度下也成功地将tmv ntk灭活。
[0155]
根据多个实施方式和替代方式,(在纯化之后但在偶联之前的)病毒灭活的步骤如下:
[0156]
通过a260测得tmv ntk溶液稀释至小于50微克/毫升的浓度(这是通过将样品暴露于260nm波长的紫外光并测定穿过样品的光量来定量核酸的常规方法)。
[0157]
以0.45微米过滤tmv溶液,以去除细菌和任何其他可能干扰紫外光视线的大物质。
[0158]
通过将病毒暴露于能量密度在约2400j/m2和约5142j/m2之间的紫外光谱中的光以将tmv ntk灭活。在一些实施方式中,uv光的能量密度在约4800j/m2至约5142j/m2之间。根据多个实施方式和替代方式,uv光的波长为254nm。
[0159]
接着,将灭活的tmv ntk准备好与重组抗原偶联。
[0160]
这些病毒灭活步骤是为商业可扩展性和合规cgmp法规而设计的
[0161]
实施例9-偶联的ph依赖性
[0162]
为了评估在酸性ph值下孵育病毒是否会导致高质量的偶联,使用相同批次的病毒、抗原、缓冲剂和酯进行了实验,但只改变了病毒的制剂。在反应1中,根据多个实施方式和替代方式,tmv被配制成1x mes偶联缓冲液,ph值为5.50,浓度为3.1mg/ml。在反应2中,tmv在磷酸盐缓冲液中浓缩至11.0mg/ml,并直接以偶联反应体积的15%加入。在这些步骤后,通过sec监控偶联过程,其中游离tmv从零分钟(以t=0表示)开始有序减少就表明成功的偶联。
[0163]
如表7和8所示,反应1表现出成功的偶联(因为游离tmv从零分钟开始有序减少),而反应2未成功,如剩余的游离tmv百分比所示。
[0164]
表7.反应1,成功的偶联-在酸性ph中配制的tmv
[0165][0166]
表8.反应2,不成功的偶联-在磷酸盐缓冲液中配制的tmv
[0167][0168]
因此,如表7所示,在酸性ph中孵育病毒会产生大于90%的偶联。如果不发生酸性ph孵育步骤,那么偶联百分比仍然低于50%(如表8所示)。
[0169]
基于该实验,开发了偶联用的模型(如图22所示)。根据多个实施方式和替代方式,通过将病毒暴露在偶联环境中来改进病毒以接合抗原的化学准备状态(在本文中称为“激活”或“活化”)而大大增强纯化的病毒和纯化的抗原(图22中用“rha”表示)之间的偶联。在一些实施方式中,病毒激活是通过在偶联反应前在酸性ph值中配制病毒,使正电荷在病毒表面聚集而发生的。在一些实施方式中,激活步骤包括将病毒暴露在约5.5或更低的ph值中,并持续足够的时间进行激活。在一些实施方式中,这种暴露在偶联环境中的时间约为18
至72小时。根据多个实施方式和替代方式,在酸性ph下加工纯化的病毒通过使外壳蛋白赖氨酸带电来活化病毒。由于在偶联环境中的激活步骤,正电荷通过胺基的聚类在病毒表面聚集(如图22所示),病毒已经准备好与重组抗原的羧基端偶联。
[0170]
根据多个实施方式和替代方式,病毒活化步骤与储存病毒时的ph通常保持在中性ph或接近中性ph的传统方法相反。如图22所示,传统方法没有在病毒表面聚集正电荷,因此,偶联百分比仍低于50%(见表8)。此外,传统方法利用了磷酸盐缓冲液,其促进了溶解性,但却牺牲了有利的表面电荷。
[0171]
在考察涉及tmv的成功偶联过程中观察到,通常在活化步骤中通过动态光散射(dls)测得的病毒半径增加了至少2.75倍时才发生成功的偶联(参见表9a与表9b的对比)。一般来说,成功的tmv偶联(如表9c讨论的)的特征为dls半径从约70nm增加到约195nm或更高,如这些表格所示。
[0172]
基于采用病毒活化的成功偶联,开发了将纯化的抗原与纯化的病毒偶联的平台。根据多个实施方式和替代方式,制备用于偶联的纯化的抗原的步骤如下:
[0173]
为了确保偶联反应的ph控制,在临近反应开始之前将纯化的抗原配制成反应缓冲液。
[0174]
在偶联前,将纯化的抗原储存在中性至微碱性ph的磷酸盐缓冲盐水中。
[0175]
取决于分子的性质,抗原的ph目标通常为ph 5.50-6.50。
[0176]
为了促进与病毒的偶联,使用超滤将储存缓冲液替换为酸性ph下的mes/nacl缓冲液。蛋白质浓度也增加到大于3mg/ml。
[0177]
然后在抗原制备完成后的4小时内开始偶联反应,以防止蛋白质结构不稳定。
[0178]
根据多个实施方式和替代方式,制备偶联用的纯化的病毒的步骤如下:
[0179]
在中性ph下储存后,在偶联前在酸性ph下将病毒激活。为了成功的反应,在偶联反应开始前,将病毒从ph 7.4的磷酸盐缓冲液配制成ph 5.50的醋酸盐缓冲液,时间最少约18小时,最多约72小时。在一些实施方式中,在偶联反应开始前,将病毒从ph 7.4的磷酸盐缓冲液配制成ph 4.50的醋酸盐缓冲液,时间最少约18小时,最多72小时。据观察,在酸性ph值下储存超过72小时的病毒会在病毒之间产生自关联(self-association),从而导致病毒不溶,并抑制偶联的效率。
[0180]
表9a和9b还利用通过dls测得的病毒半径(此时为tmv)的增加证明了活化步骤。具体而言,表9a提供了在活化之后并在成功偶联之前tmv的dls半径增加的数据,其中抗原列在右侧列中。“半径增加的因数”是将活化后的tmv半径除以中性ph下的典型tmv半径(约70nm)。相反,表9b提供了在活化步骤开始之后、在不成功的偶联尝试之前的tmv的dls半径增加的数据,其中抗原列在右侧列中。在表9a和9b中,左栏代表tmv杆在中性ph值和一般储存条件下的标准半径,即在发生任何活化之前。
[0181]
表9a.(在成功偶联之前)通过dls测得的游离tmv半径
[0182]
[0183][0184]
表9b.(在未成功偶联之前)通过dls测得的游离tmv半径
[0185][0186]
在这些制备步骤之后,抗原和病毒反应物被混合以形成偶联物混合物,并使用dls和sds-page方法监测偶联进展。表9c说明了在使用酸性ph值激活病毒后,使用dls的偶联反应的平均分子半径随时间变化的情况。如表9c所示,分子半径是病毒杆由抗原分子成功包被的一个指标。
[0187]
表9c.tmv ntk sec和dls史
[0188][0189]
反过来,图23显示了根据多个实施方式和替代方式,基于sds-page对活化的tmvntk和纯化的抗原之间的偶联的分析。如图23所示,游离tmv ntk和游离抗原随时间有序地减少,以及出现》200kda的蛋白质条带,表明成功的偶联。
[0190]
实施例10-不同比例的纯化的病毒和纯化的抗原进行偶联的tem成像
[0191]
纯化的病毒和纯化的抗原之间所需的偶联反应用以下公式表示:
[0192]
病毒+抗原
→
病毒-抗原
ꢀꢀ
(式1)
[0193]
然而,众所周知,抗原倾向于自偶联,可能无法获得所需的反应,如下式所示:
[0194]
病毒+抗原
→
病毒-抗原+抗原-抗原
ꢀꢀ
(式2)
[0195]
纯化的抗原的自偶联对于疫苗的成功开发而言是一个问题,因为在尺寸色谱步骤中不会去除抗原-抗原偶联物,其结果是免疫应答减至最小或减弱。
[0196]
为了解决该自偶联的问题,进行了各种实验以确定如何消耗未反应的抗原和抗原偶联物。首先,通过将抗原暴露在抑制自偶联的试剂中,对抗原进行封端。虽然预计这种传统的方法会成功,但这种方法失败了,因为反应发生得太快了。
[0197]
接下来,调整了病毒与抗原的比例,以确定合适的偶联比例。如表10和11以及图24-30所示,通过负染色透射电子显微镜(tem)成像分析了七个不同的样品。样品1-3是对照组,样品4-7含有不同的血凝素(ha)与tmv的比例(在偶联平台的混合步骤中,如表3的操作步骤5所示)。
[0198]
表10.tem成像样品对照组
[0199][0200][0201]
表11.tem成像样品-偶联物
[0202][0203]
图24是样品1(游离ha,批次19ul-sg-001)的tem图像,放大倍数为52,000x,比例尺为200nm。图24中,该样品含有小球形箭头(由箭头a指示)和细长颗粒(由箭头b指示),尺寸在约5nm至约9nm的范围内。这些颗粒的外观显示出与ha的有序聚集相一致的规则结构,符
合天然三聚体的构象。此外,该颗粒分散良好,结块的情况很少。
[0204]
图25是样品2(单独的tmv ntk,批次18ha-ntk-001)的tem图像,放大倍数为52,000x,比例尺为200nm。图25中,观察到杆状颗粒(箭头a),尺寸在长约125nm至约700nm、宽约18nm至约20.5nm的范围内。这些尺寸与tmv颗粒的大小和形状一致。此外,在杆中观察到约4nm的中心通道(箭头b),这是tmv的已知特征。多个杆经常平行于其长轴对齐,并且杆的表面通常是光滑的。在少数情况下,观察到约8nm至约10nm的小球形颗粒(箭头c),其既与杆的表面结合,又与背景中的杆状颗粒不结合。这些球形颗粒(箭头c)不像单个ha三聚体。
[0205]
图26是样品3(添加有tmv ntk的ha:ha自偶联物,批次19ul-sg-004)的tem图像,放大倍数为52,000x,比例尺为200nm。图26中,观察到杆状颗粒,其长度在约25nm至约885nm的范围内,宽度在约18nm至约20.5nm的范围内(箭头a),并且有一个约4nm的中心内部通道(箭头b)。这些杆要么根本不装饰,要么稀疏地装饰着各种尺寸和形状的小蛋白质颗粒(箭头c)。在背景中也可见一些小蛋白质颗粒,与杆不结合(箭头d)。图26显示较大的ha颗粒团块,但tmv看起来与预期的未偶联的tmv相同(如图25所示)。
[0206]
图27是样品4(tmw;ha为1∶1的比例,批次18tap-sg-002)的tem图像,放大倍数为52,000x,比例尺为200nm。图27中,观察到杆状颗粒,其尺寸在长约50nm至大于约1000nm、宽约18nm至约20.5nm的范围内(箭头a),并且有约4nm的中心内部通道(箭头b)。颗粒杆的大小和形状与图28中观察到的偶联的tmv相似,不同的是,大多数颗粒杆的表面上有大量的小蛋白密度的装饰(箭头c)。在背景中也可见一些小蛋白质颗粒,与杆不结合(箭头d)。图27所示的样品5看起来优于其他tem图像,这很可能是由于偶联前病毒处理的不同。对于该批次,在ph 5.50配制病毒,然后在15分钟内将ph降至4.50,并在偶联反应开始时恢复至ph 5.50。对于图28-30所示的批次,病毒被直接配制成ph 4.50,并在偶联之前保持过夜。
[0207]
图28是样品5(tmv∶ha为1∶1的比例,批次19ul-sg-001)的tem图像,放大倍数为52,000x,比例尺为200nm。图28中,可见许多杆状颗粒,其长度在约65nm至约720nm的范围内,宽度在约18nm至约20.5nm的范围内(箭头a),并且有一个约4nm的中心内部通道(箭头b)。颗粒杆的大小和形状与图25中观察到的游离tmv ntk(样品2)相似。然而,与图25中显示的未偶联的病毒相比,图28中观察到的颗粒杆中等地装饰有蛋白密度(箭头c)。这些密度在形状和尺寸上是不规则的,并且似乎与杆的表面随机结合,没有明显的图案。在背景中也可见一些小蛋白质颗粒,与杆不结合(箭头d)。
[0208]
图29是样品6(tmv∶ha为4∶1的比例,批次19ul-sg-002)的tem图像,放大倍数为52,000x,比例尺为200nm。图29中,观察到杆状颗粒,其长度在约25nm至大于约1000nm的范围内,宽度在约18nm至约20.5nm的范围内(箭头a),并且有约4nm的中心内部通道(箭头b)。在图29中观察到的颗粒杆的尺寸与先前的偶联样品类似,但是小蛋白质密度(箭头c)的表面装饰水平介于中等到稀疏之间。在背景中也可见一些小蛋白质颗粒,与杆不结合(箭头d)。
[0209]
图30是样品7(tmv∶ha为16∶1的比例,批次19ul-sg-003)的tem图像,放大倍数为52,000x,比例尺为200nm。图30中,观察到杆状颗粒,其尺寸在长约30nm至大于约1000nm、宽约18nm至约20.5nm的范围内(箭头a),并且有约4nm的中心内部通道(箭头b)。图30中观察到的颗粒杆在整体形态上与之前的偶联样品相似。然而,这些杆只有稀疏的蛋白质装饰(箭头c)或根本没有装饰。在背景中仅可见少量的小蛋白质颗粒,与杆不结合(箭头d)。
[0210]
图24-30显示,1∶1的比例显示出充分的杆装饰,4∶1的比例显示出适度的装饰,而
16:1的比例显示出稀疏的装饰。换言之,1∶1的比例产生的病毒杆上有大量的ha抗原装饰(即较多的密度),而16∶1的比例产生的病毒杆上有较少的ha抗原装饰(即较少的密度)。作为偶联反应的副产物,观察到ha-ha自偶联物,主要是在1∶1比例反应中。此外,与1∶1的反应相比,在4∶1的反应中似乎有更少的游离ha或ha-ha偶联物,在tem图像和sds-page反应分析中用16∶1反应甚至更少(数据未显示)。换言之,在16∶1的比例下,ha仅与tmv杆偶联的效率整体上更高,但与1∶1反应相比,每个杆的ha密度更低。
[0211]
实施例11-不同偶联条件下的沉降速度分析
[0212]
在分析型超速离心机(“auc”)中测得的沉降速度(“sv”)是获取有关蛋白质异质性和聚集的缔合状态的信息的理想方法。具体地,可以根据不同的沉降系数检测聚集物或不同的寡聚物。该方法还检测低于1重量%水平的聚集物或其他次要成分。此外,sv对物质的相对量进行高质量定量,并为任何聚集物提供准确的沉降系数。
[0213]
为了测定自偶联和未反应的ha的量,以及不同偶联条件下的tmv ntk上ha的占位量,用sv-auc测定与游离抗原、游离病毒和各种tmv∶ha比例的沉降有关的总信号。表12中提供了以下实例和描述:
[0214]
表12.sv-auc用样品和说明
[0215]
样品说明批次浓度1仅ha19s-g-0011.01mg/ml2仅tmv ntk18ha-ntk-0010.54mg/ml3tmv∶ha=1∶119ul-sg-0041.0mg/ml4tmv∶ha=1∶118tap-sg-0021.0mg/ml5tmv∶ha=1∶119ul-sg-0010.8mg/ml6tmv∶ha=4∶119ul-sg-0021.0mg/ml7tmv∶ha=16∶119ul-sg-0031.0mg/ml
[0216]
这些储液被冷藏运输(非冷冻),随后被储存在2-8℃直到分析。使用来自康宁公司(corning)的1x pbs来进行样品稀释并用作空白参比。样品1被1∶1稀释,样品2-7用1x pbs 1∶3稀释,以创建沉降速度样品。进行这些稀释是为了使样品的总吸光度在吸光度检测系统的线性范围内。
[0217]
方法-将稀释后的样品上样到具有12mm光程的双通道木炭制epon中心部件的皿中。1x pbs上样到每个细胞的参比通道。将装载的细胞放入分析转子,装入分析超速离心机,并将其升至20℃。然后将转子升至3000rpm,扫描(在280nm处)样品以确认正确的细胞装载。对于样品2-7,转子被调至最终的运行速度为9000rpm。在这个转子速度下尽可能快地记录扫描结果(每3分钟一次),持续约11小时(每个样品总共扫描250次)。对于样品1(游离的ha),转子被调至35,000rpm,每4分钟记录一次扫描,持续5.3小时。然后使用schuck,p.(2000),“通过沉降速度超速离心和lamm方程模型进行大分子的尺寸分布分析”,biophys.j.78,1606-1619中所述的c(s)方法分析数据。使用该方法,直接拟合原始扫描以得出沉降系数的分布,并同时针对扩散对数据的影响进行建模以提高分辨率。
[0218]
结果与讨论-样品1-7的高分辨率沉降系数分布如图31-37所示。在这些图中,纵轴提供浓度,横轴提供基于沉降系数的分离度。通过将曲线下的总面积设置为1.0(100%),每个分布都进行了标准化,以确保每个峰下的面积提供种类的分数。因为样品2-7所含的物质
进行沉降的沉降系数范围很广,所以数据分析被推进到覆盖速度快至2000个svedburg单位(s)的物种沉降,因此横轴为对数标度。为了补偿对数缩放比例可能会扭曲峰的可见面积的影响,纵轴已被乘以沉降系数,从而正确地缩放了相对峰值面积。样品1(游离ha)的数据采用传统的线性沉降系数缩放来表示。
[0219]
图31是样品1(单独的ha,批次19s-g-001)的标准化沉降系数分布。由于游离抗原的尺寸比病毒小得多,因此该样品的转子转速(35,000rpm)比样品2-7(9,000rpm)快得多,以便充分表征尺寸分布。如图31所示,样品1在某种程度上是均匀的,在8.967s提供了73.7%的主峰。这是仅有ha抗原的样品的预期结果。该沉降系数以及主边界的宽度意味着,该主峰物质的摩尔质量为约222kda,这可能表明该主峰大致对应于预期的约70kda单体的ha三聚体。该沉降系数在物理上不可能对应于单体,相反,主峰对应于比单体更大的低聚态。如下表13所示,在ha3新加坡释放时的sec hplc数据,>90%的ha被鉴定为三聚体状态,分析的4个样品中有3个三聚体化程度超过50%。
[0220]
表13.三聚体化的程度
[0221][0222][0223]
同样如图31所示,检测到七个比主峰更快沉降的次要峰,它们总共占总沉降吸光度的6.2%。据推测,这两个峰表示产物聚集,而不是高分子量的杂质。12.4s(4.25%)处的主要聚集物物质的沉降比单体快1.4倍,该比例落在通常在二聚体中可见的1.4-1.5的范围
内。尽管该比例表明该物质是主峰物质的二聚体(可能是约70kda单体的六聚体),但其沉降系数也可能表明它是主峰物质的高度扩展或部分未折叠的三聚体(可能是约70kda单体的九聚体)。
[0224]
图31中,15.3s(0.96%)处的下一个峰的沉降比单体快1.7倍,这表明主峰物质的三聚体。对于任何大于30.9s的沉降系数都没有检测到吸光度。另外,在2.8s(2.81%)、4.5s(12.44%)和6.0s(4.94%)处也检测到了比主峰沉降更慢的三个次要峰。在这些次要峰中,4.5s的峰最有可能对应的是抗原单体。
[0225]
图32是样品2(游离tmv ntk,批次18ha-ntk-001)的标准化沉降系数分布。如图32所示,在约60s之下未检测到沉降物质。该样品看起来相当异质,在229s(30.9%)处有丰度最高的峰沉降。在191s(28.7%)处检测到丰度第二高的峰。目前还不清楚哪个峰对应的是完全组装的病毒。此外,在229s到2,000s之间观察到25.3%的总信号沉淀,这是本实施例11中允许的最大沉降系数。不清楚从约60s到2000s的部分可分辨的峰代表什么。
[0226]
图33-37显示病毒-抗原偶联物的标准化沉降系数分布。这些图的每张都显示了约0.15od的显著吸光度,没有沉降。这是通过在每次运行完成后将转子速度提高到35,000rpm,以便将所有剩余的物质都颗粒化而成立的。在游离抗原或游离tmv ntk样品中都没有观察到这种物质。然而,由于这种物质不沉降,它并不影响测量的尺寸分布的结果。
[0227]
图33是样品3(tmv和ha的比例为1∶1,批次19ul-sg-004)的标准化沉降系数分布。如图33所示,沉降系数的结果范围从大约40s到2000s,与观察到的游离病毒的结果相似(如图33所示)。在1-40s的沉降系数范围内还观察到三个峰:9.9s(28.3%)、18.7s(7.8%)和34.5s(1.0%)。在9.9s处观察到的峰可能对应于在游离的ha样品中观察到的主峰(如图32所示)。各种较小的峰可能反映了ha-ha的自偶联事件。
[0228]
图34是样品4(tmv和ha的比例为1∶1,批次18tap-sg-002)的标准化沉降系数分布;并且图35是样品5(tmv和ha的比例为1∶1,批次19ul-sg-001)的标准化沉降系数分布。图34和35中显示的结果与对于样品3所讨论的(并在图33中显示)相似。然而,观察到一些明显的差异。首先,由于在这个转子速度下的分辨率很差,很难评论对于游离抗原样品(1-40s)观察到的差异。尽管如此,图34和35显示出比样品3更多的存在于40s-2,000s(表示病毒结合物质)的总信号量。
[0229]
图36是样品6(tmv和ha的比例为4∶1,批次19ul-sg-002)的标准化沉降系数分布;并且图37是样品7(tmv和ha的比例为16∶1,批次19ul-sg-003)的标准化沉降系数分布。图36显示出91.1%的总病毒结合物质(即病毒-抗原偶联物),图37显示出99.4%的病毒结合物质(即病毒-抗原偶联物)。
[0230]
如图33-37所示的病毒-抗原标准化沉降系数分布的结果列于表14。如前所述,根据多个实施方式和替代方式,介于1-40s之间的分数表示ha单体/三聚体的百分比,而介于40-2000s之间的分数表示tmv ntk-ha偶联物的百分比。
[0231]
表14.不同的病毒-抗原偶联物的sv-auc结果
[0232][0233]
表14中的结果表明,与4∶1和16∶1的比例相比,1∶1的比例具有更多的ha自偶联和ha产物。此外,增加tmv∶ha比例导致tmv偶联事件中ha产物的几乎完全接合(在样品7中接近100%的偶联)。
[0234]
根据多个实施方式和替代方式,通过将tmv ntk和ha的比例从1∶1增加到16∶1来减少偶联反应中的ha量,其结果是:(1)如实施例10和图24~30所观察到的,ha抗原在各tmv杆上的聚集减少;(2)如图31~37和表14所示,自偶联和未反应ha事件的量减少到几乎为零;以及(3)如图31~37和表14所示,与自偶联和未反应ha事件相比,ha与tmv的结合增加(以百分比表示)。
[0235]
实施例12-小鼠中的免疫应答
[0236]
为了确定给予本发明的病毒-抗原偶联物后的免疫应答,通过肌内注射向小鼠给予偶联物作为疫苗。每种疫苗都是如本文所述以1∶1(tmv∶ha)比例产生的tmv∶ha偶联物,在研究的第0天和第14天对大多数动物给药(对照动物给予单独的缓冲液、单独的tmv或单独的ha)。接种疫苗的接受了15、7.5或3.75mcg(微克)的抗原,如下表15所示。一个队列在第7天采样,另一个队列在第14和21天采样,第三个在第28、42和90天采样,然后对样品进行血凝抑制(hai)试验。
[0237]
根据该试验,在第7天或第14天,没有任何动物对任何疫苗产生可测量的应答。然而,在第21天在一些动物中看到了初步应答。具体而言,27只动物中有10只对h1n1疫苗(甲型流感/密歇根州/45/2015(h1n1pdm09))显示出低水平的应答(其中只有1只>80hai滴度)。另外,22/27对h3n2疫苗(甲型流感/新加坡/infimh-16-0019/2016)表现出低水平应答(其中只有2只>80)。在第28天,该队列中对h1n1疫苗有可测量的应答的动物数量为8/29,其中一只动物的hai滴度为80,其他的都较低。对于h3n2疫苗,有可测量应答的动物数量为14/29,也有一只动物达到了80的hai滴度,其他动物则较低。
[0238]
从第42天和第90天采集的血液样品中观察到最明显的结果,这些结果示于下表15中。在该表中,提供了平均值的标准误差(sem),以及有应答的动物的比例(fr.resp.)。应注意,在各个队列中,一些小鼠接受了乙型流感病毒疫苗(分别为b/科罗拉多/06/2017(v)和b/普吉岛/3073/2013(y))。这些动物在任何一天都没有检测到应答,如所预期的,因为已知乙型流感病毒和相应的ha免疫原在小鼠体内产生hai滴度的效率和有效性不如a型ha免疫原。
[0239]
表15.基于剂量和疫苗接种后时间的免疫应答
[0240]
[0241][0242][0243]
与先前描述的免疫应答研究分开进行,并且为了以合适的病毒和抗原的比例进一
步评估本发明的系统,以各种tmv∶ha偶联物比例(即1∶1、4∶1、16∶1)接种甲型流感病毒和乙型流感病毒的疫苗以及如下所述的对照后,评估小鼠中的体液免疫应答。通过这种方式,研究了各种偶联比例及其对免疫应答的影响。在研究的第0天和第14天,通过注射给予接受疫苗接种的小鼠15mcg ha,在背侧的皮下区域。然后分析对疫苗接种的血清抗体应答的ha特异性活性。表15(h3流感病毒用作捕获蛋白)和表16(重组h3蛋白用作捕获蛋白)显示了小鼠的分组(每组12只小鼠),以及被给予的试剂,每个表中的右侧列显示了elisa抗体(ab)滴度结果。
[0244]
表16.tmv∶ha比例研究-甲型流感ha。
[0245][0246]
图38是与表16有关的散点图,其提供了以0、1∶1、4∶1和16∶1(tmv:ha)的比例给予疫苗后的h3:ha ab滴度的图解分析。图39还以图形说明了抗原相关ab滴度的几何平均测试结果,使用重组h3抗原(表17)作为包被,或作为捕获蛋白的捕获h3病毒(表17),与抗甲型流感h3抗原抗体结合。就密度(被ha占据的tmv表面积)而言,这三种比例的趋势以1∶1(密度最高)>4∶1>16∶1(密度最低)发展,正如tem和auc分析所证明的。在这些表示用h3抗原获得的elisa结果的图片中,用密度最低的偶联物观察到的免疫应答最高。即,免疫应答的趋势是16∶1>4∶1>1∶1,与密度的趋势相反。因此,令人惊讶的是,在tmv∶ha的这些比例下,较低密度的偶联物倾向于提供更好的免疫应答。对此令人惊讶的发现,即抗原性与最大的ha偶联事件不相关,可能的解释包括:(1)当密度相对较低时,抗原更均匀,具有较少的未反应或自偶联的蛋白质;(2)可以更高效地加工偶联的抗原,并更多地保留/统一抗原构象;和(3)tmv杆(举例来说)可以刺激更多的抗原递呈细胞迁移到注射部位并刺激附着的抗原的加工;或这些因素的一些组合。然而,应注意,仅仅是tmv颗粒的存在并不能替代偶联的需要
(例如,见表14和15)。
[0247]
除甲型流感h3抗原外,还使用重组乙型流感普吉岛抗原及其相应抗体的结合倾向性对乙型流感抗原(b-普吉岛ha)进行了研究。下文表17介绍了这部分研究的结果,根据平均elisa ab滴度的结果,16∶1>4∶1>1∶1的显示不是很明显。
[0248]
表17.tmv:ha比例研究乙型流感ha.
[0249][0250][0251]
即便如此,16∶1的比例仍显示出最高的平均抗体滴度。因此,发明人认为有理由预测,密度和免疫应答之间的关系同样适用于乙型流感抗原的研究(b-普吉岛ha)。即,与h3抗原的结果一样,对于密度较低的偶联物形式,免疫应答会更高。此外,有理由相信,4∶1比例的偶联反应没有像其他比例的反应那样进行,这是因为偶联过程中可能出现异常,并且没有对该样品进行电子显微镜分析和超速离心分析。无论如何,这里的数据都显示所有三种比例下的免疫应答。在多种比例下实现免疫应答的事实强调了该系统不受任何一个特定比例的约束的稳健性。在特定的tmv偶联疫苗中看到的这种灵活性可能进一步表明,当除了这些研究中包括的h3和h1抗原外,其他抗原偶联至tmv时,以及当除tmv外的其他病毒运载体用于运载体时,该系统都能良好地发挥作用。
[0252]
就临床实用性而言,根据本文所述的多个实施方式和替代方式中的任一种进行偶联的产物可以通过经由纯化的病毒递送纯化的抗原而用作疫苗,例如但不限于实施例7、9、10、11和12中所述的病毒-抗原偶联物。再者,本公开的实施方式包括以任何数量形式(例如小瓶)包装的、具有合适的缓冲液和添加剂的任何疫苗产品,其由任何病毒-蛋白质偶联物组合物制造,为此提供其偶联。在这方面,实施方式包括其中此类疫苗产物可以以单位剂量
的形式提供递送给人或动物患者,例如但不限于通过注射器或喷雾的方式给予,包括但不限于皮下、肌肉内、皮内给予和鼻腔,以及在临床指示的范围内通过口服和/或局部给予。作为非限制性的例子,在不影响本文实施方式的广度和范围的情况下,tmv的大小(通常为18nm
×
300nm)及其杆状形状可促进抗原呈递细胞(apc)的抗原摄取,从而起到增强t细胞(如th1和th2)免疫的作用,并为表面偶联的亚基蛋白提供佐剂活性。这种活性也通过病毒rna/tlr7的相互作用被刺激。因此,疫苗摄取的组合效应直接刺激了apc的激活。体液免疫通常通过皮下和鼻内递送在igg1和igg2亚型之间进行平衡。一旦递送粘膜疫苗后,应答还包括大量的全身性和粘膜iga。细胞免疫也非常强大,诱导抗原特异性分泌,类似于活病毒感染反应。整个抗原融合允许天然细胞毒性t淋巴细胞(ctl)表位处理,而不必担心人白细胞抗原(hla)差异。
[0253]
与根据当前实施方式的多重纯化平台有关的广泛的(体液和细胞的)且(幅度和有效性)有所增强的免疫应答与没有tmv偶联的被测试的亚基蛋白质形成鲜明的对比,后者几乎或完全不诱导细胞免疫或体液免疫。这些免疫应答的影响是,根据当前实施方式,经由多重平台产生的疫苗促进了单剂疫苗的高保护性应答,并提供了其他常规疫苗平台所无法提供的速度和安全性。事实上,该偶联平台被证明可以在广泛的病毒和蛋白质(包括抗原)上发挥作用,在广泛的比例范围内进行组合,并以各种剂量成功给予,这再次表明了该系统的稳健性。当前实施方式中用于产生疫苗的多重平台的其他优点包括:是一种积极主动的抗原刺激方法,用于针对病原体的侵袭进行全身性免疫保护,该平台非常适合于从疾病病原体(包括病毒糖蛋白或非分泌性病原体抗原)产生抗原性结构域,并且该平台可充当病毒和细菌病原体的有效疫苗平台。
[0254]
除了关于疫苗应用的优点之外,可以将通过根据当前实施方式的多重平台纯化的植物病毒颗粒配制用于各种药物递送目的。这些不同的目的可以包括:1)免疫治疗-通过将治疗性抗体与病毒颗粒表面偶联并将其递送以增强细胞毒性效果;2)基因治疗-通过加载用于导入特定细胞类型以进行基因修饰的特定核酸;以及3)药物递送-通过将化疗剂加载到病毒颗粒中以进行靶向肿瘤递送。
[0255]
作为本文讨论的方法的许多优点的简要示例,根据多个实施方式的多重平台可通过首先通过将纯化的病毒暴露于如上所述的ph变化而使其溶胀来用作药物递送工具。随后,将在这种条件下的病毒与浓缩的化疗剂(例如阿霉素)溶液一起孵育,然后将ph恢复到中性,从而使病毒恢复到其溶胀前状态,从而包埋化疗分子。接下来,可以通过选自包括但不一定限于注射在内的一组中选择的递送机制将病毒颗粒递送到生物体中,以便对肿瘤靶向治疗。
[0256]
因此,以上说明提供了多个实施方式和多种替代方法,用于:(i)基于植物的病毒制造和纯化;(ii)基于植物的抗原制造和纯化;(iii)在植物外形成作为疫苗和抗原运载体具有治疗益处的病毒-抗原偶联物;以及(iv)递送包含纯化的病毒和纯化的抗原的治疗性疫苗。
[0257]
实施例13-疫苗在冷藏和室温条件下的稳定性
[0258]
疫苗极大地改善了人和动物的健康。例如,仅在20世纪,疫苗就根除了天花,在美洲消除了脊髓灰质炎,并在全世界控制了各种疾病。然而,疫苗是非常不稳定的,对温度的变化非常敏感。正如f.coenen等,流感亚单位疫苗的稳定性。在冰箱外放几天有什么关系
吗?(stability of influenza sub-unit vaccine.does a couple of days outside the refrigerator matter?)vaccine 24(2006),525-531中讨论过,流感疫苗在室温储存(即~25℃)五周后一般是不可接受的,也是没有活性的。在f.coenen文章中讨论的所有流感疫苗中,只有一种疫苗在室温储存下表现出12周的稳定性。对于其他疫苗类型也是一个重大问题。因此,目前所有的疫苗一般都必须在从商业化生产到给予的整个供应链中进行冷藏,通常被称为“冷链”。
[0259]
在冷藏环境中,大多数疫苗在典型的七八周稳定目标中保持稳定。然而,对冷链的绝对要求是一个全球性的问题,它限制了全世界的疫苗供应,因为它在发展中国家往往难以保证,并导致了普遍的疫苗损失。为创造室温稳定的疫苗做出了许多努力,但正如文献中所讨论的那样,这些努力都是不成功的。此外,对于制造商,以及接收、储存和向民众应用疫苗的医生和组织来说,维持冷链的成本非常高。因此,全球都需要增加疫苗的稳定性,增强疫苗-抗原的稳定性,以减少对冷链的依赖,确保疫苗在使用前保持其效力。此外,改进稳定性可以延长疫苗的保质期,这将有利于在潜在的大流行病的准备中储备疫苗,并防止在不利条件下的疫苗损失。与本文概述的其他特征和优点一起,本实施方式的范围满足了这些和其他需求。这样,本发明的纯化和偶联平台扩展了蛋白质-病毒偶联物在冷藏和室温条件下的稳定性。
[0260]
有几种确定抗原质量和疫苗稳定性的方法,包括:(1)通过bca蛋白测定法(其基于以下原理:蛋白质在碱性溶液中可将cu
2+
还原为cu
+1
,从而导致形成紫色)测量的蛋白质浓度,(2)通过vaxarray抗体阵列结合法(利用多重夹心免疫测定法)测量的储存效力,(3)sds-page纯度,在单个迁移带方面测量,(4)ph,作为物理污染特性的测量,以及在可能的情况下,(5)尺寸排阻色谱法来表征抗原的多聚体结构。此外,如果未能通过bca蛋白测定、vaxarray测试或sds-page分析,则被认为疫苗不能被接受使用。换言之,如果疫苗未能通过这三项测试中的任何一项,该疫苗就不能被接受使用,是失活的。
[0261]
因此,上一段提到的五项测试是对根据多个实施方式和替代方式生产和纯化的下列流感ha抗原进行的:h1ni(a/密歇根)、h3n2(a/新加坡)、h1n1(a/布里斯班)、h3n2(a/堪萨斯)、b/科罗拉多和b/普吉岛。下表提供了在释放时和装入小瓶后并在冷藏条件下储存(4
°
至8℃)的不同时间测量的稳定性数据和储存效力。如本文所用,初始浓度或完整性是指化合物、偶联物混合物、药物产品、疫苗等的在其释放日期(即,药物产品的构成或稀释后,有时被称为“第0天”)的浓度或完整性,释放日期是根据21c.f.r.第11部分(21c.f.r.part 11)和ich q1a新药物质和产品的稳定性测试,修订版2(ich q1a stability testing of new drug substances and products,revision 2)(2003年11月),以及后一文件中引用的参考文献确定的,上述所有内容通过引用完全纳入本文用于所有目的。
[0262]
表18.纯化的h1ni(a/密歇根)在冷藏条件下的稳定性
[0263][0264][0265]
表19.纯化的h3n2(a/新加坡)在冷藏条件下的稳定性
[0266][0267]
表20.h1ni(a/布里斯班)在冷藏条件下的稳定性
[0268]
[0269][0270]
表21.h3n2(a/堪萨斯)在冷藏条件下的稳定性
[0271][0272]
表22.b/科罗拉多在冷藏条件下的稳定性
[0273][0274]
表23.b/普吉岛在冷藏条件下的稳定性
[0275][0276]
表18-23说明,纯化的游离抗原表现出不同的稳定性模式。例如,一些抗原如h1ni(a/密歇根)和h3n2(a/新加坡)在6个月后似乎很稳定,测量结果没有显著偏差(如通常观察到的)。然而,其他抗原如b/科罗拉多和h1n1(a/布里斯班),以及在较小程度上h3n2(a/堪萨斯)和b/普吉岛,在这些条件下表现出降解、三聚体的损失或其他关键特性的损失。例如,图40是在冷藏条件下1个月后对纯化的b/普吉岛的sds-page分析。在图40中,在~60kda的完整条带下方的低分子量的降解条带表明纯化的b/普吉岛抗原已经降解。正如预期,表18-23和图40中的数据表明,不同的蛋白质在冷藏条件下表现出不同的稳定性。
[0277]
根据多个实施方案和替代方式,当相同的纯化抗原偶联至tmv时,其稳定性概况和储存效力会变化。在一些实施方式中,本发明的方法增强包括蛋白质和病毒颗粒的偶联化合物的稳定性的量度,并包括激活病毒颗粒,然后在偶联反应中混合病毒颗粒和抗原以形成偶联物混合物,导致当偶联化合物被置于未冷藏环境中并在释放日期后至少42天的时间段后稳定性增强。示例性的储存温度是至少20℃。稳定性增强可以通过比较偶联物混合物和单独的抗原的稳定性来衡量。合适的量度是抗原浓度、抗原完整性或抗原效力中的任何一个或多个。例如,当稳定性的量度是抗原浓度时,如通过bca或其他适当的方法来测量,偶联化合物的浓度与单独的抗原浓度之间的差异为至少10%在本实施方式的范围内。同样,当稳定性的量度是抗原的完整性时,如通过sds-page、sec-hplc或其他适当的方法测量,偶联化合物的完整性与单独的抗原的完整性之间的差异为至少10%在本实施方式的范围内。同样,当稳定性的量度是抗原效力时,如通过基于elisa结果的抗原-抗体相互作用,或vaxarray,表面等离子体共振或其他适当的方法测量,偶联化合物的效力和单独的抗原的效力之间的差异为至少30%在本实施方式的范围内。
[0278]
因此,下表提供了在释放时和装入小瓶后并在冷藏条件下(2
°
至8℃)储存后的不同时间的几种单价制剂(在tmv与抗原的比例为1∶1时)的稳定性数据。
[0279]
表24.h1ni(a/密歇根)偶联至tmv的偶联物在冷藏条件下的稳定性
[0280][0281]
表25.h3n2(a/新加坡)偶联至tmv的偶联物在冷藏条件下的稳定性
[0282][0283]
表26.b/普吉岛偶联至tmv的偶联物在冷藏条件下的稳定性
[0284][0285][0286]
表27.b/科罗拉多偶联至tmv的偶联物在冷藏条件下的稳定性
[0287][0288]
在表24-27中描述的各个偶联物中,通过冷藏条件下至少6个月的储存保持其纯度、ph、蛋白质浓度和储存效力。此外,在此时间范围内,多分散性也是一致的。多分散性是指复杂产品中粒度的变化,一般来说,多分散性越低,产品就越好。
[0289]
除了单价制剂外,根据多个实施方式和替代方式以1∶1的tmv与抗原比例生产的以下四价偶联物在冷藏(4
°
至8℃)和室温(22
°
至28℃)条件下都表现出很强的稳定性。
[0290]
表28.四价偶联物在冷藏条件下的稳定性
[0291][0292][0293]
表29a.四价偶联物在室温条件下的稳定性
[0294]
[0295][0296]
表29b.四价偶联物在室温条件下的稳定性
[0297][0298]
表28、29a和29b说明,四价偶联物在冷藏和室温条件下,在蛋白质浓度、储存效力、ph和外观方面至少6个月保持一致和稳定。表30提供了表29a和29b中描述的多种抗原的储存效力的百分比变化,通过比较初始效力和特定时间的储存效力。
[0299]
表30.通过vaxarray测量储存效力与初始效力的百分比变化
[0300]
2周1个月2个月3个月6个月a/密歇根93.50%102.44%19.51%91.87%92.68%a/新加坡101.89%163.21%27.36%108.49%75.47%b/普吉岛82.05%71.80%24.79%68.00%84.62%b/科罗拉多79.49%158.97%33.33%178.00%153.85%
[0301]
因此,如表30所示,当把偶联物置于未冷藏环境中时,30天结束时的储存效力至少是偶联后第一天内偶联物混合物初始效力的70%。在90天结束时,储存在未冷藏环境中的偶联物混合物的储存效力至少是初始效力的68%,而在至少180天结束时,偶联物混合物的
储存效力至少是75%。
[0302]
下表通过比较纯化的重组抗原与根据多个实施方式和替代方式偶联至tmv的相同蛋白质的释放条件,说明了本文所述实施方式的稳定效果。此外,通过分析蛋白质浓度、效力、sds-page纯度和ph,比较纯化的抗原和偶联至tmv的相同抗原在冷藏条件(4
°
至8℃)下6个月后的稳定性,如下:
[0303]
表31.纯化的b/科罗拉多抗原和b/科罗拉多偶联至tmv偶联物的稳定性之间的比较
[0304][0305]
表32.纯化的b/普吉岛抗原和b/普吉岛偶联至tmv偶联物的稳定性之间的比较
[0306][0307]
表33.纯化的h3n2(a/新加坡)抗原和h3n2(a/新加坡)偶联至tmv偶联物的稳定性之间的比较
[0308][0309]
表34.纯化的h1ni(a/密歇根)抗原和h1ni(a/密歇根)偶联至tmv偶联物的稳定性之间的比较
[0310][0311][0312]
表31-34说明了纯化和偶联实施方式的稳定性诱导特性,最明显的是b/科罗拉多、b/普吉岛和h1ni(a/密歇根)抗原在纯度方面的量度。对于h3n2(a/新加坡)和b/科罗拉多抗原来说,偶联物的稳定性也是以抗原浓度来显示的。如表31-34所示,根据多个实施方式和替代方式,纯化和偶联过程稳定了抗原的物理性质、抗原反应性和其他定量稳定性特征。
[0313]
此外,表29a、29b和30说明,根据多个实施方式和替代方式产生的四价偶联物在室温储存(22
°
至28℃)中表现出至少六个月或二十四周的强稳定性量度。与在室温下表现出平均约5周稳定性的传统疫苗相比(如上述f.coenen文章中所讨论的),根据多个实施方式和替代方式的疫苗表现出比传统流感疫苗至少多5倍的稳定性,比纯化抗原长几倍。因此,根据多个实施方式和替代方式的制剂和偶联过程稳定了极其不稳定的抗原-例如b/科罗拉多
‑‑
并延长了其他抗原-例如h3n2(a/新加坡)、h1ni(a/密歇根)和b/普吉岛
‑‑
的稳定性,远远超过了游离抗原和传统疫苗的稳定性极限。
[0314]
另一个实施方式,在本文中称为实施方式a,是一种使用方法,包括给予对象通过偶联蛋白质和病毒颗粒制造的化合物,即,激活病毒颗粒,然后在偶联反应中混合病毒颗粒和蛋白质以形成偶联物混合物,其中当在未冷藏环境中的储存温度下放置一段时间后,偶联物混合物的完整性或浓度至少是偶联物混合物初始完整性或初始浓度的90%,其中该时
间段在偶联物混合物的释放日期后至少42天。对象可以是人。示例性的储存温度是至少20℃。
[0315]
在实施方式a范围内的一个实施方式,并在本文中称为实施方式b中,激活病毒颗粒包括将病毒颗粒暴露在ph约为5.5或更低的偶联环境中。在实施方式a范围内的一个实施方式,并在本文中称为实施方式c中,该病毒颗粒是包膜病毒。在实施方式a范围内的一个实施方式,并在本文中称为实施方式d中,该蛋白质是抗原。在实施方式a范围内的一个实施方式,并在本文中称为实施方式e中,该抗原是血凝素抗原。在实施方式a范围内的一个实施方式,并在本文中称为实施方式f中,该时间段是在偶联物混合物的释放日期后至少90天。在实施方式a范围内的一个实施方式,并在本文中称为实施方式g中,该时间段是在偶联物混合物的释放日期后至少180天。因此,本文描述了一种使用方法,其中给予对象与实施方式a有关的所述的疫苗。该方法可通过纳入实施方式b、c、d、e、f或g中任何一个或多个的附加特征来进一步定义。
[0316]
另一个实施方式,在本文中称为实施方式h,是一种使用方法,包括给予对象通过偶联蛋白质和病毒制造的疫苗,即,激活病毒,然后在偶联反应中混合病毒和蛋白质以形成偶联物混合物,其中当在未冷藏环境中的储存温度下放置一段时间后,偶联物混合物的完整性或浓度至少是偶联物混合物初始完整性或初始浓度的90%,其中该时间段在偶联物混合物的释放日期后至少42天。对象可以是人。示例性的储存温度是至少20℃。
[0317]
在实施方式h范围内的一个实施方式,并在本文中称为实施方式i中,激活病毒包括将病毒暴露在ph约为5.5或更低的偶联环境中。在实施方式h范围内的一个实施方式,并在本文中称为实施方式i中,该病毒是烟草花叶病毒。在实施方式h范围内的一个实施方式,并在本文中称为实施方式j中,该蛋白质是抗原。在实施方式h范围内的一个实施方式,并在本文中称为实施方式k中,该抗原是血凝素抗原。在实施方式h范围内的一个实施方式,并在本文中称为实施方式l中,该时间段是在偶联物混合物的释放日期后至少90天。在实施方式h范围内的一个实施方式,并在本文中称为实施方式m中,该时间段是在偶联物混合物的释放日期后至少180天。因此,本文描述了一种使用方法,其中给予对象与实施方式h有关的所述的疫苗。该方法可通过纳入实施方式i、j、k、l或m中任何一个或多个的附加特征来进一步定义。
[0318]
另一个实施方式,在本文中称为实施方式n,是一种用于增强包括蛋白质和病毒颗粒的偶联的化合物的稳定性的量度的方法,该方法包括激活病毒颗粒,然后在偶联反应中混合病毒颗粒和蛋白质以形成偶联物混合物,其中当在未冷藏环境中的储存温度下放置一段时间后,偶联物混合物的完整性或浓度至少是偶联物混合物初始完整性或初始浓度的90%,其中该时间段在偶联物混合物的释放日期后至少42天。示例性的储存温度是至少20℃。在一些实施方式中,激活病毒颗粒包括将病毒颗粒暴露在ph约为5.5或更低的偶联环境中。
[0319]
在实施方式n范围内的一个实施方式,并在本文中称为实施方式o中,该病毒颗粒是包膜病毒。在实施方式n范围内的一个实施方式,并在本文中称为实施方式p中,该蛋白质是抗原。在实施方式n范围内的一个实施方式,并在本文中称为实施方式q中,该抗原是血凝素抗原。在实施方式n范围内的一个实施方式,并在本文中称为实施方式r中,该时间段是在偶联物混合物的释放日期后至少90天。在实施方式n范围内的一个实施方式,并在本文中称
为实施方式s中,该时间段是在偶联物混合物的释放日期后至少180天。该方法可通过纳入实施方式o、p、q、r或s中任何一个或多个的附加特征来进一步定义。
[0320]
另一个实施方式,在本文中称为实施方式t,是一种用于增强包括蛋白质和病毒的偶联的化合物的稳定性的量度的方法,该方法包括激活病毒,然后在偶联反应中混合病毒和蛋白质以形成偶联物混合物,其中当在未冷藏环境中的储存温度下放置一段时间后,偶联物混合物的完整性或浓度至少是偶联物混合物初始完整性或初始浓度的90%,其中该时间段在偶联物混合物的释放日期后至少42天。示例性的储存温度是至少20℃。在一些实施方式中,激活病毒包括将病毒颗粒暴露在ph约为5.5或更低的偶联环境中。
[0321]
在实施方式t范围内的一个实施方式,并在本文中称为实施方式u中,该病毒是烟草花叶病毒。在实施方式t范围内的一个实施方式,并在本文中称为实施方式v中,该蛋白质是抗原。在实施方式t范围内的一个实施方式,并在本文中称为实施方式w中,该抗原是血凝素抗原。在实施方式t范围内的一个实施方式,并在本文中称为实施方式x中,该时间段是在偶联物混合物的释放日期后至少90天。在实施方式t范围内的一个实施方式,并在本文中称为实施方式y中,该时间段是在偶联物混合物的释放日期后至少180天。该方法可通过纳入实施方式u、v、w、x或y中任何一个或多个的附加特征来进一步定义。
[0322]
另一个实施方式,在本文中称为实施方式z,并且是一种化合物,包括偶联的蛋白质和病毒颗粒,其中蛋白质与病毒表面的赖氨酸残基化学关联,并且当化合物在储存温度下的未冷藏环境中放置一段时间后,在该时间段结束时化合物的完整性或浓度至少是化合物的初始完整性或初始浓度的90%,其中该时间段是化合物释放日期的至少42天。示例性的储存温度是至少20℃。
[0323]
在实施方式z范围内的一个实施方式,并在本文中称为实施方式aa中,该病毒颗粒是病毒。在实施方式z范围内的一个实施方式,并在本文中称为实施方式bb中,该病毒是包膜病毒。在实施方式z范围内的一个实施方式,并在本文中称为实施方式cc中,该病毒是烟草花叶病毒。在实施方式z范围内的一个实施方式,并在本文中称为实施方式dd中,该时间段是在偶联物混合物的释放日期后至少90天。在实施方式z范围内的一个实施方式,并在本文中称为实施方式ee中,该时间段是在偶联物混合物的释放日期后至少180天。该化合物可通过纳入实施方式aa、bb、cc、dd或ee中任何一个或多个的附加特征来进一步定义。
[0324]
另一个实施方式,在本文中称为实施方式ff,是一种用于增强包括蛋白质和病毒颗粒的偶联的化合物的稳定性的量度的方法,该方法包括激活病毒颗粒,然后在偶联反应中混合病毒颗粒和抗原以形成偶联物混合物,其中当在未冷藏环境中的储存温度下放置一段时间后,并在该偶联物混合物释放日期后至少42天的时间段后,偶联物混合物表现出的稳定性超出了单独抗原的偶联物混合物稳定性的初始稳定性,该稳定性由抗原浓度、抗原完整性或抗原效力中的一项或多项衡量。示例性的储存温度是至少20℃。在一些实施方式中,激活病毒包括将病毒颗粒暴露在ph约为5.5或更低的偶联环境中。
[0325]
在实施方式ff范围内的一个实施方式中,并在本文中称为实施方式gg,该抗原是血凝素抗原。在实施方式ff范围内的一个实施方式,并在本文中称为实施方式hh中,该病毒是烟草花叶病毒。在实施方式ff范围内的一个实施方式中,并在本文中称为实施方式ii,该时间段是在偶联物混合物的释放日期后至少90天。在ff范围内的一个实施方式中,并在本文中称为实施方式jj,该时间段是在偶联物混合物的释放日期后至少180天。在ff范围内的
一个实施方式,并在本文中称为实施方案kk中,稳定性的量度是抗原浓度,并且偶联物混合物的浓度和单独的抗原浓度之间的差异至少是10%。在ff范围内的一个实施方式,并在本文中称为实施方案ll中,稳定性的量度是抗原完整性,并且偶联物混合物的完整性和单独的抗原的完整性之间的差异至少是10%。在ff范围内的一个实施方式,并在本文中称为实施方案mm中,稳定性的量度是抗原效力,并且偶联物混合物的效力和单独的抗原的效力之间的差异至少是10%。在ff范围内的一个实施方式,并在本文中称为实施方案nn中,稳定性的量度是抗原效力,并且偶联物混合物的储存效力在时间段结束时是偶联物混合物的初始效力的至少70%。该方法可通过纳入实施方式gg、hh、ii、jj、kk、ll、mm或nn中任何一个或多个的附加特征来进一步定义。
[0326]
应理解,本文描述的实施方式在其应用中不限于文中所阐述的教导和描述的细节、或者如附图所示的细节。相反,应理解,本发明的实施方式和替代方式,如本文所说明和要求保护的,能够以各种方式实施或执行。另外,应理解的是本文中使用的词语和短语是为了是说明性目的而不应被认为是限制性的。本文使用“包含”、“包括”、“例如”、“含有”或“具有”及这些词汇的变化表示涵盖其后列出的项目及其等同物以及额外的项目。
[0327]
因此,对几个实施方式和替代方式的前述描述旨在说明而不是限制本公开内容的范围。本文的说明书并不意味着穷举,也不意味着将对实施方式的理解限制在所公开的精确形式上。本领域普通技术人员应理解,根据以上教导和描述,这些实施方式的修改和变化是合理可能的。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1